修回日期: 2014-05-20
接受日期: 2014-05-29
在线出版日期: 2014-07-08
目的: 为酒精性肝病发病机制及治疗研究提供简便、经济、成模率高的动物模型并探究酒精性肝病的发病机制.
方法: 以单笼喂养, 自由摄取食水的方式饲养大鼠. 对照组不予饮酒, 自由摄取食水; 实验组予饮酒, 分为正常饲料组、高脂饲料组及高脂限食组. 将市售白酒稀释成(6%、9%、12%、20%)等不同浓度的水溶液, 以其作为大鼠的唯一水源. 先给予6%的白酒水溶液, 待大鼠适应白酒气味之后, 逐渐提高白酒浓度, 第4周时将白酒浓度提高至20%, 一直到实验结束. 实验结束后取肝组织观察病理学变化, 用生化检测仪检测大鼠血浆丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)变化. 用Real-time RCR检测肝组织转化生长因子β1(transforming growth factor beta 1, TGF-β1)和Smad7 mRNA水平变化, 并用Western blot检测蛋白水平变化.
结果: 对照组肝脏组织形态正常, 实验组中正常饲料组肝组织出现脂肪肝表现, 高脂饲料组脂肪变性程度加重并出现了肝炎及胶原纤维增生. 限食高脂组肝组织出现了大量成束的胶原纤维并伴有肝炎及脂肪肝表现. 血清ALT、AST结果显示: 至实验结束时, 对照组比实验组转氨酶活性明显升高(P<0.05), 不同实验组间比较高脂饮食组和限食高脂组转氨酶活性无差别, 但均较正常饲料组高(P<0.05). TGF-β1和Smad7这两个基因的蛋白丰度与他们各自的mRNA表达水平呈正相关, 与对照组比较3个实验组TGF-β1表达水平升高, 并与肝脏病理损伤程度呈正相关, 实验组Smad7表达水平降低, 但与肝脏病理变化无相关性.
结论: 饮用白酒水溶液结合限食及高脂饮食的方法可以成功建立酒精性肝纤维化的大鼠模型, Smad7不能有效抑制TGF-β1促进了肝纤维化的形成.
核心提示: 本实验选用雌性Wistar大鼠制备酒精性肝病模型, 用白酒水溶液作为其唯一水源, 逐步增加酒精浓度的方法克服了大鼠厌酒的问题, 并成功制备出酒精性肝纤维化动物模型. 随后用Real-time PCR和Western blot检测肝纤维化相关基因的表达情况, 发现TGF-β1表达的升高及其抑制物Smad7的降低共同发挥了促纤维化作用.
引文著录: 何培元, 侯志平, 高淑梅, 王明娟, 马立新, 李炳庆. 酒精性肝纤维化大鼠模型的建立及Smad7/TGF-β表达变化. 世界华人消化杂志 2014; 22(19): 2692-2702
Revised: May 20, 2014
Accepted: May 29, 2014
Published online: July 8, 2014
AIM: To develop a suitable rat model of alcoholic liver fibrosis, which is easily available and low in cost with a high success rate, and to detect the alteration of expression of genes involved in the pathogenesis of alcoholic liver disease.
METHODS: Rats were raised individually in respective cages and were fed ad libitum. Rats were divided into two groups: a normal control group and an experimental group. The normal control group was given a normal diet with alcohol-free water. The experimental group was further divided into three subgroups, namely, a normal diet subgroup, a high fat diet subgroup and a limited high fat diet subgroup. Commercially available Chinese spirit was diluted into different concentrations (6%, 9%, 12%, 20%) using distilled water and used as the source of alcohol consumption for rats in the experimental group. Rats in the experimental group were fed distilled water containing 6% (v/v) alcohol at the beginning of the experiment, and the concentration of alcohol was gradually increased to 20% within 4 wk. Ultimately, water containing 20% alcohol was maintained towards the end of the study. At the end of the experiment, livers of rats were dissected for histological studies whereas serum samples were taken to detect the levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST). The mRNA and protein expression of transforming growth factor β1 (TGF-β1) and Smad7 in liver tissues was detected by real-time PCR and Western blot, respectively.
RESULTS: No pathological changes were observed in the liver of rats in the normal control group. However, rats in the experimental group demonstrated histopathological changes such as fatty change, inflammation as well as fibrosis. The histopathological changes were most severe in the subgroup fed a limited high fat diet, followed by those fed a high fat diet. Fatty changes were observed in the liver of rats in the experimental subgroup fed a normal diet. A small amount of collagen fibrils, inflammation and a more severe fatty change were found in the liver of rats fed a high fat diet. Bundles of closely packed collagen fibrils, inflammation, and fatty change were observed in rats fed a limited high fat diet. Serum levels of AST and ALT were higher in the experimental group compared to the normal control group. The subgroup fed a normal diet had lower levels of AST and ALT compared to the other two subgroups, although no significant difference was seen between subgroups fed a high fat diet and a limited high fat diet. Protein expression of TGF-β1 and Smad7 was positively correlated with their mRNA levels, respectively. TGF-β1 expression level in the normal control group was lower compared to the three experimental subgroups, and the level was positively correlated with the severity of hepatic pathological changes. Smad7 expression was shown to be higher in the normal control group compared to the experimental subgroups. However, there was no correlation between the level of Smad7 and hepatic pathological changes.
CONCLUSION: Feeding a limited high fat diet with alcohol ad libitum in rats is a convenient, low cost method for developing an animal model of alcoholic liver disease with a high rate of success. Inability of Smad7 to inhibit the TGF-β1 pathway contributes to the development of alcoholic liver fibrosis.
- Citation: He PY, Hou ZP, Gao SM, Wang MJ, Ma LX, Li BQ. Establishment of a rat model of alcoholic liver fibrosis and detection of hepatic expression of Smad7/TGF-β. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2692-2702
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2692.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2692
酒精性肝病(alcoholic liver disease, ALD)是长期大量饮酒导致的一种肝脏疾病. ALD占所有肝病的比率由1991年的4.2%猛增至1996年的21.3%[1]. 依病情轻重分为酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化. 临床诊疗实践证明肝硬化不可逆转, 而肝纤维化仍有治愈的可能, 对肝纤维化发病机制的研究至关重要. 对酒精性肝病发病机制及治疗方法的研究能否成功很大程度取决于所使用的动物模型的可重复性及与人类ALD发病过程的相似性. 以往国内多采用白酒灌胃法造模, 但死亡率很高. 也有研究借助四氯化碳等化学药物建立肝纤维化动物模型, 但发病机制及组织形态学改变与酒精性肝纤维化有较大差异. 肝组织转化生长因子β1(transforming growth factor β1, TGF-β1)是肝纤维化过程中起主要促进作用的细胞因子, Smad7蛋白是TGF-β1通路中的主要抑制因子[2]. 本实验旨在建立一种操作简便、死亡率低且发病机制与人类酒精性肝病相近的动物模型, 并检测TGF-β1和Smad7蛋白的表达以研究酒精性肝纤维化的发病机制.
♀Wistar大鼠36只, 6-7周龄, 体质量180-220 g, 由天津医科大学实验动物中心提供. 大鼠酒精性肝病模型建立过程中使用市售山庄老酒, 浓度38%(v/v), 由承德避暑山庄企业集团酒业有限公司生产. 实验用玉米油购自美国Sigma公司. 全自动生化检测仪(日本OLYMPUS640). 透射电镜(日本日立H-7650). Real-time PCR仪(德国Eppendorf realplex)总RNA和蛋白提取试剂盒、反转录试剂盒及Real-time PCR购自德国凯杰公司(分类号: 80004、205311、204054). TGF-β1和Smad7抗体购自美国圣克鲁斯生物公司(产品编号分别为: SC-134013、SC-146). PCR反应中所需上下游引物由上海生工合成, 引物序列如表1所列.
| 基因 | 上游引物序列 | 下游引物序列 |
| TGF-β1 | 5'-CAAGTGGACATCAACGGGTT-3' | 5'-GCAGGAGCGCACGATCATGT-3' |
| Smad7 | 5'-GCTTGCTGGCCTAATAGCAG-3' | 5'-GCAGGACACCCTGATAGGAA-3' |
| GAPDH | 5'-CGGATTTGGTCGTATTGGGC-3' | 5'-GTCATACCAGGAAATGAGCTTG-3' |
1.2.1 分组: 共分为4组, 每组9只. 正常对照组, 该组予基础饲料喂养, 不施加任何处理因素; 饮用白酒的实验组根据饮食结构不同分为: 正常饲料组, 高脂饲料组及限食高脂组. 正常饲料组食用基础饲料且对食量不加限制; 高脂饲料组: 以基础饲料(85%)及玉米油(15%)制成高脂饲料, 其中玉米油热量约占总热量的25%[3]. 食量不限. 限食高脂组: 食用高脂饲料, 食量减半.
1.2.2 酒精性肝纤维化大鼠模型的建立: 将市售38%(v/v)山庄老酒用蒸馏水稀释成6%、9%、12%、20%等不同浓度. 先以6%白酒喂养大鼠3 d, 之后逐渐增加酒精浓度, 9%白酒喂养3 d, 12%白酒喂养2 wk, 之后以20%白酒喂养, 第7周时以38%白酒喂养3 d, 期间大鼠饮水体积明显减少, 故将酒精浓度再次降至20%直至第16周末实验结束.
1.2.3 大鼠饮酒量及体质量变化的记录: 实验中大鼠均采用单笼饲养, 每日添加白酒稀释液之前均记录每只大鼠前1天饮用酒精量. 以每kg体质量摄入乙醇量计量大鼠饮酒量, 按以下乙醇换算公式计算: 每kg体质量摄入乙醇量(g) = 饮酒量(mL)×乙醇含量(%)×0.8/1000 g. 于实验开始后每个月第1周称量各组大鼠体质量.
1.2.4 大鼠血浆谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(glutamic-oxalacetic transaminase, AST)检测: 内眦静脉取血, 用EDTA抗凝, 离心后取上层血浆, 用生化仪测定血浆中ALT、AST活性. 实验开始前检测1次作为基础值, 之后每个月月末检测1次以观察其变化情况.
1.2.5 总RNA提取、反转录及Real-time PCR检测TGF-β1和Smad7表达水平: 严格按照试剂盒说明书步骤提取肝脏总RNA, 用紫外分光光度计检测RNA的纯度及浓度, 所得RNA保存于-80 ℃冰箱. 每次反转录以1 μg总RNA为模版, 反应体系20 μL, 步骤完全按照试剂盒说明书进行, 所得1 μg cDNA保存于-20 ℃冰箱. Real-time PCR反应于96孔板中进行, 以GAPDH为内参基因, 每个样本设3个复孔, 每孔中依次加入2×SYBR Green PCR Master Mix 12.5 μL, cDNA 1 μL, 上下游引物各1 μL, 双蒸水9.5 μL, 总体积25 μL. PCR仪参数设定: 95 ℃预变性5 min, 再于95 ℃变性10 s, 复性温度60 ℃, 延伸30 s, 循环次数35, 最终温度于20 min内匀速上升至95 ℃以绘制溶解曲线. 所得结果由∆∆Ct算法得出, 数值以mean±SD表示.
1.2.6 Western blot法检测TGF-β1及Smad7蛋白水平: 按蛋白提取试剂盒操作提取肝脏组织总蛋白. 在10%聚丙烯酰胺凝胶中电泳后转膜至聚丙二氟乙烯膜. 用含10%脱脂奶粉Tris Tween缓冲液(TTBS)封闭, 加入一抗后孵育过夜, TTBS洗掉多余的一抗后加入以1:1000稀释的二抗, 37 ℃温育1 h, TTBS冲洗尚未结合的二抗终止反应后染色, 于凝胶图像分析系统照相, 应用软件BandScan分析每个条带的吸光度值. 参照蛋白为β-actin. 以目标蛋白数值/参照蛋白数值得出目标蛋白的相对丰度, 数值以mean±SD表示.
1.2.7 光镜下观察大鼠肝脏病理学改变: 打开腹腔, 取出大鼠肝脏, 固定于40 g/L的中性甲醛中, 石蜡包埋, 切片, HE染色, 光镜下观察组织病理学变化.
1.2.8 电镜下观察大鼠肝脏病理学改变: 处死大鼠后取小块肝组织切割成小米粒大小, 固定于电镜液中. 常规电镜切片, 染色, 于电镜下观察肝细胞超微结构变化.
统计学处理 结果以mean±SD表示, 用SPSS10.0统计软件对实验数据进行统计学分析, 计量资料采用方差分析统计方法, P<0.05为差异有统计学意义.
正常对照组大鼠毛发有光泽, 灵活好动, 反应灵敏, 食欲及大便均正常, 体质量持续增加. 饮酒的实验组大鼠毛发乱而无光泽, 精神萎靡, 反应迟钝, 活动量减少, 体质量增加缓慢. 第4周末饮酒后部分大鼠表现为活动减少, 行动迟缓, 步态蹒跚, 食欲减退. 而另外一部分表现为烦躁, 好斗, 易激惹. 第10周1/4大鼠出现尾尖红肿、渗血甚至坏死, 2只大鼠出现鼻衄. 第16周时一半实验组大鼠出现尾尖红肿渗血, 另一半大鼠尾尖坏死、变黑、脱落. 高脂饲料组有1只大鼠于第14周死亡, 限食高脂组有2只大鼠于第12周死亡, 均于醉酒出现意识障碍之后死亡, 解剖后未发现明确死因, 考虑可能为大量酒精抑制呼吸中枢所致.
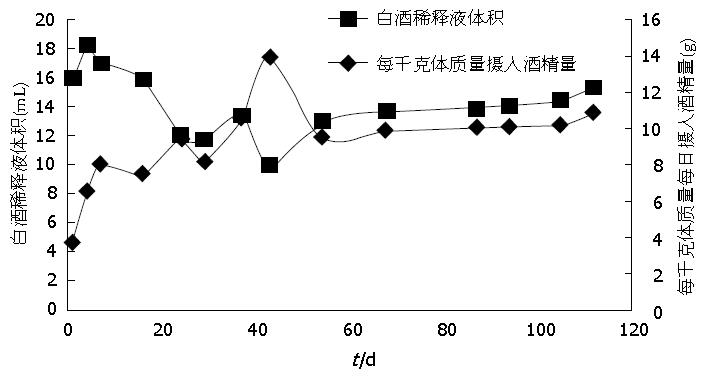
开始以6%的白酒水溶液为唯一水源喂养大鼠, 第4周逐渐增加至20%, 在前6 wk内大鼠摄入酒精量由3.7 g/(kg·d)±0.7 g/(kg·d)增至10.6 g/(kg·d)±1.8 g/(kg·d), 饮用白酒稀释液体积由每天16.00 mL±3.33 mL降至13.38 mL±2.27 mL. 第7周予饮用未经稀释的38%市售白酒3 d, 摄入酒精量可增至13.9 g/(kg·d)±1.9 g/(kg·d), 但饮用白酒体积降至每天9.94 mL±1.96 mL, 大鼠饮水量过少, 故将白酒稀释液浓度降至20%直至实验结束, 每1 kg体质量摄入酒精量维持在10 g左右, 每天饮用白酒稀释液体积约14 mL(表2, 图1).
| 时间点(d) | 白酒水溶液浓度(v/v, %) | 每1 kg体质量每天摄入酒精量(g) | 每只大鼠每日摄入白酒稀释液体积(mL) |
| 1 | 6 | 3.7±0.7 | 16.00±3.33 |
| 4 | 9 | 6.5±1.0 | 18.24±2.98 |
| 7 | 12 | 8.0±1.5 | 17.00±3.19 |
| 16 | 12 | 7.5±1.3 | 15.94±3.13 |
| 24 | 20 | 9.4±2.1 | 12.00±2.85 |
| 29 | 20 | 8.2±1.4 | 11.78±2.01 |
| 37 | 20 | 10.6±1.8 | 13.38±2.27 |
| 43 | 38 | 13.9±1.9 | 9.94±1.96 |
| 54 | 20 | 9.5±1.3 | 12.92±2.18 |
| 68 | 20 | 9.9±1.6 | 13.70±2.37 |
| 87 | 20 | 10.1±1.9 | 13.84±2.71 |
| 94 | 20 | 10.1±1.1 | 14.02±2.17 |
| 105 | 20 | 10.2±1.4 | 14.47±2.32 |
| 112 | 20 | 10.9±1.5 | 15.35±2.41 |
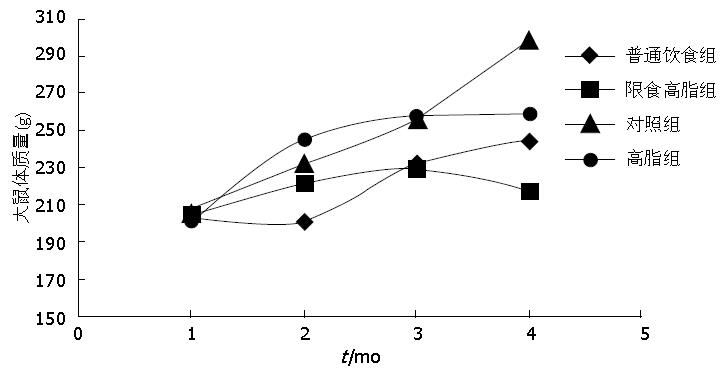
对照组大鼠呈持续匀速增长, 到第4个月时最重达298.6 g±35.91 g; 高脂饲料组大鼠体质量在第1个月增长最快, 之后明显减慢, 第4个月体质量258.45 g±32.71 g; 普通饲料组体质量增加非常缓慢, 第4个月时体质量244.8 g±20.65 g, 较实验开始时每只大鼠体质量仅平均增长32 g; 限食高脂组前两个月体质量略有增加最高达229.74 g±23.87 g, 之后出现体质量下降, 第4个月时体质量217.85 g±25.16 g, 较实验之初没有明显增加. 至第4个月时正常对照组体质量明显高于实验组(P<0.05). 三个实验组之间无明显差异(P>0.05)(表3, 图2).
| 分组 | 第1月 | 第2月 | 第3月 | 第4月 |
| 对照组 | 207.30±13.00 | 232.40±17.45 | 255.86±26.74 | 298.60±35.91 |
| 普通饲料组 | 202.75±16.78 | 201.43±19.78 | 232.80±22.20 | 244.80±20.65 |
| 高脂饲料组 | 201.75±14.63 | 245.11±16.70 | 257.62±19.25 | 258.45±32.71 |
| 限食高脂组 | 204.95±14.50 | 221.96±18.70 | 229.74±23.87 | 217.85±25.16 |
随着时间的推移, 对照组ALT、AST在不同的时间点无明显升高, 而三个实验组在饮用稀释白酒后ALT、AST水平都有不同程度升高, 到实验结束时, 与开始实验前所测基础值相比有显著差异(P<0.05). 三个实验组组间比较, 高脂饲料组及限食高脂组AST升高的幅度无明显差别(P>0.05), 但均大于正常饲料组(P<0.05). 三个实验中间ALT水平无明显差异(P>0.05)(表4).
| 分组 | 第1天 | 第1月末 | 第2月末 | 第3月末 | 第4月末 |
| 正常对照组 | |||||
| ALT | 42.18±4.86 | 44.20±3.91 | 27.59±4.16 | 34.48±3.20 | 36.54±5.23 |
| AST | 130.45±21.45 | 121.20±16.54 | 140.38±25.64 | 151.68±30.03 | 141.6±28.14 |
| 正常饲料组 | |||||
| ALT | 40.06±4.19 | 66.09±6.10 | 50.48±4.60 | 58.76±6.34 | 61.68±7.66 |
| AST | 138.53±18.31 | 147.67±28.10 | 170.24±35.60 | 169.87±38.84 | 178.31±24.58 |
| 高脂饲料组 | |||||
| ALT | 38.67±3.86 | 69.14±6.55 | 52.74±10.02 | 58.89±9.41 | 68.83±12.38 |
| AST | 142.98±22.08 | 155.70±34.65 | 171.68±30.80 | 193.65±35.4 | 238.45±41.5 |
| 限食高脂组 | |||||
| ALT | 42.69±5.6 | 66.70±7.80 | 68.55±8.12 | 77.48±9.08 | 71.95±11.01 |
| AST | 147.16±20.88 | 210.83±37.20 | 236.16±25.50 | 288.56±40.5 | 242.17±46.50 |
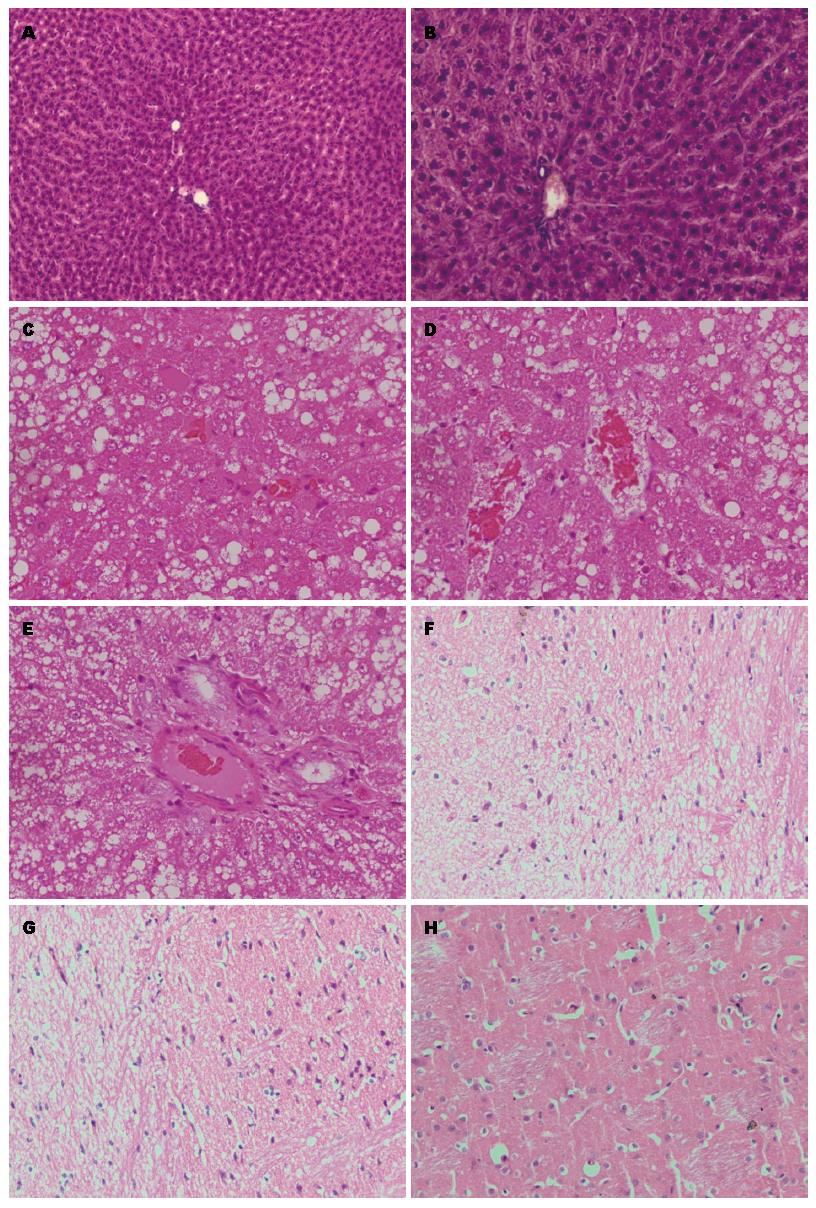
正常对照组肝脏组织形态学正常. 进食正常饲料的9只实验组大鼠均出现了不同程度的脂肪肝表现, 其中22%(2/9)脂肪变性程度轻, 根据酒精性肝病诊疗指南的诊断标准属于F1级[4], 11%(1/9)出现F2级脂肪肝表现, 其余67%(6/9)脂肪肝程度较重属于F3级. 进食高脂饲料的大鼠脂肪肝程度加重达到了F4级, 其中62.5%的大鼠(5/8)还出现了G1-G2级酒精性肝炎的表现, 37.5%的大鼠(3/8)肝脏在电镜下还观察到S1级胶原纤维的增生; 限食高脂组中71.4%(5/7)的大鼠出现了S2-S3级轻重不等的肝纤维化改变同时伴有G1-G2级肝炎和F1级脂肪肝改变; 另外28.6%(2/7)的大鼠肝脏只出现了脂肪肝及肝炎表现.
2.5.1 光镜下改变: 正常对照组: 肝细胞大小及形态正常, 肝细胞境界清晰, 细胞核圆, 位于细胞中央. 细胞索以小叶中央静脉为中心呈放射状排列, 肝窦清晰, 无扩张及充血. 正常饲料组: 肝脏可见酒精性脂肪肝表现, 肝组织内可见呈弥漫性分布的肝细胞脂肪变性, 肝细胞胞浆内可见大小不等的圆形或类圆形脂肪滴, 细胞质疏松, 可见散在嗜酸性变. 高脂饲料组: 光镜下可见肝组织内弥漫的细胞脂肪变性, 胞浆内可见大小不等的脂滴, 部分重度脂肪肝可见肝细胞增大细胞核被大的圆形脂滴挤至细胞边缘, 肝细胞索排列紊乱. 腺泡3带可见明显肝细胞气球样变、点状坏死灶及少量深染的双核肝细胞. 限食高脂组: 腺泡3带可见明显肝细胞气球样变, 有点片状坏死灶, 可见少量深染的双核肝细胞, 有淋巴细胞及中性粒细胞浸润. 腺泡内肝细胞周围纤维化, 可见大量成束胶原纤维及广泛桥接纤维化. 部分区域可见细胞脂肪变性, 脂肪变性的肝细胞在30%以下. 上述炎症、脂肪变性及纤维化改变在肝内呈不均匀分布(图3).
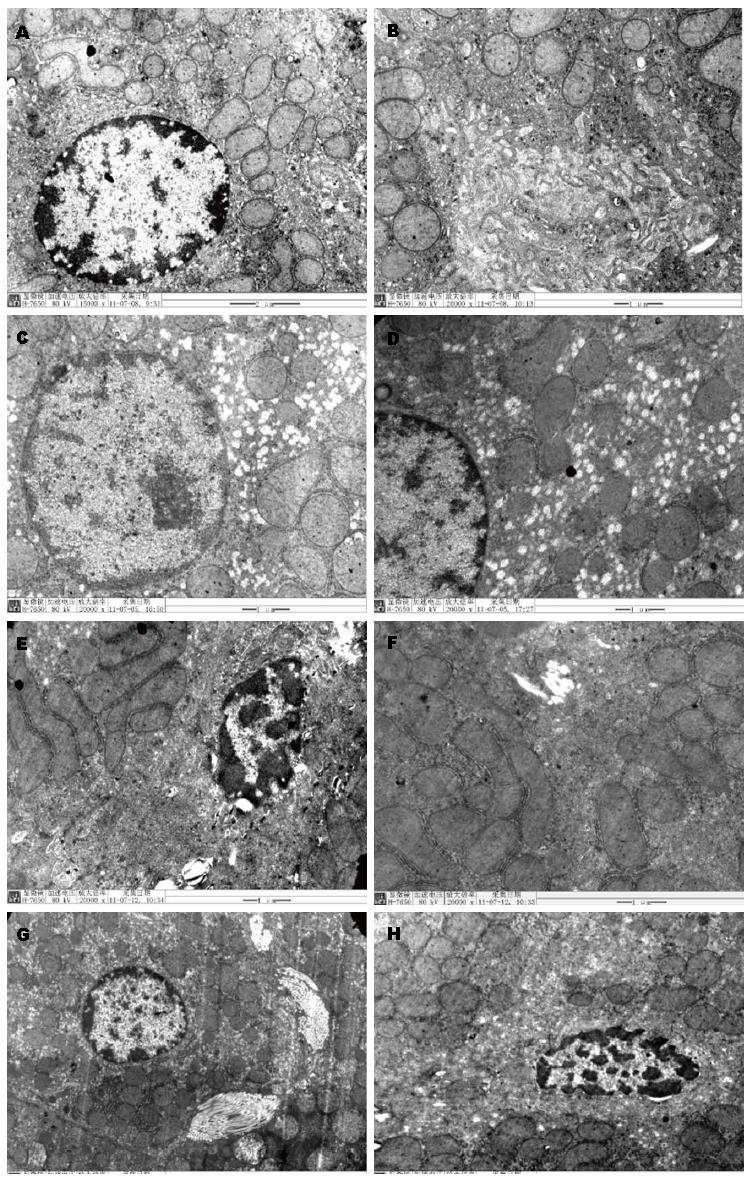
2.5.2 肝组织超微结构改变: 正常对照组: 肝细胞核呈圆形或类圆形, 核仁位于细胞核中央或近中央区. 部分细胞胞浆内含有少量脂滴. 肝细胞间隙及窦周隙无胶原纤维增生及淋巴细胞等炎性细胞浸润, 无线立体肿胀变形及细胞质异常溶解等变化. 正常饲料组: 可见脂肪肝表现. 核仁边集, 核膜略显迂曲, 核周间隙扩张, 细胞质疏松. 线粒体增生、肿胀, 多呈球形, 胞浆内可见大小不等的圆形或类圆形脂滴. 高脂饲料组: 肝细胞面间隙增加, 并出现微绒毛, 窦周间隙和肝细胞间隙可见淋巴细胞浸润, 线粒体增生, 肿胀, 呈球形, 线粒体嵴减少、变短, 细胞质疏松. 细胞间隙中可见少量胶原纤维增生. 细胞内可见圆形及类圆形脂滴. 限食高脂组: 窦周隙被成束的胶原蛋白占据, 肝细胞微绒毛减少, 线粒体呈球形, 线粒体嵴减少、变短, 内质网表面光滑, 呈囊状. 细胞间可见成束的胶原纤维. 细胞内可见少量圆形及类圆形脂滴(图4).
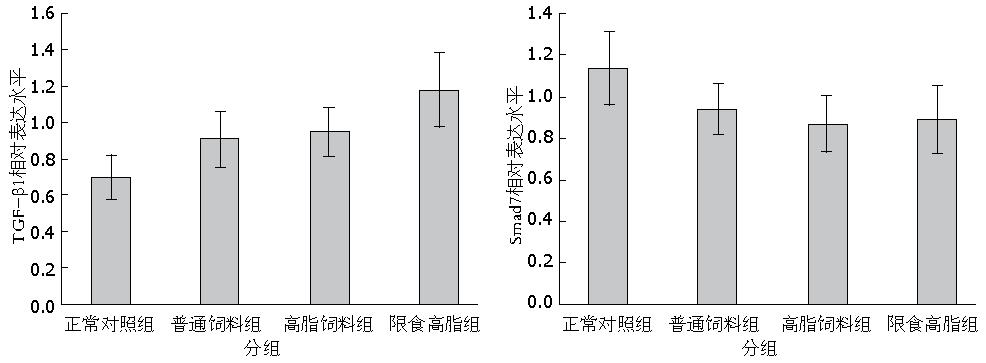
与正常对照组比较实验组肝组织中TGF-β1 mRNA表达水平升高(P<0.05), 在实验组中限食高脂组TGF-β1 mRNA水平表达较普通饲料组及高脂饲料组升高(P<0.05), 而普通饲料组和高脂饲料组比较没有差别(P>0.05). 与正常对照组比较实验组肝组织中Smad7 mRNA表达水平降低(P<0.05), 在实验组中普通饲料组、高脂饲料组及限食高脂组三组组间比较没有差别(P>0.05)(表5, 图5).
| 分组 | TGF-β1 | Smad7 |
| 正常对照组 | 0.70±0.119 | 1.14±0.102 |
| 普通饲料组 | 0.91±0.146 | 0.94±0.091 |
| 高脂饲料组 | 0.95±0.131 | 0.87±0.093 |
| 限食高脂组 | 1.18±0.198 | 0.89±0.077 |
对照组比较各实验组TGF-β1表达均有所升高, 而Smad7表达水平均下降. 从普通饮食组到高脂饮食组再到限食高脂组TGF-β1表达量也逐步升高, 但Smad7表达水平在3个实验中无明显差异(图6).
近年来生活条件的不断提高, 人群的饮酒率明显增加酒精饮料的消费量不断上升. 我国四大地区饮酒情况的调查表明, 一般人群饮酒率为59.5%, 人均年饮酒量折合成纯酒精为3.6 L[5]. 酒精饮料有潜在的成瘾性并可以对人体多种脏器造成损伤. 其中最具代表性的是酒精性肝损伤. 最初表现为脂肪肝和肝炎, 之后可逐渐发展为肝纤维化及肝硬化. 酒精性肝病已经成为我国第2大肝病, 是目前医务工作者面临的重大课题. 该类研究目前主要在动物模型上进行. 有学者用狒狒等灵长类动物历时一年多制作出肝硬化的动物模型, 但动物稀缺、历时长、费用高, 不适于推广使用[6]. 大鼠生来厌酒, 国内多采用酒精灌胃法制备大鼠模型[7-9], 这确实解决了厌酒的问题, 但也存在不可忽视的问题: (1)大鼠死亡率高, 导致模型制备的时间受到限制. 常见的死因为消化系穿孔、酒精误吸入气管引起窒息及吸入性肺炎等; (2)用于灌胃的酒精浓度不能太高, 否则会灼伤大鼠的消化道黏膜, 加之大鼠胃容积仅约3.4 mL[10], 使灌胃的酒精量受到了很大的限制. 肝脏病理学损伤轻微, 绝大多数只能看到脂肪肝、急性或慢性肝炎的病理改变[8]; (3)大鼠饮酒一段时间后会出现易激惹等异常表现, 灌胃者有被咬伤或抓伤的风险. 少数研究中出现了肝纤维化, 但用时长达24 wk[11]. 有研究为了加重肝损伤缩短造模时间而加用四氯化碳、吡唑等药物[9], 该类模型是在酒精及药物的双重作用下形成的, 与人类酒精性肝病的病理过程相差较远. 有研究证明不同病因所致的肝纤维化其细胞外基质形态等存在明显差别[12]. 有研究者通过手术置入导管再用微量泵持续注入酒精的方法控制酒精摄入量[13,14], 但术者需要特殊培训, 手术有一定死亡率, 还要特殊的设备持续注入酒精, 对人员和设备要求高, 应用受到了很大的局限. 酒精性肝硬化动物模型的建立方法有待进一步改进和提高.
在生活中, 饮酒的同时往往进食肉类、油炸食品等高脂饮食. 长期饮酒对肝脏、胰腺及消化系的损伤都非常明显, 食欲不振在长期饮酒的人群中普遍存在. Mezey等[15]研究发现厌食是酒精性肝病患者饮食摄入减少的主要原因, 酒精引起的消化不良也是造成营养不良的因素. 既往的研究也表明, 高脂饮食和热量摄入不足这两个因素均可加重酒精的肝损伤作用[16,17]. 总之, 高脂饮食和热量摄入不足这两个因素既能加重酒精的肝细胞损伤又符合酒精性肝病患者的饮食特点. 因此, 本研究采用酒精、高脂饮食及限制热量摄入这3个处理因素共同作用于大鼠, 以期能缩短酒精性肝纤维化大鼠模型的制备. 不同种类的脂肪酸的作用不同, 鱼油、玉米油等不饱和脂肪酸可加重肝损伤, 而牛油等饱和脂肪酸可起到肝细胞保护作用[18,19], 因此研究中采用玉米油制备高脂饲料. 此外, 有研究表明雌性大鼠比雄性大鼠对酒精更敏感[20-22], 故实验中选用雌性大鼠.
首先, 用低浓度的白酒水溶液作为大鼠唯一水源迫使大鼠饮酒, 之后逐渐提高浓度增加摄人酒精量. 本实验中最初大鼠可以耐受浓度为6%(v/v), 之后逐渐提高酒精浓度, 在1 mo内酒精浓度可以提高到20%(v/v), 第3周时每1 kg体质量摄入酒精量逐渐增至7.5 g/(kg·d)±1.3 g/(kg·d), 第6周达10.6 g/(kg·d)±1.8 g/(kg·d), 饮用白酒稀释液体积13.38 mL/d±2.27 mL/d. 第7周曾尝试给大鼠饮用38%(v/v)未经稀释的白酒, 每1 kg体质量摄入酒精量升至13.9 g/(kg·d)±1.9 g/(kg·d), 但饮用白酒体积下降至9.94 mL/d±1.96 mL/d, 大鼠饮水量不足, 如长期如此必将导致大鼠死亡. 遂将浓度再次降至20%(v/v), 直到第16周实验结束, 大鼠摄入白酒量一直保持稳定. 以第14周为例, 大鼠摄入酒精10.1 g/(kg·d)±1.1 g/(kg·d), 白酒稀释液体积14.02 mL±2.17 mL. 实验结果证明, 以白酒稀释液为唯一水源并逐步提高酒精浓度的方法可以成功克服大鼠的厌酒习性, 第10周之后大鼠甚至出现不同程度的嗜酒表现. 另外, 通过自由饮用的方式酒精摄入量可达10 g/(kg·d). 林红等[7]应用灌胃法制备酒精性肝病大鼠模型, 酒精量以8 g/(kg·d)起始, 至第9周增至10 g/(kg·d). 本实验中第6周就达到了10.6 g/(kg·d)±1.8 g/(kg·d). 周东方等[23]用灌胃法制备大鼠模型, 酒精量为5-9 g/(kg·d). 本研究中大鼠摄入酒精量已达到甚至超过酒精灌胃法注入的酒精量.
饮用白酒稀释液的实验组大鼠ALT及AST较对照组明显升高. 实验组间比较发现, 高脂饲料组及限食高脂组血浆AST较普通饲料组明显升高, ALT水平在3个实验组间无明显差别. 可见酒精可致大鼠肝功能受损, 高脂饮食及限食可增强酒精对肝细胞的损伤作用. 本研究应用光镜及电镜2种方法观察大鼠肝组织形态学变化. 进食正常饲料的实验组大鼠肝脏出现了F1及F3程度不等的脂肪肝表现; 进食高脂饲料的大鼠脂肪肝程度加重达到了F4级, 其中62.5%的大鼠(5/8)还出现了G2级酒精性肝炎的表现, 37.5%的大鼠(3/8)肝脏在电镜下还观察到S1级胶原纤维的增生; 限食高脂组中71.4%(5/7)的大鼠出现了S2-S3级轻重不等的肝纤维化改变同时伴有G2级肝炎F1级脂肪肝改变; 另外28.6%(2/7)的大鼠肝脏只出现了脂肪肝及肝炎表现. 光镜及电镜下的改变证明高脂饲料饮食及限制热量摄入能加重肝脏损伤, 从而缩短模型制备时间. 研究中发现, 脂肪变性, 炎症及纤维化等病理改变在肝脏呈不均匀分布, 这对临床工作中肝脏组织活检有一定的指导意义. 在临床工作中从B超及CT结果可知酒精性脂肪肝可以呈局灶性分布, 在CT结果表现为肝内低密度病灶, B超下可见块状强回声, 需与原发性肝癌进行鉴别诊断. 临床上没有能清晰显示肝炎及肝纤维化的影像学检查, 多采用肝穿活检, 取出几万分之一的肝组织进行病理学检查, 难以观察到炎症及纤维化在整个肝脏的分布. 我们在不同部位取活检可能得到不同结果, 多部位活检可以提高检出率, 更准确评估病变严重程度.
对肝纤维化形成机制的研究表明: 酒精性肝纤维化的出现是由各种促纤维化因子的增多和/或胶原蛋白酶等抑纤维化因子相对不足导致的[24]. TGF-β1是一种属于转化生长因子β超家族的细胞因子, 首次在人的血小板中被发现, 有促进创伤愈合的作用[25]. 此后在人体内还陆续发现了TGF-β2及TGF-β3两个亚型. 这个生长因子家族在纤维化、血管生成、造血和细胞增生等多方面发挥广泛的生物学作用[26]. TGF-β1是为数不多的具有促进纤维化形成及抑制细胞外基质降解双重作用的促纤维化因子, 在肝纤维化形成过程中起到重要作用[27]. 一方面, TGF-β可以诱导部分肝细胞发生上皮间质转化而成为成纤维细胞[28], 从而促进肝纤维化的形成. 另一方面, TGF-β通路可以促进纤溶酶原激活抑制物-1(plasminogen activator inhibitor-1, PAI-1)的转录, 纤溶酶原激活减少, 活性下降, 纤维蛋白生成和降解失衡, 最终造成肝纤维化的形成[29]. 此外, TGF-β1还能通过调节ADH1来增强细胞内氧化应激来加重肝细胞损伤[30]. Smad家族是TGF-β通路的细胞内信号传导分子[2]. Smad7通过阻断Smad2/3磷酸化来阻断信号的传导, 是该通路的主要抑制物[31-33]. Rui等进行的临床实验证实, 酒精性肝纤化患者肝组织中TGF-β1表达水平较正常对照组升高, 说明TGF-β1在肝纤维化的发生过程中起到了促进作用[31]. 为进一步深入探讨TGF-β1在酒精性肝病中的作用机制, 本实验在mRNA及蛋白两个水平同时检测TGF-β1及其抑制物Smad7在肝组织中的表达情况. 结果表明与对照组比较实验组TGF-β1表达均有所升高, 而Smad7表达水平均下降. 本实验中不同的实验组出现了从酒精性脂肪肝、酒精性肝炎到酒精性肝纤维化等不同程度的病变, 随着肝脏组织病理学改变的加重TGF-β1表达量也逐步升高, 但Smad7表达水平在3个实验中无明显差异. 实验结果表明在酒精性肝病中TGF-β1表达的升高及其抑制物Smad7的降低共同发挥了促纤维化作用, 其中TGF-β1表达水平与肝脏损伤程度呈正相关.
实验结果表明, 以白酒稀释液作为唯一水源, 之后逐渐增加酒精浓度可以成功克服大鼠的厌酒习性, 且酒精的摄入量可以达到或超过同类研究中的酒精摄入量. 高脂饮食及限食可加重酒精的肝脏损伤, 到第16周末限食高脂组大鼠中有71.4%(5/7)出现了轻重不等的肝纤维化表现. 应用酒精灌胃法造模的同类研究中实验组大鼠死亡率达22.2%、46.6%, 高低不等[7,34], 而本实验组中死亡率为11.1%(3/27)较灌胃法明显降低. 本研究采用的模型制备方法操作简便、成本低、成模时间相对较短、大鼠死亡率低, 应用的高脂饮食及限食等干预因素符合酒精性肝病患者的饮食特点, 动物模型制备过程更接近于人类发病过程. 实验中发现几乎所有实验组大鼠出现尾尖红肿、渗血, 有一半大鼠的尾尖坏死、变黑并最终脱落. 在之前同类研究中未见相关报道, 发生机制也不清楚, 可能与长期大量饮酒导致末梢循环障碍及末梢神经炎有关, 有待进一步研究.
随着生活水平的提高, 各种酒精饮料的消费量不断升高, 人群的饮酒率不断增加. 酒精性肝病的发病率自然也随之大幅度升高, 成为我国医学工作者必须要应对的研究课题. 国内外多以大鼠或小鼠的动物模型作为研究平台, 但目前的造模方法仍在某些方面存在欠缺, 需进一步完善.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
酒精性肝病发病率高, 发展到晚期病情危重, 对人群的生命健康造成严重威胁. 其发病机制和治疗方法是近年研究的热点. 大量相关研究需要利用大鼠等动物模型进行, 模型的质量和科研成果的价值直接相关, 理想动物模型的制备至关重要. 目前动物模型制备过程中动物死亡率过高, 造模时间过长, 动物模型的肝脏病变轻微, 造模过程与人类患病过程相似性差等问题都需要解决.
近几十年来众多研究者制备了多种酒精性肝硬化动物模型, 其各有优缺点: 以TSUKAMOTO-FRENCH模型为代表的大鼠模型能很好地控制酒精及各种营养素的摄入量, 便于研究酒精和其他营养元素在酒精性肝病中的作用. 用狒狒等灵长类动物也成功制备出了酒精性肝病模型, 模型的制备过程与人类发病过程非常相似.
国外有研究证明热量摄入不足会加重酒精引起的肝脏损伤, 而且雌性大鼠肝脏对酒精更敏感. 本实验选用雌性大鼠并在造模过程中限制其进食量, 结果大鼠肝脏出现了肝纤维化等病理改变.
本研究中的酒精性肝病大鼠模型的制备方法简单、大鼠死亡率低、造模成本低、成模时间相对较短、且研究者不需特殊的技术培训和昂贵的仪器设备, 适用于不同水平的科研实验单位.
本文设计合理, 研究内容丰富, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 2. | Taylor IW, Wrana JL. SnapShot: The TGFbeta pathway interactome. Cell. 2008;133:378.e1. [PubMed] [DOI] |
| 3. | Nanji AA, Mendenhall CL, French SW. Beef fat prevents alcoholic liver disease in the rat. Alcohol Clin Exp Res. 1989;13:15-19. [PubMed] |
| 6. | Lieber CS, DeCarli LM, Mak KM, Kim CI, Leo MA. Attenuation of alcohol-induced hepatic fibrosis by polyunsaturated lecithin. Hepatology. 1990;12:1390-1398. [PubMed] |
| 10. | McConnell EL, Basit AW, Murdan S. Measurements of rat and mouse gastrointestinal pH, fluid and lymphoid tissue, and implications for in-vivo experiments. J Pharm Pharmacol. 2008;60:63-70. [PubMed] [DOI] |
| 12. | 刘 秀英, 胡 怡秀, 胡 余明, 丘 丰, 周 月婵, 臧 雪冰, 聂 焱. 四氯化碳和猪血清肝纤维化模型组织病理比较. 世界华人消化杂志. 2004;12:1875-1879. [DOI] |
| 13. | Han D, Ybanez MD, Johnson HS, McDonald JN, Mesropyan L, Sancheti H, Martin G, Martin A, Lim AM, Dara L. Dynamic adaptation of liver mitochondria to chronic alcohol feeding in mice: biogenesis, remodeling, and functional alterations. J Biol Chem. 2012;287:42165-42179. [PubMed] [DOI] |
| 15. | Mezey E. Interaction between alcohol and nutrition in the pathogenesis of alcoholic liver disease. Seminars in Liver Disease. 1991;11:340-348. |
| 16. | Mendenhall CL, Anderson S, Weesner RE, Goldberg SJ, Crolic KA. Protein-calorie malnutrition associated with alcoholic hepatitis. Veterans Administration Cooperative Study Group on Alcoholic Hepatitis. Am J Med. 1984;76:211-222. [PubMed] |
| 17. | Reinke LA, McCay PB. Spin trapping studies of alcohol-initiated radicals in rat liver: influence of dietary fat. J Nutr. 1997;127:899S-902S. [PubMed] |
| 18. | Buko VU. Beef fat prevents alcoholic liver disease in the rat. Alcohol Clin Exp Res. 1990;14:632. [PubMed] |
| 19. | Ronis MJ, Korourian S, Zipperman M, Hakkak R, Badger TM. Dietary saturated fat reduces alcoholic hepatotoxicity in rats by altering fatty acid metabolism and membrane composition. J Nutr. 2004;134:904-912. [PubMed] |
| 20. | Enomoto N, Takei Y, Kitamura T, Hirose M, Ikejima K, Sato N. Estriol enhances lipopolysaccharide-induced increases in nitric oxide production by Kupffer cells via mechanisms dependent on endotoxin. Alcohol Clin Exp Res. 2002;26:66S-69S. [PubMed] [DOI] |
| 21. | Nanji AA, Jokelainen K, Fotouhinia M, Rahemtulla A, Thomas P, Tipoe GL, Su GL, Dannenberg AJ. Increased severity of alcoholic liver injury in female rats: role of oxidative stress, endotoxin, and chemokines. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1348-G1356. [PubMed] |
| 22. | Thurman RG. Sex-related liver injury due to alcohol involves activation of Kupffer cells by endotoxin. Can J Gastroenterol. 2000;14 Suppl D:129D-135D. [PubMed] |
| 24. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 25. | Assoian RK, Komoriya A, Meyers CA, Miller DM, Sporn MB. Transforming growth factor-beta in human platelets. Identification of a major storage site, purification, and characterization. J Biol Chem. 1983;258:7155-7160. [PubMed] |
| 26. | Falleti E, Fabris C, Toniutto P, Fontanini E, Cussigh A, Bitetto D, Fornasiere E, Avellini C, Minisini R, Pirisi M. TGF-beta1 genotypes in cirrhosis: relationship with the occurrence of liver cancer. Cytokine. 2008;44:256-261. [PubMed] [DOI] |
| 27. | Border WA, Noble NA. Transforming growth factor beta in tissue fibrosis. N Engl J Med. 1994;331:1286-1292. [PubMed] |
| 28. | Zeisberg M, Yang C, Martino M, Duncan MB, Rieder F, Tanjore H, Kalluri R. Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem. 2007;282:23337-23347. [PubMed] [DOI] |
| 29. | Furukawa F, Matsuzaki K, Mori S, Tahashi Y, Yoshida K, Sugano Y, Yamagata H, Matsushita M, Seki T, Inagaki Y. p38 MAPK mediates fibrogenic signal through Smad3 phosphorylation in rat myofibroblasts. Hepatology. 2003;38:879-889. [PubMed] [DOI] |
| 30. | Ciuclan L, Ehnert S, Ilkavets I, Weng HL, Gaitantzi H, Tsukamoto H, Ueberham E, Meindl-Beinker NM, Singer MV, Breitkopf K. TGF-beta enhances alcohol dependent hepatocyte damage via down-regulation of alcohol dehydrogenase I. J Hepatol. 2010;52:407-416. [PubMed] [DOI] |
| 31. | Nakao A, Afrakhte M, Morén A, Nakayama T, Christian JL, Heuchel R, Itoh S, Kawabata M, Heldin NE, Heldin CH. Identification of Smad7, a TGFbeta-inducible antagonist of TGF-beta signalling. Nature. 1997;389:631-635. [PubMed] [DOI] |
| 32. | Hayashi H, Abdollah S, Qiu Y, Cai J, Xu YY, Grinnell BW, Richardson MA, Topper JN, Gimbrone MA, Wrana JL. The MAD-related protein Smad7 associates with the TGFbeta receptor and functions as an antagonist of TGFbeta signaling. Cell. 1997;89:1165-1173. [PubMed] |
| 33. | Souchelnytskyi S, Nakayama T, Nakao A, Morén A, Heldin CH, Christian JL, ten Dijke P. Physical and functional interaction of murine and Xenopus Smad7 with bone morphogenetic protein receptors and transforming growth factor-beta receptors. J Biol Chem. 1998;273:25364-25370. [PubMed] |