修回日期: 2014-04-20
接受日期: 2014-04-28
在线出版日期: 2014-06-28
目的: 评估单药替吉奥(gimeracil and oteracil porassium capsules, S-1)方案在放弃静脉化疗晚期结直肠癌患者辅助化疗中有效性和安全性.
方法: 采用诊断位置(结肠癌 vs 直肠癌)作为分层因子, 对有明确组织学或细胞学诊断且放弃全身静脉化疗的83例晚期老年结直肠癌患者随机分为两组: 对照组(常规支持对症组)42例, 试验组(S-1治疗组)41例, 将所有合格受试者应用随机数字表随机分配到对照组和试验组. 试验组接受常规支持对症治疗+单药S-1治疗方案: S-1 60 mg/(m2·d), bid, 连续服用2 wk后休息1 wk, 每3 wk重复1次, 6 wk为一疗程, 直至患者出现疾病进展或不可耐受的毒性反应才停止治疗. 对照组只接受常规支持对症治疗.
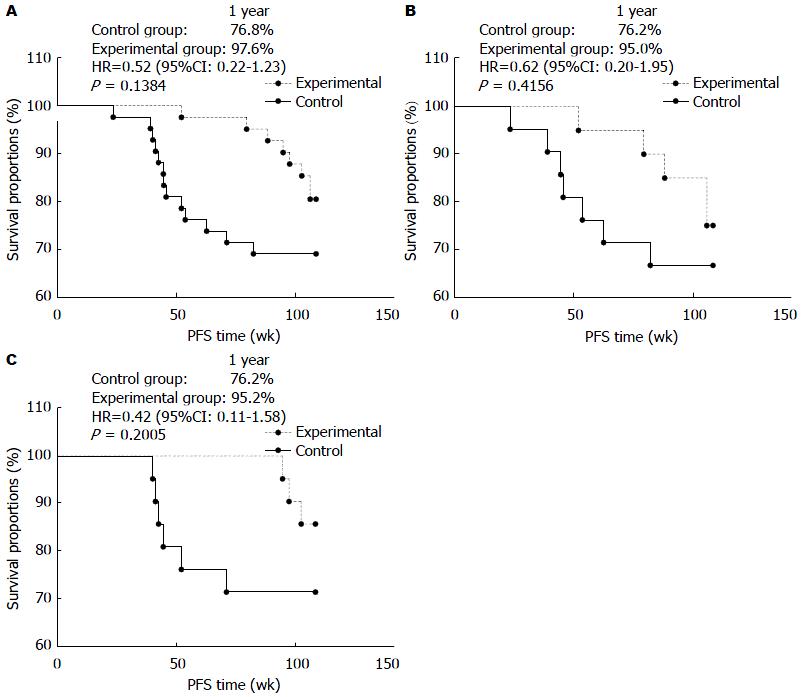
结果: 本试验共入组83例受试者, 对照组42例, 试验组41例. 两组间基线资料分布平衡, 中位随访时间为54 wk. 虽然S-1单药治疗组PFS较对照组PFS在统计学上未达到显著差异(HR = 0.52, 95%CI: 0.22-1.23, P = 0.1384>0.05), 但对照组1年无进展生存期(progression free survival, PFS)为78.6%, 试验组1年PFS为97.6%. 试验组较对照组1年PFS提高19%, 有明显临床获益趋势. 进一步分析所有晚期结肠癌患者, 试验组和对照组相比, PFS差异未有统计学意义(HR = 0.62, 95%CI: 0.20-1.95, P = 0.4156>0.05), 对照组1年PFS为76.2% , 试验组1年PFS为95.0% , 试验组较对照组1年PFS显著提高18.8%, 有明显临床获益趋势. 进一步分析所有晚期直肠癌患者, 虽然试验组较对照组PFS差异未达到统计学意义(HR = 0.42, 95%CI: 0.11-1.58, P = 0.2005>0.05), 但对照组1年PFS为76.2%, 试验组1年PFS为95.2%, 试验组较对照组1年PFS提高19%, 有明显获益趋势. S-1引起的不良反应有3例, 其中1例为2级不良反应, 2例为1级不良反应, 未因不良反应而停药.
结论: S-1单药用于晚期结直肠癌患者, 能够使结肠癌患者PFS显著提高, 有明显获益趋势, 同时降低转移复发风险, 提示应用S-1辅助化疗可能使晚期结直肠癌患者生存获益, 且安全性良好.
核心提示: S-1单药用于晚期结直肠癌患者治疗, 能够使结肠癌患者无进展生存期(progression free survival, PFS)显著提高, 有明显获益趋势, 同时降低转移复发风险, 提示应用S-1辅助化疗可能使晚期结直肠癌患者生存获益, 且安全性良好.
引文著录: 高波, 李兴华. 替吉奥单药在晚期结直肠癌辅助化疗中的疗效. 世界华人消化杂志 2014; 22(18): 2650-2656
Revised: April 20, 2014
Accepted: April 28, 2014
Published online: June 28, 2014
AIM: To evaluate the efficacy and safety of gimeracil and oteracil porassium capsules (S-1) as a single drug in the adjuvant treatment of patients with advanced colorectal cancer.
METHODS: Eligible patients with advanced colorectal cancer were randomly assigned to either a control group or an experimental group. The patients of the control group received routine symptomatic treatment, while the experimental group was additionally given S-1 [60 mg/(m2•d), bid, P.O. on days 1-14, then drug withdrawal for 1 wk, repeated every 3 wk, stopped until disease progression or unacceptable toxicity occurred] beside the routine symptomatic treatment.
RESULTS: A total of 83 eligible patients were enrolled, including 4 in the control group and 41 in the experimental arm. Median follow-up period was 54 wk. The baseline characteristics were comparable between the two groups. S-1 treatment improved the progression-free survival (PFS), though there was no statistical difference (HR = 0.52, 95%CI: 0.22-1.23, P = 0.1384). For all patients with advanced colorectal cancer, the 1-year PFS for the control arm and experimental arm was 78.6% and 97.6%, respectively, favoring the S-1 regimen. For patients with advanced colon cancer, the improvement of PFS did not differ significantly between the two arms (HR = 0.62, 95%CI: 0.20-1.95, P = 0.4156). The 1-year PFS for the control arm and experimental arm was 76.2% and 95.0%, favoring the S-1 regimen. For patients with advanced rectal cancer, the improvement of PFS did not differ significantly between the two arms (HR = 0.42, 95%CI: 0.11-1.58, P = 0.2005). The 1-year PFS for the control arm and experimental arm was 76.2% and 95.2%, respectively. Three cases developed S-1-induced adverse reactions, including one case of grade Ⅱ and two cases of grade Ⅰ, which, however, did not cause treatment discontinuation.
CONCLUSION: S-1 can improve the PFS in patients with advanced colorectal cancer, indicating that such patients may benefit from S-1 regimen in the adjuvant setting.
- Citation: Gao B, Li XH. Gimeracil and oteracil porassium capsules as a single drug in adjuvant treatment of patients with advanced colorectal cancer: A randomized clinical study. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2650-2656
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2650.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2650
结直肠癌(colorectal cancer, CRC)是为临床常见的恶性肿瘤之一, 其在全球的发病率和病死率占前3位[1]. 据统计, 全球每年CRC新发病例约120万例, 死亡病例高达近60万例[1]. 近年, 随着生活水平的提高, 我国CRC发病率呈逐年升高趋势, 特别是在东部沿海经济发达地区, CRC发病率已接近发达国家水平, 在大城市中已成为导致死亡的主要原因[2], 预计我国CRC新发病例仍将逐年增多[3]. CRC的高发病率和高死亡率, 已成为人类的一大疾病负担[1,2]. 在我国, CRC的发病呈老年趋向化[4]. 现今, 我国老龄化人口的日益增加, 因老年患者体弱, 各组织器官功能的下降, 机体不能很好地耐受静脉全身化疗, 而我国作为人口大国, 随着老龄化人口的增多和肿瘤发病率在我国的增加, 急切需要一种给药方便, 且能被各年龄层的肿瘤患者耐受的药物. 于CRC患者而言, 外科手术治疗是最有效的治疗方法, 而对于部分失去手术机会的晚期CRC患者或术后复发处于特晚期的患者, 不愿再接受如放疗或全身静脉化疗, 多数晚期CRC患者选择支持对症的姑息治疗, 但仍有一些晚期及复发转移患者, 愿意口服低毒性化疗药物[5], 如FT-207、替吉奥胶囊等. 化疗已成为晚期大肠癌的主要治疗手段. 目前, CRC的辅助化疗方案主要以FOLFOX、FOLFIRI或CAPE/L-OHP联合方案为主[6]. 由于静脉给药不方便, 上述方案药物引起的不良反应较为严重使患者不能耐受, 导致患者依从性差. 治疗CRC的基本化疗药物5-氟尿嘧啶(5-fluorouracil, 5-Fu)半衰期短, 与癌细胞作用时间短, 影响了其抗癌效应, 近几年, 作为氟尿嘧啶的衍生物-S-1在CRC的治疗方面越来越受到重视.
S-1是一种氟尿嘧啶衍生物口服抗癌剂, 他包括活性成分替加氟(FT)和以下两种生物调节剂: 吉美嘧啶(gimeracil, CDHP)及奥替拉西(oteracil potassium, Oxo). 三者按摩尔比为1:0.4:1制成的口服胶囊制剂, 是5-Fu的增效减毒改良制剂[7]. 其三种组分的作用如下: FT是5-Fu的前体药物, 具有良好的口服生物利用度, 能在活体内转化为5-Fu, 能干扰和阻断DNA、RNA及蛋白质合成. CDHP能够抑制在二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD)作用下从FT释放出来的5-Fu的分解代谢, 有助于长时间血中和肿瘤组织中5-Fu有效浓度, 从而取得与5-Fu持续静脉输注类似的疗效. Oxo能够阻断5-Fu的磷酸化, 口服给药之后, Oxo在胃肠组织中具有很高的分布浓度, 从而影响5-Fu在胃肠道的分布, 进而降低5-Fu不良反应. 替吉奥与5-Fu相比具有以下优势: (1)维持较高的血药浓度并提高抗癌活性; (2)明显减少药物不良反应; (3)给药方便.
在日本, 替吉奥目前已被批准用于治疗晚期胃癌、头颈部癌、直肠癌、非小细胞肺癌、转移性乳腺癌和胰腺癌等7类肿瘤疾病, 已经成为日本治疗晚期胃癌的一线用药. 在中国首先获批的适应症为不能切除的局部晚期或转移性胃癌. 既往国外研究显示, 单药S-1治疗转移性CRC有效率可达35%-40%, 62例患者总生存期12 mo(378 d), 两年生存率达21%, 单药取得了和持续静滴5-Fu/LV类似的效果[8]; SIR(S-1/CPT-11)方案比传统方案在安全性和生存期上能提供更多益处: SIR联合治疗方案有效率(response rate, RR)为62.5%, 5-Fu civ/LV/CPT-11传统方案RR为31%-62%, CAPE/CPT-11方案RR为47%-61%[9], 更多的研究[10]也证实了这一点; 国内一项S-1联合依立替康(观察组)与5-Fu、亚叶酸钙联合依立替康(对照组)在CRC二线治疗中的对比研究显示[11]: 观察组的中位无进展时间为6.5 mo, 明显优于对照组的, 4.7 mo(P<0.05). 观察组的疾病控制率比较无明显差异性(观察组: 73.1%, 对照组: 68.0%, P>0.05). 主要不良反应比较也无明显差异性(观察组的中性粒细胞减少52.0%, Ⅲ-Ⅳ度腹泻19%, 对照组的中性粒细胞减少34.6%, Ⅲ-Ⅳ度腹泻4.0%, P>0.05), 因样本量不大, 要观察SIR方案比5-Fu civ/LV/CPT-11方案临床优势, 有待进一步研究. 最近, 国外的一项大型、多中心的II期临床试验也证实在晚期CRC的治疗中, SIR方案比传统的FOLFIRI和IRIS方案更有效、方便、更安全[12].
SOX(S-1/L-OHP)方案有望成为转移性CRC安全有效的治疗方案, SOX方案RR: 50.0%, 中位PFS(median PFS, mPFS)196 d, 1年生存期78.6%[13]. 国内一项以36例未接受过化疗的晚期CRC患者为对象的研究[14], 对比分析了S-1联合奥沙利铂(试验组)和奥沙利铂联合5-氟尿嘧啶、亚叶酸钙(对照组)一线治疗晚期CRC的临床疗效, 结果显示, RR分别为56.1%和44.4%, 中位生存时间(medium survival time, MST)分别为18.6和16.2 mo, 中位疾病进展时间(medium time to progression, MTTP)分别为9.3和8.8 mo. 主要不良反应为血液学毒性和胃肠道反应, 试验组白细胞下降发生率66.7%, 对照组77.8%, 试验组恶心、呕吐发生率44.4%, 对照组66.7%. 鉴于多数临床试验表明, S-1在临床应用中具有良好的临床获益和安全性. 因此, 本研究拟评估S-1单药方案在晚期CRC患者辅助化疗中的有效性和安全性.
选择2011-12/2013-08我院收治的晚期CRC患者83例, 随机分配到试验组和对照组, 常规支持对症组(对照组)42例, 其中结肠癌21例, 直肠癌21例; 常规支持对症+S-1组(试验组)41例, 其中结肠癌20例, 直肠癌21例. 本试验中位随访时间为12 mo. 入组标准: 所有的受试者均需明确病理证实为结直肠腺癌; 年龄≥60岁; KPS评分>60分; 预计生存期>6 mo; 无其他危及生命的重大疾病; 有恶性肿瘤化疗指征; 放弃静脉所有静脉化疗方案; 所有受试者均需在随访开始的2 wk内进行随机分配; 且在随机分配后2 wk内应用辅助化疗; 同意参加研究并能完成治疗计划者. 排除标准: 参与试验前2 mo内已经进行过化疗或放疗者; 有明显肝肾功能异常者(ALT高于正常上限的1.5倍, 血肌酐高于正常上限者); 试验前12 mo内有心肌梗死者; 重度心衰者等. 统计学处理: 本试验假定试验组1年无进展生存期(progression free survival, PFS)为95%和对照组为75%, 试验组较对照组有20%PFS提高, 应用80%(β = 0.20)的检验效能, I类错误为5%(α = 0.05)的情况下, 则需入组88例患者, 但现实中在2011-12/2013-08本试验总共入组83例患者. 应用Kaplan-Meier方法绘制PFS曲线. 应用Log-rank双侧检验对生存率进行分析, 本研究截止日期为2014-01-31.
1.2.1 试验设计: 本研究为单中心临床随机对照试验. 该试验通过本中心伦理委员会批准, 符合赫尔辛基及其修订版本宣言. 所有受试者在入组参加临床试验前均需签署知情同意书.
1.2.2 治疗方案: 本研究采用诊断位置(结肠癌 vs直肠癌)作为分层因素, 应用随机数字表使所有受试者被随机分配到试验组和对照组. 本研究定义治疗方案如下: 试验组接受常规支持对症治疗+单药S-1治疗方案: S-1 60 mg/(m2·d), bid, 连续服用2 wk后休息1 wk, 每3 wk重复1次, 6 wk为一疗程, 直至患者出现疾病进展或不可耐受的毒性反应才停止治疗. 对照组只接受常规支持对症治疗. S-1在试验中不接受剂量调整. 但是受试者如果有3级以上的缺血性损害或者任何4级的不良反应, 则中断S-1治疗. 毒性评估标准参考NCI CTCAE 3.0版(National Cancer Institute Common Terminology Criteria for Adverse Events version 3.0).
1.2.3 评估与随访: 所有受试者需在入组后进行第一次辅助化疗前2 wk内进行完整的体格检查, 肝肾功能、肿瘤指标检测、心电图、KPS评估、上下腹部、胸部CT扫描评估等. 随后进行每次辅助化疗前也必须进行体检, 肝肾功能、肿瘤指标检查. 在第1次化疗后前2年, 每3 mo进行一次CT扫描肿瘤评估, 以后每隔6 mo复查1次. 肠镜检查每半年1次. 但是, 如果患者临床表现提示有疾病进展可能, 则需立即进行CT扫描和肠镜检查评估. 临床疗效评估采用RECIST1.1版(Response Evaluation Criteria for Solid Tumors 1.1).
统计学处理 采用SPSS16.0统计软件包进行统计分析. P<0.05为差异有统计学意义.
CRC PFS 两组患者间所有基线指标基本平衡, 两组间具有可比性(表1). 至2014-01-31, 对照组有13例(31.0%)患者, 试验组有8例患者(19.5%)发生进展或死亡. 如图1A所示, 我们观察到试验组和对照组PFS, 虽然尚未达到差异有统计学意义(HR = 0.52, 95%CI: 0.22-1.23, P = 0.1384), 但PFS曲线有明显提高. 对照组1年PFS为78.6%, 试验组1年PFS为97.6%. 试验组对照组1年PFS提高19%, 说明S-1可能使晚期CRC患者长期持续显著获益. 由于疾病位置是影响患者预后的主要影响因素之一, 因此, 有必要对结肠癌和直肠癌患者分别进一步深入分析.
| 特征变量 | 对照组 | 试验组 | κ2 | P值 |
| 诊断 | 0.012 | >0.05 | ||
| 结肠癌 | 21 | 20 | ||
| 直肠癌 | 21 | 21 | ||
| 性别 | 0.303 | >0.05 | ||
| 男 | 20 | 22 | ||
| 女 | 22 | 19 | ||
| 年龄(岁) | 0.055 | >0.05 | ||
| <65 | 8 | 7 | ||
| ≥65 | 34 | 34 | ||
| 分期 | 0.012 | >0.05 | ||
| Ⅲ期 | 21 | 21 | ||
| Ⅳ期 | 21 | 20 | ||
| 分化程度 | 0.931 | >0.05 | ||
| 分化差 | 12 | 8 | ||
| 分化好 | 30 | 33 | ||
| 肿瘤浸润程度 | 2.233 | >0.05 | ||
| 未突破浆膜层 | 10 | 16 | ||
| 突破浆膜层 | 32 | 25 | ||
| 淋巴结转移 | 0.404 | >0.05 | ||
| 否 | 6 | 8 | ||
| 是 | 36 | 33 |
两组患者间所有基线指标基本平衡, 两组间具有可比性(表2). 在晚期结肠癌患者中, 对照组有5例(23.8%), 试验组有3例(15.0%)发生进展或死亡. 如图1B所示, 我们观察到试验组较对照组PFS有明显提高, 但尚未达到差异有统计学意义(HR = 0.62, 95%CI: 0.20-1.95, P = 0.4156). 对照组1年PFS为76.2%, 试验组1年PFS为95.0%, 试验组较对照组1年PFS显著提高18.8%, 说明S-1在1年内对结肠癌患者有显著疗效, 有明显获益趋势现象.
| 特征变量 | 对照组 | 试验组 | κ2 | P值 |
| 结肠癌 | 21 | 20 | 0.012 | >0.05 |
| 性别 | 0.210 | >0.05 | ||
| 男 | 9 | 10 | ||
| 女 | 12 | 10 | ||
| 年龄(岁) | 0.671 | >0.05 | ||
| <65 | 4 | 2 | ||
| ≥65 | 17 | 18 | ||
| 分期 | 0.631 | >0.05 | ||
| Ⅲ期 | 11 | 8 | ||
| Ⅳ期 | 10 | 12 | ||
| 分化程度 | 0.176 | >0.05 | ||
| 分化差 | 3 | 2 | ||
| 分化好 | 18 | 18 | ||
| 肿瘤浸润程度 | 2.172 | >0.05 | ||
| 未突破浆膜层 | 4 | 8 | ||
| 突破浆膜层 | 17 | 12 | ||
| 淋巴结转移 | 0.287 | >0.05 | ||
| 否 | 2 | 3 | ||
| 是 | 19 | 17 |
两组患者间所有基线指标平衡, 两组间具有可比性(表3). 在晚期直肠癌患者中, 对照组有8例(38.1%), 试验组有5例(23.8%)发生进展或死亡. 如图1C所示, 试验组较对照组PFS差异无统计学意义(HR = 0.42, 95%CI: 0.11-1.58, P = 0.2005). 对照组1年PFS为76.2%, 试验组1年PFS为95.2%, 试验组较对照组1年PFS提高19%, 有明显获益趋势. 说明S-1对晚期直肠癌患者有显著疗效, 有明显的临床获益趋势.
| 特征变量 | 对照组 | 试验组 | κ2 | P值 |
| 直肠癌 | 21 | 21 | 0.012 | >0.05 |
| 性别 | 0.096 | >0.05 | ||
| 男 | 11 | 12 | ||
| 女 | 10 | 9 | ||
| 年龄(岁) | 0.141 | >0.05 | ||
| <65 | 4 | 5 | ||
| ≥65 | 17 | 16 | ||
| 分期 | 0.865 | >0.05 | ||
| Ⅲ期 | 10 | 13 | ||
| Ⅳ期 | 11 | 8 | ||
| 分化程度 | 0.933 | >0.05 | ||
| 分化差 | 9 | 6 | ||
| 分化好 | 12 | 15 | ||
| 肿瘤浸润程度 | 0.429 | >0.05 | ||
| 未突破浆膜层 | 6 | 8 | ||
| 突破浆膜层 | 15 | 13 | ||
| 淋巴结转移 | 0.141 | >0.05 | ||
| 否 | 4 | 5 | ||
| 是 | 17 | 16 |
目前, CRC作为全世界排名第3位的常见恶性肿瘤(在男性常见肿瘤中排名第3位, 女性中排名第2位), 2012年全球新增约1410万例癌症病例, 癌症死亡人数达820万例, 其中CRC病例有140万例, 占9.7%, 死亡人数占发病人数的一半以上, 其高发病率和死亡率已成为人类疾病负担之一[1,15]. 在新发病例中, 局部进展期CRC约占75.0%, 根治术后远处转移或复发是致死的主要原因[16,17]. 研究表明, 辅助化疗后CRC远处转移或复发和死亡风险的降低可能是通过化疗药物根除隐匿性转移灶来实现[18,19], 使CRC患者获得临床治愈的可能, 因此, 晚期CRC的辅助化疗对提高患者生存率具有重大临床意义.
在CRC患者中, 直肠癌约占1/3, 因以往直肠癌患者的生存率比结肠癌患者的低, 故认为直肠癌比结肠癌的恶性程度高[20-23]. 因近二十年来直肠癌的治疗水平有很大的进步, 直肠癌患者的生存率有了很大提高. 有研究报道称, 直肠癌患者生存率已接近或达到与结肠癌结果[24]. 既往的CRC的临床试验中, 结肠癌和直肠癌的治疗都是相同的方案, 临床上针对直肠癌的治疗方案是来自既往对结肠癌的研究, 并非来自对直肠癌的研究. 因此, 本试验同时将结肠癌和直肠癌纳入研究中具有合理性. 因结肠和直肠的淋巴引流和解剖结构上的差异[23], 直肠癌与结肠癌可能具有不同生物学特性, 对化疗药物的反应可能也会有所不同, 所以, 本试验将结肠癌和直肠癌作为一分层因子, 对CRC作一整体分析后, 有必要对结肠癌和直肠癌再单独做进一步研究分析. 既往有研究表明, 单药S-1治疗转移性CRC有效率可达35%-40%, 两年生存率达21%[8]. Lee等[25]研究表明单药S-1治疗一线化疗方案(FOLFOX、XELOX、FOLFIRI、XELOX+阿瓦斯汀和西妥珠单抗+伊立替康)失败的转移性CRC患者疗效肯定, 且安全性好. 本试验中, 试验组和对照组PFS虽然尚未达到差异有统计学意义, 但DFS曲线有明显提高, 试验组对照组1年PFS提高19%(HR = 0.52, 95%CI: 0.22-1.23, P = 0.1384), 有明显临床获益趋势. 进一步单独分析结肠癌和直肠癌, 虽然结肠癌组和直肠癌组中试验组和对照组PFS未达到差异有统计学意义, 但结肠癌组中试验组较对照组1年PFS显著提高18.8%(HR = 0.62, 95%CI: 0.20-1.95, P = 0.4156), 直肠癌组中试验组较对照组1年PFS提高19%(HR = 0.42, 95%CI: 0.11-1.58, P = 0.2005), 临床获益还是明显可见的. 对S-1单药治疗CRC的长期获益趋势, 未来有必要进一步对结肠癌和直肠癌患者单药S-1治疗后3、5年的生存率进行深入研究.
S-1作为5-Fu的衍生物, 他包括活性成分替加氟(tegafur, FT)和以下两种生物调节剂: CDHP及Oxo, 是5-Fu的增效减毒改良制剂[7]. FT是5-Fu的前体药物, 具有良好的口服生物利用度, 能在活体内转化为5-Fu, 能干扰和阻断DNA、RNA及蛋白质合成. 5-Fu在体内被二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD)降解, 使得其活性降低. DPD是一种细胞溶质酶, 为5-FU降解代谢中的第一个酶, 可以将85%的5-FU去活性[26,27]. 而CDHP能够抑制在DPD作用下从FT释放出来的5-Fu的分解代谢, 有助于长时间血中和肿瘤组织中5-Fu有效浓度, 从而取得与5-Fu持续静脉输注类似的疗效. 5-Fu单独口服时吸收不完全且难以预测, 如果其在胃肠道中的分布浓度很高且被磷酸化, 就会引起严重的胃肠道不良反应, 而Oxo能够阻断5-Fu的磷酸化, 口服给药之后, Oxo在胃肠组织中具有很高的分布浓度, 从而影响5-Fu在胃肠道的分布, 进而降低5-Fu的不良反应. S-1抗肿瘤过程中既产生了明显的临床效益, 安全性又得到了一定保障, 且口服方便, 适用于晚期老年的肿瘤患者.
总之, S-1单药用于晚期CRC患者, 能够使结肠癌患者PFS显著提高, 有明显获益趋势, 同时降低转移复发风险, 提示应用S-1辅助化疗可能使晚期CRC患者生存获益, 且安全性良好.
随着老龄化人口的增多和肿瘤发病率在我国的增加, 急切需要一种给药方便, 且能被各年龄层的肿瘤患者耐受的药物, 抗癌活性高毒不良反应小的口服化疗药物-替吉奥S-1带来了福音.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
替吉奥(S-1)在我国的适应症只是针对于胃癌而言, 而日本研究显示S-1对治疗晚期胃癌、头颈部癌、直肠癌、非小细胞肺癌、转移性乳腺癌和胰腺癌等有显著疗效, 本研究就S-1在中国晚期结直肠癌患者中的疗效进行评价, 尚需多中心的临床随机试验进一步验证.
Ohtsu等研究显示单药S-1治疗转移性结直肠癌(colorectal cancer, CRC)有效率可达35%-40%, 62例患者总生存期12 mo(378 d), 两年生存率达21%, 单药取得了和持续静滴5-Fu/LV类似的效果.
本研究主要以无进展生存期(progression free survival, PFS)为主要观察指标, 尚无S-1应用于晚期结直肠癌患者的此类观察研究.
本文通过研究S-1在结直肠癌的研究, 显示良好的疗效, 表示S-1在临床上应用有一定价值, 因为口服方便且不良反应小, 可提高患者的依从性, 既有临床实用价值, 又有经济效益价值.
本文选题较新颖, 提供了充足有意义的信息, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 7. | Benson AB. S-1: another oral agent for patients with colorectal cancer. Lancet Oncol. 2013;14:1244-1245. [PubMed] [DOI] |
| 8. | Ohtsu A, Baba H, Sakata Y, Mitachi Y, Horikoshi N, Sugimachi K, Taguchi T. Phase II study of S-1, a novel oral fluorophyrimidine derivative, in patients with metastatic colorectal carcinoma. S-1 Cooperative Colorectal Carcinoma Study Group. Br J Cancer. 2000;83:141-145. [PubMed] |
| 9. | Goto A, Yamada Y, Yasui H, Kato K, Hamaguchi T, Muro K, Shimada Y, Shirao K. Phase II study of combination therapy with S-1 and irinotecan in patients with advanced colorectal cancer. Ann Oncol. 2006;17:968-973. [PubMed] |
| 10. | Shiozawa M, Akaike M, Sugano N, Tsuchida K, Yamamoto N, Morinaga S. A phase II study of combination therapy with irinotecan and S-1 (IRIS) in patients with advanced colorectal cancer. Cancer Chemother Pharmacol. 2010;66:987-992. [PubMed] [DOI] |
| 12. | Ogata Y, Tanaka T, Akagi Y, Ishibashi N, Tsuji Y, Matono K, Isobe M, Sueyoshi S, Kaibara A, Shirouzu K. Multicenter Phase II Study of a New Effective S-1 and Irinotecan Combination Schedule in Patients with Unresectable Metastatic or Recurrent Colorectal Cancer. Clin Med Insights Oncol. 2013;7:21-30. [PubMed] [DOI] |
| 13. | Yamada Y, Tahara M, Miya T, Satoh T, Shirao K, Shimada Y, Ohtsu A, Sasaki Y, Tanigawara Y. Phase I/II study of oxaliplatin with oral S-1 as first-line therapy for patients with metastatic colorectal cancer. Br J Cancer. 2008;98:1034-1038. [PubMed] [DOI] |
| 15. | Ferlay J, Bray F, Parkin DM. Globocan 2012: Estimates Cancer Incidence, Mortality and Prevalence Wordwild in 2012. Available from: http://globocan.iarc.fr/Default.aspx. |
| 16. | Glimelius B, Cavalli-Björkman N. Metastatic colorectal cancer: current treatment and future options for improved survival. Medical approach--present status. Scand J Gastroenterol. 2012;47:296-314. [PubMed] [DOI] |
| 17. | Sargent D, Shi Q, Yothers G, Van Cutsem E, Cassidy J, Saltz L, Wolmark N, Bot B, Grothey A, Buyse M. Two or three year disease-free survival (DFS) as a primary end-point in stage III adjuvant colon cancer trials with fluoropyrimidines with or without oxaliplatin or irinotecan: data from 12,676 patients from MOSAIC, X-ACT, PETACC-3, C-06, C-07 and C89803. Eur J Cancer. 2011;47:990-996. [PubMed] [DOI] |
| 18. | Marin JJ, Sanchez de Medina F, Castaño B, Bujanda L, Romero MR, Martinez-Augustin O, Moral-Avila RD, Briz O. Chemoprevention, chemotherapy, and chemoresistance in colorectal cancer. Drug Metab Rev. 2012;44:148-172. [PubMed] [DOI] |
| 19. | Tsai WS, Hsieh PS, Yeh CY, Chiang JM, Tang R, Chen JS, Changchien CR, Wang JY. Long-term survival benefits of adjuvant chemotherapy by decreasing incidence of tumor recurrence without delaying relapse in stage III colorectal cancer. Int J Colorectal Dis. 2011;26:1329-1338. [PubMed] [DOI] |
| 20. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 21. | O'Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst. 2004;96:1420-1425. [PubMed] |
| 22. | Greene FL, Stewart AK, Norton HJ. New tumor-node-metastasis staging strategy for node-positive (stage III) rectal cancer: an analysis. J Clin Oncol. 2004;22:1778-1784. [PubMed] |
| 23. | Li M, Li JY, Zhao AL, Gu J. Colorectal cancer or colon and rectal cancer? Clinicopathological comparison between colonic and rectal carcinomas. Oncology. 2007;73:52-57. [PubMed] [DOI] |
| 24. | Renouf DJ, Woods R, Speers C, Hay J, Phang PT, Fitzgerald C, Kennecke H. Improvements in 5-year outcomes of stage II/III rectal cancer relative to colon cancer. Am J Clin Oncol. 2013;36:558-564. [PubMed] [DOI] |
| 25. | Lee DJ, Lee J, Lee HY, Lim T, Lee SJ, Yi SY, Park SH, Park JO, Lim HY, Kang WK. Salvage S-1 monotherapy in metastatic colorectal cancer patients who failed irinotecan-based or oxaliplatin-based chemotherapy. Med Oncol. 2011;28 Suppl 1:S291-S294. [PubMed] [DOI] |
| 27. | Diasio RB. Oral DPD-inhibitory fluoropyrimidine drugs. Oncology (Williston Park). 2000;14:19-23. [PubMed] |