修回日期: 2014-04-22
接受日期: 2014-04-30
在线出版日期: 2014-06-28
目的: 探讨姜黄素(curcumin, Cur)抑制胰腺癌细胞上皮间质转化(epithelial-mesenchymal transition, EMT)及其影响胰腺癌侵袭转移的潜在机制.
方法: 常规培养3种不同分化特征的胰腺癌细胞株PANC-1、AsPC-1、BxPC-3细胞, 采用Western blot法检测其EMT标志物E-cadherin、Vimentin蛋白的表达.以终浓度10 ng/mL的转化生长因子-β1(transforming growth factor beta1, TGF-β1)处理低分化PANC-1细胞24 h后, 在倒置显微镜下观察其形态变化. 分别以10 ng/mL TGF-β1、10 μmol/L Cur+10 ng/mL TGF-β1、10 μmol/L Cur处理PANC-1细胞, 另设空白对照组, 分别采用Real-time PCR及Western blot法检测各组E-cadherin、Vimentin表达变化.
结果: Western blot结果显示, PANC-1、AsPC-1、BxPC-3细胞的E-cadherin蛋白表达依次增强(1.00±00、1.36±0.04、2.14±0.06, P<0.05), 而Vimentin表达则依次减弱(1.00±0.00、0.60±0.05、0.49±0.04, P<0.05), 这表明低分化的PANC-1细胞间质特性最强. TGF-β1刺激PANC-1细胞发生典型的EMT形态变化. Real-time PCR和Western blot结果均显示, PANC-1细胞经姜黄素及TGF-β1处理后, 与对照组相比, TGF-β1组E-cadherin mRNA及蛋白表达均明显下调(分别为0.67±0.05、0.47±0.05, P<0.05 vs 对照组), Vimentin基因mRNA及蛋白则明显上调(分别为2.38±0.14、1.43±0.07, P<0.05 vs 对照组), 说明TGF-β1促进PANC-1细胞EMT过程. 而与TGF-β1组相比, Cur+TGF-β1及Cur组的E-cadherin表达具有上调趋势(mRNA分别为0.98±0.06、1.34±0.08, P<0.05 vs TGF-β1组; 蛋白为0.32±0.04、0.68±0.06, P<0.05 vs TGF-β1组), Vimentin却下调(mRNA分别为0.63±0.08、0.99±0.07, P<0.05 vs TGF-β1组; 蛋白分别为1.01±0.14、0.57±0.06, P<0.05 vs TGF-β1组), 其蛋白与mRNA表达结果基本一致. 这表明姜黄素具有阻断TGF-β1诱导的PANC-1细胞EMT效应.
结论: 姜黄素能够阻断TGF-β1诱导的PANC-1细胞的EMT过程, 从而抑制其侵袭转移.
核心提示: 上皮间质转化(epithelial-mesenchymal transition, EMT)是包括胰腺癌在内的多种肿瘤浸润、生长、侵袭和转移的重要机制之一, 姜黄素具有抑制转化生长因子-β1(transforming growth factor beta 1)诱导的胰腺癌PANC-1细胞的EMT过程, 从而起到抗肿瘤作用.
引文著录: 庞慧芳, 覃华, 赵秋, 许琮, 赵慧贞, 朱亮, 黎培员, 李德民. 姜黄素对胰腺癌细胞上皮间质转化的影响. 世界华人消化杂志 2014; 22(18): 2565-2571
Revised: April 22, 2014
Accepted: April 30, 2014
Published online: June 28, 2014
AIM: To investigate the effect of curcumin on epithelial-mesenchymal transition (EMT) of pancreatic cancer cells and the implications for pancreatic cancer invasion and metastasis.
METHODS: Three pancreatic cancer cell lines PANC-1, AsPC-1 and BxPC-3, with various features of cell differentiation, were used. Total proteins extracted from them were used to determine protein expression of EMT markers E-cadherin and Vimentin by Western blot. PANC-1 cells, which have the capability of low differentiation and strong invasion and metastasis, were treated with transforming growth factor beta 1 (TGF-β1) at a final concentration of 10 ng/mL for 24 h, and cellular morphological changes were observed under a microscope. PANC-1 cells were then treated with 10 ng/mL TGF-β1, 10 μmol/L curcumin + 10 ng/mL TGF-β1, and 10 μmol/L curcumin, respectively. Untreated PANC-1 cells were used as normal controls. Total RNA and proteins were extracted to assay the expression of E-cadherin and Vimentin by real-time PCR and Western blot.
RESULTS: Western blot results showed that, the expression of E-cadherin protein in pancreatic cancer cell lines PANC-1, AsPC-1 and BxPC-3 increased in the ascending order (1.00 ± 0.00, 1.36 ± 0.04, 2.14 ± 0.06, P < 0.05), but Vimentin decreased gradually (1.00 ± 0.00, 0.60 ± 0.05, 0.49 ± 0.04, P < 0.05), which indicated that poorly differentiated PANC-1 cells had the most remarkable mesenchymal phenotype and stronger potential ability of invasion and metastasis than moderately and well differentiated AsPC-1 and BxPC-3 cells. TGF-β1 induced PANC-1 cells to present typical morphological changes of EMT. Real-time PCR and Western blot indicated that compared with the control group, the expression of E-cadherin in the TGF-β1 group was down-regulated significantly at both mRNA and protein levels (P < 0.05), and Vimentin expression was up-regulated remarkably (P < 0.05), which suggested that TGF-β1 can promote the EMT of PANC-1 cells. However, compared with the TGF-β1 group, the mRNA and protein expression of E-cadherin was up-regulated gradually in the Cur + TGF-β1 and Cur group (P < 0.05 for both), and that of Vimentin was down-regulated (P < 0.05 for both ).
CONCLUSION: Curcumin can inhibit TGF-β1-induced EMT of PANC-1 cells.
- Citation: Pang HF, Qin H, Zhao Q, Xu C, Zhao HZ, Zhu L, Li PY, Li DM. Curcumin inhibits TGF-β1-induced epithelial-mesenchymal transition of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2565-2571
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2565.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2565
胰腺癌是胰腺导管上皮细胞来源的恶性肿瘤, 其侵袭和远处转移能力较强. 目前认为, 上皮间质转化(epithelial-mesenchymal transition, EMT)是包括胰腺癌在内的多种肿瘤浸润、生长、侵袭和转移的重要机制之一[1-3]. EMT是指上皮细胞在特定情况下失去其极性向间质细胞表型转变的过程, 他具有促进肿瘤侵袭、转移播散和获得治疗耐受等作用[1,4], 其特点为细胞黏附性下降或消失, 极性丧失, 细胞运动能力和侵袭力增强. EMT是胰腺癌具有高度转移潜能的基础. EMT发生的标志性事件是上皮标志物E-cadherin表达的缺失与减弱, 而间质标志物Vimentin表达增强[5].
近年来人们围绕转化生长因子(transforming growth factor, TGF)/SMADs、Ras/ERK1/2、Wnt/β-catenin等EMT相关信号通路及其信号靶点广泛开展研究, 目的是寻找抑制或逆转肿瘤细胞EMT的分子机制, 以便研发出控制肿瘤侵袭、转移的靶向药物. 中药姜黄素的抗纤维化及抗肿瘤作用已被广泛证实, 但以往的研究多集中在姜黄素对肿瘤细胞增殖、凋亡方面[6,7], 关于针对其在肿瘤细胞EMT方面的研究甚少.
本研究选择3种不同分化特征的胰腺癌细胞株PANC-1、AsPC-1、BxPC-3, 从蛋白水平检测其上皮与间质标志物, 并选择其中一种间质表型最显著、潜在侵袭能力最强的一种细胞株作为主要研究对象. 人们认为, TGF-β/SMADs是EMT最经典的信号通路, TGF-β诱导胰腺癌细胞发生EMT是促进胰腺癌侵袭和转移的重要原因之一[8]. 本小组前期研究证实, 以10 ng/mL TGF-β1处理胰腺癌BxPC-3细胞后, 其 EMT相关分子E-cadherin表达下调, Vimentin表达上调, 促进胰腺癌细胞发生EMT[9]. 因此, 我们使用姜黄素与TGF-β1处理潜在转移能力最强的胰腺癌细胞, 检测其上皮和间质标志物, 分析探讨姜黄素对TGF-β1诱导的胰腺癌细胞EMT的影响.
人胰腺癌细胞株PANC-1、AsPC-1、BxPC-3细胞由同济医院肝病研究所保存备用. RPMI 1640高糖培养基购自美国Gibco公司. 胎牛血清购自美国Hyclone公司. 姜黄素(curcumin, Cur)(纯度>95%)购自美国Sigma公司. TGF-β1冻干粉购自美国Peprotech公司. E-cadherin兔抗人多克隆抗体、Vimentin兔抗人多克隆抗体购自美国Proteintech公司. β-actin兔抗人单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG购自武汉谷歌生物公司. BCA蛋白定量试剂盒购自武汉博士德生物公司. Western凝胶试剂盒购自武汉博士德生物公司. TRIzol试剂购自美国Invitrogen公司. Real-time PCR逆转录试剂盒及SYBR Green Master Mix购自日本TaKaRa公司. NanoDrop 2000微量分光光度计购自美国Thermo Fisher公司, PCR引物由上海生工生物有限公司合成.
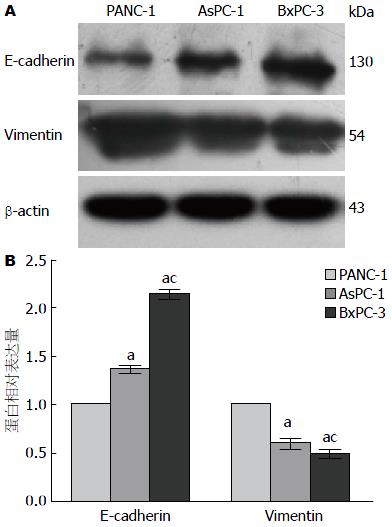
1.2.1 Western blot法检测胰腺癌PANC-1、AsPC-1、BxPC-3细胞E-cadherin、Vimentin蛋白表达: (1)常规培养3种不同分化特征的胰腺癌细胞株PANC-1、BxPC-3、ASPC, 以RIPA蛋白裂解液裂解细胞提取其总蛋白, BCA法测定样本蛋白浓度, 再将蛋白样品与5×SDS蛋白上样缓冲液按4:1混匀后, 于100 ℃煮沸10-15 min使蛋白完全变性; (2)每个样本以等量蛋白(30 μg)加样并进行10%SDS-PAGE凝胶电泳, 将蛋白转至PVDF膜上, 5%牛奶封闭液封闭后, 分别按比例稀释孵育E-cadherin(130 kDa, 1:1000)、Vimentin(54 kDa, 1:1000)、 β-actin(43 kDa, 1:1000)一抗以及相应的HRP标记二抗, ECL显色; (3)用BioDoc-It 220凝胶成像系统(美国UVP公司)以及Image J分析软件对图像条带作半定量分析比较EMT标志物的表达, 并间接判断其细胞表型的潜在侵袭转移能力.
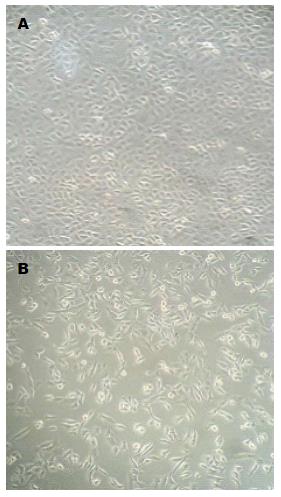
1.2.2 TGF-β1处理胰腺癌PANC-1细胞形态学观察: (1)将常规培养的PANC-1细胞待生长融合度达到70%时, 用PBS清洗后以新鲜无血清培养基饥饿培养12 h; (2)实验组加入TGF-β1使终浓度为10 ng/mL, 对照组无需加药, 继续培养24 h; (3)在倒置相差显微镜下观察两组细胞的形态变化并拍照记录.
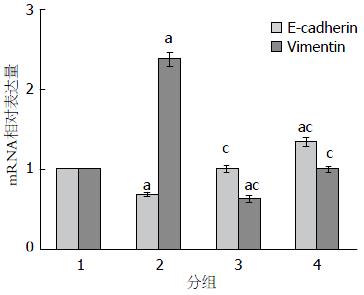
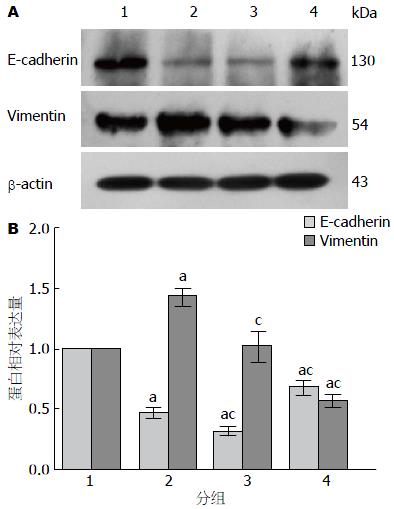
1.2.3 姜黄素对胰腺癌PANC-1细胞EMT的影响: (1)Real-time PCR检测PANC-1细胞E-cadherin、Vimentin的mRNA表达: 将胰腺癌PANC-1细胞先用无血清培养基饥饿培养12 h, 再分别以10 ng/mL TGF-β1、10 μmol/L Cur+10 ng/mL TGF-β1、10 μmol/L Cur处理, 未用药处理组设为对照组, 处理48 h后采用TRIzol试剂盒提取细胞总RNA. 采用NanoDrop 2000微量分光光度计测定RNA浓度和纯度, 再以TaKaRa逆转录试剂盒将RNA逆转录为cDNA, 使用SYBR Green试剂盒配制PCR反应液, 在StepOne Real-time PCR systems(ABI, USA)上按反应条件进行Real-time PCR反应. 每组设3个复孔, 设β-actin为内参. E-cadherin上游引物序列为5'-ACAGCCCCGCCTTATGATTCTC-3',下游引物序列为5'-AAGCGATTGCCCCATTCGTT-3'; Vimentin上游引物序列为5'-ACAGCCCCGCCTTATGATTCTC-3',下游引物序列为5'-GACATGCTGTTCCTGAATCTGAG-3'; β-actin上游引物序列为5'-GTTGCGTTACACCCTTTCTTG-3',下游引物序列为5'-GACTGCTGTCACCTTCACCGT-3'. PCR反应条件为: 95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 40个循环. 将对照组mRNA表达量定为100%, 以2-∆∆Ct法计算E-cadherin、Vimentin mRNA相对表达量, 并分析比较各组基因表达差异; (2)Western blot法检测PANC-1细胞E-cadherin、Vimentin的蛋白表达: 将PANC-1细胞以姜黄素和TGF-β1如同上述处理48 h后, 以RIPA蛋白裂解液提取细胞总蛋白, 以BCA法对样本蛋白定量及常规变性处理. 每组以30 μg加样再进行电泳、转膜、封闭后, 分别孵育一抗E-cadherin(1:1000)、Vimentin(1:1000)、β-actin(1:1000)及HRP标记二抗, ECL显色. 再以BioDoc-It 220凝胶成像系统和Image J分析软件对图像条带作半定量分析并比较各组E-cadherin、Vimentin的蛋白表达变化.
统计学处理 实验数据均以mean±SD表示, 应用SPSS17.0统计软件进行统计分析, 多重均数比较采用单因素方差分析(one-way ANVOA), 组间比较采用LSD组间t检验, P<0.05为差异有统计学意义.
Western blot结果显示, 胰腺癌PANC-1、AsPC-1、BxPC-3细胞中E-cadherin蛋白的相对表达量分别为1.00±00、1.36±0.04、2.14±0.06, 其蛋白表达水平依次增强, 各组间差异均具有显著性(P<0.05); 而Vimentin蛋白表达量分别为1.00±0.00、0.60±0.05、0.49±0.04, 其表达则依次减弱, 组间差异均有显著性(P<0.05). 这表明低分化的PANC-1细胞间质表型特征最显著, 其潜在侵袭转移能力可能较中、高分化的AsPC-1、BxPC-3细胞强(图1).
倒置相差显微镜下可见, 与对照组相比, TGF-β1处理组胰腺癌PANC-1细胞的细胞间隙变宽, 由原来的紧密连接变得排列松散, 细胞形态由扁椭圆形变为长梭形, 细胞极性丧失, 细胞由上皮向间质转化, 即发生了典型的EMT形态变化(图2).
2.3.1 胰腺癌PANC-1细胞E-cadherin、Vimentin的mRNA表达变化: Real-time PCR结果显示, 胰腺癌PANC-1细胞经姜黄素及TGF-β1处理后, 各组E-cadherin的mRNA相对表达量分别为1.00±0.00、0.67±0.05、0.98±0.06、1.34±0.08, 而Vimentin mRNA相对表达量分别为1.00±0.00、2.38±0.14、0.63±0.08、0.99±0.07. 与对照组相比, TGF-β1组的E-cadherin表达下调, Vimentin表达则显著上调, 差异均有统计学意义(P<0.05); 而Cur+TGF-β1组的E-cadherin表达无明显变化(P>0.05), Vimentin则明显下调(P<0.05); Cur组的E-cadherin显著上调(P<0.05), Vimentin则无明显变化(P>0.05). 此外, 与TGF-β1组相比, Cur+TGF-β1及Cur组的E-cadherin表达上调, Vimentin却下调, 差异均有统计学意义(P<0.05). 该结果表明, 姜黄素对TGF-β1诱导的胰腺癌PANC-1细胞具有抑制并阻断EMT作用(图3).
2.3.2 胰腺癌PANC-1细胞E-cadherin、Vimentin的蛋白表达变化: Western blot结果显示, PANC-1细胞经姜黄素及TGF-β1处理后, 各组E-cadherin蛋白表达量分别为1.00±0.00、0.47±0.05、0.32±0.04、0.68±0.06, 而Vimentin蛋白相对表达量分别为1.00±0.00、1.43±0.07、1.01±0.14、0.57±0.06. 与对照组相比, TGF-β1组和Cur+TGF-β1组的E-cadherin蛋白表达下调, 而Cur组与前两者相比较E-cadherin蛋白表达量则明显上调, 差异均有统计学意义(P<0.05); 与对照组相比, TGF-β1组Vimentin表达显著上调(P<0.05), Cur组Vimentin表达则下调(P<0.05), Cur+TGF-β1组的表达无明显差异(P>0.05); 与TGF-β1组比较, Cur+TGF-β1及Cur组Vimentin表达依次下调, 差异均有显著性(P<0.05). 因此, 从蛋白水平上, 进一步说明姜黄素具有阻断TGF-β1诱导PANC-1细胞的EMT效应(图4).
上皮来源的恶性肿瘤在侵袭转移过程中常常伴发上皮表型的缺失及具有较强侵袭转移能力的间质表型的获得, 即发生EMT. E-cadherin是典型的上皮标志物, 其表达减弱或消失在胰腺癌侵袭转移过程中起重要作用[10,11]. Vimentin作为间质细胞最经典的表型蛋白, 其过表达被认为EMT较可靠的判断指标[12]. 本研究Western blot结果显示, 低分化特征的胰腺癌PANC-1细胞的E-cadherin表达最弱, 而Vimentin表达最强, 认为其间质表型最显著且潜在侵袭转移能力可能最强, 这与文献报道基本一致[13]. 以经典的EMT诱导因子TGF-β1刺激PANC-1细胞后发生了典型的EMT形态变化, 镜下可见, 细胞间隙变宽, 由原来的紧密连接变得排列松散, 细胞形态由扁椭圆形变为长梭形, 细胞极性丧失, 细胞由上皮向间质表型转化. 这与本小组前期研究结果基本一致[9].
已有的研究显示, 姜黄素可阻断一些上皮细胞的EMT过程. 赵爱青等[14]报道, 姜黄素可能通过下调单侧输尿管梗阻(unilateral urethral obstruction, UUO)诱导的肾间质纤维化模型大鼠组织中TGF-β1、α-平滑肌激动蛋白(α-smooth muscle actin, α-SMA)及Vimentin蛋白表达, 从而抑制UUO大鼠肾小管EMT过程. 杨丽霞等[15]的研究显示, 姜黄素通过抑制α-SMA及增强E-cadherin的表达, 下调胶原Ⅰ、胶原Ⅲ和纤连蛋白(fibronectin, FN)的表达, 从而抑制TGF-b1诱导的HK-2细胞的转分化及肾间质纤维化过程. 李彧等[16]在此基础上证实, 姜黄素通过干预TGF-β1/SMADs信号转导途径的多个位点阻断HK-2细胞的EMT过程. 他们也在UUO模型大鼠肾组织中观察到α-SMA表达增强, E-cadherin表达减弱; 姜黄素处理组的α-SMA及TGF-β1蛋白与UUO组比较显著下降, E-cadherin和Smad7蛋白表达明显升高, 并进一步证实上述结论[17].
近年来有研究证实, 姜黄素能够阻断肿瘤上皮细胞的EMT过程. 刘红军等[18]的研究显示, 姜黄素通过阻滞G1期细胞抑制膀胱癌细胞T24的细胞增殖及细胞周期, 促进细胞凋亡过程, 并用毒性较低浓度姜黄素干预后, 上皮标志物CK及E-cadherin表达上调, 间质标志物Vimentin及SMA表达下调, 从而逆转T24细胞的间质表型, 降低肿瘤侵袭和迁移能力, 起到抗肿瘤作用. 该项研究表明姜黄素使膀胱癌细胞T24发生由间质向上皮转化, 也是国内首次报道姜黄素具有抑制肿瘤细胞EMT的作用.
然而, 为了证实姜黄素能够抑制胰腺癌的上皮间质转化过程, 本研究以姜黄素处理TGF-β1诱导的胰腺癌PANC-1细胞并从mRNA及蛋白水平检测其EMT指标. Real-time PCR与Western blot实验结果均提示姜黄素对TGF-β1诱导的PANC-1细胞具有抑制EMT作用. 与对照组相比, TGF-β1组的E-cadherin表达下调, Vimentin表达则上调, 差异均有统计学意义(P<0.05); 与TGF-β1组比较, Cur+TGF-β1及Cur组的Vimentin表达具有下调趋势, 而E-cadherin表达具有上调趋势. 我们的研究结果进一步证实上述结论, 初步认为姜黄素具有抑制并阻断TGF-β1诱导的胰腺癌PANC-1细胞的EMT过程, 并且其阻断机制可能通过介导TGF-β/SMADs信号通路起作用, 有待进一步研究SMAD-依赖与非依赖途径中相关信号来证实.
总之, 低分化的胰腺癌PANC-1细胞的潜在侵袭转移能力较强, 姜黄素能够阻断TGF-β1诱导的胰腺癌PANC-1细胞的上皮向间质转化过程, 从而降低其侵袭及远处转移可能. 因此, 姜黄素可能是胰腺癌潜在的治疗药物.
胰腺癌是一种预后极差的消化系恶性肿瘤, 5年生存率低于5%, 他具有较强的侵袭转移能力和放化疗抵抗性. 上皮间质转化(epithelial-mesenchymal transition, EMT)在许多恶性肿瘤的侵袭和转移过程中起到重要作用.
谭晓冬, 教授, 中国医科大学附属盛京医院
手术切除、放疗和吉西他滨为基础的化疗手段对治疗侵袭转移性胰腺癌都具有缺陷和不足, 因此研发出更加有效的治疗药物是我们亟待解决的问题.
有人们广泛研究证实中药姜黄素的抗纤维化及抗肿瘤作用, 但以往的研究多集中在姜黄素对肿瘤细胞增殖、凋亡方面. 近年来刘红军等首次报道了姜黄素通过阻断和逆转膀胱癌T24细胞EMT过程, 抑制其侵袭和迁移的能力.
本研究结果初步认为姜黄素具有抑制并阻断转化生长因子-β1诱导的胰腺癌PANC-1细胞的EMT过程, 抑制其侵袭转移可能, 并且其阻断机制可能通过介导TGF-β/SMADs信号通路起作用.
随着人们对姜黄素抑制肿瘤细胞发生EMT及侵袭转移作用机制研究的不断深入和探索, 姜黄素有望成为新型、高效、安全的防癌及抗癌药物, 并造福广大癌症患者, 延长寿命及提高生存质量.
本文针对姜黄素对胰腺癌细胞上皮间质转化的影响进行研究, 行文流畅, 具有一定的科学性和创新性.
编辑: 郭鹏 电编:鲁亚静
| 1. | Polyak K, Weinberg RA. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nat Rev Cancer. 2009;9:265-273. [PubMed] [DOI] |
| 2. | Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349-361. [PubMed] [DOI] |
| 3. | Cano CE, Motoo Y, Iovanna JL. Epithelial-to-mesenchymal transition in pancreatic adenocarcinoma. Sci World J. 2010;10:1947-1957. [PubMed] [DOI] |
| 4. | Arumugam T, Ramachandran V, Fournier KF, Wang H, Marquis L, Abbruzzese JL, Gallick GE, Logsdon CD, McConkey DJ, Choi W. Epithelial to mesenchymal transition contributes to drug resistance in pancreatic cancer. Cancer Res. 2009;69:5820-5828. [PubMed] [DOI] |
| 5. | 殷 涛, 王 春友, 赵 刚, 刘 涛, 周 峰, 陶 京. 转化生长因子-β1 诱导的上皮向间叶转化对胰腺癌侵袭和转移的意义. 华中科技大学学报(医学版). 2007;36:67-70. |
| 6. | Kunnumakkara AB, Guha S, Krishnan S, Diagaradjane P, Gelovani J, Aggarwal BB. Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation, angiogenesis, and inhibition of nuclear factor-kappaB-regulated gene products. Cancer Res. 2007;67:3853-3861. [PubMed] |
| 7. | Guo LD, Chen XJ, Hu YH, Yu ZJ, Wang D, Liu JZ. Curcumin inhibits proliferation and induces apoptosis of human colorectal cancer cells by activating the mitochondria apoptotic pathway. Phytother Res. 2013;27:422-430. [PubMed] [DOI] |
| 8. | Thiery JP, Sleeman JP. Complex networks orchestrate epithelial-mesenchymal transitions. Nat Rev Mol Cell Biol. 2006;7:131-142. [PubMed] |
| 9. | Zhu L, Qin H, Li PY, Xu SN, Pang HF, Zhao HZ, Li DM, Zhao Q. Response gene to complement-32 enhances metastatic phenotype by mediating transforming growth factor beta-induced epithelial-mesenchymal transition in human pancreatic cancer cell line BxPC-3. J Exp Clin Cancer Res. 2012;31:29. [PubMed] [DOI] |
| 10. | von Burstin J, Eser S, Paul MC, Seidler B, Brandl M, Messer M, von Werder A, Schmidt A, Mages J, Pagel P. E-cadherin regulates metastasis of pancreatic cancer in vivo and is suppressed by a SNAIL/HDAC1/HDAC2 repressor complex. Gastroenterology. 2009;137:361-71, 371.e1-5. [PubMed] [DOI] |
| 11. | Pryczynicz A, Guzińska-Ustymowicz K, Kemona A, Czyzewska J. Expression of the E-cadherin-catenin complex in patients with pancreatic ductal adenocarcinoma. Folia Histochem Cytobiol. 2010;48:128-133. [PubMed] [DOI] |
| 12. | Kokkinos MI, Wafai R, Wong MK, Newgreen DF, Thompson EW, Waltham M. Vimentin and epithelial-mesenchymal transition in human breast cancer--observations in vitro and in vivo. Cells Tissues Organs. 2007;185:191-203. [PubMed] |
| 14. | 赵 爱青, 张 晓明, 侯 恒, 李 荣山, 马 存根. 姜黄素对单侧输尿管梗阻大鼠肾小管上皮细胞转分化影响的研究. 中国中西医结合急救杂志. 2007;14:348-351. |
| 15. | 杨 丽霞, 李 彧, 王 谦, 李 健, 李 亚东, 刘 铜华, 牛 建昭. 姜黄素对TGF-β1 诱导人肾小管上皮细胞转分化及分泌细胞外基质成分的影响. 中国中西医结合肾病杂志. 2008;9:1040-1043. |
| 17. | Li Y, Chen ZQ, Li YD. [Effects of curcumin on the epithelial mesenchymal transition and TGF-beta/Smads signaling pathway in unilateral ureteral obstruction rats]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2011;31:1224-1228. [PubMed] |