修回日期: 2014-05-09
接受日期: 2014-05-19
在线出版日期: 2014-06-28
目的: 构建人含sushi重复蛋白X连锁2(sushi repeat-containing protein, X-linked 2, SRPX2)基因真核表达载体pcDNA3.1-SRPX2, 并在结肠癌细胞系SW480中瞬时表达.
方法: 采用逆转录PCR方法从人结直肠癌HCT116细胞总RNA中扩增出SRPX2 CDS区的cDNA片段, 先后与T载体pMD19及真核表达载体pcDNA3.1连接, 重组质粒经双酶切和测序鉴定无误后, 采用Lipofectamine 2000瞬时转染SW480细胞, 应用实时荧光定量PCR及免疫印迹法检测SRPX2 mRNA及蛋白的表达
水平.
结果: 成功构建真核表达载体pcDNA3.1-SRPX2, 测序和双酶切鉴定结果均正确, 载体能在SW480细胞中上调SRPX2 mRNA表达, 并正确表达SRPX2蛋白.
结论: 成功构建SRPX2真核表达载体, 为进一步研究SRPX2基因在结直肠癌中的功能奠定了基础.
核心提示: 本文成功的从HCT116细胞系调取了含sushi重复蛋白X连锁2(sushi repeat-containing protein, X-linked 2, SRPX2)基因, 构建了SRPX2真核表达载体, 并证实其可在SW480中上调SRPX2 mRNA水平, 并正确表达SRPX2蛋白, 为深入研究SRPX2在结肠癌中的功能做出了铺垫.
引文著录: 刘揆亮, 周跃, 吴静. SRPX2真核表达载体的构建及其在SW480细胞中的表达. 世界华人消化杂志 2014; 22(18): 2553-2558
Revised: May 9, 2014
Accepted: May 19, 2014
Published online: June 28, 2014
AIM: To construct a eukaryotic vector expressing sushi repeat-containing protein (SRPX2) [pcDNA3.1(+)-SRPX2] and investigate its transient expression in colon cancer cell line SW480.
METHODS: The cDNA sequence of SRPX2 (NM_014467) was amplified from the total RNA extracted from HCT116 cells using RT-PCR and inserted into the T-vector pMD19 and eukaryotic expression vector pcDNA 3.1(+) sequentially. The resulting pcDNA 3.1-SRPX2 plasmid was identified by double digestion and DNA sequencing. The constructed plasmid was then transfected into colon cancer cell line SW480 using Lipofectamine 2000. The expression levels of SRPX2 mRNA and protein were detected by real-time PCR and Western blot, respectively.
RESULTS: The eukaryotic expression vector pcDNA 3.1-SRPX2 was constructed successfully and verified by double digestion and DNA sequencing. The constructed vector could express mature SRPX2 protein correctly in colon cancer cell line SW480.
CONCLUSION: Successful construction of the eukaryotic expression vector pcDNA 3.1-SRPX2 provides an experimental basis for further study of functions of the SRPX2 gene in colorectal cancer.
- Citation: Liu KL, Zhou Y, Wu J. Construction of a eukaryotic vector expressing SRPX2 and its expression in cell line SW480. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2553-2558
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2553
含sushi重复蛋白X连锁2(sushi repeat-containing protein, X-linked 2, SRPX2)是一种硫酸软骨素蛋白聚糖(chondroitin sulfate proteoglycan, CSPG)[1], 其基因最早于1999年由Kurosawa等[2]在白血病细胞中发现, 为E2A-HLF融合基因的下游靶基因. 后续研究发现其具有参与癫痫发作、血管生成、细胞黏附等多种作用, 是细胞外基质的重要成分[3]. 新近一些研究提示SRPX2可能在胃癌及结肠癌中发挥一定作用[4], 但目前尚缺乏深入研究. 我们构建了SRPX2真核表达载体, 为进一步研究其在结肠癌中的功能奠定了基础.
人结肠癌细胞系SW480及HT-29均购自北京协和细胞资源中心, 常规培养分别使用含10%FBS(HyClone)的IMDM培养基(HyClone)和DMEM/F12培养基(Neuronbc); 人结直肠癌HCT116细胞系由中国医学科学院药物研究所馈赠, 常规培养使用含10%FBS(HyClone)的RPMI 1640培养基(Neuronbc). pcDNA3.1(+)真核表达质粒购于Invitrogen公司. DNA凝胶回收试剂盒、西班牙琼脂糖、RNA提取试剂盒、PrimeScript™逆转录PCR试剂盒与PrimeSTAR HS DNA聚合酶、MiniBEST Agarose Gel DNA提取试剂盒均购自Takara公司; 兔抗人SRPX2抗体(NBP1-86999)购自Novus公司; 鼠抗人GAPDH抗体购自Santa Cruz公司; 6孔细胞培养板购自BD falcon公司; Lipofectamine 2000购自Invitrogen公司; 重组表达质粒测序由宝生物工程(大连)有限公司完成. PCR引物由上海生工公司合成, 实时荧光定量通用试剂购自北京全式金公司; PVDF膜、细胞蛋白提取液、SDS-PAGE凝胶配制试剂盒、SDS蛋白上样缓冲液及预染蛋白Marker均购自北京博然一新公司.
1.2.1 结肠癌细胞株SRPX2表达含量分析: 根据Oncomine数据库分析结果, 初步选择HCT116、HT29、SW480三株细胞, 采用实时荧光定量PCR分析SRPX2 mRNA表达含量.
1.2.2 基因的扩增及克隆: 根据SRPX2基因序列(NM_014467)设计扩增引物, 提取HCT116细胞总RNA, RT-PCR扩增SRPX2基因CDS区(1398 bp). 5'端添加Kozak序列, 两侧添加Hind Ⅲ/EcoRⅠ酶切位点. 扩增引物设计如下: SRPX2-F 01 5'-AAGCTTGCCACCATGGCCAGTCAGCTAACTCA-3'; SRPX2-R01: 5'-GAATTCTCACTCGCATATGTCCCTTTG-3'; SRPX2-F02: 5'-GATGGCTGACTTCTGAAAGTC-3'; SRPX2-R02: 5'-GTCCTGTCCCTAGAACTGTG-3'. PCR反应体系共50 μL, 反转录反应液2 μL, 含5×PCR反应Buffer 10.0 μL; dNTP 混合物4 μL, 上下游引物各0.5 μL(10 pmol), DNA聚合酶0.5 μL(1.25 U), 加水补足. PCR扩增反应条件为98 ℃ 10 s, 55 ℃ 15 s, 72 ℃ 90 s, 共30个循环, 72 ℃延伸5 min. 变性5 min, 95 ℃ 30 s, 66 ℃ 30 s, 72 ℃ 1 min, 20个循环后, 72 ℃延伸7 min. 各取产物5 μL进行琼脂糖凝胶电泳. 对符合要求的PCR产物进行切胶, 回收. 测序验证后进行连接处理. 使用T4 DNA连接酶将目的DNA与T载体pMD19(Simple)连接, 热转化至E. coli感受态细胞JM109中, 涂布平板, 37 ℃过夜培养. 挑选阳性菌落植菌, 提取阳性克隆质粒. 之后再次进行测序.
1.2.3 pcDNA3.1-SRPX2质粒的构建与酶切鉴定: 重组子T载体pMD19-SRPX2, 表达载体pcDNA3.1(+)分别经EcoRⅠ与Hind Ⅲ酶切后, 从凝胶中分别回收SRPX2目的基因和表达载体pcDNA3.1. 使用T4 DNA连接酶进行连接反应, 热转化至E. coli感受态细胞JM109中, 涂布平板, 37 ℃过夜培养, 挑选两个阳性菌落植菌并提取质粒, 分别命名为pcDNA3.1-SRPX2-1、pcDNA3.1-SRPX2-2, 使用Hind Ⅲ/EcoRⅠ进行双酶切鉴定, 各取10 μL进行1%琼脂糖凝胶电泳.
1.2.4 pcDNA3.1-SRPX2重组质粒转染SW480细胞: 以每孔1.6×106个细胞数铺板(6孔板), 用含10%FBS的IMDM培养基(不含双抗)放置于37 ℃、5%CO2培养箱中培养, 24 h后取出, 参照Lipofectamine 2000说明书以DNA: Lipofectamine 2000 = 4 μg:8 μL比例将重组质粒转染6孔板中的SW480细胞, 6 h后弃去转染上清液, 重新加入培养基, 24 h后收集细胞提取mRNA进行实时荧光定量PCR检测, 48 h后收集细胞提取蛋白进行Western blot检测. 分为3组: (1)转染pcDNA3.1-SRPX2质粒; (2)转染空质粒pcDNA3.1; (3)空白对照的SW480细胞.
1.2.5 实时荧光定量PCR检测: 参照试剂盒说明书, TRIzol法抽提细胞总RNA, 取总RNA 1 μg, 以Oligo dT为引物逆转录合成cDNA第一链, 以此cDNA链2 μL为模板进行PCR扩增. SRPX2引物采用跨内含子设计, 序列为: F: 5'- AGTCACTTTCCTTTGCCCTGG-3'; R: 5'-CGGATAGTAGCCAGAACCTGC-3'. 以GAPDH为内参. PCR反应条件为: 95 ℃, 预变性3 min, 95 ℃ 30 s; 52 ℃ 45 s; 72 ℃ 45 s; 35个循环后72 ℃再延伸7 min. 采用2-∆∆Ct进行相对定量分析.
1.2.6 蛋白的Western blot检测: 以每孔20 μg的蛋白总量将样品在10%SDS-PAGE上分离后湿转到PVDF膜上, 5%BSA封闭2 h后, 分别与SRPX2及GAPDH一抗(5%BSA稀释)于4 ℃摇床孵育过夜, 洗膜完成后将其放入生物素标记的抗体中, 37 ℃摇床封闭1.5 h, 再将其放入辣根酶标记链霉卵白素中, 置于37 ℃摇床0.5 h, 室温摇床孵育1 h, 洗脱30 min后, 表面滴加eECL化学发光液, 于化学发光成像系统中曝光显影.
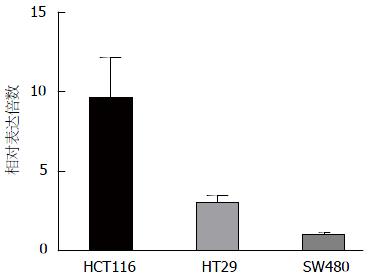
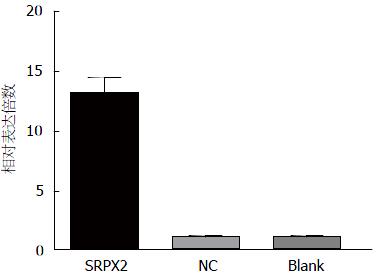
实时荧光定量PCR方法分析SRPX2 mRNA在SW480、HT29、HCT116三种细胞系中的表达情况, 结果提示HCT116中SRPX2 mRNA表达量最高, HT29次之, SW480中表达量最低(图1), 因此本实验选择从HCT116细胞系中获取SRPX2基因并构建高表达载体, 继而转染SW480细胞系.
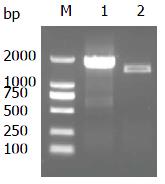
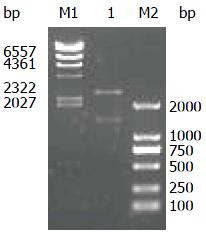
采用两种引物分别由RT-PCR扩增SRPX2基因CDS 区, 1.0%琼脂糖凝胶电泳检测见SRPX2-F02/R02扩增者于约1.4 kb处见一特异性条带(图2), 与预期相符. 经测序证实该序列与Genbank提供序列(NM_014467)完全相符. 将该片段连接至T载体pMD19上, 经Hind Ⅲ/EcoRⅠ酶切, 1.0%琼脂糖凝胶电泳检测见分别位于2.7及1.4 kb的两条条带(图3), 与预期相符. 再次测序仍与目的序列完全相符.
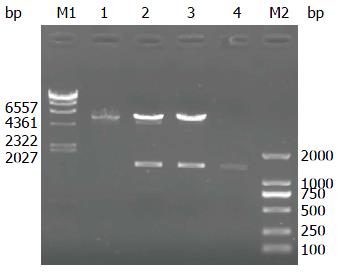
重组真核表达质粒pcDNA3.1-SRPX2-1, pcDNA3.1-SRPX2-2经Hind Ⅲ/EcoRⅠ酶切后鉴定, pcDNA3.1-SRPX2-2可得到大约为2900和1400 bp的两条条带, 与预期相符(图4). 选择该质粒进行后续实验.
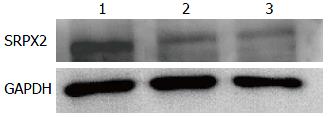
SRPX2真核表达载体pcDNA3.1-SRPX2转染细胞24 h后实时荧光定量PCR检测见SRPX2 mRNA表达较空白对照组和空载体转染组明显上调(图5). 48 h后Western blot检测到转染组细胞裂解液中SRPX2表达水平明显上调, 对照组和空载体转染组SW480细胞中可见较弱的SRPX2 mRNA及蛋白表达(图6), 结果证实所构建的表达载体能在SW480细胞中上调SRPX2 mRNA水平, 正确表达SRPX2蛋白.
SRPX2蛋白由465个氨基酸组成, 含有1个信号序列、3个sushi重复结构域和1个HYR(hyaline repeat)结构域[5]. SRPX2基因表达于脑神经元以及心、肺、气管等多种正常组织, 在外周血、脑脊液、骨髓中表达量甚低[2,6], 其基因突变可致大脑中央沟和外侧裂言语区癫痫发作、发育性言语失用和双侧外侧裂综合征的脑发育畸形[7,8]. 还有研究提示人SRPX2基因可在小鼠体内调节神经突触的形成[9], 而在大鼠中沉默SRPX2的表达可影响其神经系统发育, 造成神经元移行缺陷[10]. Tanaka[1]及Wilson[3]等最近的研究通过生物化学分析证实SRPX2为一含糖胺聚糖(glycosaminoglycan, GAG)链的CSPG. Wilson等[3]的蛋白质组学研究证实SRPX2为一种新发现的ECM蛋白.
近年来的一些研究发现SRPX2可能在胃肠道肿瘤中发挥一定作用[4]. Tanaka等[1,6]发现SRPX2在胃癌、结直肠癌等多种人类肿瘤细胞株中呈过表达, 且胃癌组织、结直肠癌组织中SRPX2表达量均显著高于非癌黏膜[6]. 最近, Yamada等[11]检测了227例未经治疗的胃癌患者癌组织及其癌旁配对组织中SRPX2 mRNA的表达水平, 发现SRPX2的表达水平与肿瘤体积及远处转移相关, SRPX2表达水平较高的患者生存期明显缩短, 且多因素分析中, SRPX2的表达水平为生存的一项独立危险因素. 不过, Wang等[12]检测胃癌患者术前的外周血有核细胞中SRPX2表达, 发现与健康志愿者间SRPX2表达量无明显差异. 进一步的研究发现, 采用SRPX2条件培养基培养胃癌细胞株SNU-16时可明显促进该细胞株的迁移活性, 外源性SRPX2还可显著增强胃癌细胞株SNU-16和HSC-39细胞的黏附能力, 并上调其FAK磷酸化水平, 提示外源性SRPX2可能通过FAK信号途径影响胃癌细胞的生物学行为[6]. 此外, 还有研究发现SRPX2可与uPAR结合, 并可作用于血管内皮细胞而发挥促血管生成作用[13-15]. Øster等[16]也证实SRPX2在结肠癌组织中表达明显上调. 但目前还缺少有关SRPX2在结肠癌中具体作用的研究.
基因克隆、基因转染是明确基因功能的主要研究手段. 目前针对SRPX2在胃肠道肿瘤中功能的研究较少, 根据文献报道, 仅有Tanaka等进行了SRPX2的高表达载体构建[6]. 他们从胃癌细胞系44As3中调取SRPX2基因后克隆至pcDNA3.1载体, 并将其转染至HEK293细胞系, 通过构建SRPX2条件培养基, 主要关注了外源性SRPX2对于胃癌细胞系生物学行为的影响[6]. 而目前尚无研究关注内源性SRPX2表达升高在结肠癌中的影响. 本研究中, 我们在检索oncomine数据库后选取了HCT116、HT29、SW480三株结肠癌细胞, 通过实时荧光定量PCR证实SRPX2在HCT116细胞系中存在相对高表达, 在SW480中为相对低表达, 继而采用逆转录PCR方法从HCT116中克隆了SRPX2基因CDS区, 通过T-A克隆连接至简单载体[17], 载体构建过程中, 在翻译起始点5'上游添加Kozak序列有助于增强基因的表达水平. 成功构建载体后, 两次测序均证实所克隆的片段与NCBI提供的序列一致. 之后我们成功将SRPX2 cDNA片段连接至常用的pcDNA3.1(+)载体上, 并将高表达载体转染至SW480细胞中. 我们采用实时荧光定量PCR和Western blot对转染重组质粒后SW480细胞内SRPX2 mRNA及蛋白表达水平变化进行了评价. 我们通过设计跨内含子的引物, 避免了实时定量PCR过程中表达载体所含目的基因cDNA对定量结果的影响. PCR及Westen blot也证实转染后目的基因mRNA及其蛋白表达增高, 证实我们所构建的重组质粒可在SW480细胞中正确表达SRPX2蛋白.
总之, 我们在本研究中成功构建了SRPX2的真核表达载体, 并对其在SW480中表达SRPX2蛋白的作用进行了验证, 为之后研究内源性SRPX2表达增强对结肠癌细胞的作用以及后续研究奠定了坚实的基础.
含sushi重复蛋白X连锁2(sushi repeat-containing protein, X-linked 2, SRPX2)是一种新发现的硫酸软骨素蛋白聚糖, 具有参与癫痫发作、血管生成、细胞黏附等多种作用, 是细胞外基质的重要成分. 近年发现SRPX2可能在胃癌及结肠癌中发挥一定的作用.
李正荣, 副主任医师, 副教授, 南昌大学附属第一医院胃肠外科(普六病区)
蛋白聚糖是ECM的主要成分之一, 各类蛋白多糖可通过与各自不同的配体及受体相结合, 影响肿瘤的发展. 对蛋白多糖在肿瘤中发挥功能的深入认识对于揭示肿瘤的发病机制及开发新的治疗手段具有重要意义.
Tanaka等通过从胃癌细胞系44As3中调取SRPX2基因, 将其转染至HEK293细胞系, 构建SRPX2条件培养基, 发现外源性SRPX2具有促进胃癌细胞迁移和黏附的作用.
本文首次从HCT116细胞系中调取了SRPX2基因, 成功构建了SRPX2真核表达载体, 并通过实时荧光定量PCR及Western blot证实该载体可在结肠癌细胞中正确表达SRPX2蛋白.
本文成功构建了SRPX2真核表达载体, 并成功转染大肠癌细胞系, 为后续研究奠定了实验基础.
本文有一定创新性, 有一定的临床价值.
编辑: 田滢 电编:鲁亚静
| 1. | Tanaka K, Arao T, Tamura D, Aomatsu K, Furuta K, Matsumoto K, Kaneda H, Kudo K, Fujita Y, Kimura H. SRPX2 is a novel chondroitin sulfate proteoglycan that is overexpressed in gastrointestinal cancer. PLoS One. 2012;7:e27922. [PubMed] |
| 2. | Kurosawa H, Goi K, Inukai T, Inaba T, Chang KS, Shinjyo T, Rakestraw KM, Naeve CW, Look AT. Two candidate downstream target genes for E2A-HLF. Blood. 1999;93:321-332. [PubMed] |
| 3. | Wilson R, Norris EL, Brachvogel B, Angelucci C, Zivkovic S, Gordon L, Bernardo BC, Stermann J, Sekiguchi K, Gorman JJ. Changes in the chondrocyte and extracellular matrix proteome during post-natal mouse cartilage development. Mol Cell Proteomics. 2012;11:M111.014159. [PubMed] |
| 5. | O'Leary JM, Bromek K, Black GM, Uhrinova S, Schmitz C, Wang X, Krych M, Atkinson JP, Uhrin D, Barlow PN. Backbone dynamics of complement control protein (CCP) modules reveals mobility in binding surfaces. Protein Sci. 2004;13:1238-1250. [PubMed] |
| 6. | Tanaka K, Arao T, Maegawa M, Matsumoto K, Kaneda H, Kudo K, Fujita Y, Yokote H, Yanagihara K, Yamada Y. SRPX2 is overexpressed in gastric cancer and promotes cellular migration and adhesion. Int J Cancer. 2009;124:1072-1080. [PubMed] |
| 7. | Roll P, Rudolf G, Pereira S, Royer B, Scheffer IE, Massacrier A, Valenti MP, Roeckel-Trevisiol N, Jamali S, Beclin C. SRPX2 mutations in disorders of language cortex and cognition. Hum Mol Genet. 2006;15:1195-1207. [PubMed] |
| 8. | Royer B, Soares DC, Barlow PN, Bontrop RE, Roll P, Robaglia-Schlupp A, Blancher A, Levasseur A, Cau P, Pontarotti P. Molecular evolution of the human SRPX2 gene that causes brain disorders of the Rolandic and Sylvian speech areas. BMC Genet. 2007;8:72. [PubMed] |
| 9. | Sia GM, Clem RL, Huganir RL. The human language-associated gene SRPX2 regulates synapse formation and vocalization in mice. Science. 2013;342:987-991. [PubMed] |
| 10. | Salmi M, Bruneau N, Cillario J, Lozovaya N, Massacrier A, Buhler E, Cloarec R, Tsintsadze T, Watrin F, Tsintsadze V. Tubacin prevents neuronal migration defects and epileptic activity caused by rat Srpx2 silencing in utero. Brain. 2013;136:2457-2473. [PubMed] |
| 11. | Yamada T, Oshima T, Yoshihara K, Sato T, Nozaki A, Shiozawa M, Ota M, Yoshikawa T, Akaike M, Numata K. Impact of overexpression of Sushi repeat-containing protein X-linked 2 gene on outcomes of gastric cancer. J Surg Oncol. 2014;109:836-840. [PubMed] |
| 12. | Wang YY, Li L, Zhao ZS, Wang HJ. Clinical utility of measuring expression levels of KAP1, TIMP1 and STC2 in peripheral blood of patients with gastric cancer. World J Surg Oncol. 2013;11:81. [PubMed] |
| 13. | Royer-Zemmour B, Ponsole-Lenfant M, Gara H, Roll P, Lévêque C, Massacrier A, Ferracci G, Cillario J, Robaglia-Schlupp A, Vincentelli R. Epileptic and developmental disorders of the speech cortex: ligand/receptor interaction of wild-type and mutant SRPX2 with the plasminogen activator receptor uPAR. Hum Mol Genet. 2008;17:3617-3630. [PubMed] |
| 14. | Miljkovic-Licina M, Hammel P, Garrido-Urbani S, Bradfield PF, Szepetowski P, Imhof BA. Sushi repeat protein X-linked 2, a novel mediator of angiogenesis. FASEB J. 2009;23:4105-4116. [PubMed] |
| 15. | Roll P, Vernes SC, Bruneau N, Cillario J, Ponsole-Lenfant M, Massacrier A, Rudolf G, Khalife M, Hirsch E, Fisher SE. Molecular networks implicated in speech-related disorders: FOXP2 regulates the SRPX2/uPAR complex. Hum Mol Genet. 2010;19:4848-4860. [PubMed] |
| 16. | Øster B, Linnet L, Christensen LL, Thorsen K, Ongen H, Dermitzakis ET, Sandoval J, Moran S, Esteller M, Hansen TF. Non-CpG island promoter hypomethylation and miR-149 regulate the expression of SRPX2 in colorectal cancer. Int J Cancer. 2013;132:2303-2315. [PubMed] |
| 17. | Marchuk D, Drumm M, Saulino A, Collins FS. Construction of T-vectors, a rapid and general system for direct cloning of unmodified PCR products. Nucleic Acids Res. 1991;19:1154. [PubMed] |