修回日期: 2014-04-17
接受日期: 2014-04-24
在线出版日期: 2014-06-08
目的: 探讨Wnt-1、Snail在结肠癌组织中的差异表达及其意义, 并探讨两者与预后的影响关系.
方法: 选取79例结肠癌组织, 应用免疫组织化学法检测Wnt-1、Snail蛋白的表达, 分析其与临床病理分期之间的关系, 并进行预后的关系分析.
结果: 79例结肠癌组织中Wnt-1与Snail的阳性率分别为46.8%、57.0%, Wnt-1、Snail的表达与结肠癌的分化程度、分期、淋巴转移有关(P<0.05), 并呈现明显的正相关性(r = 0.418, P<0.01). Kaplan-Meier法生存分析显示Wnt-1与Snail阳性组中位生存期明显低于阴性组中位生存期(30.00 mo±1.25 mo vs 44.00 mo±4.25 mo; 30.00 mo±1.68 mo vs 57.00 mo±6.36 mo, P<0.01). Cox回归表明肿瘤浸润深度、临床分期、淋巴结转移以及Wnt-1及Snail的异常表达是影响结肠癌患者预后的危险因素.
结论: 结肠癌患者可能存在Wnt-1、Snail异常表达, Wnt-1、Snail可作为结肠癌的一个预后指标.
核心提示: 结肠癌中存在Wnt-1与Snail的异常活化, 可能存在某些交叉点, 对结肠癌的转移风险评估、药物靶点设计具有重要的指导意义.
引文著录: 郭云霞, 王郁杰, 王瑞勤, 郭娜. Wnt-1与Snail在结肠癌组织中的表达及其临床意义. 世界华人消化杂志 2014; 22(16): 2370-2374
Revised: April 17, 2014
Accepted: April 24, 2014
Published online: June 8, 2014
AIM: To investigate the expression of Wnt-1 and Snail in colon cancer, and to analyze their clinical significance.
METHODS: The expression of Wnt-1 and Snail in 79 colon cancer tissues was detected by immunohistochemistry. The relationships of Wnt-1 and Snail expression with clinicopathologic factors and survival were evaluated.
RESULTS: The positive rates of Wnt-1 and Snail in 79 colon cancer tissues were 46.8% and 57%, respectively. Wnt-1 and Snail expression was significantly correlated with tumor differentiation, lymph node metastasis, and TNM stage (P < 0.05). There was a positive correlation between Wnt-1 and Snail expression (r = 0.418, P < 0.01). Survival analysis by the Kaplan-Meier method showed that the median survival times of Wnt-1 and Snail positive patients were significantly lower than those of Wnt-1 and Snail negative patients, respectively (30.00 mo ± 1.25 mo νs 44.00 mo ± 4.25 mo, 30.00 mo ± 1.68 mo νs 57.00 mo ± 6.36 mo, P < 0.01). The Cox regression analysis showed that the depth of tumor invasion, clinical stage, lymph node metastasis and abnormal expression of Wnt-1 and Snail were risk factors for the prognosis of patients with colon cancer.
CONCLUSION: Patients with colon cancer may have abnormal expression of Wnt-1 and Snail, which can be used as prognostic indicators of colon cancer.
- Citation: Guo YX, Wang YJ, Wang RQ, Guo N. Clinical significance of expression of Wnt-1/Snail in colon cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2370-2374
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2370.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2370
结肠癌是消化系常见的恶性肿瘤之一, 并在早期即可发生淋巴道转移, 发病率和死亡率较高. 临床分期是目前判断结肠癌预后的重要指标, 但即使是同一分期的患者也可能具有不同的预后. 因此, 有效的预后分子指标有助于尽早诊治并进行个体化治疗[1]. Wnt-1、Snail是调控干细胞增殖、分化的重要分子, 其不恰当激活对肿瘤的发生发展起着重要作用, 并在多种肿瘤细胞中异常表达[2,3]. 本实验通过79例人结肠癌组织的免疫组织化学染色, 探讨Wnt-1、Snail二者在结肠癌组织中的表达情况, 分析两者与结肠癌生长、浸润和转移能力的关系, 并探讨Wnt-1与Snail两者是否存在一定的关联性.
79例标本选自郑州人民医院2006-01/2011-01收治的结肠癌患者术后石蜡标本, 均经病理检查证实为结肠癌. 其中男33例, 女46例, 年龄42-79岁, 中位年龄64岁. 高分化37例, 中分化24例, 低分化18例; 淋巴结转移37例, 无淋巴结转移42例. 病例术前均未行放疗、化疗. 选择70例相应癌旁正常结肠组织作为正常对照. Wnt-1与Snail山羊抗人多克隆抗体购自美国Santa Cruz公司产品, 免疫组织化学SP试剂盒购自福州迈新生物技术公司.
1.2.1 免疫组织化学染色: 标本均采用4%多聚甲醛固定, 常规石蜡包埋, 4 µm连续切片, 水化后免疫组织化学染色行链霉素亲和素-过氧化酶复合物法(S-P)法, 所有切片均行微波抗原修复, 试验步骤严格按照试剂盒说明进行. 对照染色采用PBS代替一抗作为阴性对照.
1.2.2 结果判定: Wnt-1阳性判断以肿瘤细胞膜、胞浆中出现棕黄色染色为阳性, Snail阳性判断以细胞核内出现黄色染色为阳性. 阳性判定标准按瘤细胞着色的深度计分, 染色强度浅黄色1分, 棕黄色2分, 棕褐色3分. 按照阳性细胞数记分, 阳性细胞数<10% 0分; 11%-25% 1分, 26%-50% 2分; 51%-75% 3分, 75%以上4分. 两个分值相乘, 0分为阴性, 记为(-); 1-4分为弱阳性, 记为(+); 5-8分为中度阳性(++), ≥8分为强阳性(+++).
1.2.3 随访: 本组删失数据共8例, 死于非结肠癌相关原因的患者排除在本研究外. 随访时间为4-100 mo, 中位随访时间35 mo.
统计学处理 用SPSS16.0软件进行统计学处理, 两样本间采用卡方检验, Wnt-1与Snail的相关性采用Spearman相关性分析. 生存分析采用Kaplan-Meier法, 并用Log-rank法进行组间比较; 以Cox回归模型进行多因素分析. P<0.05为差异有统计学意义.
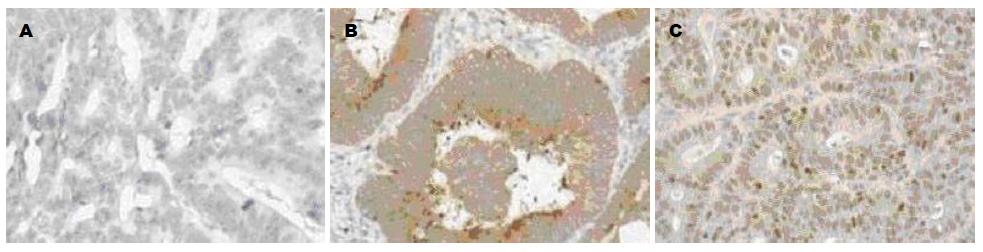
Wnt-1在正常结肠癌组织中几乎不表达, 其阳性表达定位于细胞浆, Wnt-1在结肠癌组织细胞胞浆染色为黄色到棕色, 呈散在和片状表达(图1B). Wnt-1在正常组织和结肠癌组组织中的阳性表达率8.6%和46.8%, 两组比较差异有显著差异(P<0.01). 结肠癌组高分化组、中分化组、低分化组阳性率分别为29.7%、 58.3%、66.7%, 三组比较差异有显著差异(P<0.01). 肿瘤分期Ⅰ-Ⅱ期和Ⅲ-Ⅳ期阳性率分别为42.9%和69.6%, 两组比较差异有显著差异(P<0.01). 淋巴转移有和无阳性率分别为62.2%和57.1%, 两组比较差异有显著差异(P<0.01). 在年龄、性别方面差异无统计学差异(表1).
| 临床病理参数 | n | Wnt-1 | Snail | ||||
| + | - | P值 | + | - | P值 | ||
| 分组 | 0.000 | 0.000 | |||||
| 正常组 | 70 | 6 | 64 | 5 | 65 | ||
| 结肠癌组 | 79 | 37 | 42 | 45 | 34 | ||
| 性别 | 0.602 | 0.544 | |||||
| 男 | 33 | 15 | 18 | 21 | 12 | ||
| 女 | 46 | 22 | 24 | 24 | 22 | ||
| 年龄(岁) | 0.434 | 0.547 | |||||
| <60 | 33 | 12 | 21 | 19 | 14 | ||
| ≥60 | 46 | 25 | 21 | 22 | 24 | ||
| 组织学分型 | 0.005 | 0.006 | |||||
| 高分化 | 37 | 11 | 26 | 17 | 20 | ||
| 中分化 | 24 | 14 | 9 | 15 | 9 | ||
| 低分化 | 18 | 12 | 7 | 13 | 5 | ||
| 肿瘤分期 | 0.009 | 0.006 | |||||
| Ⅰ-Ⅱ | 49 | 21 | 28 | 29 | 20 | ||
| Ⅲ-Ⅳ | 23 | 16 | 7 | 16 | 7 | ||
| 淋巴转移 | 0.023 | 0.025 | |||||
| 有 | 37 | 23 | 15 | 25 | 12 | ||
| 无 | 42 | 24 | 18 | 22 | 20 | ||
Snail在正常结肠癌组织中几乎不表达, 其阳性表达定位于细胞核, Snail在结肠癌组织细胞胞浆染色为棕黄色(图1C). Snail在正常组织和结肠癌组组织中的阳性表达率7.1%和57.0%, 两组比较有显著差异(P<0.01). 结肠癌组高分化组、中分化组、低分化组阳性率分别为45.9%、62.5%、72.2%, 三组比较差异有显著差异(P<0.01). 肿瘤分期Ⅰ-Ⅱ期和Ⅲ-Ⅳ期阳性率分别为59.2%和70.0%, 两组比较有显著差异(P<0.01). 淋巴转移有和无阳性率分别为67.6%和52.4%, 两组比较有显著差异(P<0.01). 在年龄、性别方面无统计学差异(表1).
以Wnt-1及Snail高中低分化组各自的阳性率进行Spearman相关性分析, 结果显示, 79例结肠癌组织中, Snail阳性45例, Snail阴性34例; Snail阳性和阴性患者Wnt-1蛋白阳性率分别为48.9%(22/45)、55.9%(19/34), Wnt-1和Snail蛋白表达呈明显相关性(r = 0.418, P<0.01)(表2).
| Wnt-1 | Snail | 总计 | r值 | P值 | |
| 阳性 | 阴性 | ||||
| 阳性 | 22 | 15 | 37 | 0.418 | 0.0042 |
| 阴性 | 23 | 19 | 42 | ||
| 总计 | 45 | 34 | 79 | ||
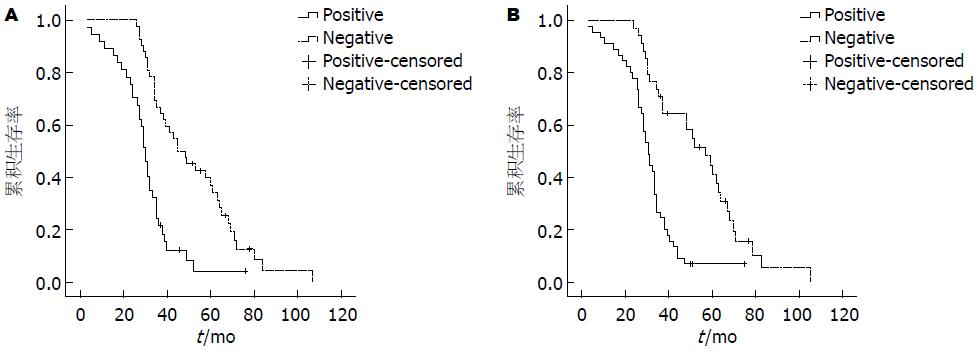
Kaplan-Meier法行生存分析, Wnt-1阳性表达组中位生存期为30.00 mo±1.25 mo, 阴性组为44.00 mo±4.25 mo, Wnt-1阳性组生存期明显低于阴性组, 组间比较差异具有统计学意义(χ2 = 22.142, P<0.01). Snail阳性表达组中位生存期为30.00 mo±1.68 mo, 阴性组为57.00 mo±6.36 mo, Snail阳性组生存期明显低于阴性组, 组间比较差异具有统计学意义(χ2 = 20.386, P<0.01)(图2).
经χ2检验筛选影响结肠癌患者生存时间的因素为肿瘤分化程度、临床分期、淋巴结转移、Wnt-1与Snail的异常表达, Cox多因素分析结果表明临床分期、淋巴结转移、Wnt-1与Snail的异常表达为结肠癌预后的独立风险因素(表3).
| 因素 | 回归系数估计值 | 标准误 | Wald | P值 | Exp(B) | 95%CI | |
| 下限 | 上限 | ||||||
| 分化程度 | -0.521 | 0.324 | 3.624 | 0.053 | 0.525 | 0.123 | 1.049 |
| 临床分期 | 1.018 | 0.316 | 8.776 | 0.003 | 2.635 | 1.267 | 5.098 |
| 淋巴结转移 | 1.361 | 0.223 | 17.338 | 0.000 | 3.485 | 1.387 | 6.375 |
| Wnt-1 | 0.698 | 0.252 | 8.125 | 0.004 | 2.135 | 1.115 | 3.895 |
| Snail | 0.711 | 0.249 | 8.431 | 0.001 | 2.139 | 1.317 | 3.798 |
结肠癌的发生发展与多基因参与有关, 是多阶段、多因素参与的复杂过程. Wnt-1蛋白是Wnt-1基因编码的分泌糖蛋白, 是信号转导的始动因子[4], 通过β-catenin、结肠腺瘤样息肉(adenomatous polyposis coli, APC)等磷酸化和去磷酸化完成Wnt-1信号传递, 与生物发育、细胞转移及细胞凋亡关系密切[5]. 正常细胞中胞质内游离的β-catenin水平极低, 一般没有Wnt-1信号, 当Wnt-1信号激活时, 抑制β-catenin磷酸化, 与转录因子结合而激活下游靶基因, 引起细胞增殖加快和凋亡抵抗, 进而导致细胞增生和肿瘤形成[6]. 本实验采用免疫组织化学检测Wnt-1在结肠癌组织中的表达情况, 发现Wnt-1在结肠癌组组织中的阳性表达37例, 而在正常对照结肠黏膜仅有6例, 证明了Wnt-1在结肠癌组织中阳性表达明显高于正常组织, 这与Davies等[7]对大肠癌的Wnt-1的研究结果相符. 并且随着肿瘤分期和淋巴结转移的发生, Wnt-1的表达逐渐增高, 提示Wnt-1与结肠癌的浸润转移呈正相关. 而且Wnt-1阳性表达组中位生存期明显低于阴性组, 提示Wnt-1可能与结肠癌的预后转归存在直接关系, 并参与结肠组织的癌变过程.
Snail是一种含有锌指结构的转录抑制因子, 可以被重新激活, 抑制细胞之间E-钙黏蛋白的表达引起表达的减少[8], 与E-钙黏蛋白表达成负相关, 而与肿瘤的侵袭性及肿瘤细胞转移性成正相关[9], 是E-钙黏蛋白转录的直接抑制子, 这一现象在结肠癌等肿瘤中已经获得证实[10]. 本研究旨在探讨Snail在结肠癌发生发展中的作用, 结果显示Snail定位在结肠癌细胞的细胞核, 提示Snail结肠癌中的作用与基因的转录调节关系密切, 其阳性表达率达57.0%. 在45例Snail阳性表达的结肠癌组织中有25例发生了淋巴结转移, 提示Snail的表达和淋巴结浸润和转移存在着明显的相关性, 与组织学类型、分化程度、浸润深度、有无淋巴结转移、Dukes分期均有关[11].
对结肠癌癌预后影响因素的分析中, 肿瘤浸润深度、临床分期、淋巴结转移也是影响结肠癌预后的重要因素. 目前结肠癌治疗及判断预后仍是以分期作为依据, 结合分子预后指标将有助于更好的诊治. 本研究发现, Wnt-1与Snail蛋白在结肠癌组织中的阳性表达较高, 提示部分结肠癌中存在存在Wnt-1与Snail的异常活化, 与肿瘤复发、转移的预后转归相关, 在结肠癌的发生发展中起重要作用, 鉴于Wnt-1与Snail蛋白在细胞增殖、周期调控、细胞凋亡及血管生成等生物过程中的作用, 本实验将Wnt-1与Snail与结肠癌癌共同进行研究, 以探索两种蛋白表达之间有无相关性, 探讨二者与结肠癌生物学行为间的关系. 本研究显示, 在Wnt-1阳性表达的结肠癌细胞中Snail表达量明显升高, 呈现正相关, 这与Yook等[12]的研究一致, Snail与β-catenin都有含有糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)识别位点, 由此进入降解途径, Wnt-1激活后形成的复合物可抑制GSK-3β的活性[13,14], 故可同时减少Snail与β-catenin的分解而引起积聚. 同样, 由于Snail蛋白N-端有一个可以直接与β-catenin作用的区域, 通过此区域与β-catenin结合后增强β-catenin的活性, 因此Snail阳性表达虽不能直接影响Wnt-1的表达量, 但可明显提高Wnt-1/β-catenin通路中β-catenin的量, 进而扩大Wnt-1的作用效果, 这在结肠癌体外细胞实验中也已证实: 过表达Snail可增加Wnt-1靶基因的表达, 而使用RNA干扰技术抑制Snail则Wnt-1的靶基因表达水平也下降[15], 提示两者在调节结肠癌细胞分化与转移的信号途径中可能存在某些交叉点, 为进一步研究结肠癌的发生、发展拓展了新的研究方向. 而这些信号途径一旦被研究清楚, 可能对结肠癌的转移风险评估、药物靶点设计具有重要的指导意义.
总之, 本研究通过检测结肠癌组织中Wnt-1、Snai分子的异常表达情况, 证实了两者彼此之间的相互联系, 为研究肿瘤发生、转移及预后提供了参考, 也为后续的信号异常途径研究提供依据.
结肠癌发病率和死亡率较高. Wnt-1、Snail是调控干细胞增殖、分化的重要分子, 其不恰当激活对肿瘤的发生发展起着重要作用, 并在多种肿瘤细胞中异常表达.
刘宝林, 教授, 中国医科大学附属盛京医院
探讨Wnt-1、Snail二者在结肠癌组织中的表达情况, 分析两者与结肠癌生长、浸润和转移能力的关系, 并分析Wnt-1与Snail两者是否存在一定的关联性.
结肠癌中存在Wnt-1与Snail的异常活化, 与肿瘤复发、转移的预后转归相关.
实验探讨Wnt-1、Snail二者在结肠癌组织中的表达情况, 分析两者与结肠癌生长、浸润和转移能力的关系, 并分析Wnt-1与Snail两者之间的关联性以及预后.
本文研究结肠癌组织中Wnt-1与Snail的异常活化以及彼此的相关性和预后, 立题新颖, 设计合理, 结论可信, 有一定科学性和参考价值.
编辑: 郭鹏 电编:鲁亚静
| 2. | Wieczorek M, Paczkowska A, Guzenda P, Majorek M, Bednarek AK, Lamparska-Przybysz M. Silencing of Wnt-1 by siRNA induces apoptosis of MCF-7 human breast cancer cells. Cancer Biol Ther. 2008;7:268-274. [PubMed] [DOI] |
| 4. | Watanabe O, Imamura H, Shimizu T, Kinoshita J, Okabe T, Hirano A, Yoshimatsu K, Konno S, Aiba M, Ogawa K. Expression of twist and wnt in human breast cancer. Anticancer Res. 2004;24:3851-3856. [PubMed] |
| 7. | Davies SR, Davies ML, Sanders A, Parr C, Torkington J, Jiang WG. Differential expression of the CCN family member WISP-1, WISP-2 and WISP-3 in human colorectal cancer and the prognostic implications. Int J Oncol. 2010;36:1129-1136. [PubMed] [DOI] |
| 9. | Poser I, Domínguez D, de Herreros AG, Varnai A, Buettner R, Bosserhoff AK. Loss of E-cadherin expression in melanoma cells involves up-regulation of the transcriptional repressor Snail. J Biol Chem. 2001;276:24661-24666. [PubMed] [DOI] |
| 10. | Liu YN, Lee WW, Wang CY, Chao TH, Chen Y, Chen JH. Regulatory mechanisms controlling human E-cadherin gene expression. Oncogene. 2005;24:8277-8290. [PubMed] [DOI] |
| 12. | Yook JI, Li XY, Ota I, Fearon ER, Weiss SJ. Wnt-dependent regulation of the E-cadherin repressor snail. J Biol Chem. 2005;280:11740-11748. [PubMed] [DOI] |