修回日期: 2014-04-05
接受日期: 2014-05-19
在线出版日期: 2014-06-08
目的: 探讨伊马替尼辅助治疗时间对中高度复发风险胃肠间质瘤(gastrointestinal stromal tumor, GIST)患者无复发生存的影响以及不良反应.
方法: 回顾性分析2003-03/2009-01我院收治的中高度复发风险GIST患者65例的临床资料. 评价近期疗效、复发情况, 并依据伊马替尼辅助治疗的时间进行分组, 比较各组间复发情况、无复发生存以及不良反应之间的差异.
结果: 完全缓解(complete remission, CR)5例(7.69%), 部分缓解(partial remission, PR)44例(67.69%), 疾病稳定(stable disease, SD)13例(20.0%), 疾病进展(progressive disease, PD)3例(4.62%), 客观有效率(overall response rate, ORR)为75.38%(49/65), 疾病控制率(disease control rates, DCR)为95.38%(62/65). 65例患者中共有12例患者(18.46%)出现肿瘤复发;随着伊马替尼治疗时间的延长, 患者1、2、3、4、5年无复发生存率均呈逐渐升高的趋势, 治疗时间≥4年的1、2、3、4年无复发生存率均为100%, 5年可达95.24%. 治疗时间≥3年组5年无复发生存率(92.11%)显著高于<3年组(59.26%), 差异有统计学意义(P = 0.026);治疗>3年组5年无复发生存率(95.65%)有高于治疗3年组(92.59%)的趋势, 但差异无统计学意义(P = 0.168). 伊马替尼治疗期间不良发硬以血液毒性、消化系反应、皮肤黏膜水肿、乏力等为主, 多为0-2级, 经相关对症治疗后好转. 治疗时间≥3年组乏力的发生率显著高于<3年组, 差异有统计学意义(P<0.05).
结论: 对于中高度复发风险的GIST患者, 延长术后伊马替尼辅助治疗的时间至3年以上可以在一定程度上提高无复发生存时间, 不良反应除乏力发生率明显升高外, 其余均未发现明显升高的现象.
核心提示: 对于中高度复发风险的胃肠间质瘤(gastrointestinal stromal tumor)患者, 将术后伊马替尼辅助治疗延长至3年可以在一定程度上提高无复发生存时间, 其不良反应除乏力发生率明显升高外, 其余均未发现明显升高的现象, 说明延长疗程的安全性有保障.
引文著录: 王晓媚. 伊马替尼辅助治疗时间对中高度复发风险胃肠间质瘤患者无复发生存的影响. 世界华人消化杂志 2014; 22(16): 2351-2356
Revised: April 5, 2014
Accepted: May 19, 2014
Published online: June 8, 2014
AIM: To explore the influence of imatinib as adjuvant therapy on relapse-free survival in patients with gastrointestinal stromal tumors (GISTs) at moderate to high risk of recurrence.
METHODS: Sixty-five patients with GISTs at moderate to high risk of recurrence who were treated at our hospital from March 2006 to January 2009 were retrospectively analyzed. The short term curative effect and relapse were evaluated. The patients were divided into different groups according to imatinib treatment time, and the differences in relapse, relapse-free survival and adverse reactions were compared between different groups.
RESULTS: Complete remission was achieved in 5 (7.69%) cases, partial remission in 44 (67.69%) cases, stable disease in 13 (20.0%) cases, and progressive disease in 3 (4.62%) cases. The overall response rate was 75.38% (49/65), and disease control rate was 95.38% (62/65). Twelve (18.46%) patients developed tumor recurrence. With the increase in imatinib treatment time, the relapse-free survival rates of patients at 1, 2, 3, 4 and 5 years showed a rising trend. The relapse-free survival rates at 1, 2, 3 and 4 years were all 100%, and it was 95.24% at 5 years. The 5-year relapse-free survival rate (92.11%) in the treatment ≥ 3 years group was significantly higher than that in the < 3 years group (59.26%)(P = 0.026); the 5-year relapse-free survival rate (95.65%) in the ≥ 3 years group was higher than that in the 3 years group (92.59%), but there was no significant difference (P = 0.168). Imatinib toxicities mainly included blood toxicity, digestive tract toxicity, skin and mucosal edema, and debilitation, and most of these toxicities were mild (grades 0-2) and improved after symptomatic treatment. The incidence of debilitation in the ≥ 3 years group was significantly higher than that in the < 3 years group (P < 0.05).
CONCLUSION: For patients with GISTs at moderate to high risk of recurrence, prolonged postoperative imatinib adjuvant treatment to more than 3 years can improve relapse-free survival time to some extent. Except for the significantly increased incidence of debilitation, the incidence of other adverse reactions showed no significant rise.
- Citation: Wang XM. Influence of imatinib as adjuvant therapy on relapse-free survival in patients with gastrointestinal stromal tumors at moderate to high risk of recurrence. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2351-2356
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2351.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2351
胃肠间质瘤(gastrointestinal stromal tumor, GIST)起源于胃肠道间质的Cajal细胞, 是胃肠道最为常见的间叶源性肿瘤. 外科手术切除是早期局限性GIST的最佳方法, 但是术后复发率较高, 可达80%-85%[1,2]. 在分子靶向药物应用于临床之前, 复发转移的GIST主要采用阿霉素类药物为基础的化疗方案, 但有效率较低, 而且该病对放疗、介入栓塞等的敏感性均不高, 即使这些方法联合应用也无法获得满意疗效. 伊马替尼为小分子络氨酸激酶受体抑制剂, 是首个被临床应用于恶性肿瘤治疗的细胞信号传导抑制剂, 标志着人类对肿瘤的治疗已进入分子靶向时代. 国内外研究证实[3,4], 伊马替尼对手术后复发的GIST疗效较好, 口服伊马替尼400 mg/d已成为该病的标准一线治疗方案; 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的指南中推荐伊马替尼辅助治疗的时间为3年. 但是, Dematteo等[5]和Joensuu等[6]的研究结果均发现, 在完成伊马替尼辅助治疗3年后, GIST的复发率又出现升高趋势, 说明3年的疗程可能无法真正控制复发. 目前国内外对伊马替尼辅助治疗GIST的时间仍未达到共识, 因此, 本研究分别采用不同疗程治疗GIST患者, 以探讨伊马替尼术后辅助治疗时间对肿瘤复发的影响.
纳入2006-03/2009-01我院收治的GIST患者65例. 纳入标准: 经病史询问、临床症状、辅助检查以及手术完整切除后病理组织学检查证实为原发性GIST; 依据国立卫生研究所(National Institute of Health, NIH)修订的GIST复发风险分级标准(2008版)[7]诊断为中、高度复发风险的GIST; 既往未接受过化疗、放疗及其他治疗, 或接受过这些治疗但已终止4 wk以上, 东部临床肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体力状况评分不限. 排除标准: 伴有严重心、肺、肝、肾等脏器功能障碍, 活动性出血, 以及其他未能控制的疾病; 有其他恶性肿瘤病史; 妊娠期及哺乳期妇女; 依从性较差. 65例患者中, 男41例, 女24例, 年龄25-78岁, 平均52.35岁±6.54岁; ECOG评分<2分43例, ≥2分22例; 中度复发风险者19例, 高度复发风险者46例; 原发部位: 胃14例, 十二指肠5例, 小肠25例, 结直肠6例, 其他15例; 既往有化疗史15例, 无化疗史50例; c-kit及和PDGFRA基因突变检测结果: c-kit外显子11突变55例, c-kit外显子9突变7例, 无PDGFRA突变型, c-kit/PDGFRA野生型3例.
1.2.1 治疗: 所有患者术后均取原发肿瘤组织进行病理分析, 并于术后2 mo内实施伊马替尼化疗方案: 给予甲磺酸伊马替尼片(瑞士诺华制药有限公司生产, 商品名: 格列卫, 规格: 0.4 g/片), 起始剂量为400 mg/d, 清晨顿服, 持续用药期间, 可依据药物不良反应以及病情变化适当调整剂量和治疗时间, 但不得<300 mg/d, 亦不得>800 mg/d.
1.2.2 观察指标: (1)统计65例患者采用伊马替尼辅助治疗的时间; (2)治疗3 mo后依据实体瘤疗效评价标准(Response Evaluation Criteria in SolidTumors, RECIST)评价近期疗效, 分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD), 计算客观有效率(overall response rate, ORR)以及疾病控制率(disease control rates, DCR), DCR = (CR+PR+SD)例数/总例数×100%; (3)随访至患者死亡或至随访截止日期2014-01, 统计复发率及复发时间, 并依据复发风险分级、基因突变类型等对复发率进行比较; (4)无复发生存率: 比较伊马替尼不同治疗时间的患者1、2、3、4、5年无复发生存率的差异; 再比较治疗时间<3年组与≥3年组无复发生存率的差异, 以及治疗3年者与>3年者PFS的差异; (5)不良反应: 比较<3年组与≥3年组治疗期间不良反应的差异, 依据美国国立癌症研究院通用毒性标准(National Cancer Institute Common Toxicity Criteria, NCI-CTC)3.0进行评价, 分为0-4级.
统计学处理 采用SPSS13.0 for windows统计学软件对本组数据进行分析, 计量资料的比较采用独立样本t检验, 计数资料的比较采用卡方检验; 无复发生存曲线的绘制应用Kaplan-Meier法, 生存率的比较采用Log-rank检验. P<0.05为差异有统计学意义.
65例患者中, 治疗时间<1年者2例(3.08%), 系因药物不良反应较大而停药; 治疗时间≥1年且<2年者13例(20.0%); 治疗时间≥2年且<3年者12例(18.46%), 治疗时间≥3年且<4年者17例(26.15%), 治疗时间≥4年者21例(32.31%).
65例患者中CR 5例(7.69%), PR 44例(67.69%), SD 13例(20.0%), PD 3例(4.62%), ORR为75.38%(49/65), DCR为95.38%(62/65). 本组65例患者均获得随访, 随访时间为7-74 mo, 中位随访时间为62 mo, 共有12例患者(18.46%)出现肿瘤复发, 其中单纯腹盆腔转移8例, 单纯肝转移5例, 肝和腹盆腔转移6例, 残胃局部复发1例. 中度复发风险的19例患者均未发现肿瘤复发, 高度复发风险的46例患者中有12例(26.09%)出现肿瘤复发, 两组差异有统计学意义(χ2 = 4.4693, P<0.05). c-kit外显子11突变的55例患者中有10例(18.18%)复发, 外显子9突变的7例患者中有1例复发(14.29%), c-kit/PDGFRA野生型的3例患者中有1例复发(33.33%), 三者之间比较, 差异无统计学意义(P>0.05). 伊马替尼治疗过程中有2例患者复发, 1例于治疗24个月时复发, 将伊马替尼剂量调整至600 mg/d后评价疗效为SD, 1例于治疗64 mo时复发, 终止伊马替尼, 改用舒尼替尼37.5 mg/d连续口服, 3 mo后评价疗效为SD; 伊马替尼治疗终止后有10例患者复发, 其中治疗时间<2年者5例, ≥2年且<3年者3例, 3年者1例, 5年者1例, 均再次进行伊马替尼400 mg/d的治疗方案, 3 mo后评价疗效, PR 4例, SD 6例, 但是在治疗12、18 mo时分别有1例患者出现肿瘤进展, 改用舒尼替尼37.5 mg/d连续口服, 3 mo后评价疗效为SD.
如表1所示, 随着伊马替尼治疗时间的延长, 患者1、2、3、4、5年无复发生存率均呈逐渐升高的趋势, 治疗时间≥4年的1、2、3、4年无复发生存率均为100%, 5年无复发生存率可达95.24%.
| 伊马替尼治疗时间 | n | 无复发生存率 | ||||
| 1年 | 2年 | 3年 | 4年 | 5年 | ||
| <1年 | 2 | 1(50.0) | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) |
| ≥1年且<2年 | 13 | 13(100.0) | 12(92.31) | 10(76.92) | 10(76.92) | 8(61.53) |
| ≥2年且<3年 | 12 | 12(100.0) | 12(100.0) | 11(91.67) | 9(75.0) | 8(66.67) |
| ≥3年且<4年 | 17 | 17(100.0) | 17(100.0) | 17(100.0) | 15(88.24) | 15(88.24) |
| ≥4年 | 21 | 21(100.0) | 21(100.0) | 21(100.0) | 21(100.0) | 20(95.24) |
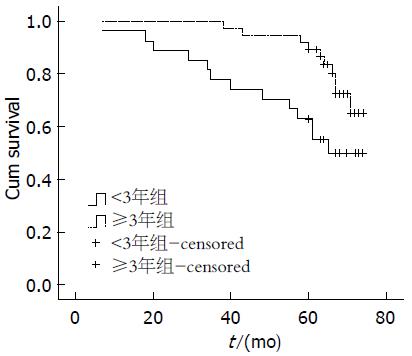
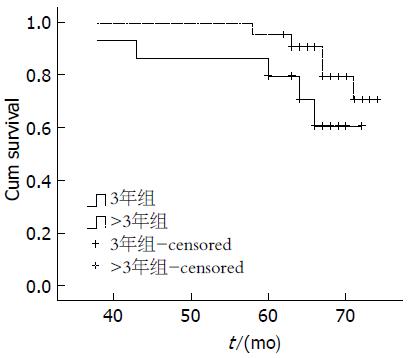
如图1所示, 治疗时间≥3年组5年无复发生存率(92.11%)显著高于<3年组(59.26%), 差异有统计学意义(P = 0.026); 如图2所示, 治疗>3年组5年无复发生存率(95.65%)有高于治疗3年组(92.59%)的趋势, 但差异无统计学意义(P = 0.168).
如表2所示, 伊马替尼治疗期间不良反应以血液毒性、消化系反应、皮肤黏膜水肿、乏力等为主, 多为0-2级, 经止吐、静脉滴注粒细胞集落刺激因子等相关对症治疗后好转, 药物不良反应均可耐受, 无1例终止治疗. 治疗时间≥3年组仅有乏力的发生率显著高于<3年组, 差异有统计学意义(P<0.05).
| 不良反应 | <3年组(n = 27) | ≥3年组(n = 38) | ||||||||
| 0-1级 | 2级 | 3级 | 4级 | 合计n(%) | 0-1级 | 2级 | 3级 | 4级 | 合计n(%) | |
| 白细胞减少 | 15 | 7 | 1 | 0 | 23(85.19) | 20 | 12 | 2 | 0 | 34(89.47) |
| 血小板减少 | 2 | 2 | 0 | 0 | 4(14.81) | 4 | 1 | 1 | 0 | 6(15.79) |
| 血红蛋白减少 | 2 | 0 | 0 | 0 | 2(7.41) | 2 | 1 | 0 | 0 | 3(7.89) |
| 肝功能损害 | 1 | 1 | 0 | 0 | 2(7.41) | 2 | 2 | 0 | 0 | 4(10.53) |
| 肾功能损害 | 1 | 0 | 0 | 0 | 1(3.70) | 1 | 1 | 0 | 0 | 2(5.26) |
| 腹泻 | 10 | 3 | 1 | 0 | 14(51.85) | 12 | 6 | 2 | 0 | 20(52.63) |
| 恶心呕吐 | 7 | 1 | 2 | 0 | 10(37.04) | 7 | 6 | 1 | 0 | 14(36.84) |
| 食欲减退 | 13 | 2 | 0 | 0 | 15(55.56) | 12 | 6 | 2 | 0 | 20(52.63) |
| 乏力 | 15 | 3 | 0 | 0 | 18(66.67)a | 24 | 8 | 2 | 0 | 34(89.47) |
| 脱发 | 2 | 2 | 1 | 0 | 5(18.52) | 3 | 3 | 1 | 0 | 7(18.42) |
| 皮肤黏膜水肿 | 20 | 2 | 0 | 0 | 22(81.48) | 25 | 5 | 2 | 0 | 32(84.21) |
| 心脏毒性 | 0 | 0 | 0 | 0 | 0(0.00) | 1 | 0 | 0 | 0 | 1(2.63) |
伊马替尼应用于胃肠间质瘤术后的辅助治疗已获得了国内广泛的认可. ACOSIG-Z9001研究[5]中, 713例GIST患者被随机分为伊马替尼400 mg/d的治疗组以及安慰剂治疗组, 结果显示, 伊马替尼治疗组1年无复发生存率为98%, 显著高于对照组的83%. 但是, 该研究的后续报道显示, 在伊马替尼停药6 mo后, 治疗组复发率较前明显升高, 而且治疗组与安慰剂之间总生存率比较, 差异无统计学意义. 以上结果提示我们, GIST患者术后应有伊马替尼进行辅助治疗可获得肯定疗效, 但可能需要进一步延长服药时间, 以降低肿瘤复发率, 提高生存率. 之后的SSG ⅩⅧ/AIO研究[6]则对高复发风险c-kit阳性GIST患者采用不同疗程伊马替尼的疗效进行了对比, 结果显示, 治疗3年组的5年无复发生存率(66%)显著高于1年组(48%), 但是3年伊马替尼治疗结束后, GIST的复发率也同样呈现升高的趋势, 说明即使是3年的治疗时间仍可能无法有效控制复发.
本研究对伊马替尼不同治疗时间对GIST患者的无复发生存率进行了分析, 结果提示, 随着伊马替尼治疗时间的延长, 患者的无复发生存率逐渐升高, 治疗时间≥3年的患者5年无复发生存率为92.11%, 显著高于<3年的患者(59.26%), 差异有统计学意义(P = 0.026); 与治疗3年的患者相比, >3年者5年无复发生存率也呈升高趋势(95.65% vs 92.59%), 但差异无统计学意义(P = 0.168), 说明延长术后伊马替尼辅助治疗的时间对改善无复发生存情况是有利的, 但获益的程度有限, 还需扩大样本量、延长随访时间进行深入分析.
ACOSIG-Z9001[5]以及SSG ⅩⅧ/AIO研究[6]中, 伊马替尼对c-kit外显子11突变的患者具有显著疗效, 而对c-kit外显子9突变以及c-kit/PDGFRA野生型的患者疗效不佳. 本研究中, c-kit外显子11突变的55例患者中18.18%复发, 外显子9突变的7例患者中14.29%复发, c-kit/PDGFRA野生型的3例患者中有33.33%复发, 三者之间比较, 差异无统计学意义(P>0.05), 但是, 外显子9突变以及c-kit/PDGFRA野生型患者例数尚不足, 无法进行亚组分析. 另外, 本组中中度复发风险的19例患者均未发现肿瘤复发, 高度复发风险的46例患者中26.09%出现肿瘤复发, 两组差异显著, 但是, 有3例患者接受了不足3年的伊马替尼辅助治疗, 但5年随访期间仍未出现肿瘤复发, 这一结果又与肿瘤复发风险评估的标准相互矛盾. 在分析相关报道后[8,9], 我们认为, GIST患者基因突变的类型可能会影响伊马替尼辅助治疗的效果, 将这一预测因子融合入其他风险预测因子中是否会对肿瘤复发的风险评估标准产生影响, 本次研究未按照基因突变类型进行分类治疗, 今后可针对该方面进行深入研究.
另外, 本组中伊马替尼治疗过程中以及停药后均有肿瘤复发患者, 前者仅有2例, 在增加伊马替尼剂量或改用舒尼替尼后疗效评价达SD; 后者有10例, 虽然再次进行伊马替尼400 mg/d治疗, 且3 mo后疗效评价均在SD以上, 但是在12、18 mo后又分别出现1例进展患者, 遂改用舒尼替尼治疗, 3 mo后评价疗效为SD, 其余患者由于随访时间限制, 复发情况还未得到完全统计. 以上结果说明, 虽然肿瘤复发的患者在二次接受伊马替尼治疗后病情有所控制, 但是在2年的随访期间内已有20%的患者出现复发, 可能预示着伊马替尼二次治疗所带来的生存获益不如一线治疗. 分析原因, 我们认为这可能与伊马替尼首次治疗时, GIST亚临床病灶对其的耐药机制已不同程度地启动有关, 而首次伊马替尼使用时间的长短可能对其二次治疗的疗效产生影响.
ACOSIG-Z9001[5]以及SSG ⅩⅧ/AIO研究[6]中, 有20%左右的患者在伊马替尼400 mg/d的剂量下连续口服12 mo, 出现了较为严重的不良反应, 服药36 mo时, 其不良反应发生率高达30%左右. 伊马替尼对机体产生的不良反应主要与用药剂量、疗程以及患者自身耐受情况有关, 用药前详细评估患者一般状况, 用药期间加强对药物相关性不良反应的观察, 并及时给予正确处理, 可有效减轻不良反应给患者身体状况和治疗情况带来的影响. 本研究中, 伊马替尼治疗期间不良反应以血液毒性、消化系反应、皮肤黏膜水肿、乏力等为主, 多为0-2级, 经相关对症治疗后好转, 基本未影响患者的生活质量, 但其中治疗时间<1年的2例患者系因药物不良反应较大而停药, 在停药后4及15 mo死亡. 治疗时间≥3年的患者在乏力的发生率上显著高于<3年组, 但其他不良反应均未发现明显的增加, 尽管如此, 延长伊马替尼治疗时间后, 可能还会出现预期之外的不良反应, 因此在治疗期间应尤其注意对相关不良反应的监测, 及时发现并进行正确的处理, 以降低不良事件的发生率.
总之, 对于中高度复发风险的GIST患者, 延长术后伊马替尼辅助治疗的时间至3年以上可以在一定程度上提高无复发生存时间, 不良反应除乏力发生率明显升高外, 其余均未发现明显升高的现象. 今后的研究中, 我们将对GIST患者基因突变的类型与肿瘤复发风险的关系、延长伊马替尼治疗的远期疗效以及可预期的不良反应、伊马替尼耐药后治疗方案的选择等进行更深层次的探索.
目前, 外科手术切除仍是早期局限性胃肠间质瘤(gastrointestinal stromal tumor, GIST)的最佳方法, 但是术后复发率高达80%-85%. 一些研究已证实, 伊马替尼对术后复发患者的疗效较好, 口服伊马替尼400 mg/d成为GIST的标准一线治疗方案. NCCN指南推荐其辅助治疗时间为3年, 但是近年来有研究发现在完成3年治疗后, GIST复发率又呈现升高趋势, 导致国内外对于伊马替尼辅助治疗GIST的时间仍未达成共识.
刘占举, 教授, 同济大学附属上海市第十人民医院
目前, 国内外研究针对伊马替尼辅助治疗GIST的重点集中于: 3年时间是否不足以真正控制复发?延长治疗时间是否可以有效降低复发率, 延长生存期?延长治疗时间的安全性如何?不同基因突变类型的GIST患者接受伊马替尼辅助治疗的个体差异如何.
首先, 本研究将伊马替尼辅助治疗时间细分为<1年、≥1年且<2年、≥2年且<3年、≥3年且<4年以及≥4年, 而不仅以3年为限; 其次, 本研究分别比较了中度复发风险和高度复发风险患者的肿瘤复发率, 并按照基因突变类型进行分类, 比较, c-kit外显子11、9突变以及c-kit/PDGFRA野生型患者肿瘤复发率的差异; 另外, 本研究对≥3年和<3年组的药物相关性不良反应进行完整统计.
对于中高度复发风险的GIST患者, 术后伊马替尼辅助治疗的时间≤3年可能无法良好控制肿瘤复发, 临床上可延长疗程至3年以上, 并在治疗过程中严密观察患者出现的不良反应, 及时给予相关处理, 以延长无复发生存时间. 今后可以进一步开展个体化治疗的研究, 如患者的体力状况评估、耐药瘤组织的突变检测、肿瘤局部浸润或核分裂象的检测等, 探讨更适合中国患者体质特点的给药剂量和给药途径, 以保证安全性的情况下最大限度地提高辅助治疗效果.
本文为临床用药提供了依据, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Neuhaus SJ, Clark MA, Hayes AJ, Thomas JM, Judson I. Surgery for gastrointestinal stromal tumour in the post-imatinib era. ANZ J Surg. 2005;75:165-172. [PubMed] |
| 4. | Blanke CD, Demetri GD, von Mehren M, Heinrich MC, Eisenberg B, Fletcher JA, Corless CL, Fletcher CD, Roberts PJ, Heinz D. Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol. 2008;26:620-625. [PubMed] [DOI] |
| 5. | Dematteo RP, Ballman KV, Antonescu CR, Maki RG, Pisters PW, Demetri GD, Blackstein ME, Blanke CD, von Mehren M, Brennan MF. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet. 2009;373:1097-1104. [PubMed] [DOI] |
| 6. | Joensuu H, Eriksson M, Sundby Hall K, Hartmann JT, Pink D, Schütte J, Ramadori G, Hohenberger P, Duyster J, Al-Batran SE. One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. JAMA. 2012;307:1265-1272. [PubMed] [DOI] |
| 7. | Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-1419. [PubMed] [DOI] |
| 8. | Paul PC, Chakraborty J, Kundu D, Sarkar R. Gastro-intestinal stromal tumour--role of CD117 in diagnosis and management. Indian J Pathol Microbiol. 2007;50:279-283. [PubMed] |