修回日期: 2014-04-03
接受日期: 2014-04-09
在线出版日期: 2014-06-08
目的: 提高骨髓间充质干细胞(mesenchymal stem cell, MSC)移植治疗急性肝衰竭时在肝脏的定植率及疗效.
方法: 采用慢病毒转染使MSC过表达CXCR4基因, RT-PCR和细胞流式检测CXCR4表达. ELISA实验检测肝衰竭裸鼠肝脏MSC向基质衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)水平. 迁移实验检测转染的SDF-1α趋化能力. 20%(V/V)四氯化碳(CCl4)橄榄油溶液8 μL/g腹腔注射诱导裸鼠急性肝衰竭模型, 24 h后尾静脉注射CXCR4转染的间充质干细胞(CXCR4-MSC)和未转染的间充质干细胞(Null-MSC). 于注射后各时间点活体示踪MSC分布情况、裸鼠肝功能、生存率、组织病理学改变和肝细胞增殖情况.
结果: CXCR4-MSC高表达CXCR4基因和CXCR4蛋白, 肝衰竭裸鼠肝脏SDF-1α水平升高, 与正常裸鼠相比有统计学差异. 体外迁移实验证实CXCR4-MSC比Null-MSC具有向SDF-1α更好的迁移能力. 体内活体成像显示移植后5 d CXCR4-MSC主要定植在肝脏, 而Null-MSC在肝脏和脾脏都有定植. 高定植率使得转染组裸鼠比未转染组裸鼠肝细胞受损更轻且具有更长的生存期, 同时转染组裸鼠肝细胞增殖明显多于未转染组, 两者有统计学差异. 我们的实验证实转染CXCR4基因的骨髓间充质干细胞能够更好地促进肝再生.
结论: 基因修饰使骨髓间充质干细胞过表达CXCR4基因能够促进干细胞在肝脏的定植, 改善肝功能, 提高肝细胞的再生和裸鼠的生存率, 为干细胞移植治疗肝功能衰竭提供了更广阔的应用途径.
核心提示: 骨髓间充质干细胞(mesenchymal stem cell, MSC)移植有望替代肝移植, 成为急性肝衰竭的新手段. 但干细胞在肝脏较低的定植率制约了其疗效. 骨髓间充质干细胞向基质衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)/CXCR4轴在干细胞向损伤组织的归巢过程中发挥了重要作用. 我们通过基因修饰的方法使MSCs高表达CXCR4, 体外活体示踪证实了CXCR4修饰的MSCs在衰竭肝脏中的定植率要明显高于未修饰者. 而更高的定植率也导致了更长的生存期和更好的肝功能恢复.
引文著录: 马虎成, 施晓雷, 任昊桢, 袁献温, 丁义涛. CXCR4转染的骨髓间充质干细胞靶向治疗急性肝衰竭. 世界华人消化杂志 2014; 22(16): 2229-2236
Revised: April 3, 2014
Accepted: April 9, 2014
Published online: June 8, 2014
AIM: To explore whether mesenchymal stem cells (MSCs) overexpressing CXCR4 show increased colonization ability and confer better liver regeneration in mice.
METHODS: MSCs were modified with CXCR4 gene (CXCR4-MSCs) or not (Null-MSCs) through lentiviral transduction. The characteristics of CXCR4-MSCs and Null-MSCs were determined by RT-PCR and flow cytometry. CXCR4-MSCs and Null-MSCs were infused intravenously 24 h after administration of CCl4 in nude mice. The concentration of SDF-1α in the damaged liver was detected by ELISA. Transwell migration assays were carried out to evaluate the migration ability of MSCs toward SDF-1α. The distribution of the stem cells, their survival rates, liver function, histopathology and hepatocyte regeneration were analyzed.
RESULTS: Transfected MSCs overexpressed CXCR4 at both gene and protein levels. In vitro, CXCR4-MSCs showed better migration capability toward SDF-1α. In vivo imaging showed that CXCR4-MSCs migrated to the liver in greater numbers than Null-MSCs 5 d after intravenous infusion in mice with acute liver failure (ALF). Higher colonization led to a longer lifetime and better liver function. Immunohistochemistry analysis of Ki-67 showed increased cell proliferation in the damaged liver of CXCR4-MSC-treated animals.
CONCLUSION: Genetically modified MSCs expressing CXCR4 show greater colonization ability and confer better functional recovery of the damaged liver.
- Citation: Ma HC, Shi XL, Ren HZ, Yuan XW, Ding YT. Genetically modified mesenchymal stem cells overexpressing CXCR4 show increased colonization ability and confer better liver regeneration in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2229-2236
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2229
近些年来, 骨髓间充质干细胞(mesenchymal stem cell, MSC)已被证实具有免疫抑制和修复损伤组织的能力[1,2]. 并且大量基于干细胞移植治疗的研究已在医学领域取得了令人瞩目的成果, 为多种疾病的治疗提供了新的思路. MSC移植也已被用于治疗包括急性肝衰竭在内的各种终末期肝病的实验及临床研究[3-6]. 但同时国内外的许多研究也发现了细胞移植疗效不佳的现象, 对这一系列文献的回顾性研究发现制约MSC移植疗效的主要原因是由于移植的MSC在肝脏的定植率较低, 不能完全发挥MSC损伤修复的作用[7].
目前一系列关于促干细胞归巢的研究已经证实了基质细胞衍生因子1α(stromal cell-derived factor-1α, SDF-1α)在促进移植干细胞向损伤组织迁移过程中的作用[8-11]. SDF-1α是骨髓基质细胞产生的CXC类趋化蛋白, 为已知的唯一能与其受体CXCR4结合并能激活它的天然趋化因子. SDF-1α和CXCR4广泛地、组成性地表达于多种细胞和组织中, 包括免疫细胞、脑、心脏、肝脏、肾、肺和脾. 大量的研究已经表明SDF-1α/CXCR4轴在机体的损伤修复过程中担任了非常重要的角色[12]. SDF-1α能够动员骨髓内的干细胞, 并且通过与分布在干细胞表面的CXCR4结合促进骨髓干细胞向损伤组织的迁移与归巢. Zhang等[13]发现SDF-1α/CXCR4轴能够显著提高移植的干细胞在梗死心肌中的数量, 并且明显改善心肌功能. Liu等[14]也发现给予低氧刺激能够加强MSC表达CXCR4, 进而促进了肾脏损伤部位MSC的募集, 提高了功能恢复, 并且减少了细胞凋亡.
虽然损伤组织遭受低氧、内毒素、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎症因子的刺激后, 可以提高骨髓内MSC表面的CXCR4的表达, 但是经过多次传代培养后的MSC表面低表达CXCR4[15]. 于是, 我们期望通过慢病毒将CXCR4整合到移植的MSC基因组内, 使得MSC稳定表达CXCR4, 来提高其向肝脏迁移的效率和治疗急性肝衰竭的疗效.
转染和未转染CXCR4基因的人骨髓间充质干细胞系(CXCR4-MSC和Null-MSC)购自上海Invitrogen公司; ♂ 裸鼠(nu/nu)30只, 体质量18-22 g, 由南京大学医学院附属鼓楼医院实验动物中心提供. L-DMEM培养液、特级胎牛血清、胰蛋白酶购自Gibco公司; RT-PCR试剂盒(南京Biouniquer公司); APC标记的鼠抗人CD184(美国BD Pharmingen公司); 四氯化碳, SDF-1α(美国Sigma公司); ELISA试剂盒(美国R&D公司); Ki-67抗体(Abcam公司); Transwell小室(德国Millipore公司); DiR荧光染料(北京Fanbo Biochemicals公司).
1.2.1 裸鼠急性肝衰竭模型建立: 将CCl4按照体积比1:4溶于橄榄油配成体积分数为20%CCl4橄榄油溶液; CCl4橄榄油溶液以8 μL/g的量腹腔注射诱导裸鼠急性肝衰竭(acute liver failure, ALF)模型.
1.2.2 RT-PCR检测CXCR4表达: 提取CXCR-MSC和Null-MSC总RNA, 立即用于逆转录. 使用BU-SuperScript RT kit试剂盒进行逆转录, 具体如下: 在EP管中加入10 μL DEPC水, 1 μL引物, 1 μL模板RNA, 1 μL dNTP, 短暂离心后65 ℃水浴5 min, 立刻0 ℃冰水浴至少1 min. 短暂离心后冰上操作: 加入4 μL 5×First-Strand Buffer, 1 μL 0.1 MDTT, 1 μL RNase Inhibitor, 1 μL SSⅢ逆转录酶, 短暂离心后50 ℃水浴60 min进行逆转录, 70 ℃水浴15 min灭火逆转录酶, 立即进行PCR. PCR反应条件为94 ℃ 1 min, 58 ℃ 50 s, 72 ℃ 90 s, 进行40个循环, 然后72 ℃ 10 min完成. 引物序列为: CXCR4上游引物: 5'-ggtggtctatgttggcgtct-3', 下游引物: 5'-tcgatgctgatcccaatgta-3'; β-actin上游引物: 5'-ggcatggggtcagaaggatt-3', 下游引物: 5'-gaggcgtacagggatagcac-3'. PCR产物进行琼脂糖凝胶电泳.
1.2.3 流式细胞术检测CXCR4表达: 大约1×106个细胞装入流式管中1500 r/min离心5 min, 加入1 mL PBS重悬后加入20 μL APC标记的抗人CD184抗体, 室温避光孵育20 min, 1500 r/min离心5 min, 1 mL PBS洗3遍. 500 μL PBS重悬, 上流式细胞仪检测.
1.2.4 ELISA检测肝衰竭肝脏SDF-1α水平: 取100 mg冰冻肝衰竭肝脏组织, 加入1 mL PBS, 用玻璃研磨器制成肝组织匀浆, 匀浆用离心机12000 r/min离心5 min, 取上清按照说明书用ELISA试剂盒进行检测, 获得肝衰竭肝组织匀浆SDF-1α浓度.
1.2.5 迁移实验: 采用孔径为8 μm的聚碳酸酯膜(Millipore)进行迁移实验, 将CXCR-MSC和Null-MSC以2×105个细胞/mL的密度培养在上层小室, 下层小室为600 μL浓度为30 ng/mL的SDF-1α溶液. 37 ℃培养10 h, 轻轻挂掉膜上表面的细胞, 然后将膜用4%的多聚甲醛固定15 min, 再用0.5%的结晶紫染色10 min, 在显微镜下观察迁移细胞的数量.
1.2.6 活体成像示踪移植细胞在体内分布情况: 细胞移植前将DiR染料(2 mL, 50 μmol/L)加入到培养瓶里, 与细胞37 ℃孵育20 min, PBS洗两遍, 加入胰酶消化细胞, 1500 r/min离心5 min, PBS重悬, 制备成细胞悬液尾静脉注射. 移植后5 d, 用小动物活体成像系统观察移植细胞在体内的分布.
1.2.7 肝功能检测和生存期比较: 所有动物建模后随机分3组, PBS对照组(n = 25), CXCR4-MSC组(n = 25)和Null-MSC组(n = 25). 各组诱导24 h后, PBS对照组尾静脉注射PBS 100 μL, CXCR4-MSC组尾静脉注射CXCR4-MSC悬液100 μL(约1×106), Null-MSC组尾静脉注射Null-MSC悬液100 μL(约1×106). 每组随机抽取10只裸鼠进行生存期的比较. 余下的每组15只移植后1-5 d和1-3 wk定期抽血检测肝功能、组织病理学改变并统计3组裸鼠的生存期.
1.2.8 肝细胞增殖情况检测: 在移植后第2周取肝组织做石蜡切片并行Ki67免疫组织化学染色, 随机选择6个高倍视野, 计算肝脏细胞增殖数目, 计算各组平均值, 观察各组肝脏细胞的增殖情况.
统计学处理 实验结果用mean±SD表示. 采用SPSS19.0统计学软件进行数据处理, 组间比较应用独立样本t检验, 生存期分析采用Kaplan-Meier曲线, P<0.05为差异有统计学意义.
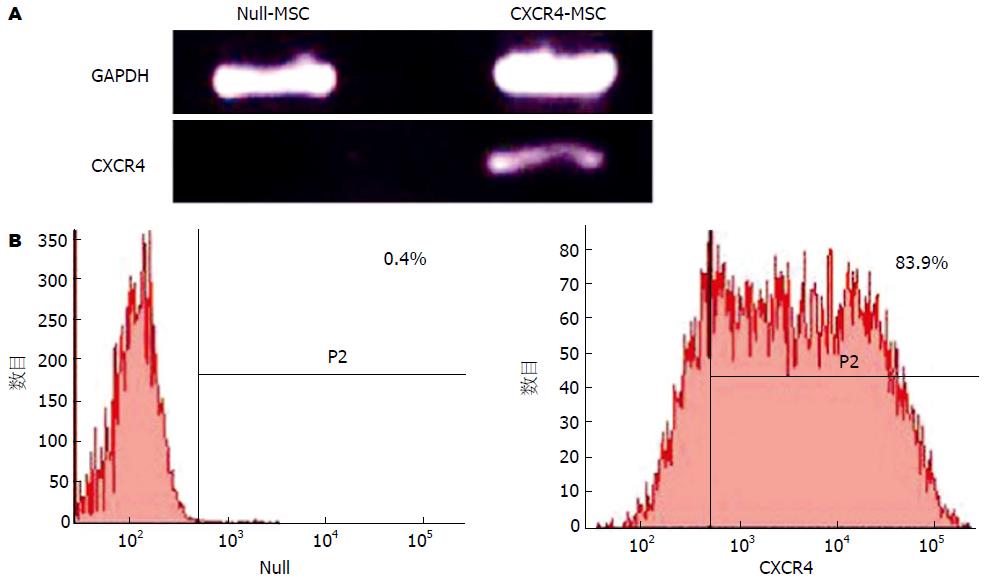
RT-PCR显示CXCR4-MSC高表达CXCR4基因, 而Null-MSC检测不到CXCR4条带, 表明构建的CXCR4-MSC成功, 而经过多代培养后的MSC不表达或者低表达CXCR4基因(图1A). 流式细胞术显示有83.9%的CXCR4-MSC表达CXCR4蛋白, 表明CXCR4分布于细胞表面, 是SDF-1α有效结合位置(图1B).
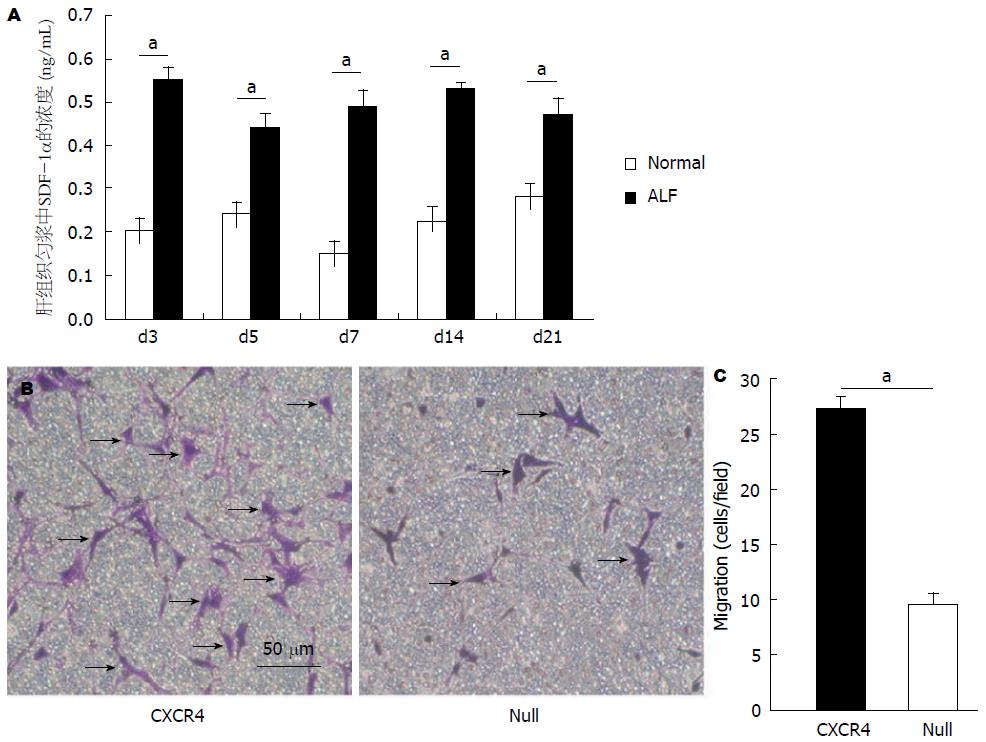
CCl4以8 mL/g的量腹腔注射, 并在注射后的第3、5、7天和第2、3周检测肝脏组织匀浆中的SDF-1α水平. 结果显示相比较正常肝脏, 给予8 mL/g的CCl4后, SDF-1α水平明显升高, 并且在3 wk内保持一个较稳定的水平(图2A). 随后的迁移实验显示CXCR4修饰过的MSC向SDF-1α的迁移数量明显多于修饰的MSC(图2B), 分别为CXCR4-MSC: 27.4/高倍镜视野, Null-MSC: 9.6/高倍镜视野, 两者有统计学差异(P<0.01)(图2C).
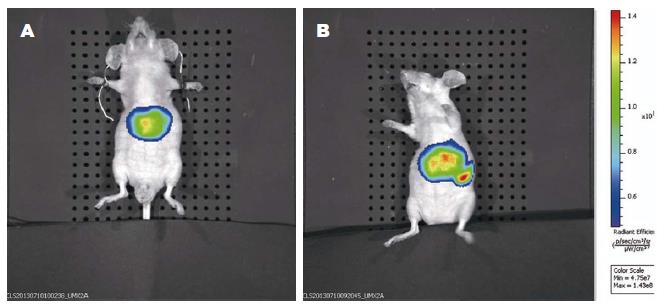
我们采用IVIS系统示踪移植细胞在体内的分布. 细胞移植后5 d发现CXCR4组只有在肝脏处检测到一个强烈的近红外信号, 其余部位均检测不出近红外信号, 表示移植后5 d CXCR4-MSC全部分布于肝脏; 而在Null组, 肝脏和脾脏均检测到近红外信号, 且强度几乎相等, 表明移植的Null-MSC在肝脏和脾脏均有定植, 对肝脏无靶向性(图3).
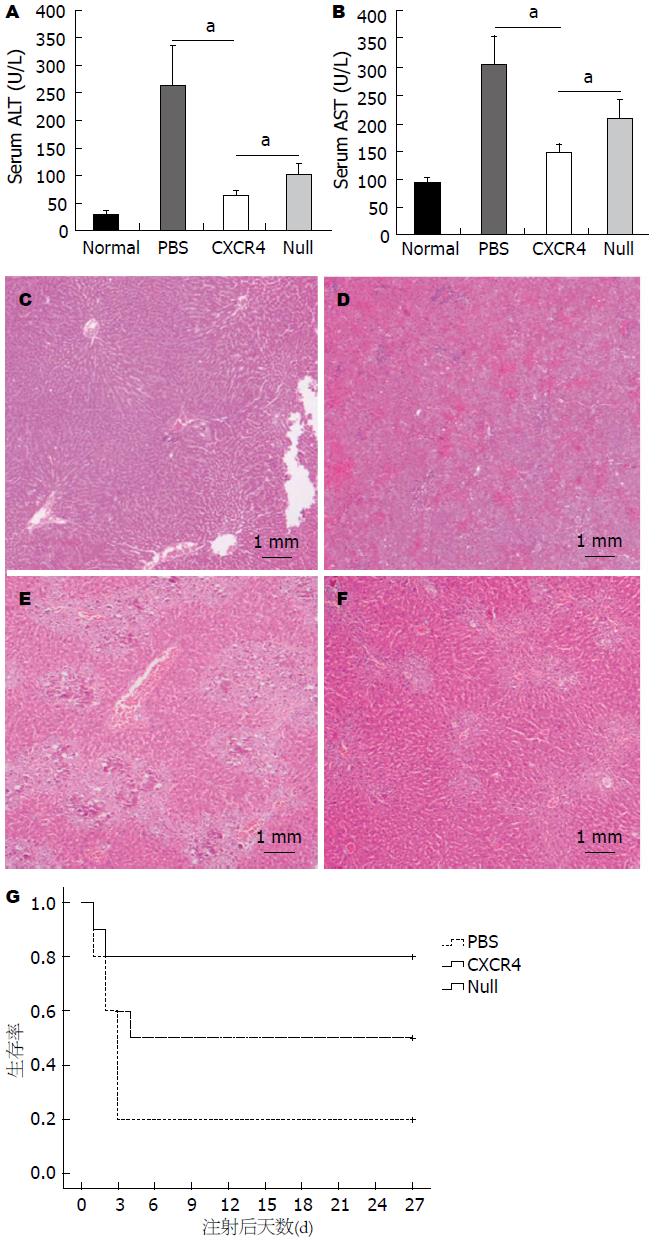
组织病理学HE染色分析显示正常肝脏颜色均匀, 具有完整的肝小叶结构(图4A), 而急性肝衰竭肝脏呈现出大片坏死, 肝细胞肿胀、充血, 肝小叶结构遭到破坏(图4B). CXCR4-MSC和Null-MSC移植均减少了肝细胞坏死区域, 而CXCR4-MSC组坏死区域面积要比Null-MSC组少(图4A-C、图4A-D). 与对照组相比, CXCR4-MSC组和Null-MSC组转氨酶水平均有所降低, ALT分别降低了76.09%和60.88%, AST分别降低了52.00%和31.11%, CXCR4-MSC组明显降低更多, 两者有统计学差异(P<0.05)(图4C-F). 而生存率方面, CXCR4-MSC组和Null-MSC组4 wk时生存率分别为80%和50%, 两者有显著差异(图4G). 由以上数据可以看出CXCR4-MSC相比较Null-MSC更具有肝保护作用.
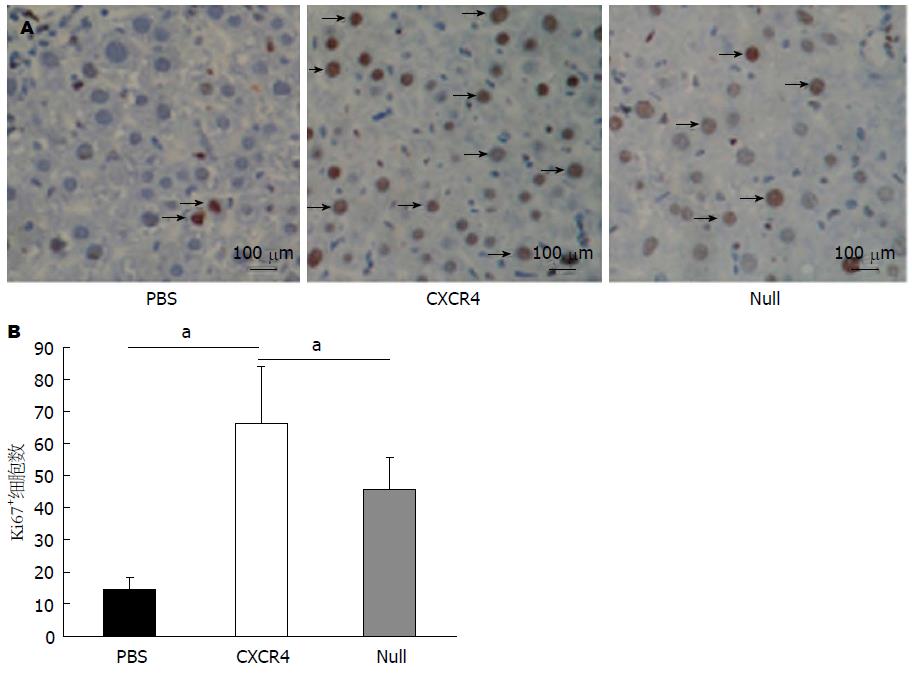
为了评估干细胞移植对肝细胞增殖情况的影响, 本研究采用Ki67免疫组织化学实验. Ki67阳性表达细胞核着棕黄色, 细小颗粒状, 疏密不等. 细胞移植后2 wk, 取各组小鼠肝脏制成石蜡切片, 结果显示PBS组、CXCR4-MSC组和Null-MSC组肝脏组织阳性细胞数分别为14.6±3.5、66.2±14.5和41±4.2, 后两组有统计学差异(P<0.05)(图5).
肝衰竭导致的肝细胞损伤会刺激一系列的细胞因子和趋化因子的分泌, 而这些因子参与了随后的损伤修复. SDF-1α是其中非常重要的一种细胞因子, 在干细胞的募集和归巢方面起了核心作用. 本实验检测到肝衰竭肝脏组织匀浆中SDF-1α的浓度明显升高. CXCR4作为SDF-1α的受体, 与SDF-1α共同了参与了MSC募集的过程. 但是MSC在体外培养和增殖过程中会逐渐丢失CXCR4的表达, 导致细胞表面CXCR4数量减少, 从而对SDF-1α的迁移能力减弱[15]. 因此, 我们采用慢病毒转染的方法使MSC过表达CXCR4, 之后我们采用细胞流式术检测了细胞膜上的CXCR4的表达情况, 结果显示转染组有83.9%的MSC表达CXCR4, 过表达的CXCR4强化了MSC对SDF-1α的迁移能力, 同时体内活体示踪实验也证实: 修饰CXCR4基因后, 除了肝脏之外MSC在其他器官几乎无定植. 因此, 正如我们所预想, 修饰CXCR4基因后促进了MSC在受损肝脏的定植.
目前干细胞移植实验已在世界范围内广泛开展, 但是疗效并不能令人十分满意. 一项正在进行的干细胞治疗临床实验显示通过门静脉注射的干细胞只有不超过5%能够在肝脏检测到[16]. 而另一项研究显示采用肝动脉途径注射干细胞, 能将这一比例提高到20%-30%[17]. 但即便如此, 大部分的细胞仍然分布在其他脏器, 而目前能够提高移植干细胞在靶器官定植的方法主要包括采用支架材料作为载体, 如PCL支架[18]、水凝胶支架[19]和PLGA支架[20]等. 支架材料具有生物可降解性、无免疫源性、无毒、易于成型加工等优点, 但其表面的生物惰性不利于细胞在其上的黏附, 因此, 这类材料在用作支架材料时必须进行一定的表面改性, 即表面生物功能化. 这一点限制了支架材料的应用. 另一种有效的方式是基因修饰[21,22]. 我们选择慢病毒作为载体, 慢病毒能够将目的基因整合到宿主细胞染色体内, 使得宿主细胞在增殖后仍然能够稳定表达目的基因编码的蛋白. 同时慢病毒具有低免疫原性和高丰度表达的优点, 特别适合作为基因修饰的载体[23]. 实验证实我们采用慢病毒构建的MSC稳定表达CXCR4, 并且CXCR4-MSC具有肝脏的归巢能力.
到目前为止, 干细胞修复器官衰竭的具体机制仍有争议[24,25]. 在MSC移植治疗肝衰竭方面最早认为干细胞通过转分化作用来替代损伤坏死肝细胞[26,27], 但是这种说法最近受到了质疑, 有研究者报道在受体体内只能检测到有限的存活的供体干细胞[28]. 最新的研究更加支持MSC主要通过旁分泌/自分泌作用的观点[29,30]. MSC在体外能分泌可溶性物质、 细胞表面分子以及细胞外基质, 包括血管内皮生长因子(vascular endothelial growth factor)、肝细胞生长因子(hepatocyte growth factor)、胰岛素样生长因子(insulin-like growth factor-1)、内皮生长因子(epidermal growth factor)、NO、角质细胞生长因子、SDF-1α、巨噬细胞炎症蛋白1a和促红细胞生成素(erythropoietin)[31]. 这些释放的因子对细胞的生存和生存至关重要. 本实验中我们在CXCR4-MSC组和Null-MSC组观察到了更多的肝细胞增殖. 因此, MSC移植改善肝功能的其中一个机制就是增加了肝细胞增殖.
总之, 我们证实了采用慢病毒转染CXCR4基因能够显著促进MSC在衰竭肝脏的定植率, 并且通过增加肝细胞增殖改善了肝功能, 降低了死亡率. 因此, 我们认为外周静脉输注CXCR4基因修饰过的MSC是一种有效和无创的治疗急性肝衰竭的新型方式.
近些年来基于干细胞移植治疗肝脏疾病的研究取得了令人瞩目的成就. 但是干细胞在肝脏较低的定植率制约了其疗效. 为解决这一问题, 本研究通过基因修饰的方法使骨髓间充质干细胞(mesenchymal stem cell, MSCs)高表达CXCR4, 并期望利用SDF-1α/CXCR4之间的趋化作用提高移植MSCs在衰竭肝脏的定植率.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心; 庄林, 主任医师, 昆明市第三人民医院肝病科
MSCs具有自我更新、免疫调节和旁分泌的作用, 被认为是干细胞移植研究领域的最佳细胞来源. 本研究聚焦于如何提高移植MSCs在靶器官的定植率. 诸多研究证实SDF-1α/CXCR4轴在干细胞向损伤组织的归巢过程中发挥了重要作用.
大量的研究表明, SDF-1α/CXCR4轴在干细胞归巢、趋化、表达粘附分子、增殖和存活中起重要作用. 本研究中我们通过慢病毒构建CXCR4修饰的MSCs以提高MSCs的迁移和归巢能力. 该方法在治疗急性肝衰竭的研究中尚属首次. 为了追踪干细胞在体内的分布, 本研究利用DIR荧光染料(波长为700-800纳米)标记MSCs, 体内活体成像显示, 相比Null-MSCs, CXCR4-MSCs具有更强的向受损肝脏迁移能力.
本研究证实了修饰CXCR4基因可以提高MSCs向损伤肝脏的迁移与定植能力. 因此静脉移植CXCR4-MSCs或许是一种有效和无创的治疗急性肝衰竭的新手段.
该文探讨CXCR4转染后的骨髓间充质干细胞向急性肝衰竭动物肝脏靶向迁移及疗效, 获得了有一定创新性和科学意义的结果.
编辑: 田滢 电编:鲁亚静
| 1. | Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease. Nat Rev Immunol. 2008;8:726-736. [PubMed] [DOI] |
| 2. | Phinney DG, Prockop DJ. Concise review: mesenchymal stem/multipotent stromal cells: the state of transdifferentiation and modes of tissue repair--current views. Stem Cells. 2007;25:2896-2902. [PubMed] [DOI] |
| 3. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 4. | Moore JK, Stutchfield BM, Forbes SJ. Systematic review: the effects of autologous stem cell therapy for patients with liver disease. Aliment Pharmacol Ther. 2014;39:673-685. [PubMed] [DOI] |
| 5. | Levine P, McDaniel K, Francis H, Kennedy L, Alpini G, Meng F. Molecular mechanisms of stem cell therapy in alcoholic liver disease. Dig Liver Dis. 2014;46:391-397. [PubMed] [DOI] |
| 6. | Salomone F, Barbagallo I, Puzzo L, Piazza C, Li Volti G. Efficacy of adipose tissue-mesenchymal stem cell transplantation in rats with acetaminophen liver injury. Stem Cell Res. 2013;11:1037-1044. [PubMed] [DOI] |
| 7. | Gao J, Dennis JE, Muzic RF, Lundberg M, Caplan AI. The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion. Cells Tissues Organs. 2001;169:12-20. [PubMed] [DOI] |
| 8. | Jin DK, Shido K, Kopp HG, Petit I, Shmelkov SV, Young LM, Hooper AT, Amano H, Avecilla ST, Heissig B. Cytokine-mediated deployment of SDF-1 induces revascularization through recruitment of CXCR4+ hemangiocytes. Nat Med. 2006;12:557-567. [PubMed] [DOI] |
| 9. | Tang YL, Zhu W, Cheng M, Chen L, Zhang J, Sun T, Kishore R, Phillips MI, Losordo DW, Qin G. Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR4 expression. Circ Res. 2009;104:1209-1216. [PubMed] [DOI] |
| 10. | Song M, Jang H, Lee J, Kim JH, Kim SH, Sun K, Park Y. Regeneration of chronic myocardial infarction by injectable hydrogels containing stem cell homing factor SDF-1 and angiogenic peptide Ac-SDKP. Biomaterials. 2014;35:2436-2445. [PubMed] [DOI] |
| 11. | Yuan L, Sakamoto N, Song G, Sato M. Low-level shear stress induces human mesenchymal stem cell migration through the SDF-1/CXCR4 axis via MAPK signaling pathways. Stem Cells Dev. 2013;22:2384-2393. [PubMed] [DOI] |
| 12. | Bowie MB, McKnight KD, Kent DG, McCaffrey L, Hoodless PA, Eaves CJ. Hematopoietic stem cells proliferate until after birth and show a reversible phase-specific engraftment defect. J Clin Invest. 2006;116:2808-2816. [PubMed] [DOI] |
| 13. | Zhang D, Fan GC, Zhou X, Zhao T, Pasha Z, Xu M, Zhu Y, Ashraf M, Wang Y. Over-expression of CXCR4 on mesenchymal stem cells augments myoangiogenesis in the infarcted myocardium. J Mol Cell Cardiol. 2008;44:281-292. [PubMed] [DOI] |
| 14. | Liu H, Liu S, Li Y, Wang X, Xue W, Ge G, Luo X. The role of SDF-1-CXCR4/CXCR7 axis in the therapeutic effects of hypoxia-preconditioned mesenchymal stem cells for renal ischemia/reperfusion injury. PLoS One. 2012;7:e34608. [PubMed] [DOI] |
| 15. | Wynn RF, Hart CA, Corradi-Perini C, O'Neill L, Evans CA, Wraith JE, Fairbairn LJ, Bellantuono I. A small proportion of mesenchymal stem cells strongly expresses functionally active CXCR4 receptor capable of promoting migration to bone marrow. Blood. 2004;104:2643-2645. [PubMed] [DOI] |
| 16. | Puppi J, Strom SC, Hughes RD, Bansal S, Castell JV, Dagher I, Ellis EC, Nowak G, Ericzon BG, Fox IJ. Improving the techniques for human hepatocyte transplantation: report from a consensus meeting in London. Cell Transplant. 2012;21:1-10. [PubMed] [DOI] |
| 17. | Khan AA, Shaik MV, Parveen N, Rajendraprasad A, Aleem MA, Habeeb MA, Srinivas G, Raj TA, Tiwari SK, Kumaresan K. Human fetal liver-derived stem cell transplantation as supportive modality in the management of end-stage decompensated liver cirrhosis. Cell Transplant. 2010;19:409-418. [PubMed] |
| 18. | Schantz JT, Chim H, Whiteman M. Cell guidance in tissue engineering: SDF-1 mediates site-directed homing of mesenchymal stem cells within three-dimensional polycaprolactone scaffolds. Tissue Eng. 2007;13:2615-2624. [PubMed] |
| 19. | Kimura Y, Tabata Y. Controlled release of stromal-cell-derived factor-1 from gelatin hydrogels enhances angiogenesis. J Biomater Sci Polym Ed. 2010;21:37-51. [PubMed] [DOI] |
| 20. | Thevenot PT, Nair AM, Shen J, Lotfi P, Ko CY, Tang L. The effect of incorporation of SDF-1alpha into PLGA scaffolds on stem cell recruitment and the inflammatory response. Biomaterials. 2010;31:3997-4008. [PubMed] [DOI] |
| 21. | Cheng Z, Ou L, Zhou X, Li F, Jia X, Zhang Y, Liu X, Li Y, Ward CA, Melo LG. Targeted migration of mesenchymal stem cells modified with CXCR4 gene to infarcted myocardium improves cardiac performance. Mol Ther. 2008;16:571-579. [PubMed] [DOI] |
| 22. | Thieme S, Ryser M, Gentsch M, Navratiel K, Brenner S, Stiehler M, Rölfing J, Gelinsky M, Rösen-Wolff A. Stromal cell-derived factor-1alpha-directed chemoattraction of transiently CXCR4-overexpressing bone marrow stromal cells into functionalized three-dimensional biomimetic scaffolds. Tissue Eng Part C Methods. 2009;15:687-696. [PubMed] [DOI] |
| 23. | Badillo AT, Chung S, Zhang L, Zoltick P, Liechty KW. Lentiviral gene transfer of SDF-1alpha to wounds improves diabetic wound healing. J Surg Res. 2007;143:35-42. [PubMed] |
| 24. | Al Battah F, De Kock J, Vanhaecke T, Rogiers V. Current status of human adipose-derived stem cells: differentiation into hepatocyte-like cells. Scientific World Journal. 2011;11:1568-1581. [PubMed] [DOI] |
| 25. | Wang J, Liao L, Tan J. Mesenchymal-stem-cell-based experimental and clinical trials: current status and open questions. Expert Opin Biol Ther. 2011;11:893-909. [PubMed] [DOI] |
| 26. | Thorgeirsson SS, Grisham JW. Hematopoietic cells as hepatocyte stem cells: a critical review of the evidence. Hepatology. 2006;43:2-8. [PubMed] [DOI] |
| 27. | Almeida-Porada G, Porada CD, Chamberlain J, Torabi A, Zanjani ED. Formation of human hepatocytes by human hematopoietic stem cells in sheep. Blood. 2004;104:2582-2590. [PubMed] [DOI] |
| 28. | Lange C, Tögel F, Ittrich H, Clayton F, Nolte-Ernsting C, Zander AR, Westenfelder C. Administered mesenchymal stem cells enhance recovery from ischemia/reperfusion-induced acute renal failure in rats. Kidney Int. 2005;68:1613-1617. [PubMed] [DOI] |
| 29. | Zagoura DS, Roubelakis MG, Bitsika V, Trohatou O, Pappa KI, Kapelouzou A, Antsaklis A, Anagnou NP. Therapeutic potential of a distinct population of human amniotic fluid mesenchymal stem cells and their secreted molecules in mice with acute hepatic failure. Gut. 2012;61:894-906. [PubMed] [DOI] |