修回日期: 2014-03-26
接受日期: 2014-04-09
在线出版日期: 2014-05-28
目的: 探讨影响结肠癌患者术后生存的临床病理因素.
方法: 回顾性分析2007-07/2010-05北京肿瘤医院结直肠外科手术治疗的结肠癌患者临床病理资料, 对可能影响患者生存的因素进行单因素和Cox多因素模型分析. 分析影响结肠癌预后的因素.
结果: (1)全部患者3年总生存率为81.9%; (2)单因素分析发现术前血清癌胚抗原(carcino-embryonic antigen, CEA)水平>5 ng/mL、肿瘤分化程度低、年龄<40岁、更高的T分期、N分期、M分期、术中输血和脉管癌栓(P<0.05)是影响患者预后的因素; (3)多因素回归分析术前血清CEA水平(P = 0.017)、肿瘤分化程度(P = 0.002)、N分期(P = 0.005)M、分期(P = 0.000)是患者生存的独立预后危险因素.
结论: 根据术前血清CEA水平、肿瘤分化程度、更高N分期、有无远处转移可以对结肠癌具有预后不良因素的患者进行更准确的风险分层, 针对此类高危患者临床上应采取更积极的治疗以及术后更加密切的随访.
核心提示: 本研究明确淋巴结转移、远隔转移、术前血清癌胚抗原(carcino-embryonic antigen, CEA)水平>5 ng/mL、病理分化程度是接受根治性结肠癌术后的独立预后因素, 从而使我们在术前对结肠癌预后作出更准确判断, 采取更加积极的治疗策略, 术后更严密的监测随访, 提高生存率及生活质量.
引文著录: 张宝昕, 潘宏达, 高兆亚, 顾晋, 赵军. 结肠癌患者预后临床病理的多因素分析. 世界华人消化杂志 2014; 22(15): 2202-2207
Revised: March 26, 2014
Accepted: April 9, 2014
Published online: May 28, 2014
AIM: To investigate the prognostic factors for colon carcinoma by analyzing its clinical and pathological characteristics.
METHODS: We retrospectively reviewed the demographic, clinical, histopathological, and laboratory data for consecutive patients with colon cancer who underwent curative surgery alone from July 2007 to May 2010 at Peking University Cancer Hospital. Unvaried and multivariate analyses were conducted to identify prognostic factors for colon carcinoma.
RESULTS: A total of 226 valid cases were reviewed in this study, and their 3-year overall survival rate was 81.9%. Univariate analysis showed that preoperative CEA level > 5 ng/mL, poor differentiation, age < 40, blood transfusion, higher T stage, higher N stage, metastasis and lymphatic vessel invasion were poor prognostic factors for patients with colon cancer (P < 0.05). Multivariate analysis found that preoperative CEA level (P = 0.017), higher N stage (P = 0.005), poor differentiation (P = 0.002), and higher M stage (P = 0.000) were the independent prognostic factors for colon carcinoma.
CONCLUSION: Based on the prognostic risk factors such as preoperative CEA level, poor differentiation, higher N stage and metastasis, more accurate risk stratification can be conducted in patients with colon cancer. Patients with such risk factors should be considered as candidates for receiving more intensive treatment and surveillance.
- Citation: Zhang BX, Pan HD, Gao ZY, Gu J, Zhao J. Multivariate analysis of prognostic factors for patients with colon carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2202-2207
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2202.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2202
结直肠癌(colorectal cancer, CRC)在世界范围内是常见的恶性肿瘤. 全球范围每年结直肠癌的新发病例及死亡病例数已位居恶性肿瘤的第3位, 每年结直肠癌的新发病例120万例, 死亡约60万例, 严重的危险人民的健康[1]. 在我国, 结直肠癌的发病率也逐渐上升[2]. 卫生部于2010年颁布了《结直肠癌诊疗指南》, 推广结直肠癌的综合诊治, 目前手术治疗仍是唯一根治手段. 虽然采取了积极的手术治疗手段, 但对术后患者的随访发现结肠癌与直肠癌的预后存在差异. 因此, 在临床实践中, 外科医生迫切需要明确影响结肠癌患者预后的临床病理因素, 从而采取针对性治疗. 我们对北京大学肿瘤医院结直肠外科2007-07/2010-05经治的、具备完整临床随访资料的226例患者进行回顾性分析. 探讨影响结肠癌患者生存预后的因素, 为结肠癌预后的判断、临床治疗决策的选择及提供依据.
选取2007-07/2010-05于北京大学肿瘤医院结直肠外科治的、具备完整临床随访资料的226例患者进行回顾分析. 226例患者中男女各113例, 中位年龄为63岁(28-89岁). 入组标准: (1)结肠原发性肿瘤; (2)有明确病理诊断; (3)术中完整切除肿瘤; (4)排除既往肿瘤病史; (5)排除家族性息肉病性结肠癌、遗传性非息肉病性结肠癌和克隆氏病、溃疡性结肠炎恶变; (6)排除同时性多原发肿瘤; (7)有完整的临床及随访资料.
1.2.1 手术治疗: 所有患者都接受了开放的根治性结肠切除术, 符合目前所提倡的全结肠系膜切除的标准[3]. 手术采用吻合器进行肠道重建, 并常规手工加固和留置无负压吸引的引流管.
1.2.2 术后随访: 所有患者术后均按照NCCN结肠癌治疗指南进行随访: 患者术后2年内每3 mo随访, 3-5年每6 mo随访. 检查项目包括体检、血清癌胚抗原(carcinoembryonic antigen, CEA)、血常规及生化、胸片、腹盆腔CT或超声. 对于肿瘤局部复发或远隔转移的判断, 以影像学诊断为主. 随访时间1.8-44.9 mo, 中位随访时间25.3 mo. 其中失访12例, 随访率94.7%.
统计学处理 应用SPSS17.0软件进行统计分析. 以患者术后3年无病生存率作为观测指标, 按Kaplan-Meier法进行分析, 生存率的比较采用时序检验Log-rank法. 采用Backward: LR方式进行Cox回归多因素回归分析. P<0.05为差异有统计学意义.
226例患者中男女各113例(50.0%), 中位年龄为63岁(28-89岁). 术前存在贫血诊断者88例[女: 血红蛋白(hemoglobin, Hb)<110 g/L, 男: Hb<120 g/L]. 术前血清CEA升高者110例(48.7%). 肿瘤部位: 升结肠癌或横结肠癌99例, 左半结肠或乙状结肠癌127例. 病理检查提示中位淋巴结检出数量为18(4-56)枚, 共有86.3%的患者获取淋巴结数>12枚. 镜下诊断可见有39.8%(90/226)患者肿瘤分化不良, 25.7%(58/226)的患者存在脉管癌栓. 本组226例患者总的3年无病生存率为81.9%.
影响预后的指标有: 年龄、术中输血、术前血清CEA水平>5 ng/mL、肿瘤分化程度低、肿瘤侵犯深度、淋巴结转移、远处转移和脉管癌栓(P<0.05). 而性别、贫血、肿瘤部位、肿瘤大小、检出淋巴结数目、术前有无体质量减轻等因素则未显示对预后有影响(P>0.05)(表1).
| 临床病理因素 | n | 3年生存率(%) | P值 |
| 性别 | |||
| 男 | 113 | 81.4 | 0.891 |
| 女 | 113 | 82.3 | |
| 年龄(岁) | |||
| ≤40 | 10 | 70.0 | 0.041 |
| 40-65 | 108 | 88.0 | |
| >65 | 108 | 76.9 | |
| 血清CEA(ng/mL) | |||
| ≤5 | 116 | 92.2 | 0.000 |
| >5 | 110 | 70.9 | |
| 血红蛋白(g/L) | |||
| 女<110, 男<120 | 88 | 77.3 | 0.153 |
| 女≥110, 男≥120 | 138 | 84.8 | |
| 肿瘤部位 | |||
| 右侧结肠 | 99 | 80.8 | 0.766 |
| 左侧结肠 | 127 | 82.7 | |
| 肿瘤分化 | |||
| 高、中分化 | 136 | 87.5 | 0.004 |
| 低分化、黏液腺癌 | 90 | 73.3 | |
| 肿瘤直径(cm) | |||
| <5 | 93 | 82.8 | 0.689 |
| ≥5 | 133 | 51.5 | |
| T分期 | |||
| T1 | 6 | 100.0 | 0.010 |
| T2 | 15 | 100.0 | |
| T3 | 173 | 82.7 | |
| T4 | 32 | 65.6 | |
| N分期 | |||
| N0 | 111 | 92.8 | 0.000 |
| N1 | 56 | 85.7 | |
| N2 | 59 | 57.6 | |
| M分期 | |||
| M0 | 216 | 84.7 | 0.000 |
| M1 | 10 | 20.0 | |
| 淋巴结总数 | |||
| <12 | 20 | 85.0 | 0.736 |
| ≥12 | 206 | 81.6 | |
| 脉管癌栓 | |||
| 无 | 167 | 87.4 | 0.000 |
| 有 | 58 | 65.5 | |
| 输血 | |||
| 无 | 201 | 83.6 | 0.008 |
| 有 | 25 | 68.0 | |
| 体质量减轻 | |||
| 有 | 69 | 81.2 | 0.820 |
| 无 | 157 | 82.2 |
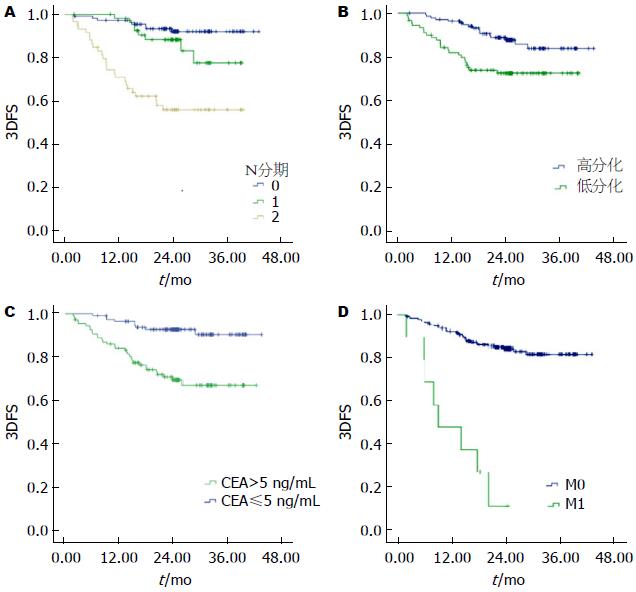
将临床病理学因素引入Cox比例风险模型进行多因素回归分析, 采用Backward: LR方式计算. 发现术前血清CEA水平, 肿瘤分化程度, 淋巴结转移, 远处转移是影响结肠癌预后的独立因素, 而其余因素未能进入Cox多因素模型(表2, 图1).
| 影响因素 | 回归系数(β) | 标准误(SE) | Wald值 | P值 | 相对危险度 | 95%可信区间 |
| CEA数据化 | 0.943 | 0.395 | 5.705 | 0.017 | 2.568 | 1.184-5.569 |
| 病理分化 | 1.118 | 0.367 | 9.282 | 0.002 | 3.059 | 1.490-6.279 |
| N分期 | 0.651 | 0.230 | 7.990 | 0.005 | 1.917 | 1.221-3.009 |
| M分期 | 2.291 | 0.474 | 23.387 | 0.000 | 9.886 | 3.906-25.021 |
在判断结肠癌预后的众多因素中, 肿瘤的TNM分期为最重要的因素. 但是因为肿瘤的异质性和诸多临床病理学的预后因素尚未纳入评价系统中, 常常会导致相同临床病理分期的肿瘤预后与治疗效果大相径庭. NCCN指南推荐对Ⅱ期结肠癌伴有高危因素的患者可行术后辅助治疗. 我们从中获得启发, 能否寻找出不良的预后因素, 可以结合TNM分期更加完善结肠癌患者预后的评价体系, 以便术前就能作出更准确判断, 采取更加积极的治疗策略, 术后更严密地监测随访, 提高生存率及生活质量, 这是我们临床研究中亟待解决的问题.
本研究回顾性总结了262例结肠癌患者的临床病理资料, 统计分析显示: 淋巴结转移、远隔转移、术前CEA水平升高、肿瘤分化程度成为患者独立的预后因素.
3.2.1 淋巴结转移: 美国癌症联合会(American Joint Committee on Cancer, AJCC)指南中II期和Ⅲ期结肠癌的5年生存率分别为82.5%和59.5%, 有明显差异, 其根本区别在于有无转移淋巴结. 淋巴结转移代表了肿瘤在局部除了浸润深度外, 向外扩张的程度, 反映了肿瘤的生物学行为, 可以代表恶性程度的高低, 与生存密切相关[4,5]. 7版AJCC指南较6版引入N1c, 新分期中对于N的精细分期也是基于淋巴结数目影响预后的新研究数据, 并且反映了原发肿瘤淋巴引流区域有肿瘤种植的预后价值的研究数据, 在相同的T分期下, N1a的患者的5年生存率较N1b患者高3%-10%. N2a患者5年生存率较N2b高5%-20%[6].
有研究[7,8]认为淋巴结检出数目是预测结直肠癌预后的重要因素. 5年生存率的比较中, 获得淋巴结总数≤9枚的患者较获得淋巴结总数>27枚的Ⅱ期结肠癌中低6.4%, 在Ⅲ期结肠癌患者中要低8.8%. 但统计学上未找到一个淋巴结数量的临界点, 尽可能检查更多的淋巴结是有益的. 有不少学者在Swanson等[9]、Tsai等[10]及Vather等[11]研究的基础上找到了临界点, 认为至少要检出个淋巴结总数要>13、18或16枚, 才能对患者的淋巴结有无转移作出准确的判断. 同样AJCC指南中指出淋巴结数目不足12枚是Ⅱ期结直肠癌的高危因素. 这可能因为淋巴结检出数目不足导致临床分期被低估.
我们的研究显示更高的N分期是影响预后的主要因素(表1). 多因素分析显示, 更高的N分期也是影响预后的独立因素(表2). 这与一般认为淋巴结转移是影响结肠癌预后的独立因素的观点相符. 关于清扫淋巴结总数, 根据NCCN指南, 我们将12枚作为分界点, 未能发现淋巴结总数与预后相关.
3.2.2 病理分化程度: 一般认为病理类型是影响预后的重要因素, 肿瘤分化越差, 恶性程度越高, 局部侵袭和远处转移能力强, 预后越差[12,13]. O'Connell[5]比较Ⅱ、ⅢI、Ⅳ期结肠癌患者的预后, 发现低分化组的5年生存率明显低于高分化组, 有明显的统计学差异. 关于分化程度的界定, 有些研究提出四分法即: 高分化、中分化、低分化、未分化[14]. 亦有学者建议将病理分级简化为高分化(高分化+中分化)和低分化(低分化+未分化)两级, 以更有利于的判断预后[15]. 此外, 还有一些其他的研究认为, 黏液腺癌应当作为一种分化程度高但恶性程度高的特殊类型[16]. 本组病例将分化程度分为两级, 经多因素分析证实病理分化程度是影响预后的独立因素.
3.2.3 术前血清CEA水平: CEA水平在结直肠癌患者的预后判断、疗效观察以及复发、转移的检测中具有重要临床意义[17,18]. 美国癌症协会和病理联合会推荐通过测定术前CEA水平来预测结直肠癌患者预后, 认为CEA是具有较大价值的判断指标之一, 可被当作对TNM系统的补充[19,20]. 许多的临床研究证实术前血清CEA水平是重要的预后指标, 并且独立于肿瘤的TNM分期和组织学分级[21]. 尽管存在不同意见[22]. 但大多数观点认为CEA是预测预后的重要指标. 相比其他手段, 术前测定血清CEA水平的测定简单、资料采集方便、操作无创、卫生经济学优势明显.本组病例资料结果显示: 术前CEA增高(≥5 ng/mL)的结肠癌患者术后3年的生存率明显低于CEA正常的患者.测定患者术前CEA水平, 对于在术前预测患者预后以及术后的随访具有重要意义.
3.2.4 远处转移: 有远处转移的患者, 从TNM分期来说属于Ⅳ期, 预后最差[4,23]. 日本的数据显示Ⅳ期5年生存率仅为14.3%, 显著低于Ⅲ期5年生存率62.1%-76.1%[24]. 对于转移灶普遍认为手术切除转移灶的患者生存获益明显增加, 并且转移灶的多少影响预后[24,25]. 本文显示远处转移是影响患者生存的非常显著的独立因素. 术前出现远处转移患者的生存率极差, 3年生存率仅为20.0%, 较无转移者84.7%有明显的统计学差异.
总之, 本研究回顾了226例结肠癌患者的临床病理学资料, 统计分析发现, 年龄、术中输血、术前血清CEA水平>5 ng/mL、肿瘤分化程度低、肿瘤侵犯深度、淋巴结转移、远隔转移和脉管癌栓与预后相关, 多因素分析提示: 淋巴结转移、远隔转移、术前血清CEA水平>5 ng/mL、病理分化程度是独立预后因素. 对于具有不良预后因素的患者我们建议术后行更积极的治疗并加强术后随访, 以减少术后复发转移的机会, 从而提高术后生存期及改善生存质量. 这些预测因素有待进一步的前瞻性研究证实.
在判断结肠癌预后的众多因素中, 肿瘤的TNM分期为最重要的因素. 但是因为肿瘤的异质性和诸多临床病理学的预后因素尚未纳入评价系统中, 常常会导致临床病理分期相同的肿瘤预后与治疗效果大相径庭. 如何寻找出不良的预后因素, 可以结合TNM分期更加完善结肠癌患者预后的评价体系, 以便术前就能作出更准确判断, 采取更加积极的治疗策略和更严密的监测随访, 提高生存率及生活质量, 这是我们临床研究中亟待解决的问题.
顾国利, 副主任医师, 空军总医院普通外科
全球范围每年结直肠癌的新发病例及死亡病例数已位居恶性肿瘤的第3位. 在我国, 结直肠癌的发病率也逐渐上升, 已越来越为人们所重视. 然而, 尽管采取了积极的治疗手段, 但患者的预后仍不尽如人意. 在临床实践中, 医生迫切需要了解影响结肠癌患者预后的病理因素, 从而做出更准确的判断及针对性治疗.
国内外多数报道表明: 更高N分期、更高M分期、术前血清CEA水平、肿瘤直径≥5 cm、肿瘤侵犯深度、年龄、送检淋巴结总数、肿瘤根治度、脉管癌栓、围手术期输血等是结肠癌预后的独立危险因素, 不同的研究结论略有不同.
本文具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Li M, Gu J. Changing patterns of colorectal cancer in China over a period of 20 years. World J Gastroenterol. 2005;11:4685-4688. [PubMed] |
| 3. | Hohenberger W, Weber K, Matzel K, Papadopoulos T, Merkel S. Standardized surgery for colonic cancer: complete mesocolic excision and central ligation--technical notes and outcome. Colorectal Dis. 2009;11:354-64; discussion 364-5. [PubMed] [DOI] |
| 4. | Compton CC, Fielding LP, Burgart LJ, Conley B, Cooper HS, Hamilton SR, Hammond ME, Henson DE, Hutter RV, Nagle RB. Prognostic factors in colorectal cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med. 2000;124:979-994. [PubMed] [DOI] |
| 5. | O'Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst. 2004;96:1420-1425. [PubMed] [DOI] |
| 6. | Gunderson LL, Jessup JM, Sargent DJ, Greene FL, Stewart A. Revised tumor and node categorization for rectal cancer based on surveillance, epidemiology, and end results and rectal pooled analysis outcomes. J Clin Oncol. 2010;28:256-263. [PubMed] [DOI] |
| 7. | Kotake K, Honjo S, Sugihara K, Hashiguchi Y, Kato T, Kodaira S, Muto T, Koyama Y. Number of lymph nodes retrieved is an important determinant of survival of patients with stage II and stage III colorectal cancer. Jpn J Clin Oncol. 2012;42:29-35. [PubMed] [DOI] |
| 8. | Chang GJ, Rodriguez-Bigas MA, Skibber JM, Moyer VA. Lymph node evaluation and survival after curative resection of colon cancer: systematic review. J Natl Cancer Inst. 2007;99:433-441. [PubMed] [DOI] |
| 9. | Swanson RS, Compton CC, Stewart AK, Bland KI. The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol. 2003;10:65-71. [PubMed] |
| 10. | Tsai HL, Lu CY, Hsieh JS, Wu DC, Jan CM, Chai CY, Chu KS, Chan HM, Wang JY. The prognostic significance of total lymph node harvest in patients with T2-4N0M0 colorectal cancer. J Gastrointest Surg. 2007;11:660-665. [PubMed] [DOI] |
| 11. | Vather R, Sammour T, Kahokehr A, Connolly AB, Hill AG. Lymph node evaluation and long-term survival in Stage II and Stage III colon cancer: a national study. Ann Surg Oncol. 2009;16:585-593. [PubMed] [DOI] |
| 12. | Oñate-Ocaña LF, Montesdeoca R, López-Graniel CM, Aiello-Crocifoglio V, Mondragón-Sánchez R, Cortina-Borja M, Herrera-Goepfert R, Oros-Ovalle C, Gallardo-Rincón D. Identification of patients with high-risk lymph node-negative colorectal cancer and potential benefit from adjuvant chemotherapy. Jpn J Clin Oncol. 2004;34:323-328. [PubMed] [DOI] |
| 13. | Radespiel-Tröger M, Hohenberger W, Reingruber B. Improved prediction of recurrence after curative resection of colon carcinoma using tree-based risk stratification. Cancer. 2004;100:958-967. [PubMed] [DOI] |
| 14. | André T, Sargent D, Tabernero J, O'Connell M, Buyse M, Sobrero A, Misset JL, Boni C, de Gramont A. Current issues in adjuvant treatment of stage II colon cancer. Ann Surg Oncol. 2006;13:887-898. [PubMed] [DOI] |
| 15. | Treanor D, Quirke P. Pathology of colorectal cancer. Clin Oncol (R Coll Radiol). 2007;19:769-776. [PubMed] [DOI] |
| 16. | Nozoe T, Anai H, Nasu S, Sugimachi K. Clinicopathological characteristics of mucinous carcinoma of the colon and rectum. J Surg Oncol. 2000;75:103-107. [PubMed] |
| 17. | Kanellos I, Zacharakis E, Kanellos D, Pramateftakis MG, Tsahalis T, Altsitsiadis E, Betsis D. Prognostic significance of CEA levels and detection of CEA mRNA in draining venous blood in patients with colorectal cancer. J Surg Oncol. 2006;94:3-8. [PubMed] |
| 18. | Kim SB, Fernandes LC, Saad SS, Matos D. Assessment of the value of preoperative serum levels of CA 242 and CEA in the staging and postoperative survival of colorectal adenocarcinoma patients. Int J Biol Markers. 2003;18:182-187. [PubMed] |
| 19. | Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American Joint Committee on Cancer Prognostic Factors Consensus Conference: Colorectal Working Group. Cancer. 2000;88:1739-1757. [PubMed] |
| 20. | Peng Y, Wang L, Gu J. Elevated preoperative carcinoembryonic antigen (CEA) and Ki67 is predictor of decreased survival in IIA stage colon cancer. World J Surg. 2013;37:208-213. [PubMed] [DOI] |
| 21. | Reiter W, Stieber P, Reuter C, Nagel D, Lau-Werner U, Lamerz R. Multivariate analysis of the prognostic value of CEA and CA 19-9 serum levels in colorectal cancer. Anticancer Res. 2000;20:5195-5198. [PubMed] |
| 22. | Wiggers T, Arends JW, Volovics A. Regression analysis of prognostic factors in colorectal cancer after curative resections. Dis Colon Rectum. 1988;31:33-41. [PubMed] |
| 23. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 24. | Watanabe T, Itabashi M, Shimada Y, Tanaka S, Ito Y, Ajioka Y, Hamaguchi T, Hyodo I, Igarashi M, Ishida H. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2010 for the treatment of colorectal cancer. Int J Clin Oncol. 2012;17:1-29. [PubMed] [DOI] |
| 25. | Pfannschmidt J, Muley T, Hoffmann H, Dienemann H. Prognostic factors and survival after complete resection of pulmonary metastases from colorectal carcinoma: experiences in 167 patients. J Thorac Cardiovasc Surg. 2003;126:732-739. [PubMed] |