修回日期: 2014-03-02
接受日期: 2014-03-19
在线出版日期: 2014-05-18
目的: 探讨人类真核延伸因子1A2(eukaryotic elongation factor 1A2, EEF1A2)和生长因子受体结合蛋白2(growth factor receptor-bound 2, GRB2)在胰腺癌组织中的表达、相互关系及临床病理意义.
方法: 应用免疫组织化学方法检测97例胰腺癌及其周边胰腺组织中EEF1A2和GRB2蛋白表达情况.
结果: EEF1A2蛋白在胰腺癌周边组织中不表达, 但在77.8%(76/97)的胰腺癌组织中表达阳性. EEF1A2的异常表达与胰腺癌周边淋巴结转移(χ2 = 4.28, P = 0.039)和神经浸润显著相关(χ2 = 4.11, P = 0.043). GRB2蛋白在胰腺癌和周边胰腺组织中阳性表达率分别为82.5%(80/97)和30.2%(31/97), 胰腺癌组织中GRB2蛋白阳性率显著高于周边胰腺组织(χ2 = 48.5, P<0.001). GRB2阳性表达率与淋巴结转移显著相关(χ2 = 4.63, P = 0.031). 胰腺癌中EEF1A2和GRB2表达具有显著等级正相关(rs = 0.451, P<0.001).
结论: EEF1A2和GRB2的表达与胰腺癌的生物学行为密切相关, 且两者之间的表达强度具有显著等级正相关.
核心提示: 我们前期发现生长因子受体结合蛋白2(growth factor receptor-bound 2, GRB2)可能是真核延伸因子1A2(eukaryotic elongation factor 1A2, EEF1A2)促进胰腺癌发生、发展的关键分子. 本研究中我们进一步证实胰腺癌中EEF1A2和GRB2分子高表达, 二者与肿瘤的侵袭和转移关系密切, 故者EEF1A2和GRB2可作为胰腺癌预后判断的指标以及抑制肿瘤复发和转移的潜在靶点.
引文著录: 周维霞, 蒋晓红, 杨勇, 陈瑞东, 胡端敏. 人类真核延伸因子1A2与生长因子受体结合蛋白2在胰腺癌组织中的表达及临床病理意义. 世界华人消化杂志 2014; 22(14): 2049-2054
Revised: March 2, 2014
Accepted: March 19, 2014
Published online: May 18, 2014
AIM: To investigate the expression of eukaryotic elongation factor 1A2 (EEF1A2) and growth factor receptor-bound 2 (GRB2) in pancreatic adenocarcinoma (PA) and to analyze their clinicopathologic significance.
METHODS: Expression of EEF1A2 and GRB2 was examined by immunohistochemistry in 97 PA specimens and surrounding pancreatic tissues.
RESULTS: EEF1A2 expression was absent in normal pancreatic tissue. In contrast, EEF1A2 showed positive immunoreactivity in 77.8% (76/97) of PA cases. The increased eEF1A2 expression was significantly associated with the presence of nodal metastasis (χ2 = 4.28, P = 0.039) and perineural invasion (χ2 = 4.11, P = 0.043). The expression rate of GRB2 in 97 PA specimens and surrounding pancreatic tissues were 82.5% (80/97) and 30.2% (31/97), respectively. The expression level of GRB2 in PA was significantly higher than that in surrounding pancreatic tissues (χ2 = 48.5, P < 0.001). The positive rate of GRB2 expression was significantly correlated with lymph node metastasis (χ2 = 4.63, P = 0.031). There was a positive expression between the expression of EEF1A2 and that of GRB2 in PA (rs = 0.451, P < 0.001).
CONCLUSION: The expression of GRB2 and EEF1A2 is closely correlated with the biological behavior of PA. The expression of GRB2 is significantly correlated with that of EEF1A2.
- Citation: Zhou WX, Jiang XH, Yang Y, Chen RD, Hu DM. Clinicopathologic significance of expression of EEF1A2 and GRB2 in pancreatic adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 2049-2054
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/2049.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.2049
我国胰腺癌的发病率近年来逐年增加, 目前胰腺癌患者占所有癌症患者的2.3%, 是第6大癌症死亡原因[1]. 临床诊治中, 胰腺癌发病隐匿, 进展迅速, 预后极差, 其5年生存率仅为1%-3%[2]. 因此, 进一步积极深入探讨影响胰腺癌发生发展的机制将会为上述问题的解决提供良好的理论与实践依据. 人类真核延伸因子1A2(homo sapiens eukaryotic elongation factor 1A2, EEF1A2)直接与氨基酰-tRNA结合, 将其运至核糖体A位, 使肽链延长, 保证蛋白质合成的准确性和速度[3]. 传统观点认为EEF1A2是管家基因, 但我们的前期工作[4-8]提示EEF1A2的过度和异位表达参与了胰腺癌的发生、发展. 生长因子受体结合蛋白2(growth factor receptor-bound 2, GRB2)是位于细胞膜上的一种衔接蛋白, 承接细胞外信号向细胞内的传递, 在肿瘤发生[9], 侵袭和转移[10]过程中起重要作用. 我们最近的研究中发现[11]GRB2可能是EEF1A2促进胰腺癌发生、发展的关键分子. 为进一步明确EEF1A2和GRB2在胰腺癌病情发展中的作用, 本研究采用免疫组织化学方法检测了胰腺癌及周边组织中EEF1A2和GRB2的表达, 探讨二者与胰腺癌临床病理特点的关系.
包含97例胰腺癌手术标本的组织芯片购自上海生物芯片有限公司. 其中男性59例, 女性38例, 年龄39-76岁, 平均年龄59岁. 术前未予放疗、化疗. 同一病灶的周边胰腺组织作为对照. 胰头及钩突部肿瘤68例, 胰体尾部肿瘤29例, 病理组织分型: 标本经病理证实为腺癌, 其中低分化腺癌27例, 高、中分化腺癌分别为23和47例. 病理分期采用国际抗癌联盟(UICC)2008年公布的胰腺癌TNM分期法, 其中Ⅰ期9例、Ⅱ期32例、Ⅲ期51例和Ⅳ5例(表1). EEF1A2和GRB2多克隆抗体(兔抗)购于Abcam公司, 链霉菌抗生物素蛋白-过氧化物酶免疫组化染色试剂盒采用武汉博士德生物工程有限公司产品, 免疫组织化学染色技术的具体操作步骤按照试剂盒要求进行.
| n | EEF1A2阳性 | EEF1A2阴性 | P值 | GRB2阳性 | GRB2阴性 | P值 | |
| 年龄(岁) | 0.684 | 0.656 | |||||
| ≤60 | 47 | 36(76.6) | 11(23.4) | 38(80.9) | 9(19.1) | ||
| >60 | 50 | 40(80.0) | 10(20.0) | 42(84.0) | 8(16.0) | ||
| 性别 | 0.696 | 0.852 | |||||
| 男 | 59 | 47(79.7) | 12(20.3) | 49(83.1) | 10(16.9) | ||
| 女 | 38 | 29(76.3) | 9(23.7) | 31(81.6) | 7(18.4) | ||
| 部位 | 0.491 | 0.592 | |||||
| 胰头及钩突 | 68 | 52(76.5) | 16(23.5) | 57(83.8) | 11(16.2) | ||
| 胰腺体尾部 | 29 | 24(82.8) | 5(17.2) | 23(79.3) | 6(20.7) | ||
| 肿瘤大小(cm) | 0.241 | 0.072 | |||||
| ≤2 | 19 | 13(76.5) | 6(23.5) | 13(68.4) | 6(31.6) | ||
| >2 | 78 | 63(82.8) | 15(17.2) | 67(85.9) | 11(14.1) | ||
| 肿瘤分级 | 0.215 | 0.378 | |||||
| 低分化 | 23 | 15(65.2) | 8(34.8) | 17(73.9) | 6(26.1) | ||
| 中分化 | 47 | 38(80.9) | 9(19.1) | 39(83) | 8(17.0) | ||
| 高分化 | 27 | 23(85.2) | 4(14.8) | 24(88.9) | 3(11.1) | ||
| 淋巴结转移 | 0.039 | 0.031 | |||||
| 有 | 76 | 63(82.9) | 13(17.1) | 66(86.9) | 10(13.2) | ||
| 无 | 21 | 13(61.9) | 8(38.1) | 14(66.7) | 7(33.3) | ||
| 血管累及 | 0.397 | 0.445 | |||||
| 有 | 34 | 25(73.5) | 9(26.5) | 27(79.4) | 7(20.6) | ||
| 无 | 63 | 51(81.0) | 12(19.0) | 53(85.5) | 10(14.5) | ||
| 神经累及 | 0.043 | 0.110 | |||||
| 有 | 72 | 60(83.3) | 12(16.7) | 62(86.1) | 10(13.9) | ||
| 无 | 25 | 16(64.0) | 9(36.0) | 18(72.0) | 7(28.0) | ||
| TNM 分期 | 0.091 | 0.191 | |||||
| Ⅰ | 9 | 6(66.7) | 3(33.3) | 7(77.8) | 2(22.2) | ||
| Ⅱ | 32 | 22(68.8) | 10(31.3) | 23(71.9) | 9(28.1) | ||
| Ⅲ | 51 | 45(88.2) | 6(11.8) | 46(90.2) | 5(9.8) | ||
| Ⅳ | 5 | 3(78.4) | 2(21.6) | 4(80.0) | 1(20.0) |
EEF1A2和GRB2蛋白均定位于细胞膜和细胞浆, 浅黄、棕黄、或更深的棕褐色的细小颗粒作为阳性染色. 采用3个参数[12](即染色强度、阳性细胞数和两者记分的和)半定量记数方法. 染色强度记分标准: 无着色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分. 光镜下随机观察并记录5个高倍视野中染色阳性细胞的百分率, 记分标准: ≤10%为0分, 10%-25%为1分, 26%-50%为2分, ≥51%为3分. 染色强度记分与阳性细胞数记分之和为判断依据: 0-1分为(+), 2分为(++), 3-4分为(+++), 5-6分为(++++). 最终得分>2分判定为阳性结果.
统计学处理 应用SPSS11.0统计软件包进行统计分析, 组间采用χ2检验, 两指标间采用有序分组资料的等级相关检验. P<0.05为差异有统计学意义.
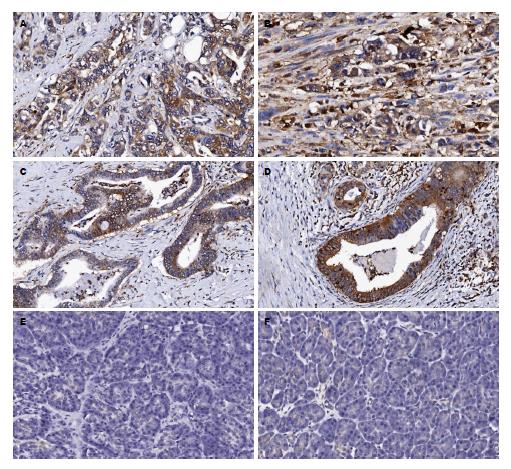
EEF1A2在97例胰腺癌组织中表达为76例阳性、21例阴性, 阳性率为77.8%, EEF1A2在肿瘤细胞的胞膜及胞浆中表达(图1A, C), 间质细胞中无表达, EEF1A2的阳性染色分布异质性明显, 阳性染色的细胞常分布于深部浸润的癌巢, 尤其在浸润的前沿, 在肿瘤周围的正常胰腺(图1E)中未见EEF1A2阳性表达. GRB2在97例胰腺癌组织中表达为80例阳性, 有17例表达阴性, 阳性率为82.5%, 阳性染色主要见于癌细胞的细胞浆, 胞膜及癌间质组织(图1B, D), 在肿瘤周边的胰腺组织中, 有31例表达阳性, 66例为阴性(图1F), 阳性率为30.2%,经卡方检验显示胰腺癌组中GRB2阳性率显著高于癌周边组织(χ2 = 48.5, P<0.001).
EEF1A2与GRB2的阳性表达在各性别组和各年龄组之间无显著差异, EEF1A2表达在有无淋巴结转移(χ2 = 4.28, P = 0.039)和有无神经累及(χ2 = 4.11, P = 0.043)的胰腺癌间差异明显, 而与肿瘤大小、分级和TNM分期无显著相关(P>0.05). GRB2表达在伴有淋巴结转移的胰腺癌中明显高于无淋巴结转移组(χ2 = 4.63, P = 0.031), 但在TNM分期之间, 有无神经累及的胰腺癌间, GRB2表达无显著性差异(P>0.05)(表1).
胰腺癌是一种预后极差的恶性肿瘤, 远处转移是胰腺癌患者治疗失败和死亡的主要原因之一, 即使是肿瘤得到早期手术切除且切缘阴性的患者, 其中的75%在5年内仍最终因远处转移而死亡[13]. 因此探明与胰腺癌生物学行为密切相关的蛋白分子将对患者的预后判断及抑制肿瘤进展的靶向治疗极其重要.
传统观点认为, EEF1A2仅是一个管家基因, 在蛋白翻译过程中发挥重要作用[3]. 然而, 最新的研究结果显示, EEF1A2在肿瘤中呈异常表达, 可能具备癌基因的特征, 当其转录表达异常时可以导致肿瘤的发生[14]. 本课题组前期工作显示, EEF1A2在正常胰腺组织中不表达, 但在胰腺癌组织中表达水平明显上调, 过表达EEF1A2可增强胰腺癌细胞的增殖能力和裸鼠体内移植瘤的生长[8]. 此外, 我们发现上调EEF1A2的表达可促进胰腺癌细胞SW1990的运动和黏附能力, 而特异性的siRNA靶向干扰EEF1A2可抑制胰腺癌细胞BxPC-3体外迁移和侵袭[4-6]. 因此, EEF1A2的异常表达不仅可导致肿瘤细胞增殖和发展, 在肿瘤侵袭、转移过程中也发挥重要作用. 但是EEF1A2表达与胰腺癌临床病理特点的是否存在相关性, 目前尚未见报道.
本研究的免疫组化结果显示, 伴有淋巴结转移的胰腺癌组织中EEF1A2表达明显高于无淋巴结转移的胰腺癌组织. 这一发现和最近的一项研究结果相符, Edmonds等[15]发现, EEF1A2在具有转移潜能的大鼠乳腺癌细胞中表达水平明显高于无转移能力的细胞. 随后的体外实验证实, 在乳腺癌BT549细胞中过表达EEF1A2可明显增强肿瘤细胞的迁移和侵袭能力; 相反, 在乳腺癌HCC1937细胞中沉默EEF1A2表达则可抑制细胞的侵袭能力[16]. 嗜神经性是胰腺癌的较为特异的临床特点, 很多患者在疾病早期就有内脏神经侵犯, 已有研究证实神经受累是胰腺癌术后复发转移的独立预测因子[17], 本研究中, 我们发现EEF1A2高表达与神经累及存在明显正相关. 这些结果提示EEF1A2参与了胰腺癌的侵袭、转移过程, 与患者的临床预后密切相关.
但是, EEF1A2促进肿瘤细胞侵袭转移的分子机制目前仍不清楚, 我们最近应用蛋白芯片技术证实[11], 在过表达EEF1A2之后, 与肿瘤密切相关的GRB2的表达明显增加. 进一步[4]我们使用特异性siRNA沉默Bxpc-3胰腺癌细胞的EEF1A2后, 发现GRB2的mRNA和蛋白水平相应明显下调. 在本研究中, 我们又发现胰腺癌组织中的EEF1A2与GRB2的表达呈显著正相关, 这些结果均提示EEF1A2与GRB2之间存在密切联系. GRB2蛋白与肿瘤细胞周期的调控, 细胞增殖的变化及细胞分化的改变密切相关, 直接参与乳腺癌、膀胱癌及白血病的发病、进展及转移过程[18,19]. 我们发现GRB2在伴有淋巴结转移的胰腺癌组中表达明显高于无淋巴结转移组, 这一结果提示GRB2蛋白参与了胰腺癌的转移和临床进展. 结合我们的前期发现, 干扰GRB2可使内源性高表达EEF1A2的胰腺癌BxPC-3运动能力明显减弱. 故GRB2可能是EEF1A2促进胰腺癌侵袭和转移的重要要分子.
总之, 本研究发现胰腺癌组织中EEF1A2和GRB2蛋白存在高表达, EEF1A2和GRB2与胰腺癌的侵袭和转移关系密切, 且二者在胰腺癌中的表达正相关, 二者可作为胰腺癌预后判断的指标以及抑制肿瘤复发和转移的潜在靶点.
我们前期研究中发现生长因子受体结合蛋白2(growth factor receptor-bound2, GRB2)可能是人类真核延伸因子1A(eukaryotic elongation factor1A2, EEF1A2)促进胰腺癌发生、发展的关键分子. 为进一步明确EEF1A2和GRB2在胰腺癌病情发展中的作用, 本研究采用免疫组织化学方法检测了胰腺癌及周边组织中EEF1A2和GRB2的表达, 探讨二者与胰腺癌临床病理特点的关系.
白雪巍, 副主任医师, 哈尔滨医科大学
EEF1A2可能通过GRB2的介导来促进胰腺癌生物学行为的恶性转化. 但EEF1A2和GRB2表达与胰腺癌临床病理特点的是否存在相关性, 目前尚未见报道.
EEF1A2在肿瘤中呈异常表达, 可能具备癌基因的特征, 当其转录表达异常时可以导致肿瘤的发生. 但是, EEF1A2促进肿瘤细胞侵袭转移的分子机制目前仍不清楚,我们前期研究中发现GRB2可能是EEF1A2促进胰腺癌发生、发展的关键分子.
本研究不仅发现胰腺癌组织中EEF1A2和GRB2蛋白存在高表达, 且EEF1A2和GRB2与胰腺癌的侵袭和转移关系密切.
EEF1A2和GRB2蛋白可能作为胰腺癌预后判断的指标以及抑制肿瘤复发和转移的潜在靶点.
本文学术价值好, 具有一定的指导意义.
编辑 田滢 电编 鲁亚静
| 1. | Guo X, Cui Z. Current diagnosis and treatment of pancreatic cancer in China. Pancreas. 2005;31:13-22. [PubMed] [DOI] |
| 2. | Pannala R, Basu A, Petersen GM, Chari ST. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol. 2009;10:88-95. [PubMed] [DOI] |
| 3. | Lukash TO, Turkivska HV, Negrutskii BS, El'skaya AV. Chaperone-like activity of mammalian elongation factor eEF1A: renaturation of aminoacyl-tRNA synthetases. Int J Biochem Cell Biol. 2004;36:1341-1347. [PubMed] [DOI] |
| 8. | Cao H, Zhu Q, Huang J, Li B, Zhang S, Yao W, Zhang Y. Regulation and functional role of eEF1A2 in pancreatic carcinoma. Biochem Biophys Res Commun. 2009;380:11-16. [PubMed] [DOI] |
| 10. | Xu XL, Wang X, Chen ZL, Jin M, Yang W, Zhao GF, Li JW. Overexpression of Grb2-associated binder 2 in human lung cancer. Int J Biol Sci. 2011;7:496-504. [PubMed] [DOI] |
| 12. | Kim HS, Lee SH, Do SI, Lim SJ, Park YK, Kim YW. Clinicopathologic correlation of beclin-1 expression in pancreatic ductal adenocarcinoma. Pathol Res Pract. 2011;207:247-252. [PubMed] [DOI] |
| 13. | Neoptolemos JP, Stocken DD, Friess H, Bassi C, Dunn JA, Hickey H, Beger H, Fernandez-Cruz L, Dervenis C, Lacaine F. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N Engl J Med. 2004;350:1200-1210. [PubMed] [DOI] |
| 14. | Tomlinson VA, Newbery HJ, Wray NR, Jackson J, Larionov A, Miller WR, Dixon JM, Abbott CM. Translation elongation factor eEF1A2 is a potential oncoprotein that is overexpressed in two-thirds of breast tumours. BMC Cancer. 2005;5:113. [PubMed] [DOI] |
| 15. | Edmonds BT, Wyckoff J, Yeung YG, Wang Y, Stanley ER, Jones J, Segall J, Condeelis J. Elongation factor-1 alpha is an overexpressed actin binding protein in metastatic rat mammary adenocarcinoma. J Cell Sci. 1996;109:2705-2714. [PubMed] |
| 16. | Amiri A, Noei F, Jeganathan S, Kulkarni G, Pinke DE, Lee JM. eEF1A2 activates Akt and stimulates Akt-dependent actin remodeling, invasion and migration. Oncogene. 2007;26:3027-3040. [PubMed] [DOI] |
| 17. | Xu Q, Zhang TP, Zhao YP. Advances in early diagnosis and therapy of pancreatic cancer. Hepatobiliary Pancreat Dis Int. 2011;10:128-135. [PubMed] [DOI] |