修回日期: 2014-03-27
接受日期: 2014-03-28
在线出版日期: 2014-05-18
目的: 证明四氯化碳(carbon tetrachloride, CCl4)诱导的肝纤维化小鼠对致死性D-氨基半乳糖/脂多糖(D-galactosamine and lipopolysaccharide, D-GalN/LPS)攻击的耐受性.
方法: 建立CCl4诱导的肝纤维化小鼠模型, 于纤维化6 wk时以致死剂量的D-GalN(700 mg/kg)/LPS(50 μg/kg)进行攻击, 以同样处理的正常小鼠作为对照, 即实验共分为4组: 正常对照组(Nor)、急性损伤组(Nor+D-GalN/LPS)、肝纤维化组(Fib)、肝纤维化+急性攻击组(Fib+D-GalN/LPS). 根据攻击前后小鼠生存率、转氨酶水平及肝组织学的变化来评估正常和纤维化小鼠对致死性D-GalN/LPS损伤的耐受性.
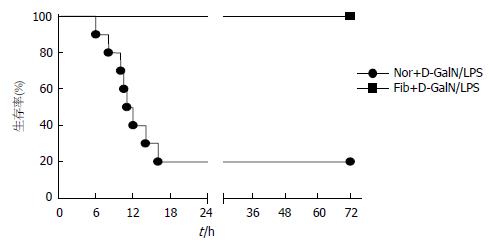
结果: 生存分析显示, Fib+D-GalN/LPS组的生存率显著高于Nor+D-GalN/LPS组(100% vs 20%). 血清转氨酶结果表明, Fib+D-GalN/LPS组肝损伤程度明显轻于Nor+D-GalN/LPS组, 其sALT水平分别为(6630 U/L±1675 U/L)和(22429 U/L±5446 U/L)(P<0.01). 接受攻击的纤维化和正常小鼠的sALT分别升高了14.3倍和455.9倍. 肝组织学检查结果也证明, 接受致死性D-GalN/LPS攻击的纤维化小鼠的肝损伤较同样处理的正常小鼠明显减轻.
结论: CCl4诱导的肝纤维化可保护小鼠抵抗致死性D-GalN/LPS损伤的攻击.
核心提示: 肝纤维化是一把"双刃剑", 除导致病变外, 还具有很强的组织修复能力. 本研究利用致死剂量的D-氨基半乳糖/脂多糖(D-galactosamine and lipopolysaccharide, D-GalN/LPS)对正常和肝纤维化小鼠进行攻击, 观察二者对损伤的耐受性. 结果证明, CCl4诱导的肝纤维化可以保护小鼠抵抗致死性D-GalN/LPS攻击.
引文著录: 白丽, 孔明, 张晓慧, 丁美, 郑素军, 陈煜, 段钟平. 肝纤维化能够保护小鼠抵抗D-GalN/LPS诱导的致死性损伤. 世界华人消化杂志 2014; 22(14): 1998-2002
Revised: March 27, 2014
Accepted: March 28, 2014
Published online: May 18, 2014
AIM: To assess the tolerance of mice with carbon tetrachloride (CCl4)-induced fibrosis to a lethal dose of D-galactosamine/lipopolysaccharide (D-GalN/LPS).
METHODS: A mouse model of hepatic fibrosis was established by intraperitoneal injection of CCl4 (in mineral oil), twice a week for 6 wk. At the end of fibrosis induction, mice were challenged intraperitoneally with D-GalN (700 mg/kg)/LPS (50 μg/kg). Normal mice treated in the same way were used as controls. Mice were sacrificed 24 h after acute insult. Sera and liver tissues were harvested for analyses. To evaluate the tolerance of normal and fibrotic mice to a lethal dose of D-GalN/LPS, survival rate, serum alanine aminotransferase (sALT) levels and histological changes of the liver were compared between before and after acute challenge.
RESULTS: The survival rate of fibrotic mice subjected to a lethal dose of D-GalN/LPS was significantly higher than that of normal mice treated in the same way (100% vs 20%). After challenged by D-GalN/LPS, sALT in normal mice increased by 455.9 folds (49.2 U/L ± 12.9 U/L vs 22429 U/L ± 5446 U/L, P < 0.01), which was significantly higher than that in fibrotic mice (14.3 folds) [(463.7 U/L ± 109.0 U/L vs 6630 U/L ± 1675 U/L, P < 0.01). The tolerance of fibrotic mice to D-GalN/LPS was confirmed by well-preserved liver architecture as compared with controls.
CONCLUSION: CCl4-induced liver fibrosis protects mice against a lethal dose of D-GalN/LPS.
- Citation: Bai L, Kong M, Zhang XH, Ding M, Zheng SJ, Chen Y, Duan ZP. Liver fibrosis protects mice against lethal injury induced by D-GalN/LPS. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1998-2002
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1998.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1998
肝纤维化是各种慢性肝脏疾病的共同终末途径, 以肝星状细胞(hepatic stellate cells, HSC)活化、细胞外基质(extracellular matrix, ECM)过量沉积、正常肝组织结构破坏和血液循环紊乱为特征. 一旦肝内胶原组织过度沉积和增生, 假小叶形成, 可进一步发展为肝硬化, 甚至进展为致死性肝衰竭[1-4]. 因此, 大多数临床医生将肝纤维化视为一种有害的病理反应. 然而, 不容忽视的是, 肝纤维化还是一种针对慢性肝损伤的伤口愈合反应, 是促使组织修复、进而保护自身的一种正常反应[5-8]. 近年来国外有研究显示, 胆管结扎(bile duct ligation, BDL)或硫代乙酰胺(thioacetamide, TAA)诱导的肝纤维化可通过促进肝细胞生存/肝再生、抑制肝细胞凋亡而发挥有益的肝脏保护效应[9-11]. 然而, 关于四氯化碳(carbon tetrachloride, CCl4)诱导的肝纤维化中是否存在该保护性效应尚无明确报道. 本研究中, 我们利用致死剂量的D-氨基半乳糖/脂多糖(D-galactosamine and lipopolysaccharide, D-GalN/LPS)对正常和肝纤维化小鼠进行攻击, 观察二者对损伤的耐受性. 我们的研究证明, CCl4诱导的肝纤维化可以保护小鼠抵抗致死性D-GalN/LPS攻击.
健康♂Balb/c小鼠, 8-12周龄, 购自军事医学科学院实验动物中心. 普通饲养, 自由饮水, 维持12 h亮/12 h暗昼夜节律. CCl4购自国药集团(分析纯), 矿物油为Amresco产品, D-GalN和LPS购自Sigma公司.
1.2.1 小鼠肝纤维化损伤模型的建立: 给Balb/c小鼠腹腔注射CCl4(溶于矿物油中), 2次/wk, 共6 wk. CCl4的初始剂量为2% (0.1 mL/10 g), 然后逐渐增加剂量至30%, 即遵从2%→5%→10%→20%→30%的给药模式.
1.2.2 急性攻击: 分别给正常小鼠和纤维化小鼠腹腔注射D-GalN(700 mg/kg)/LPS(50 μg/kg)进行急性攻击.
1.2.3 实验分组: 共分为4组: 正常对照组(Nor)、D-GalN/LPS诱导的急性肝损伤组(Nor+D-GalN/LPS)、肝纤维化组(Fib)、肝纤维化+急性攻击组(Fib+D-GalN/LPS). 于急性攻击后24 h处死小鼠, 收集血液和肝组织标本以供检测分析.
1.2.4 生存率分析: 记录各组小鼠在72 h内的死亡时间点, 并计算生存率.
1.2.5 肝细胞损害检测: 采用全自动生化分析仪检测反映肝细胞损害程度的指标血清丙氨酸氨基转移酶(serum alanine aminotransferase, sALT)的水平.
1.2.6 肝组织病理学检测: 肝组织经常规福尔马林固定、石蜡包埋、切片, HE染色及Masson染色, 在光学显微镜下观察肝组织细胞损伤情况及胶原纤维增生情况.
统计学处理 所有数据以mean±SD表示. 利用Graphpad Prism 5.0软件包处理数据, 组间差异的比较采用One-way ANOVA分析. P<0.05为差异有统计学意义.
给正常小鼠腹腔注射致死剂量的D-GalN/LPS, 小鼠的死亡率可高达80%, 而给纤维化小鼠腹腔注射同样剂量的D-GalN/LPS, 小鼠均未死亡(图1). 这就提示, 纤维化小鼠并非像我们预期的那样"脆弱", 相反, 他对致死性损伤的耐受性较正常小鼠明显增强, 因而生存率远远高于后者(100% vs 20%).
正常小鼠经D-GalN/LPS急性攻击后, 血清转氨酶水平由49.2U/L±12.9 U/L急剧升高至22429 U/L±5446 U/L, 而在肝纤维化基础上给予D-GalN/LPS攻击时, 其sALT由463.7 U/L±109.0 U/L升高为6630 U/L±1675 U/L, 差异均有统计学意义(Nor vs Nor+D-GalN/LPS, Fib vs Fib+D-GalN/LPS, Nor+D-GalN/LPS vs Fib+D-GalN/LPS, P<0.01)(表1). 接受攻击前后, 正常组小鼠的sALT水平升高了455.9倍, 而纤维化小鼠的sALT水平仅升高了14.3倍. 该结果进一步证实, 纤维化小鼠对急性致死性损伤的耐受性较正常小鼠显著增强.
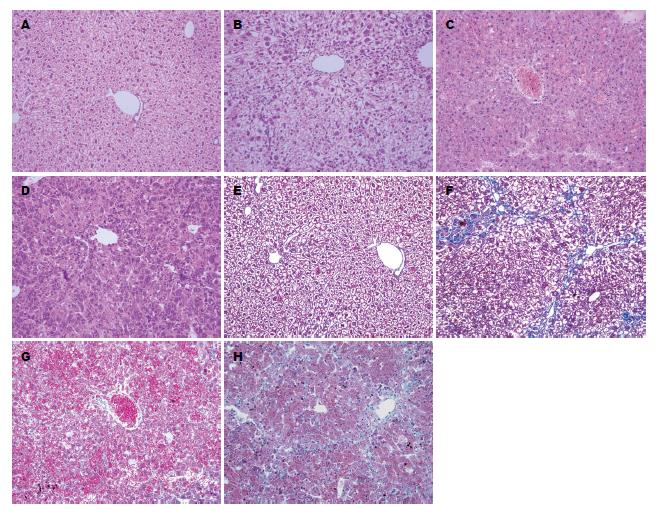
病理结果显示: 正常小鼠肝小叶形态结构完整, 未见变性、坏死及炎症细胞浸润等. 纤维化组小鼠的正常肝小叶破坏, 汇管区纤维结缔组织增生, 形成线条状纤维间隔, 分割肝组织而形成假小叶. 急性损伤组小鼠肝损害严重, 肝小叶结构明显紊乱, 肝细胞明显肿胀、变性、凋亡及坏死, 汇管区可见大量炎细胞浸润. 而在肝纤维化基础上接受急性攻击的小鼠, 其肝细胞变性、坏死程度较急性损伤组明显减轻, 浸润的炎细胞也明显减少. Masson染色显示, 纤维化组小鼠纤维组织明显增生, 证明纤维化模型建立成功(图2).
肝纤维化的有害作用已为广大临床医生和研究者所熟知. 然而, 人们往往忽视, 除导致病变外, 肝纤维化还是一种针对慢性肝损伤的伤口愈合反应, 能够促使组织修复、进而保护自身. 近年来, 研究者不再过度关注肝纤维化的危害性, 单纯将其视为一种有害的病理过程, 反而将研究重心逐渐转移到肝纤维化作为"双刃剑"的另一面, 即其通过损伤修复可能呈现出的有益的肝脏保护效应.
本研究中, 当同时给正常小鼠和CCl4诱导的纤维化小鼠腹腔注射D-GalN/LPS进行急性攻击时, 结果出乎意料: 接受急性攻击的纤维化小鼠的损伤程度明显轻于同样处理的正常小鼠, 表现为: 生存率更高(100% vs 20%); sALT水平明显降低; 肝组织学明显改善. 这就表明, 纤维化肝脏并不像我们所预期的那样"脆弱", 相反, 他对损伤的耐受性较正常小鼠明显增强, 可以保护小鼠抵抗急性致死性损伤的攻击.
我们所报道的关于肝纤维化诱导损伤耐受这一现象并非无迹可寻. Chalasani等[12]首次阐述了关于基线肝酶升高患者对他汀类药物的肝毒性是否更为敏感的问题. 研究发现, 基线肝酶升高患者的轻-中度(而非重度)生化指标升高较基线肝酶正常者更为多见, 然而这些生化指标的升高与是否服用他汀类药物无关, 也就是说, 肝酶升高者对他汀类药物肝毒性的敏感性并不高于肝酶正常者. 该结果提示肝损伤患者存在对肝毒性物质的耐受性. 部分胆管结扎(partial bile duct ligation, PBDL)小鼠模型(可快速形成纤维化)中, 与非结扎叶相比, 结扎叶对TNF-α/D-GalN诱导的肝细胞凋亡的耐受性更强, 并可阻止广泛出血的发生. BDL诱导的这种保护性凋亡抵抗可延缓或阻止肝衰竭的发生[9]. 同样, TAA诱导的肝纤维化小鼠也可以抵抗Fas介导的肝细胞凋亡及肝损害[11]. 体外实验也证明, 经Ⅰ型胶原(typeⅠcollagen, COL1)处理的肝细胞对于多种肝毒素的耐受性增强(呈剂量依赖方式), 其促凋亡蛋白(Bad、Bid和Bax)的表达明显受到抑制[11].
上述临床和实验室证据证明了慢性肝损伤(肝纤维化)诱导的损伤耐受现象的存在. 那么, 这种保护性损伤耐受是通过何种细胞和分子途径发挥作用的呢?利用PBDL小鼠模型进行的研究显示, 结扎叶所具有的肝脏保护效应(即对TNF-α/D-GalN诱导的肝细胞凋亡和肝损害的抵抗)与肝细胞内AKT(一种重要的促生存信号分子)的活化密切相关. 与非结扎叶相比, 结扎叶中AKT的磷酸化及活化显著增强. 然而, 抑制AKT时(Ad5DN-AKT), 结扎叶和非结扎叶对TNF-α/D-GalN诱导的肝损伤的反应相同, 此时结扎叶所具有的肝脏保护效应丧失[9]. 在TAA诱导的肝纤维化中也存在肝组织AKT磷酸化活性的增强[11]. 另外, ERK, 特别是ERK1, 也是涉及纤维化诱导的肝脏保护效应的关键效应信号分子. 在体外, 暴露于COL1的肝细胞中ERK1/2的活化更强、更快速. 然而, 抑制ERK信号通路可逆转COL1的凋亡抵抗效应. 在体内, 野生型纤维化小鼠肝脏中ERK1的磷酸化活性明显高于ERK1-/-纤维化小鼠, 并且前者对Fas诱导细胞死亡的抵抗效应也明显强于后者[11].
以上提到的AKT和ERK都是重要的促生存信号分子, 其介导的肝保护效应主要与增强肝细胞的生长、增生、凋亡抵抗反应有关[13-15]. 在细胞水平, 肝纤维化诱导的损伤耐受与Kupffer细胞密切相关. 在PBDL小鼠模型中, 利用alendronate liposomes耗竭Kupffer细胞后, 结扎叶对TNF-α诱导的肝细胞凋亡的敏感性增强, 而肝细胞的再生则明显削弱, 从而致使结扎叶所具有的肝脏保护效应丧失[10]. Kupffer细胞在肝纤维化形成和消融中的关键作用已经明确[16-19], 因此, 经纤维化诱导活化的Kupffer细胞可能通过抑制肝细胞凋亡及促进肝细胞再生而保护小鼠抵抗随后的损伤攻击, 进而阻止肝衰竭或死亡的发生.
表面上, 肝纤维化诱导的肝脏保护效应似乎与临床医生对肝纤维化的认知相违背, 然而, 这一新认知实际上与肝脏强大而卓越的组织修复能力相符. 需要强调的是, 肝纤维化诱导的损伤耐受中对肝细胞凋亡的抵抗、肝细胞再生的促进是针对剩余正常肝细胞(而非已经发生异常转变的肝细胞)而言的[11]. 虽然肝纤维化诱导的保护效应在短期内是有益的. 然而, 长远来看, 如纤维化损伤过重, 则修复、保护效应远远弱于损伤效应, 最终仍会导致不可逆性肝损害.
肝纤维化是许多肝脏病变的最终共同结局. 当前人们对纤维化的认知往往强调其导致病理损害的一面, 而忽视了纤维化本身也是一种针对慢性肝损伤的伤口愈合反应. 近年来有研究显示, 纤维化可能通过其强大的损伤修复能力发挥肝脏保护效应. 然而, 关于四氯化碳(carbon tetrachloride, CCl4)诱导的肝纤维化中是否存在对致死性损伤的耐受效应尚无明确报道.
鲁玉辉, 副教授, 福建中医药大学中医学院
近年来, 临床医生和研究者逐渐将研究重心转移到肝纤维化作为"双刃剑"的另一面, 即其强大的组织修复能力可能具有的肝脏保护效应. 这种认知的转变促使我们能够对肝纤维化这种疾病产生全面而正确的认识.
国外研究报道, 胆管结扎(bile duct ligation, BDL)或硫代乙酰胺(thioacetamide, TAA)诱导肝纤维化小鼠能够抵抗Fas介导的急性肝损伤.
本文从新的角度(即肝纤维化的组织修复功能)验证了纤维化小鼠对急性致死性攻击的保护性损伤耐受效应, 研究结果对于全面正确认识肝纤维化有积极意义.
本文证明了肝纤维化诱导的损伤耐受现象的存在, 有一定的创新性, 能反映我国肝纤维化基础研究的先进水平.
编辑 田滢 电编 鲁亚静
| 1. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 2. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 3. | Qin L, Han YP. Epigenetic repression of matrix metalloproteinases in myofibroblastic hepatic stellate cells through histone deacetylases 4: implication in tissue fibrosis. Am J Pathol. 2010;177:1915-1928. [PubMed] [DOI] |
| 4. | Friedman SL. Evolving challenges in hepatic fibrosis. Nat Rev Gastroenterol Hepatol. 2010;7:425-436. [PubMed] [DOI] |
| 5. | Wynn TA. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat Rev Immunol. 2004;4:583-594. [PubMed] [DOI] |
| 6. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 8. | Wynn TA. Integrating mechanisms of pulmonary fibrosis. J Exp Med. 2011;208:1339-1350. [PubMed] [DOI] |
| 9. | Osawa Y, Hannun YA, Proia RL, Brenner DA. Roles of AKT and sphingosine kinase in the antiapoptotic effects of bile duct ligation in mouse liver. Hepatology. 2005;42:1320-1328. [PubMed] [DOI] |
| 10. | Osawa Y, Seki E, Adachi M, Suetsugu A, Ito H, Moriwaki H, Seishima M, Nagaki M. Role of acid sphingomyelinase of Kupffer cells in cholestatic liver injury in mice. Hepatology. 2010;51:237-245. [PubMed] [DOI] |
| 11. | Bourbonnais E, Raymond VA, Ethier C, Nguyen BN, El-Leil MS, Meloche S, Bilodeau M. Liver fibrosis protects mice from acute hepatocellular injury. Gastroenterology. 2012;142:130-139. e4. [PubMed] [DOI] |
| 12. | Chalasani N, Aljadhey H, Kesterson J, Murray MD, Hall SD. Patients with elevated liver enzymes are not at higher risk for statin hepatotoxicity. Gastroenterology. 2004;126:1287-1292. [PubMed] [DOI] |
| 13. | Frémin C, Ezan F, Guegan JP, Gailhouste L, Trotard M, Le Seyec J, Rageul J, Theret N, Langouët S, Baffet G. The complexity of ERK1 and ERK2 MAPKs in multiple hepatocyte fate responses. J Cell Physiol. 2012;227:59-69. [PubMed] [DOI] |
| 14. | Owens DM, Keyse SM. Differential regulation of MAP kinase signalling by dual-specificity protein phosphatases. Oncogene. 2007;26:3203-3213. [PubMed] |
| 15. | Lips DJ, Bueno OF, Wilkins BJ, Purcell NH, Kaiser RA, Lorenz JN, Voisin L, Saba-El-Leil MK, Meloche S, Pouysségur J. MEK1-ERK2 signaling pathway protects myocardium from ischemic injury in vivo. Circulation. 2004;109:1938-1941. [PubMed] [DOI] |
| 16. | Duffield JS, Forbes SJ, Constandinou CM, Clay S, Partolina M, Vuthoori S, Wu S, Lang R, Iredale JP. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 2005;115:56-65. [PubMed] |
| 17. | Thomas JA, Pope C, Wojtacha D, Robson AJ, Gordon-Walker TT, Hartland S, Ramachandran P, Van Deemter M, Hume DA, Iredale JP. Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis, regeneration, and function. Hepatology. 2011;53:2003-2015. [PubMed] [DOI] |
| 18. | Tacke F, Zimmermann HW. Macrophage heterogeneity in liver injury and fibrosis. J Hepatol. 2014; Jan 8. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Male P. [Problems of the 1st development disorders in their relations with the psychopathology of the adolescent]. Rev Neuropsychiatr Infant. 1970;Suppl:97-108. [PubMed] [DOI] |