修回日期: 2014-03-13
接受日期: 2014-03-18
在线出版日期: 2014-05-18
目的: 研究蟾毒灵(bufalin, Bu)对肝癌BEL-7402细胞生长、迁移侵袭的作用.
方法: 体外培养人肝癌BEL-7402细胞, 应用CCK-8比色法、流式细胞仪、Transwell小室迁移侵袭实验观测不同浓度和作用时间Bu对肝癌细胞增殖、迁移、侵袭的影响.
结果: Bu明显抑制肝癌BEL-7402细胞生长和增殖, 呈浓度-时间效应关系; 0.085 μg/mL Bu分别作用于肝癌BEL-7402细胞48、72 h, 肝癌细胞周期阻滞于G2/S期[48 h(G2: t = -6.618, P<0.01; S: t = -5.339, P<0.01), 72 h(G2: t = -14.273, P<0.01; S: t = -4.812, P<0.01)]; 0.085 μg/mL Bu作用肝癌BEL-7402细胞72 h, 显著抑制肝癌细胞迁移(t = 11.717, P<0.01)和侵袭(t = 5.437, P<0.01).
结论: Bu能抑制肝癌细胞迁移、侵袭, 并且通过阻滞肝癌细胞周期于G2/S期, 抑制肝癌细胞增殖, 其生长抑制作用呈时间和剂量依赖效应.
核心提示: 蟾毒灵影响肝癌Bel-7402细胞凋亡及迁移、侵袭转移的机制可能与影响肝癌细胞中P53、survivin、Bcl-xL、基质金属蛋白酶(matrix metalloproteinases)、E-钙黏蛋白(E-cadherin)等因子表达有关.
引文著录: 盖吉钦, 秦建民, 范跃祖. 蟾毒灵对人肝癌细胞增殖与侵袭的影响. 世界华人消化杂志 2014; 22(14): 1921-1927
Revised: March 13, 2014
Accepted: March 18, 2014
Published online: May 18, 2014
AIM: To assess the effect of bufalin on cell proliferation, migration and invasion in human hepatocellular carcinoma cell line BEL-7402.
METHODS: BEL-7402 cells were cultured in vitro. The effect of bufalin on cell proliferation and cell cycle was measured by CCK-8 colorimetric method and flow cytometry. Cell migration and invasion were assessed by Transwell assay.
RESULTS: Bufalin significantly inhibited the growth and proliferation of BEL-7402 cells in a dose- and time-dependent manner. Bufalin at a dose of 0.085 μg/mL blocked the cell cycle of BEL-7402 cells in G2/S phase [48 h (G2: t = -6.618, P < 0.01; S: t = -5.339, P < 0.01), 72 h (G2: t = -14.273, P < 0.01; S: t = -4.812, P < 0.01)]. Treatment with bufalin at a dose of 0.085 μg/mL for 72 h significantly inhibited the migration (t = 11.717, P < 0.01) and invasion (t = 5.437, P < 0.01) of BEL-7402 cells.
CONCLUSION: Bufalin inhibits the migration and invasion of human liver cancer cells. Besides, bufalin can inhibit the proliferation of human liver cancer cells by blocking the cell cycle in G2/S phase. The anti-proliferative effect of bufalin is dose- and time-dependent.
- Citation: Gai JQ, Qin JM, Fan YZ. Bufalin inhibits proliferation and invasion of human liver cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1921-1927
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1921.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1921
原发性肝癌(hepatocellular carcinoma, HCC)是较常见的消化系肿瘤, 其发病率在我国占第3位, 世界范围占第5位, 每年全球约有100万例以上的新增肝癌患者, 同时有60万例死于该肿瘤, 严重威胁人类健康[1,2]. 蟾毒灵(bufalin, Bu)为抗肿瘤传统中药蟾酥中抗肿瘤作用最强的毒性配基[3], 除了具有强心、升压、平喘、镇咳、兴奋呼吸中枢、利尿、抗炎、增强机体免疫力、抗辐射、抗血小板凝聚等药理作用, 还具有很强的抗肿瘤作用[4]. 本研究在观察Bu对肝癌细胞增殖及周期的作用的同时, 进一步观察了Bu对肝癌BEL-7402细胞迁移侵袭能力的影响.
人肝癌BEL-7402细胞株(中国科学院上海细胞生物学研究所提供), Bu(上海博谷生物科技有限公司), 细胞培养基RPMI 1640(美国Gibco公司), 胎牛血清(杭州四季青生物公司), CCK-8试剂(上海博谷生物科技有限公司), 细胞周期即时检测试剂盒(南京凯基生物公司), 胰蛋白酶(美国Sigma公司), Matrigel胶(美国BD公司), 0.1%结晶紫染色液(江苏碧云天生物公司).
1.2.1 细胞系培养: 在37 ℃, 5%CO2和饱和湿度的培养箱中用10%胎牛血清的RPMI 1640培养基常规培养. 取单层贴壁、对数期生长的细胞进行试验.
1.2.2 CCK-8比色实验测定细胞生长抑制率: 消化收集细胞后用含10%胎牛血清的RPMI 1640培养液稀释细胞浓度, 调整细胞浓度至8×104/mL, 以每孔100 μL接种于96孔培养板中, 饱和湿度、5%CO2孵箱37 ℃常规培养12 h使其贴壁生长后加药, 实验设10%胎牛血清RPMI 1640培养液阴性对照组和Bu实验组. 根据预实验的结果, Bu实验组选择低于各作用时间100%抑制率的浓度, 最终浓度设定如下: 24 h Bu: 0.7、0.8、0.9、1.0、1.1、1.2 μg/mL; 48 h Bu: 0.05、0.1、0.2、0.3、0.4 μg/mL; 72 h Bu: 0.05、0.1、0.15、0.2、0.25 μg/mL. 每个浓度组分别设置5个复孔, 置于饱和湿度、5%CO2孵箱37 ℃常规培养24、48和72 h后吸去上清液, 每孔加无血清培养液100 μL及CCK-8 10 μL, 继续培养1.5 h后, 在自动酶标仪上检测各孔吸光度450 nm, 以空白组平均值调零. 按以下公式计算生长抑制率. 抑制率(%) = (1-实验组平均A值/对照组平均A值)×100%.
1.2.3 流式细胞仪技术检测细胞周期改变: 消化收集细胞后用含10%胎牛血清的RPMI 1640培养液稀释细胞浓度, 调整细胞浓度至5×104/mL, 以每孔2 mL接种于6孔培养板中, 饱和湿度、5%CO2孵箱37 ℃常规培养12 h使其贴壁生长, 然后吸弃培养液后再加入无血清的RPMI 1640培养液2 mL于6孔培养板中, 饱和湿度、5%CO2孵箱37 ℃常规培养12 h后加药. 实验设10%胎牛血清RPMI 1640培养液阴性对照组和Bu实验组, Bu实验组的最终浓度选取CCK-8比色实验所得到的IC50浓度. 各组置于饱和湿度、5%CO2孵箱37 ℃常规培养24、48和72 h后收集细胞, PBS清洗细胞碎片后用细胞周期即时检测试剂盒中Solution A、B、C处理细胞并染色, 1 h内行流式细胞仪检测荧光标记检测凋亡率和细胞周期分布, ModiFit软件分析细胞周期.
1.2.4 细胞迁移实验: 消化收集细胞后用含10%胎牛血清的RPMI 1640培养液稀释细胞浓度, 将细胞接种于10 cm培养皿中, 每个培养皿接种8×105个细胞, 饱和湿度、5%CO2孵箱37 ℃常规培养12 h使其贴壁生长后加药. 实验设10%胎牛血清RPMI 1640培养液阴性对照组和Bu实验组, Bu实验组的最终浓度选取CCK-8比色实验所得到的IC50浓度. 各组置于饱和湿度, 5%CO2孵箱37 ℃常规培养72 h后吸弃含药培养液, 用PBS洗涤培养皿, 去除残余药物后再加入无血清的RPMI 1640培养液置于饱和湿度、5%CO2孵箱37 ℃常规培养12 h后收集细胞, 用无血清的RPMI 1640培养液制备成1×106/mL的细胞悬液, 每个Transwell小室上室接种100 μL细胞悬液, 下室加入600 μL含10%胎牛血清的RPMI 1640, 每组各设置3个复孔. 5%CO2孵箱37 ℃常规培养24 h后将上室培养液吸弃清洗结晶紫染色后倒置相光学显微镜下选取上、中、下三个视野进行观察, 并拍照计数计算迁移细胞.
1.2.5 细胞侵袭实验: 消化收集细胞后用含10%胎牛血清的RPMI 1640培养液稀释细胞浓度, 将细胞接种于10 cm培养皿中, 每个培养皿接种8×105个细胞, 饱和湿度、5%CO2孵箱37 ℃常规培养12 h使其贴壁生长后加药. 实验设10%胎牛血清RPMI 1640培养液阴性对照组和Bu实验组, Bu实验组的最终浓度选取CCK-8比色实验所得到的IC50浓度. 各组置于饱和湿度、5%CO2孵箱37 ℃常规培养72 h后吸弃含药培养液, 用PBS洗涤培养皿, 去除残余药物后再加入无血清的RPMI 1640培养液置于饱和湿度、5%CO2孵箱37 ℃常规培养12 h后收集细胞, 用无血清的RPMI 1640培养液制备成1×106/mL的细胞悬液, Transwell小室上室铺设Matrigel胶后每个Transwell小室上室接种100 μL细胞悬液, 下室加入600 μL含10%胎牛血清的RPMI 1640, 每组各设置3个复孔. 5%CO2孵箱37 ℃常规培养48 h后将上室培养液吸弃清洗, 结晶紫染色后倒置相光学显微镜下选取上、中、下3个视野进行观察, 并拍照计数计算侵袭细胞.
统计学处理 实验数据均以mean±SD表示, 并用SPSS19.0统计软件进行统计学处理, 首先进行方差齐性检验, 方差齐的两组间比较采用t检验, 多组间比较采用单因素方差分析数据, 组间两两比较采用LSD法; 方差不齐者两组间比较采用矫正t检验, 多组间比较将数据转换后得到齐方差数据后再采用单因素方差分析检验数据.
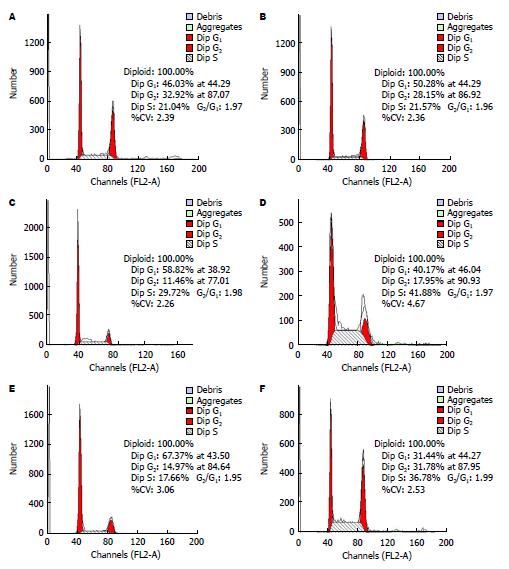
肝癌BEL-7402细胞经不同浓度Bu处理24、48、72 h, 随药物浓度逐渐提高, Bu对肝癌BEL-7402细胞抑制率逐渐提高(P<0.05), (表1). 24、48、72 h的IC50分别为0.87 μg/mL±0.07 μg/mL, 0.16 μg/mL±0.02 μg/mL, 0.085 μg/mL±0.01 μg/mL, 提示其随药物作用时间延长逐渐降低(F = 429.881, 24 h vs 48 h, 48 h vs 72 h, 均P<0.01).
Bu处理BEL-7402肝癌细胞24、48、72 h, 24 h后G2和S期细胞比例与阴性对照组无差异(P>0.05); 48、72 h后, G2期和S期细胞比例与阴性对照组相比增加, 表现出G2期和S期阻滞(P<0.01, 表2, 图1); 但48 h与72 h的G2期(1.17±0.28 vs 1.25±0.35)、S期(0.37±0.18 vs 1.12±0.67)增幅比较无差异(P>0.05). 表明, 同一药物浓度下Bu对肝癌BEL-7402细胞的增殖周期影响, 具有一定时间依赖性, 但超过48 h未表现时间依赖性.
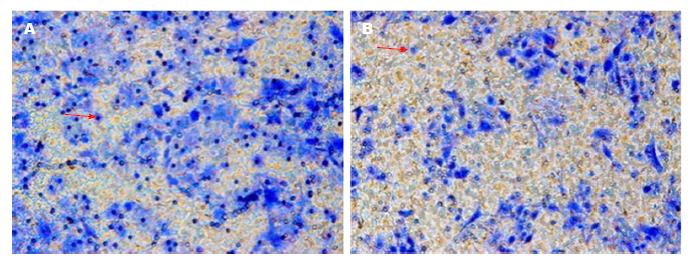
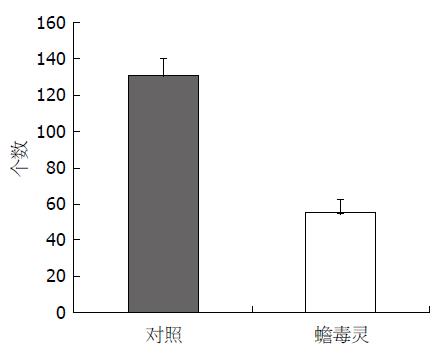
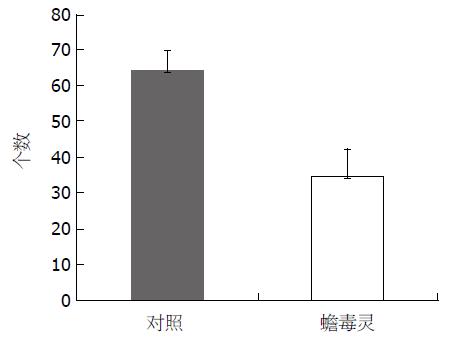
Bu作用BEL-7402细胞72 h, 与阴性对照相比, 显著抑制肝癌BEL-7402细胞迁移能力(t = 11.717, P<0.01), (图2, 3).
Bu是一种多羟基的甾体化合物, 其抗肿瘤作用效果, 已受到越来越多的关注[5-8]. 苏永华等[9]通过将经Bu作用48 h的人肝癌SMMC-7721和BEL-7402细胞进行锥虫蓝染色, 发现Bu对肝癌细胞膜具有明显破坏作用, 提示Bu对肝癌细胞的毒性作用与破坏癌细胞膜、导致细胞直接死亡有关. 王旭等[10]应用Bu作用于大肠癌HCT116细胞, 结果发现Bu可使大肠癌细胞阻滞在S期, 且电镜见到细胞浆疏松、染色质边集、凋亡小体等典型细胞凋亡特征, 推断Bu可以通过使肠癌细胞周期阻滞而诱导细胞凋亡. 多项研究均证明细胞周期阻滞与细胞凋亡密切相关[11-13]. 王艳丽等[14]认为细胞周期的阻滞最终将导致细胞的凋亡. 细胞周期受到细胞周期依赖性蛋白激酶(cyclin-dependent kinases)、细胞周期蛋白(Cyclin)、Polo样聚合酶、Aurora激酶和周期抑制蛋白(cyclin-dependent-kinase inhibitor)等因素调控[15-17]. 其中Cyclin A和Cyclin B与细胞周期中的G1/S期和G2/M期的转换调控有关, Cyclin A参与细胞从G1期到S期的转换过程, 而细胞由G2期进入M期需要Cyclin B与周期依赖性蛋白激酶结合物的调控[18,19]. 研究发现, 恶性肿瘤中Cyclin A和Cyclin B较正常细胞高[20,21], Bu可降低肝癌HepG2细胞中Cyclin B的表达[22], 而含有Bu成分的抗肿瘤药物华蟾素具有下调肿瘤细胞Cyclin A表达能力[23]. Bu还可能通过下调P53蛋白[3]、降低survivin蛋白表达使促凋亡蛋白Smac/DIABLO从线粒体释放入胞浆[24], 抑制Bcl-xL基因表达和促进Bax基因表达[25]等途径引起癌细胞凋亡. 本实验结果发现Bu对肝癌BEL-7402细胞具有细胞毒性、增殖抑制作用, 呈时间和剂量依赖性, 肝癌BEL-7402细胞被阻滞在G2期和S期, 表明Bu抑制肝癌Bel-7402细胞的增殖与细胞周期被阻滞在S期和G2期密切相关. 其机制可能与Bu降低肝癌Bel-7402细胞Cyclin A和Cyclin B表达, 影响凋亡相关因子P53、survivin、Bcl-xL等表达, 从而使细胞周期发生阻断后导致了肝癌细胞的凋亡.
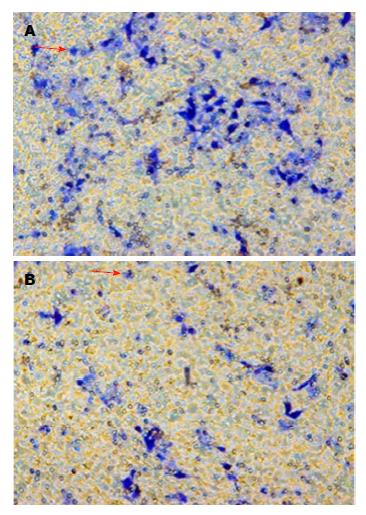
转移是恶性肿瘤的特征性表现, HCC极易发生转移, 术后5年复发率可达70%, 是导致肝癌患者死亡的一个主要原因[26]. 癌细胞降解基底膜和细胞外基质及迁移运动是恶性肿瘤转移的关键步骤, 其过程与E-钙黏蛋白(E-cadherin)表达降低, 基质金属蛋白酶(matrix metalloproteinases, MMPs)与金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, TIMP)之间平衡被打破等多种因素有关[27-29]. Hong等[30]研究发现Bu能加强细胞间紧密连接, 并通过增加细胞外信号调节激酶(extracellular regulated protein kinases)通路磷酸化从基因和蛋白层面减少MMP-7和-9, 增加TIMP-1和-2, 从而降低膀胱癌T24细胞侵袭. Chueh等[31]发现Bu可通过阻止MAPK信号抑制MMP-2生成, 降低骨肉瘤U-2细胞侵袭转移. 本实验研究结果表明Bu明显抑制肝癌细胞迁移侵袭能力, 其抑制迁移与侵袭转移可能与影响肝癌细胞MMPs和E-cadherin表达有关, 但其确切的机制尚需进一步深入研究.
原发性肝癌是较常见的消化系肿瘤, 其发病率及死亡率均较高, 严重威胁人类健康, 现有的治疗方法存在一定的限制性. 蟾毒灵(bufalin, Bu)是传统抗肿瘤中药蟾酥中主要的活性成分之一, 具有明确的抗肿瘤效果. 为了进一步明确Bu抗肝癌的机制, 本研究对Bu对肝癌细胞增殖侵袭作用的影响进行了观察.
姚登福, 教授, 南通大学附属医院
Bu的抗肝癌作用机制比较复杂, 目前尚未完全阐明, 尤其是Bu抑制肝癌BEL-7402细胞的迁移和侵袭的机制目前尚不明确, 需要进一步深入研究.
已有报道Bu对多种肿瘤细胞的增殖、侵袭具有抑制作用, 其机制可能是Bu促进了细胞的凋亡, 同时能够抑制与侵袭转移有关的细胞通路和通路中相关因子.
我们通过观察Bu对肝癌BEL-7402细胞增殖、细胞周期、迁移、侵袭的影响, 为进一步探索其影响机制奠定了基础.
由于Bu对多种实体及血液恶性肿瘤均表现出良好的抗肿瘤效果, 因此在中药现代化研究的背景下, 将其应用于临床治疗将为无法手术的恶性肿瘤患者治疗提供了一个新的手段.
Bu能够抑制多种恶性肿瘤细胞增殖、侵袭, 但在肝癌细胞研究报道较少, 本研究通过体外培养人肝癌细胞, 详细观察了Bu对肝癌细胞生长、迁移和侵袭具有显著抑制作用, 结果可靠, 为进一步深入研究Bu抗肝细胞癌作用和机制奠定了理论基础.
编辑 郭鹏 电编 都珍珍
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | 王 晋, 尹 军强, 贾 强, 沈 靖南, 黄 纲, 谢 显彪, 邹 昌业. 蟾毒灵诱导骨肉瘤U-2OS和U-2OS/MTX300细胞系的凋亡. 中华肿瘤杂志. 2010;32:734-738. |
| 5. | Huang H, Cao Y, Wei W, Liu W, Lu SY, Chen YB, Wang Y, Yan H, Wu YL. Targeting poly (ADP-ribose) polymerase partially contributes to bufalin-induced cell death in multiple myeloma cells. PLoS One. 2013;8:e66130. [PubMed] [DOI] |
| 8. | 李 梅影, 李 际盛, 于 学军, 孙 丽美, 王 艾君, 刘 奇迹, 王 秀问. 蟾毒灵对CAPAN-2胰腺癌细胞增殖和细胞周期的影响. 山东大学学报(医学版). 2013;51:37-41. |
| 11. | Chang WA, Lin ES, Tsai MJ, Huang MS, Kuo PL. Isolinderalactone inhibits proliferation of A549 human non small cell lung cancer cells by arresting the cell cycle at the G0/G1 phase and inducing a Fas receptor and soluble Fas ligand-mediated apoptotic pathway. Mol Med Rep. 2014;9:1653-1659. [PubMed] [DOI] |
| 12. | Chen J, Wang FL, Chen WD. Modulation of apoptosis-related cell signalling pathways by curcumin as a strategy to inhibit tumor progression. Mol Biol Rep. 2014; Mar 7. [Epub ahead of print]. [PubMed] [DOI] |
| 13. | Kang N, Wang MM, Wang YH, Zhang ZN, Cao HR, Lv YH, Yang Y, Fan PH, Qiu F, Gao XM. Tetrahydrocurcumin induces G2/M cell cycle arrest and apoptosis involving p38 MAPK activation in human breast cancer cells. Food Chem Toxicol. 2014;67:193-200. [PubMed] [DOI] |
| 14. | 王 艳丽, 朱 晓琳, 段 丽丽, 陈 杰鹏, 牛 哲峰, 曲 迎春, 丛 培芳, 李 岭, 张 美侠. 维康醇对肝癌细胞增殖抑制和诱导凋亡的作用. 中国医科大学学报. 2013;42:999-1002. |
| 15. | Diaz-Moralli S, Tarrado-Castellarnau M, Miranda A, Cascante M. Targeting cell cycle regulation in cancer therapy. Pharmacol Ther. 2013;138:255-271. [PubMed] [DOI] |
| 16. | Cholewa BD, Liu X, Ahmad N. The role of polo-like kinase 1 in carcinogenesis: cause or consequence? Cancer Res. 2013;73:6848-6855. [PubMed] [DOI] |
| 17. | Nikonova AS, Astsaturov I, Serebriiskii IG, Dunbrack RL, Golemis EA. Aurora A kinase (AURKA) in normal and pathological cell division. Cell Mol Life Sci. 2013;70:661-687. [PubMed] [DOI] |
| 18. | Santala S, Talvensaari-Mattila A, Soini Y, Honkavuori-Toivola M, Santala M. High expression of cyclin A is associated with poor prognosis in endometrial endometrioid adenocarcinoma. Tumour Biol. 2014; Feb 12. [Epub ahead of print]. [PubMed] [DOI] |
| 24. | Zhu Z, Li E, Liu Y, Gao Y, Sun H, Wang Y, Wang Z, Liu X, Wang Q, Liu Y. Bufalin induces the apoptosis of acute promyelocytic leukemia cells via the downregulation of survivin expression. Acta Haematol. 2012;128:144-150. [PubMed] [DOI] |
| 25. | 王 杰, 奉 典旭, 陈 超, 倪 振华, 左 青松, 陈 亚峰, 王 旭, 张 勇, 陈 腾. 蟾毒灵对裸鼠大肠癌原位移植瘤的抗肿瘤作用及其对凋亡相关基因Bcl-xL, Bax表达的影响. 肿瘤防治研究. 2011;38:1121-1125. |
| 27. | Shapiro L, Weis WI. Structure and biochemistry of cadherins and catenins. Cold Spring Harb Perspect Biol. 2009;1:a003053. [PubMed] [DOI] |
| 28. | 周 新木, 陈 丽荣. GS、E-cadherin和β-catenin在肝细胞癌中的表达及其临床意义. 中国组织化学与细胞化学杂志. 2013;22:140-144. |
| 29. | Daniele A, Divella R, Quaranta M, Mattioli V, Casamassima P, Paradiso A, Garrisi VM, Gadaleta CD, Gadaleta-Caldarola G, Savino E. Clinical and prognostic role of circulating MMP-2 and its inhibitor TIMP-2 in HCC patients prior to and after trans-hepatic arterial chemo-embolization. Clin Biochem. 2014;47:184-190. [PubMed] [DOI] |
| 30. | Hong SH, Kim GY, Chang YC, Moon SK, Kim WJ, Choi YH. Bufalin prevents the migration and invasion of T24 bladder carcinoma cells through the inactivation of matrix metalloproteinases and modulation of tight junctions. Int J Oncol. 2013;42:277-286. [PubMed] [DOI] |
| 31. | Chueh FS, Chen YY, Huang AC, Ho HC, Liao CL, Yang JS, Kuo CL, Chung JG. Bufalin-inhibited migration and invasion in human osteosarcoma U-2 OS cells is carried out by suppression of the matrix metalloproteinase-2, ERK, and JNK signaling pathways. Environ Toxicol. 2014;29:21-29. [PubMed] [DOI] |