修回日期: 2014-03-18
接受日期: 2014-03-31
在线出版日期: 2014-05-08
目的: 从诱导基因表达角度评估解毒化瘀健脾方及拆方对胃黏膜异型增生模型大鼠治疗的贡献作用.
方法: 甲基化特异性PCR(methylmion specific PCR, MSP)法检测正常对照组、胃黏膜异型增生组、西药维甲酸治疗组、解毒化瘀健脾全组方治疗组、中药单组方解毒组、化瘀组、益气组、养阴组、理气组抑癌基因及肿瘤相关基因p16、PETN、凝血栓蛋白酶基因1(thrombospondin 1, Thbs1)、E-Cadherin、Runx3的甲基化程度; Real-time PCR及免疫组织化学法检测解毒化瘀健脾中药各组处理因促使各基因去甲基化导致的mRNA及蛋白表达水平表达变化.
结果: 解毒化瘀健脾方及各拆方组均可一定程度实现p16、PETN、Thbs1、E-Cadherin、Runx3的去甲基化; 转录水平各组相比CG组基因表达变化分别为: A组p16极显著升高(P<0.01), PETN、E-Cadherin、Thbs1、B组Thbs1、C组p16、PETN、Thbs1、E组Thbs1、F组p16、Thbs1显著升高(P<0.05); 蛋白水平各组相比CG组蛋白表达的变化为: A组p16、PTEN、E-Cadherin、RUNX3、THBS1、B组p16、C组p16、THBS1、D组除RUNX3外的蛋白、E组除PTEN的蛋白、F组除THBS1外的蛋白均显著上调(P<0.05); 统计各组在转录和蛋白翻译水平的变化积分, 结果表明解毒化瘀健脾中药方贡献分值最为突出, 其次为单组方理气组、养阴组、化瘀、益气组及解毒组.
结论: 解毒化瘀健脾方对胃黏膜异型增生的治疗作用优于各拆方治疗组, 对胃黏膜异型增生的治疗应以理气养阴为主.
核心提示: 解毒化瘀健脾中药全组方相比各组拆方对于胃黏膜异型增生的治疗作用更佳, 对于胃黏膜异型增生的治疗应以理气养阴为主.
引文著录: 李志钢, 张伟, 邱作成, 纪勇, 李玲, 夏宽宏. 解毒化瘀健脾方及拆方对胃黏膜异型增生大鼠多基因去甲基化诱导表达的比较. 世界华人消化杂志 2014; 22(13): 1820-1825
Revised: March 18, 2014
Accepted: March 31, 2014
Published online: May 8, 2014
AIM: To evaluate the contribution of each prescription of Jiedu Huayu Jianpi Fang to the therapeutic effects on gastric mucosal dysplasia from the perspective of induced gene expression.
METHODS: We divided gastric mucosal dysplasia rats into a model control (MG) group, a Western medicine (retinoic acid) treatment (PCG) group, a combined prescription (Jiedu Huayu Jianpi) treatment (A) group, and Jiedu (B), Huayu (C), Yiqi (D), Yangying (E) and Liqi (F) single prescription treatment groups. Normal rats were used as controls (CG). Methylation specific PCR technique was used to detect the methylation status of p16, PETN, Thbs1, E-Cadherin, and Runx3 genes in gastric mucosal cells of rats. Real-time PCR and immunohistochemistry were used to detect the mRNA and protein expression of each genes.
RESULTS: All of the Jiedu Huayu Jianpi treatment groups showed a certain degree of demethylation of p16, PETN, Thbs1, E-Cadherin, and Runx3 gene. Compared with group CG, the mRNA expression of p16 (P < 0.01), PETN, E-Cadherin and Thbs1 in group A, Thbs1 in group B, p16, PETN and Thbs1 in group C, Thbs1 in group E, p16 and Thbs1 in group F increased significantly (P < 0.05 for all); and the protein expression of p16, PTEN, E-cad, RUNX3, and THBS1 in group A, p16 in group B, p16 and THBS1 in group C, p16, PTEN, E-cad and THBS1 in group D, p16, E-cad, RUNX3 and THBS1 in group E, p16, PTEN, E-cad, RUNX3 and THBS1 in group F increased significantly (P < 0.05 for all). The effect of Jiedu Huayu Jianpi Fang on gastric mucosal dysplasia was the most prominent, followed by Liqi, Yangyin, Huayu, Yiqi and Jiedu single prescriptions.
CONCLUSION: The effect of Jiedu Huayu Jianpi Fang on gastric mucosal dysplasia is much better than those of each single prescription. Gastric mucosal dysplasia should be treated mainly by means of Liqi and Yangyin.
- Citation: Li ZG, Zhang W, Qiu ZC, Ji Y, Li L, Xia KH. Comparative analysis of each prescription of Jiedu Huayu Jianpi Fang for multiple gene demethylation and expression in mucosal dysplasia in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1820-1825
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1820
胃癌是常见的消化系癌症之一. 病死率居我国恶性肿瘤首位[1], 居世界癌症第2位[2], 每年死于此病者超过16万例, 约占全部肿瘤死亡的1/5[3]. 研究证实, 胃癌的发生发展是涉及多种抑癌基因及肿瘤相关基因参与的多步骤过程. 胃癌发生之前, 常经历被称为胃癌前病变的肠化生及胃黏膜异型增生阶段, 如何有效抑制胃癌前病变的发展, 逆转胃癌的发生成为胃癌防治的关键. 胃癌的发生涉及遗传学及表观遗传学两大作用机制, 其中表观遗传学机制的DNA甲基化在胃癌发生进展中具有重要的作用[4-6], 成为除基因突变和缺失之外的促使抑癌基因失活的第3种机制[7], 抑癌基因CpG岛甲基化也成为目前肿瘤分子生物学的研究热点. 甲基化常导致抑癌基因p16[8]、PETN、凝血栓蛋白酶基因1(thrombospondin 1, Thbs1)[9]以及肿瘤远端转移相关基因上皮细胞钙黏蛋白基因(E-Cadherin)[10]、转录因子Runx3[11]等肿瘤相关基因的失活, 与胃癌的发生密切相关. DNA甲基化可因外界环境的干预而逆转, 因此选用合适的药物干预改变抑癌基因及肿瘤相关基因的甲基化程度, 可以一定程度抑制胃癌前病变的进程, 预防胃癌的发生.
本研究前期的研究发现解毒化瘀健脾方对于胃黏膜异型增生模型大鼠具有一定的治疗作用, 该中药方由解毒、化瘀、益气、养阴、理气5个单组方组成, 本研究拟通过检测该中药全组方及各单组方处理下胃黏膜异型增生大鼠p16、PETN、Thbs1、E-Cadherin、Runx3基因的甲基化逆转情况, 及检测各基因在mRNA和蛋白水平的表达变化, 从因去甲基化诱导基因表达的角度评估该中药全组方及各单组方对胃黏膜异型增生治疗的贡献大小, 为解毒化瘀健脾中药的临床应用提供参考依据.
SPF级健康♂SD大鼠[SCXK(新)20110004]10只, 胃黏膜异型增生模型大鼠123只, 置于新疆医科大学实验动物中心SPF动物实验室条件下饲养. 解毒化瘀健脾方药材: 购自新疆医科大学附属中医医院门诊中药房, 经自治区中医医院中药药理鉴定室李玲主任中药师鉴定. 维甲酸: 上海第六制药厂生产, 批号: H31020263. 盐酸雷尼替丁胶囊: 赛诺菲安万特(杭州)制药有限公司产品, 产品批号: 2011; 雷尼替丁饲料. 由新疆新疆医科大学实验动物中心制成0.04%雷尼替丁的颗粒状SPF级大鼠饲料. 乙醇: 汕头市光华化学厂产品, 批号: 20110706. 精确称取解毒化瘀健脾方全组方及各拆方相应剂量的生药, 加入清洁自来水浸泡30 min, 常规煎煮2次, 30 min/次, 4层纱布过滤滤液, 2次药液混合后, 加热浓缩为提取药液. 为保证各拆方组及配伍组合组中组成药物的生药浓度与全方中相应生药浓度相同, 各拆方组及配伍组合组加热浓缩后的体积与全方煎液的浓缩体积相同. 制备好的药液, 装入玻璃器具中, 4 ℃放置备用.
1.2.1 分组: 造模成功的胃黏膜异型增生大鼠随机分为: 模型组(MG组, n = 18)、维甲酸阳性对照组(positive control group, PCG组, n = 15)、解毒化瘀健脾方中药全方组(A组, n = 15)、解毒组(B组, n = 15)、化瘀组(C组, n = 15)、益气组(D组, n = 15)、养阴组(E组, n = 15)、理气组(F组, n = 15). 另外, 以SPF级♂SD大鼠10只为空白对照组(CG).
1.2.2 给药: 各组中药方剂量按实验动物与成人用药量的换算方法[12]计算, 同时采用中剂量动物实验标准方法给药. 解毒化瘀健脾方全方水煎剂30.5 g/(kg·d)+三七粉0.83 g/(kg·d)、及解毒组中药水煎剂6.5 g/(kg·d)、化瘀组化瘀中药水煎剂4 g/(kg·d)+三七粉0.83 g/(kg·d)、益气组中药水煎剂8.33 g/(kg·d)、养阴组中药水煎剂3.33 g/(kg·d)、理气组中药水煎剂8.33 g/(kg·d)分别灌胃相应各组大鼠; 维甲酸对照组灌服维甲酸悬浊液0.04 g/(kg·d). 其中空白对照组、模型组分别灌服生理盐水10 mL/(kg·d); 治疗6 wk后断颈处死.
1.2.3 取材及实验设计: 摘离全胃, 迅速沿大弯侧剪开, 冷生理盐水漂洗内容物, 再沿小弯侧剪开, 一半用滤纸吸干水分, 钝刀片从胃窦侧刮取胃黏膜约50-100 mg, 然后分别行甲基化特异性PCR(methylmion specific PCR, MSP)检测(引物如表1)、Real-time PCR检测(引物如表2)、免疫组织化学检测p16、PETN、Thbs1、E-Cadherin、Runx3的甲基化程度及各基因在转录与蛋白翻译水平的表达变化.
| 引物 | 序列 | 扩增片段长度(bp) |
| p16 | F: 5'-TGTTTGTTGAGGATAAGGATTATTC-3' | 147 |
| R: 5'-AAAAAAAACACAAAAAAATCACGAC-3' | ||
| PTEN | F: 5'-TTTTGAGTAGTTTTGGAAAGAGATG-3' | 126 |
| R: 5'-AACCCTAACAATAATAACAAACAAC-3' | ||
| E-cad | F: 5'-AGGTTATTAAAGAAAATCGTCGG-3' | 128 |
| R: 5'-AAAAATTTTAAATAACATTTTAACGTA-3' | ||
| RUNX3 | F: 5'-TTTTTTATTTACGGGGAGAAAGC-3' | 119 |
| R: 5'-AAAACACAACAAAACCTACAACGA-3' | ||
| Thbs1 | F: 5'-ATTATATTTTTGTTTTGGGAGTTGA-3' | 132 |
| R: 5'-ATAACCACTCATATTTCTTAACATA-3' |
| 基因名 | 序列 | 扩增片段长度(bp) |
| p16 | F: 5'-TCGTGCGGTATTTGCGGTAT-3' | 184 |
| R: 5'-TAGTCTCGCGTTGCCAGAAG-3' | ||
| PTEN | F: 5'-TACCAGGACCAGAGGAAACCT-3' | 120 |
| R: 5'-GGGTGAGCACAAGATACTCCT-3' | ||
| E-cad | F: 5'-GCGGCGAAGAAGACTAGAGA-3' | 156 |
| R: 5'-ACTGGTAGGTAGAGTGGGACC-3' | ||
| RUNX3 | F: 5'-ACCGAGCCATCAAGGTTACTG-3' | 101 |
| R: 5'-GTCTCCGAAGCGGTCGGG-3' | ||
| Thbs1 | F: 5'-ACTTGGACGCTCTGCCTATG-3' | 248 |
| R: 5'-TTGCGGGGGTTGTAGA-3' |
统计学处理 采用 SPSS19.0统计软件进行数据分析, GraphPad Prism5.0软件绘图, 计数资料的比较采用秩和检验; Real-time PCR与免疫组织化学数据以3次独立试验mean±SD表示, 计量资料用单因素方差分析, 两两比较用q检验(LSD法), P<0.05为差异有统计学意义.
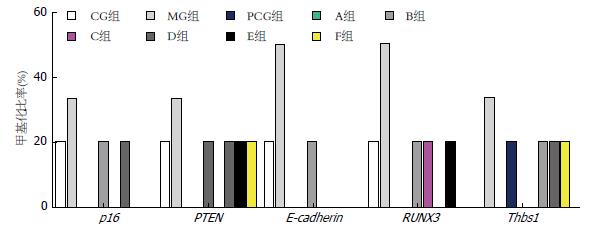
各检测基因甲基化检测结果表明, 各药物处理组各检测基因的甲基化程度相比模型组均有下降, 或降至与正常对照组甲基化程度, 或降低为零, 即各组药物治疗均不同程度抑制了被检测基因的甲基化程度(图1).
表3汇总了各治疗组对目标基因去甲基化影响的Real-time PCR结果, 可以清楚地看到, 在中药治疗组中, A组对p16、PTEN、E-cadherin、Thbs1 4个基因在mRNA水平的上调表达具有积极干预作用; 其次, C组、F组对p16、Thbs1 2个基因在mRNA水平的上调表达也具有积极干预作用; 除D组外, 各中药组方处理均使Thbs1在mRNA水平的表达显著增加.
| 基因 | PCG组(维甲酸组) | A组(全方组) | B组(解毒组) | C组(化瘀组) | D组(益气组) | E组(养阴组) | F组(理气组) |
| p16 | 2.62±0.61 | 1618.86±262.44b | 1.60±0.62 | 1914.90±238.17a | 3.58±1.27 | 1.53±0.50 | 1744.58± 377.63a |
| PTEN | 1.02±0.07a | 1.06±0.07a | 0.67±0.10 | 0.06±0.02a | 0.96±0.11 | 0.69±0.12 | 0.003± 0.002 |
| E-cadherin | 0.87±0.06a | 0.97±0.04a | 0.83±0.05 | 0.77±0.06 | 0.67±0.04 | 0.76±0.07 | 0.73± 0.11 |
| RUNX3 | 0.88±0.04a | 0.80±0.03 | 0.65±0.06 | 0.71±0.07 | 0.74±0.05 | 0.67±0.03 | 0.50± 0.04 |
| Thbs1 | 1.65±0.08a | 1.49±0.09a | 1.51±0.10a | 1.58±0.19a | 0.98±0.08 | 1.59±0.11a | 1.35± 0.13a |
表4从蛋白表达水平汇总了各治疗组对目标基因去甲基化影响的免疫组织化学结果, 结果显示: 在中药治疗组中, A组、E组、F组分别对 4个被检测基因在蛋白水平的上调表达具有积极干预作用; 其次, D组对3个被检测基因在蛋白水平的上调表达具有积极干预作用; 而C组则使p16、Thbs1 2个蛋白及B组(解毒组)使Thbs1蛋白的表达量显著增加.
| 基因 | PCG组(维甲酸组) | A组(全方组) | B组(解毒组) | C组(化瘀组) | D组(益气组) | E组(养阴组) | F组(理气组) |
| p16 | 0.78±0.11a | 1.61±0.10a | 1.51±0.10a | 0.80±0.11a | 1.22±0.10a | 1.12±0.08a | 0.55±0.05a |
| PTEN | 0.74±0.21 | 1.07±0.11a | 0.50±0.07 | 0.67±0.06 | 0.97±0.10a | 0.70±0.08 | 1.06±0.19a |
| E-cadherin | 0.34±0.09 | 1.07±0.07a | 0.23±0.06 | 0.26±0.04 | 1.04±0.06a | 1.07±0.09a | 1.02±0.09a |
| RUNX3 | 0.85±0.12a | 0.58±0.07 | 0.44±0.10 | 0.38±0.04 | 0.70±0.12 | 1.46±0.11a | 1.06±0.07a |
| Thbs1 | 0.51±0.03a | 0.52±0.07a | 0.24±0.06 | 0.63±0.05a | 0.26±0.06 | 0.44±0.06a | 0.27±0.03 |
由于抑癌基因及肿瘤相关基因的甲基化而导致的此类基因失活与胃癌发生发展密切相关, 使用药物干预实现该类基因的去甲基化, 诱导该类基因表达对于控制胃癌前病变进程, 实现胃癌转归有重要的贡献作用. 因此, 本研究制定以下评分规则评估各组药物处理对于因药物治疗使各被检测基因去甲基化而诱导基因在mRNA水平和蛋白表达水平表达上调的贡献, 间接反映各组药物对于治疗胃黏膜异型增生的贡献. 以各处理组各被检测基因在mRNA水平和蛋白表达水平与模型对照组具有显著差异记1分, 具有极显著差异记2分, 汇总每组各检测基因总得分值为该组处理总得分. 结果显示, 中药全方组贡献分值最高(9分), 且高于阳性对照西药维甲酸治疗组(7分); 各拆方治疗组的贡献分值由高到低依次为理气组(6分)、养阴组(5分)、化瘀(4分)、益气组(4分)及解毒组(2分).
DNA甲基化是对DNA的一种化学修饰, 在维持染色体结构、胚胎发育、细胞分化及肿瘤发生等方面发挥重要的作用[13]. 近期人们对比分析几种癌、癌旁组织和正常组织的DNA, 发现某些癌基因的低甲基化和抑癌基因的高甲基化改变是细胞癌变的重要特征[14,15]. 由于甲基化调节基因表达的过程是可逆且受环境因素的影响, 因此可以选择合适的药物干预达到去甲基化, 诱导相关基因蛋白上调表达, 从而控制癌症发展进程. 本研究的结果也表明, 解毒化瘀健脾中药无论是全组方还是单组方, 均能够一定程度的实现被检测基因的去甲基化, 预示解毒化瘀健脾中药对于控制胃癌前病变进程具有调节作用.
抑癌基因及肿瘤相关基因的异常表达与肿瘤的发生发展密切相关. 抑癌基因p16可通过与CDK4/6结合抑制后者的作用, 进而低磷酸化RB蛋白, 调控G1/S转变而抑制细胞增殖[8], 胃癌中该基因异常甲基化是使其失活的主要机制[16], 该基因蛋白异常表达与胃癌的发生发展、恶变程度、淋巴结转移预后有密切关系[17]. 肿瘤远端转移相关基因E-cadherin因启动子区CpG岛的高甲基化而导致该基因的低表达的现象在胃癌、结直肠癌、乳腺癌及前列腺癌等肿瘤中均得到证实[10]. Thbs1具抑制肿瘤发生发展的作用[9], 据文献报道胃癌[18,19]中因该基因甲基化而导致该蛋白表达量的下调. 此外, 超过半数的胃癌组织和更高比例的胃癌细胞株中, 转录因子Runx3基因表达明显降低甚至缺失[20,21]. 本研究Real-time PCR及免疫组织化学结果均表明, 该基因无论在mRNA水平或蛋白水平, 解毒化瘀健脾方及拆方干预均可一定程度诱导以上被检测基因表达量上调. 抑癌基因PTEN与胃癌的关系文献报道较少, 且结论并不一致, 部分学者认为该基因的甲基化与胃癌的发生及分化程度存在相关性[22,23], 也有研究得出截然相反的结论[24]. 我们的研究结果显示, 解毒化瘀健脾方及拆方的干预均使异型增生胃黏膜中该基因甲基化程度降低, 也诱导该基因在mRNA和蛋白水平表达量增加.
汇总各药物处理组诱导的基因表达变化与模型对照组间的差异显著性积分, 结果表明: 解毒化瘀健脾中药全组方对于诱导基因表达的贡献分值最高; 单组方中理气与养阴组总积分较高. 该结果从侧面提示我们应选择解毒化瘀健脾中药全组方用于胃黏膜异型增生治疗, 且应以理气养阴为主. 此外, 该中药方在胃黏膜异型增生的治疗中P16、E-Cadherin、PTEN、Thbs1相比Runx3更为易感, 其中抑癌基因Thbs1对该药物干预的易感性最为突出.
该研究为解毒化瘀健脾中药的临床应用提供了分子生物学方面的参考依据. 胃癌的发生还涉及其他多种抑癌基因的参与, 解毒化瘀健脾方及拆方对胃癌前病变的干预贡献还应结合临床病理生理的变化得出进一步结论.
肠化生与胃黏膜异型增生属胃癌前病变阶段, 选择合适的药物可有效阻断胃癌前病变向胃癌的转变.
李康, 副教授, 广东药学院药科学院药物分析教研室
抑癌基因及肿瘤相关基因的甲基化与胃癌的发生发展密切相关. 选择有效的药物干预, 逆转抑癌基因及肿瘤相关基因的甲基化状态可改变这些基因在转录和蛋白水平的表达, 可有效抑制胃癌前病变向胃癌的发展, 甚至转归.
范尧夫等研究认为P16蛋白异常表达对胃癌的发生发展、恶变程度密切相关. 刘芬、Kang等认为PTEN的甲基化与胃癌的发生及分化程度存在一定到各相关性, 但Sato的报道得出截然相反的结论. Yuecheng等研究发现胃癌中E-Cadherin因启动子区CpG岛的高甲基化而导致该基因的低表达. Kim等发现在胃癌中基因因甲基化低表达. Sakakura和刘芬等认为超过半数的胃癌组织和更高比例的胃癌细胞株中, 转录因子Runx3基因表达明显降低甚至缺失.
本研究采用MSP法检测解毒化瘀健脾中药各个组方干预后抑癌基因及肿瘤相关基因p16, PETN, Thbs1, E-Cadherin, Runx3甲基化受抑制程度及被检测基因在转录和蛋白水平的表达量变化, 且对比分析该中药方各组成成分对胃黏膜异型增生治疗的贡献贡献.
探讨解毒化瘀健脾中药全组方及各组拆方对胃黏膜异型增生抑癌基因、肿瘤相关基因p16, PETN, Thbs1, E-Cadherin, Runx3的甲基化及表达异常的干预作用, 分析各组药物处理治疗胃黏膜异型增生的贡献, 为确认采用中药治疗胃黏膜异型增生可能的侧重方向提供数据资料.
研究具有一定科学价值. 解毒化瘀健脾方及拆方对胃黏膜异型增生大鼠多基因去甲基化诱导表达, 说明全方治疗作用优于各拆方治疗组, 对胃黏膜异型增生的治疗应以理气养阴为主. 从去甲基化诱导基因表达的角度评估, 为解毒化瘀健脾中药的临床应用提供参考依据.
编辑 郭鹏 电编 鲁亚静
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 4. | 刘 玺, 陈 卫刚, 李 睿, 刘 芳, 刘 晓燕, 康 雪, 马 聪, 窦 玉琴, 郑 勇. 新疆哈萨克族胃癌中Smad4基因启动子的甲基化状态. 世界华人消化杂志. 2013;21:1907-1913. |
| 5. | Saito K, Kawakami K, Matsumoto I, Oda M, Watanabe G, Minamoto T. Long interspersed nuclear element 1 hypomethylation is a marker of poor prognosis in stage IA non-small cell lung cancer. Clin Cancer Res. 2010;16:2418-2426. [PubMed] [DOI] |
| 9. | Filleur S, Volpert OV, Degeorges A, Voland C, Reiher F, Clézardin P, Bouck N, Cabon F. In vivo mechanisms by which tumors producing thrombospondin 1 bypass its inhibitory effects. Genes Dev. 2001;15:1373-1382. [PubMed] [DOI] |
| 10. | Yuecheng Y, Hongmei L, Xiaoyan X. Clinical evaluation of E-cadherin expression and its regulation mechanism in epithelial ovarian cancer. Clin Exp Metastasis. 2006;23:65-74. [PubMed] [DOI] |
| 11. | Bangsow C, Rubins N, Glusman G, Bernstein Y, Negreanu V, Goldenberg D, Lotem J, Ben-Asher E, Lancet D, Levanon D. The RUNX3 gene--sequence, structure and regulated expression. Gene. 2001;279:221-232. [PubMed] [DOI] |
| 12. | 苗 明三. 实验动物学和动物实验技术. 北京: 中国中医药出版社 1997; 144. |
| 13. | Li Y, Tollefsbol TO. Impact on DNA methylation in cancer prevention and therapy by bioactive dietary components. Curr Med Chem. 2010;17:2141-2151. [PubMed] [DOI] |
| 14. | Wong ML, Tao Q, Fu L, Wong KY, Qiu GH, Law FB, Tin PC, Cheung WL, Lee PY, Tang JC. Aberrant promoter hypermethylation and silencing of the critical 3p21 tumour suppressor gene, RASSF1A, in Chinese oesophageal squamous cell carcinoma. Int J Oncol. 2006;28:767-773. [PubMed] |
| 15. | Fang JY, Lu R, Mikovits JA, Cheng ZH, Zhu HY, Chen YX. Regulation of hMSH2 and hMLH1 expression in the human colon cancer cell line SW1116 by DNA methyltransferase 1. Cancer Lett. 2006;233:124-130. [PubMed] [DOI] |
| 16. | Li Q, Wang X, Lu Z, Zhang B, Guan Z, Liu Z, Zhong Q, Gu L, Zhou J, Zhu B. Polycomb CBX7 directly controls trimethylation of histone H3 at lysine 9 at the p16 locus. PLoS One. 2010;5:e13732. [PubMed] [DOI] |
| 18. | Guo W, Dong Z, He M, Guo Y, Guo J, Chen Z, Yang Z, Kuang G. Aberrant methylation of thrombospondin-1 and its association with reduced expression in gastric cardia adenocarcinoma. J Biomed Biotechnol. 2010;2010:721485. [PubMed] |
| 19. | Kim JH, Jung EJ, Lee HS, Kim MA, Kim WH. Comparative analysis of DNA methylation between primary and metastatic gastric carcinoma. Oncol Rep. 2009;21:1251-1259. [PubMed] [DOI] |
| 20. | Oshimo Y, Oue N, Mitani Y, Nakayama H, Kitadai Y, Yoshida K, Ito Y, Chayama K, Yasui W. Frequent loss of RUNX3 expression by promoter hypermethylation in gastric carcinoma. Pathobiology. 2004;71:137-143. [PubMed] [DOI] |
| 21. | Sakakura C, Hagiwara A, Miyagawa K, Nakashima S, Yoshikawa T, Kin S, Nakase Y, Ito K, Yamagishi H, Yazumi S. Frequent downregulation of the runt domain transcription factors RUNX1, RUNX3 and their cofactor CBFB in gastric cancer. Int J Cancer. 2005;113:221-228. [PubMed] [DOI] |
| 23. | Kang YH, Lee HS, Kim WH. Promoter methylation and silencing of PTEN in gastric carcinoma. Lab Invest. 2002;82:285-291. [PubMed] [DOI] |
| 24. | Sato K, Tamura G, Tsuchiya T, Endoh Y, Sakata K, Motoyama T, Usuba O, Kimura W, Terashima M, Nishizuka S. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer. Virchows Arch. 2002;440:160-165. [PubMed] [DOI] |