修回日期: 2014-03-18
接受日期: 2014-03-31
在线出版日期: 2014-05-08
目的: 探讨应用腺病毒与乙型肝炎病毒嵌合载体表达胶原酶Ⅱ对肝硬化大鼠模型的治疗作用.
方法: 以硫代乙酰胺口服法16 wk诱导大鼠形成肝硬化模型, 用腺病毒穿梭质粒与乙型肝炎病毒嵌合载体表达截断的胶原酶Ⅱ基因tMMP-8片断或全长MMP-8基因, 分别构建了腺病毒Ad-CH-tMMP8、Ad-C-MMP8, 并以表达红色荧光蛋白(red fluorescent protein, RFP2)的Ad-CH-RFP2作为对照, 经尾静脉注射治疗已形成肝硬化模型的大鼠.
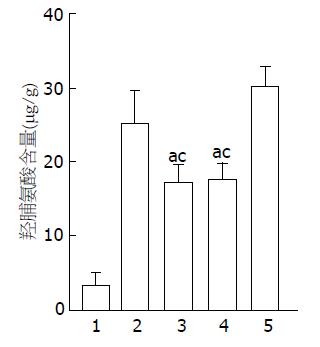
结果: 在Ad-CH-tMMP8、Ad-C-MMP8尾静脉注射肝硬化大鼠的体内转染研究中, 转染4 wk, 相比于模型组, 肝纤维化程度显著的减轻, 肝细胞再生明显, 同时伴有肝组织羟脯氨酸含量的下降(28.97 µg/g±2.36 µg/g vs 17.04 µg/g±0.61 µg/g, 17.62 µg/g±1.30 µg/g, P<0.05), Ad-CH-RFP2对照组, 纤维化程度同模型组类似.
结论: 用腺病毒与乙型肝炎病毒嵌合载体表达胶原酶Ⅱ能够有效地减轻大鼠肝纤维化程度.
核心提示: 用腺病毒载体转导乙型肝炎病毒(hepatitis B virus, HBV)载体表达胶原酶Ⅱ用于抗肝硬化的基因治疗, 充分利用了腺病毒方便制备、感染效率高的优点, 也利用了HBV载体用于慢性HBV感染者时具有嗜肝导向性、放大效应、无细胞毒性及免疫源性的优点, 将外原基因胶原酶Ⅱ导入硬化的肝脏, 开辟肝硬化软肝治疗新途径.
引文著录: 郭争荣, 孙殿兴, 李兵顺, 刘金霞, 李东, 王君平, 常丽丽, 周晓娜, 李敏然. 胶原酶Ⅱ对肝硬化大鼠的治疗作用. 世界华人消化杂志 2014; 22(13): 1778-1784
Revised: March 18, 2014
Accepted: March 31, 2014
Published online: May 8, 2014
AIM: To explore the therapeutic effect of an adenovirus-HBV chimeric vector expressing collagenase Ⅱ against cirrhosis in a rat model.
METHODS: Rat liver cirrhosis was induced with 0.03% thioacetamide in drinking water for 16 wk. Ad-CH-tMMP8 and Ad-C-MMP8 were constructed using an adenovirus shuttle plasmid and a HBV chimeric vector expressing truncated and full-length collagenase Ⅱ gene. Ad-CH-RFP2 expressing red fluorescent protein was used as a negative control. Liver cirrhosis rats were injected with the three plasmids through the tail vein.
RESULTS: Compared with the model group and negative control group, fibrosis was dramatically attenuated four weeks after the infection. HE staining and picric acid-Sirius red staining showed that hepatocyte steatosis, necrosis and inflammation were significantly milder in the treatment group, along with hepatocyte proliferation, recovery of hepatic lobule structure, and diminished content of HYP (28.97 µg/g ± 2.36 µg/g vs 17.04 µg/g ± 0.61 µg/g, 17.62 µg/g ± 1.30 µg/g, P < 0.05), whereas the fibrosis in Ad-CH-RFP2-treated rats persisted.
CONCLUSION: Adenovirus-HBV chimeric vector expressing collagenase Ⅱ effectively reduces the degree of liver fibrosis in rats.
- Citation: Guo ZR, Sun DX, Li BS, Liu JX, Li D, Wang JP, Chang LL, Zhou XN, Li MR. Therapeutic effect of collagenase Ⅱ against rat liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1778-1784
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1778
肝硬化是一种慢性, 进展性疾病, 其特征是肝脏再生结节和假小叶结构的形成, 进一步发展可导致肝细胞癌. 肝硬化病因是多种多样的, 在全球30%, 中国高达66%的肝硬化是由乙型肝炎病毒(hepatitis B virus, HBV)感染引起. 肝纤维化组织的形成是胶原纤维在肝脏过度沉积, 而Ⅰ型胶原可占硬化肝脏胶原总量的60%-70%[1-3], 因此, 减少Ⅰ型胶原含量将能够大大减轻肝纤维化程度. 胶原酶Ⅱ是中性粒细胞分泌的一种胶原酶, 能够特异的降解Ⅰ型胶原[4-6], 如何将外原基因胶原酶Ⅱ通过载体导入肝细胞是抗肝硬化治疗的关键. 我国肝硬化患者多数伴有HBV感染, 理论上利用HBV载体可以在乙型肝炎患者体内被野生型HBV提供的结构蛋白所包装, 从而实现放大效应, 但目前缺乏HBV感染易感的小动物, 且HBV载体难以大量制备; 重组腺病毒制备方便, 但具有免疫原性, 重复应用因中和抗体产生而失去疗效, 而且大剂量应用时有细胞毒性. 本研究意旨应用腺病毒-HBV嵌合载体携带胶原酶Ⅱ治疗肝硬化大鼠模型, 为HBV相关的肝硬化患者探索一个软化肝脏新方法, 为将来进一步临床应用奠定了基础.
表达胶原酶Ⅱ的质粒pGW1GH-MMP8(Genbank登记号: NP_002415.1)由加拿大Christopher M教授赠予; E1区和E3区双缺失的复制缺陷型腺病毒骨架质粒pBHGLox△E1, 3Cre由Microbix Biosystems公司提供. 野生型HBV表达载体pCH-9/3091(Genbank登记号: V01460)、HepG2细胞, E. coliTOP10菌株为本实验室保存; 腺病毒载体的质粒pDC312(AdMax系统, 加拿大Microbix公司); 人胚肾细胞系293细胞(HEK293)由中国人民解放军军事医学研究院提供. VigoFect转染试剂[威格拉斯生物技术(北京)有限公司]; TRIzol、cDNA合成第一条链试剂盒、MMLV、DNTP、DNApolymerase、RNase、DEPC等RT-PCR各种试剂(天根生物试剂公司). 荧光显微镜(LEICA公司德国); 5%CO2培养箱(HF161上海力申科学仪器有限公司); 荧光定量PCR仪(上海宏石医疗科技有限公司, 国产); 核酸蛋白分析仪(Biophotometer德国)等.
1.2.1 pDC-CH-tMMP8, pDC-C-MMP8腺病毒-HBV载体质粒的构建: 野生型HBV表达载体pCH-9/3091删除S基因, 插入绿色荧光蛋白基因(green fluorescent protein, GFP), 构建质粒PCH-S-GFP[7], 为了去除内源性HBV蛋白的表达, pCH-S-GFP经过以下突变, G28T(GGA to TGA, 编码从核心蛋白ATG起始), T444A(TTG to TAG), C2677T(CAA to TAA)分别使核心蛋白、P蛋白和X蛋白产生终止密码, 前S1和S2起始密码ATG突变为ACG, 得到质粒pCH-M5-GFP. 质粒pCH-M5-RFP2是利用RFP2替换pCH-M5-GFP质粒中的GFP, pCH-M5-tMMP8是利用PCR方法扩增截短型tMMP8片段, 上游引物: 5'-GGCGCCATGGTAACCCCAGGAAACC-3'; 下游引物: 5'-GCCGACTAGTCATCCATAGATGGCCTGAATG-3', 所得到的tMMP8片段插入到PCH-M5-GFP, 构建了质粒pCH-M5-tMMP8, 腺病毒穿梭质粒pDC312插入一个人源化GFP(hrGFP)表达盒以构建pDC312-hrGFP, pCH-M5-tMMP8和PCH-M5-RFP2质粒中包括CMV启动子和完整的HBV载体的NheⅠ片段插入到pDC312-hrGFP质粒, 构建了腺病毒-HBV载体穿梭质粒pDC-CH-tMMP8和pDC-CH-RFP2. 利用同样的方法, 把包括CMV启动子和全长MMP8基因的pGW1GH-MMP8的SpeⅠ至BamHⅠ片段插入到pDC312-hrGFP, 构建了质粒pDC-C-MMP8.
1.2.2 表达MMP8的重组腺病毒质粒的包装与扩增: HEK293细胞接种于6孔板, 加入10%FCS的DMEM培养基, 置37 ℃, 5%CO2培养箱中培养24 h, pBHGLox△E1, 3Cre分别和重组质粒pDC-CH-tMMP8、pDC-CH-RFP2、pDC-C-MMP8以5:1的比例共转染HEK293细胞, 转染15-20 d后有较明显的病毒蚀斑形成. 将HEK293细胞自培养皿内刮下, 收集培养物于50 mL离心管中, 于-70 ℃/37 ℃水浴中反复冻融3次裂解, 经扩大培养后, 用氯化铯梯度离心法进行腺病毒纯化, 测定A260, 根据公式病毒颗粒数 = A260×稀释倍数×1.1×1012算出腺病毒的滴度, 保存于-70 ℃进行体内外研究.
1.2.3 肝硬化动物模型的制备: 清洁级、♂Wistar大鼠40只, 体质量200 g±20 g, 硫代乙酰胺(thioacetamide, TAA)用精确度为1/10000的电子天平称取并用饮用水稀释, 8只为正常组, 用饮用水喂养, 其余均用0.03%TAA诱导饲喂5 wk, 然后0.04%的TAA诱导喂饲5 wk, 大约16 wk后制成稳定的肝硬化模型[8], 每1-2 d更换1次诱导用饮用水, 以保证水的新鲜和药物浓度的稳定, 在诱导期间随即处死实验动物, 经病理证实为肝硬化, 大约10 wk后制成稳定的肝硬化模型.
1.2.4 重组腺病毒感染肝硬化大鼠及组织取样: 造模成功后将肝硬化大鼠随机分为4组, 即治疗组A, 用腺病毒Ad-CH-tMMP8治疗; 治疗组B, 用腺病毒Ad-C-MMP8治疗; 阴性对照组, 用腺病毒Ad-CH-RFP2治疗; 模型对照组, 未做任何治疗, 每组8只. 停药1 wk, 治疗组A、B, 阴性对照组分别尾静脉注射1.5×1011病毒/kg体质量. 治疗2 wk, 4 wk后分两批处死动物. 0.3%戊巴比妥(40 mg/kg)腹腔注射麻醉, 腹主动脉取血, 分离血清做肝功能、肝纤4项等检查, 分离肝组织部分40 g/L的甲醛固定, 进行组织学检查, 其余-80 ℃保存, 供羟脯氨酸(hydroxyproline, Hyp)检查备用[9].
1.2.5 大鼠肝功能: 由我院检验科全自动生化分析仪检测, 透明质酸(hyaluronic acid, HA)和层黏连蛋白(laminin, LN)由我院核医学科放射免疫学检测.
统计学处理 使用SPSS19.0统计软件处理实验数据, 有关资料的指标采用mean±SD表示, 两样本均数的比较采用t检验, P<0.05为差异具有统计学意义.
0.03%TAA诱导饲喂5 wk, 然后0.04%的TAA诱导喂饲5 wk, 大约16 wk后制成稳定的肝硬化模型. 造模期间, 正常大鼠毛发光泽, 活动正常, 而进行造模的大鼠则普遍出现皮毛蓬乱无光泽, 精神萎靡, 活动减少, 进食量和体质量均低于正常组, 并出现死亡现象. 此方法建立的肝硬化模型持续时间长, 在停药2 mo后肝硬化程度几乎没有减轻, 我们的实验中模型组一共有8只动物, 每只动物都得到的相同的结果, 与Lukivskaya等[10]、Gu等[11]报道一致, 以上研究结果显示TAA诱导的肝硬化模型比较稳定、持久, 可作为一种与临床患者肝硬化相似的模型进行治疗、研究.
大体观察: 正常肝脏颜色鲜红, 有光泽, 质软, 边缘锐; 模型组肝组织颜色灰暗, 无光泽, 表面粗糙, 可见大片状的岛屿状结节形成, 质地硬, 边缘钝, 其中一半以上(6/8)的大鼠伴有腹水形成; 阴性对照组注射Ad-CH-RFP2腺病毒治疗后大鼠肝脏颜色深红色, 无光泽, 大片状的岛屿状结节, 质地硬, 边缘钝, 其中4只大鼠伴有腹水(4/8); Ad-CH-tMMP8和Ad-C-MMP8治疗2 wk后肝脏颜色暗红, 同样可见片状岛屿状结节, 但较模型组和阴性对照组明显减少, 质地变软, 边缘钝, 其中一只大鼠(Ad-CH-tMMP8组1/8)有少量腹水形成.
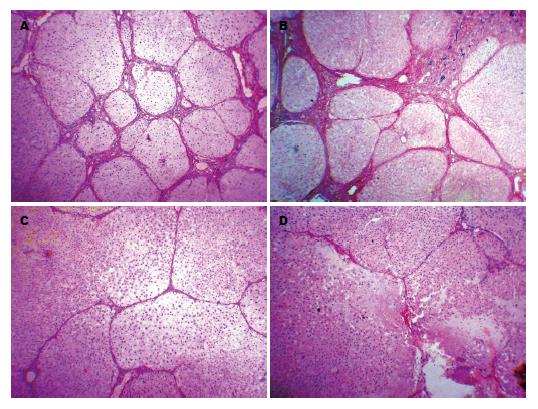
HE染色: 正常组肝脏肝小叶结构完整, 肝板以中央静脉为中心, 呈条索状向四周放射样排列, 无肝细胞萎缩、变性、坏死、炎症细胞浸润及纤维组织增生; 模型组肝小叶结构破坏, 可见广泛肝细胞变性、坏死、伴有较多的炎症细胞浸润及纤维结蒂组织增生, 中央静脉塌陷或扭曲变形, 可见粗大的胶原纤维条索分割肝小叶形成假小叶; 阴性对照Ad-CH-RFP2组与模型组相比无明显变化, 肝纤维化程度未见减轻; Ad-CH-tMMP8和Ad-C-MMP8治疗组与模型组、阴性对照组相比, 肝小叶结构破坏明显减轻, 胶原纤维条索较细, 肝细胞水肿好转、变形情况明显改善, 炎症细胞浸润减少, 汇管区结缔组织增生好转, 肝纤维化程度明显减轻(P<0.05), 但两治疗组之间比较无统计学意义(P>0.05)(图1).
肝纤维化的半定量通过天狼猩红染色分析: 胶原纤维染成红, 红色区域的面积代表着肝脏内胶原的沉积, Ad-CH-tMMP8和Ad-C-MMP8治疗组与模型组、阴性对照组相比, 肝小叶结构破坏减轻, 肝脏胶原纤维增生亦明显减轻, 纤维条索变细变窄, 肝小叶结构恢复, 汇管区和中央静脉周围胶原显著减少(P<0.05), 但两治疗组之间比较无统计学意义(P>0.05)(图2).
肝脏内羟脯氨酸含量的定量分析: 模型组肝组织Hyp含量较正常组升高, 达正常值得约9倍; Ad-CH-tMMP8和Ad-C-MMP8治疗组Hyp含量与模型组相比有所下降(17.04 µg/g±0.60 µg/g、17.62 µg/g±1.31 µg/g vs 28.97 µg/g±2.36 µg/g, P<0.05), 而Ad-CH-RFP2组较模型组又有所升高(30.89 µg/g±3.67 µg/g)(图3). Hyp含量测定在判断肝纤维化程度方面没有HE染色、天狼猩红染色明显, 究其原因可能是肝脏内降解和没有降解的胶原都可被分解成为Hyp而被测出, 此结果与Iimuro等[12]、Siller-López等[6]报道一致.
肝纤维化是各种慢性肝病的共同病理基础, 是肝硬化的必经阶段, 其实质是细胞外基质(extracellular matrix ECM)成份的改变和过度沉积[13]. 肝纤维化是一个慢性、渐进性的过程, 持续发展可导致肝小叶结构改建, 假小叶形成, 导致肝硬化发生. 肝硬化被认为是一种不可逆转的肝脏疾病, 唯一有效的治疗措施是肝移植, 但因费用昂贵、捐赠器官数量有限等限制其广泛应用. 有文献报道[14-20]几种途径已经成功预防、阻止动物模型肝纤维化的进展, 然而, 在未发展至肝硬化之前, 肝纤维化临床症状不典型, 往往被忽视. 因此, 如何逆转肝硬化已经成为一个关键性问题.
肝纤维化时, ECM的质和量均发生显著变化, 以胶原为主的ECM成份可较正常肝增加3-8倍, ECM的各型胶原之间、糖蛋白之间及蛋白聚糖之间的比值异常, 就胶原而言, Ⅲ型胶原在纤维化早期即明显增多, 但随纤维化进展, 可渐被Ⅰ型胶原替代, 至肝硬化时Ⅰ型胶原可占胶原量的60%-70%(正常肝两者各占40%-45%)[21]. 几种机制调控着ECM的合成与降解, 然而, 基质金属蛋白酶家族在ECM的降解过程中起主要作用, 目前的研究表明, ECM在降解开始起主要作用的为基质金属蛋白酶家族中的间质胶原酶类. Iredale[5]发表的一篇评论性文章"划时代的进展? MMP-8与肝纤维化基因治疗"中, 对MMP-8治疗肝硬化给与了极高的评价, 认为这项研究将很快从实验室走进临床!
在肝硬化动物模型的制作过程中, 0.03%TAA诱导饲喂5 wk, 然后0.04%的TAA诱导喂饲5 wk, 大约16 wk后制成稳定的肝硬化模型. TAA诱导慢性肝损伤的机制是影响蛋白合成及肝细胞中酶的代谢. 在造模结束2 mo后, 病理结果显示模型组大鼠肝脏假小叶仍明显, 较2 mo前无明显减轻(图3), 可见此方法诱导的肝硬化模型在停药2 mo后几乎没有自发性逆转, 持续时间长, 其诱导肝硬化的机制与人类肝硬化形成的机制类似, 可作为一种与临床患者肝硬化相似的模型进行治疗、研究.
用腺病毒作为载体治疗肝硬化的大鼠, 其毒性大小成为我们考虑的问题[22], 包括对机体产生的免疫反应, 肝硬化大鼠能耐受多大剂量腺病毒的毒性? 最近的资料报道[23-26], 在使用腺病毒载体作为基因治疗的实验中, 病毒剂量达到1012病毒颗粒/公斤大鼠体质量(VP/kg)对肝硬化大鼠毒性较高, 而肝硬化大鼠能够耐受1011 VP/kg的剂量, 我们在实验中选择了单一剂量(3×1011 VP/kg)进行了大鼠肝硬化的治疗, 在治疗1 mo期间内未发现由腺病毒导致的大鼠死亡, 因此, 腺病毒载体作为基因载体运用于大鼠基因治疗将有可能是有效和安全的. 动物实验结果显示Ad-C-MMP8和Ad-CH-tMMP8两治疗组在体内都能够有效的降解胶原, 表现为肝细胞变形、水肿好转, 胶原纤维条索较细, 肝纤维化程度明显减轻, 同时伴有肝脏羟脯氨酸含量的下降和肝细胞再生.
腺病毒载体是继逆转录病毒载体后发展起来且发展较快的又一病毒载体. 其主要特点是易通过基因操作缺失关键的调节元件, 可携带外源基因的量大(约7.5 kb)、不整合进入宿主DNA(无遗传毒性)、可感染处于任何增值周期的细胞、宿主细胞范围广泛, 感染效率高. 而且他容易制取、纯化、浓缩获得高滴度病毒液, 但大剂量应用时有细胞毒性, 也具有免疫原性, 重复应用因中和抗体产生而失去疗效, 再加上肝硬化患者大多具有肝功能异常, 如果再大剂量应用具有细胞毒性的腺病毒, 则可能加重肝功能损伤, 有可能向重症肝炎发展, 重复应用时疗效减低, 但肝损伤加重. 因此, 大剂量重组腺病毒治疗肝硬化具有一定的危险性. 基于以上腺病毒的缺点, 我们在腺病毒载体的基础上导入了HBV载体[27,28], HBV载体是将HBV进行了改造, 即删除了所有HBV蛋白的表达, 强化了表达外源基因的启动子, 能够表达外源基因. 由于HBV载体不再表达任何结构蛋白, 根据目前对HBV致病机制的认识, 除非所表达的目的基因具有毒性, 否则他将不具有致病性. 把HBV改造成载体用于HBV相关的肝病基因治疗, 与其他病毒载体相比, 具有明显的优势, 他可利用乙型肝炎患者这个天然廉价的包装细胞, 携带的目的基因在体内将有嗜肝导向性及放大效应, 有可能从根本上克服上述病毒载体的缺陷.
我们实验中发现胶原酶Ⅱ在减轻肝纤维化的同时没有出现明显的炎症反应, 表明胶原酶Ⅱ体内的大量表达不会促使严重的肝脏损害. 在评价肝纤维化程度减轻的指标中, 羟脯氨酸的测定结果在反应肝纤维化减轻的程度没有病理学观察到的那样显著, 人们先前研究中同样报道形态测定分析和定量羟脯氨酸含量分析之间存在着差异[29-31], 一个可能的原因是由于实验时间比较短, 一些降解的胶原片段沉积在肝脏内没有被吸收, 其仍然能够被作为羟脯氨酸测出.
另外, 我们同时检测到治疗组血清ALT短暂的升高, 血清ALT的升高在2 wk时比较明显, 到治疗4 wk结束时血清ALT水平恢复正常. 因此, 腺病毒的过度表达也导致了肝细胞轻度的破坏, 表现为血清ALT水平短暂的升高, 其具体机制尚未探讨.
我国是一个乙型肝炎大国, 肝硬化发生率很高. 但缺乏临床适用的有效的软化肝脏的药物, 目前一般认为肝硬化是不可逆的, 临床医生几乎不敢想象硬化的肝脏尚能变的松软. 胶原酶Ⅱ是中性粒细胞分泌的一种胶原酶, 能够特异的降解Ⅰ型胶原, 将外原基因胶原酶Ⅱ通过载体导入肝细胞是抗肝硬化治疗的关键.
高润平, 教授, 吉林大学第一医院肝胆胰内科
化学药物(如秋水仙碱)毒性很大, 难以临床应用, 众多的中成药只有很微弱的抗肝纤维化作用, 临床疗效很不满意. 因此, 广大学者已经把治疗肝纤维化的目光转移到基因治疗方面, 目前常用的方法是通过缺陷病毒(如腺病毒)转入特定的细胞因子和酶(如肝细胞生长因子、转化生长因子β1受体、γ干扰素、白介素10、金属蛋白酶)的基因, 通过靶细胞表达这些因子作用于受损的肝脏, 抑制或阻断肝纤维化过程中的某个环节, 从而达到治疗或治愈肝纤维化的目的.
Siller-Lopez等应用经过基因修饰MMP-8转染了HepG2, 发现细胞培育上清液具有降解I型胶原的作用, 并且这种作用能够被EDTA, 1,10-邻二氮杂菲及TIMP-1等抑制, 说明其能够分泌到细胞外发挥酶催化反应. 随后应用腺病毒表达MMP-8一次性感染肝硬化大鼠, 发现其使肝纤维化减少45%, 并使MMP-2, MMP-3, MMP-9及肝细胞生长因子的表达上调, 星型细胞激活剂TGF-β的表达下调, 对腹水、肝功能、及曲张的胃静脉均有明显的改善作用.
本研究将HBV改造成载体用于HBV相关的肝病基因治疗, 与其他病毒载体相比, 具有明显的优势, 他可利用乙型肝炎患者这个天然廉价的包装细胞, 携带的目的基因在体内将有嗜肝导向性及放大效应, 有可能从根本上克服其他病毒载体的缺陷. 利用腺病毒载体转导HBV载体, 把二者结合到一起, 克服了各自的缺点, 实现制备方便、具有靶向性、放大效应、低细胞毒性、无免疫源性等. 这一方法学的创新也将对本领域的研究产生一定的影响, 或许有助于突破"重组HBV难以大量制备"这一HBV载体研究的瓶颈.
应用重组腺病毒携带HBV载体表达胶原酶Ⅱ, 克服HBV载体制备困难及感染效率低的缺陷, 发挥HBV载体的优势, 以野生型HBV提供包装, 形成重组HBV颗粒, 将具有放大效应, 一次性小剂量注射重组腺病毒有望实现一次性注射维持持久疗效, 在体内形成的重组HBV具有嗜肝导向性, 无细胞毒性、无免疫源性等, 这一创新, 有可能把胶原酶Ⅱ基因治疗带入临床应用.
本研究应用能够表达胶原酶Ⅱ的腺病毒-乙型肝炎病毒嵌合载体对硫代乙酰胺诱导大鼠肝硬化模型进行了治疗研究. 课题新颖, 设计合理, 值得进一步研究和探索.
编辑 郭鹏 电编 鲁亚静
| 1. | Ellis EL, Mann DA. Clinical evidence for the regression of liver fibrosis. J Hepatol. 2012;56:1171-1180. [PubMed] [DOI] |
| 2. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 3. | Eng FJ, Friedman SL. Fibrogenesis I. New insights into hepatic stellate cell activation: the simple becomes complex. Am J Physiol Gastrointest Liver Physiol. 2000;279:G7-G11. [PubMed] |
| 4. | Page-McCaw A, Ewald AJ, Werb Z. Matrix metalloproteinases and the regulation of tissue remodelling. Nat Rev Mol Cell Biol. 2007;8:221-233. [PubMed] [DOI] |
| 5. | Iredale JP. A cut above the rest? MMP-8 and liver fibrosis gene therapy. Gastroenterology. 2004;126:1199-1201. [PubMed] [DOI] |
| 6. | Siller-López F, Sandoval A, Salgado S, Salazar A, Bueno M, Garcia J, Vera J, Gálvez J, Hernández I, Ramos M. Treatment with human metalloproteinase-8 gene delivery ameliorates experimental rat liver cirrhosis. Gastroenterology. 2004;126:1122-1133; discussion 949. [PubMed] [DOI] |
| 7. | Protzer U, Nassal M, Chiang PW, Kirschfink M, Schaller H. Interferon gene transfer by a hepatitis B virus vector efficiently suppresses wild-type virus infection. Proc Natl Acad Sci U S A. 1999;96:10818-10823. [PubMed] [DOI] |
| 9. | Rojkind M, González E. An improved method for determining specific radioactivities of proline-14C and hydroxyproline-14C in collagen and in noncollagenous proteins. Anal Biochem. 1974;57:1-7. [PubMed] [DOI] |
| 10. | Lukivskaya O, Patsenker E, Lis R, Buko VU. Inhibition of inducible nitric oxide synthase activity prevents liver recovery in rat thioacetamide-induced fibrosis reversal. Eur J Clin Invest. 2008;38:317-325. [PubMed] [DOI] |
| 11. | Gu K, Zhao JD, Ren ZG, Ma NY, Lai ST, Wang J, Liu J, Jiang GL. A natural process of cirrhosis resolution and deceleration of liver regeneration after thioacetamide withdrawal in a rat model. Mol Biol Rep. 2011;38:1687-1696. [PubMed] [DOI] |
| 12. | Iimuro Y, Nishio T, Morimoto T, Nitta T, Stefanovic B, Choi SK, Brenner DA, Yamaoka Y. Delivery of matrix metalloproteinase-1 attenuates established liver fibrosis in the rat. Gastroenterology. 2003;124:445-458. [PubMed] [DOI] |
| 13. | Moore CS, Crocker SJ. An alternate perspective on the roles of TIMPs and MMPs in pathology. Am J Pathol. 2012;180:12-16. [PubMed] [DOI] |
| 14. | Ueno H, Sakamoto T, Nakamura T, Qi Z, Astuchi N, Takeshita A, Shimizu K, Ohashi H. A soluble transforming growth factor beta receptor expressed in muscle prevents liver fibrogenesis and dysfunction in rats. Hum Gene Ther. 2000;11:33-42. [PubMed] |
| 15. | Zhu J, Wu J, Frizell E, Liu SL, Bashey R, Rubin R, Norton P, Zern MA. Rapamycin inhibits hepatic stellate cell proliferation in vitro and limits fibrogenesis in an in vivo model of liver fibrosis. Gastroenterology. 1999;117:1198-1204. [PubMed] |
| 16. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] [DOI] |
| 17. | Masunaga H, Fujise N, Shiota A, Ogawa H, Sato Y, Imai E, Yasuda H, Higashio K. Preventive effects of the deleted form of hepatocyte growth factor against various liver injuries. Eur J Pharmacol. 1998;342:267-279. [PubMed] [DOI] |
| 18. | Murata T, Arii S, Nakamura T, Mori A, Kaido T, Furuyama H, Furumoto K, Nakao T, Isobe N, Imamura M. Inhibitory effect of Y-27632, a ROCK inhibitor, on progression of rat liver fibrosis in association with inactivation of hepatic stellate cells. J Hepatol. 2001;35:474-481. [PubMed] [DOI] |
| 19. | Tada S, Iwamoto H, Nakamuta M, Sugimoto R, Enjoji M, Nakashima Y, Nawata H. A selective ROCK inhibitor, Y27632, prevents dimethylnitrosamine-induced hepatic fibrosis in rats. J Hepatol. 2001;34:529-536. [PubMed] [DOI] |
| 20. | Yasuda M, Shimizu I, Shiba M, Ito S. Suppressive effects of estradiol on dimethylnitrosamine-induced fibrosis of the liver in rats. Hepatology. 1999;29:719-727. [PubMed] [DOI] |
| 21. | Neubauer K, Saile B, Ramadori G. Liver fibrosis and altered matrix synthesis. Can J Gastroenterol. 2001;15:187-193. [PubMed] |
| 22. | Descamps D, Benihoud K. Two key challenges for effective adenovirus-mediated liver gene therapy: innate immune responses and hepatocyte-specific transduction. Curr Gene Ther. 2009;9:115-127. [PubMed] [DOI] |
| 23. | Salgado S, Garcia J, Vera J, Siller F, Bueno M, Miranda A, Segura A, Grijalva G, Segura J, Orozco H. Liver cirrhosis is reverted by urokinase-type plasminogen activator gene therapy. Mol Ther. 2000;2:545-551. [PubMed] [DOI] |
| 24. | Hecht N, Pappo O, Shouval D, Rose-John S, Galun E, Axelrod JH. Hyper-IL-6 gene therapy reverses fulminant hepatic failure. Mol Ther. 2001;3:683-687. [PubMed] [DOI] |
| 25. | Nakatani T, Kuriyama S, Tominaga K, Tsujimoto T, Mitoro A, Yamazaki M, Tsujinoue H, Yoshiji H, Nagao S, Fukui H. Assessment of efficiency and safety of adenovirus mediated gene transfer into normal and damaged murine livers. Gut. 2000;47:563-570. [PubMed] [DOI] |
| 26. | Garcia-Bañuelos J, Siller-Lopez F, Miranda A, Aguilar LK, Aguilar-Cordova E, Armendariz-Borunda J. Cirrhotic rat livers with extensive fibrosis can be safely transduced with clinical-grade adenoviral vectors. Evidence of cirrhosis reversion. Gene Ther. 2002;9:127-134. [PubMed] [DOI] |
| 27. | Untergasser A, Protzer U. Hepatitis B virus-based vectors allow the elimination of viral gene expression and the insertion of foreign promoters. Hum Gene Ther. 2004;15:203-210. [PubMed] [DOI] |
| 28. | Ueki T, Kaneda Y, Tsutsui H, Nakanishi K, Sawa Y, Morishita R, Matsumoto K, Nakamura T, Takahashi H, Okamoto E. Hepatocyte growth factor gene therapy of liver cirrhosis in rats. Nat Med. 1999;5:226-230. [PubMed] |
| 29. | 孙 殿兴, 胡 大荣, 邬 光惠, 胡 学玲, 李 娟, 范 公忍. 重组逆转录病毒载体携带乙型肝炎病毒载体的构建与表达. 中华实验与临床病毒学杂志. 2002;12:162-165. |
| 30. | Bickel M, Baringhaus KH, Gerl M, Günzler V, Kanta J, Schmidts L, Stapf M, Tschank G, Weidmann K, Werner U. Selective inhibition of hepatic collagen accumulation in experimental liver fibrosis in rats by a new prolyl 4-hydroxylase inhibitor. Hepatology. 1998;28:404-411. [PubMed] [DOI] |
| 31. | Sakaida I, Hironaka K, Uchida K, Suzuki C, Kayano K, Okita K. Fibrosis accelerates the development of enzyme-altered lesions in the rat liver. Hepatology. 1998;28:1247-1252. [PubMed] [DOI] |