修回日期: 2014-03-19
接受日期: 2014-04-03
在线出版日期: 2014-04-28
目的: 探讨三维适形放疗联合盆腔热疗的疗效, 安全性, 以及对患者免疫功能的影响.
方法: 46例复发直肠癌患者按收治的时间顺序交替分为两组. A组三维适形放疗联合盆腔热疗组, B组为单纯三维适形放射治疗组, 比较两组的疗效、不良反应和免疫功能.
结果: A组中位局部无进展生存期较B组显著延长(16.3 mo vs 14.1 mo, P<0.05); 对患者外周血T淋巴细胞亚群分析表明: A组治疗后CD3+、CD4+水平以及CD4+/CD8+比值较治疗前显著增加(CD3+: 65.40%±6.18% vs 56.90%±6.16%; CD4+: 32.70%±6.37% vs 28.30%±6.33%; CD4+/CD8+比值: 1.24±0.23 vs 0.96±0.28, 均P<0.05). B组上述指标变化无统计学差异; 不良反应主要为直肠急性放射性反应, 均可耐受; 两组患者局部症状缓解率、1年生存率、2年生存率比较无显著差异.
结论: 三维适形放疗联合盆腔热疗与单纯三维适形放射治疗相比可延长患者中位局部无进展生存期, 耐受性好, 可明显提高患者免疫功能.
核心提示: 三维适形放疗联合盆腔热疗, 耐受性好, 可明显提高复发直肠癌患者的免疫功能, 延长中位局部无进展生存期.
引文著录: 吕晓涓, 卢驰, 应环珍, 董震. 联合热疗提高复发直肠癌患者免疫功能和放疗疗效. 世界华人消化杂志 2014; 22(12): 1768-1772
Revised: March 19, 2014
Accepted: April 3, 2014
Published online: April 28, 2014
AIM: To investigate the efficacy and safety of three-dimensional conformal radiotherapy combined with pelvic hyperthermia and their impact on the immune function in patients with recurrent colorectal cancer.
METHODS: Forty-six patients with recurrent colorectal cancer were divided into two groups in a chronological order. Patients in group A received three-dimensional conformal radiotherapy combined with pelvic hyperthermia, while patients in group B received three-dimensional conformal radiation therapy only. The efficacy, adverse reactions and the immune function were compared between the two groups.
RESULTS: The median local progression-free survival in group A was significantly longer than that in group B (16.3 mo vs 14.1 mo, P < 0.05). Compared with pre-treatment values, the percentages of CD3+ and CD4+ lymphocytes and CD4+/CD8+ ratio in group A increased significantly (CD3+: 65.40% ± 6.18% vs 56.90% ± 6.16%; CD4+: 32.70% ± 6.37% vs 28.30% ± 6.33%; CD4+/CD8+ ratio: 1.24 ± 0.23 vs 0.96 ± 0.28, P < 0.05 for all), while there were no significant changes in these indicators in group B. In both groups, adverse reactions, mainly acute rectal radiation reactions, could be tolerated. There were no significant differences in partial remission rate, one- and two-year survival rates between the two groups.
CONCLUSION: Compared with three-dimensional conformal radiotherapy alone, three-dimensional conformal radiotherapy combined with pelvic hyperthermia can prolong median local progression-free survival and improve immune function in patients with recurrent colorectal cancer, and is well tolerated.
- Citation: Lv XJ, Lu C, Ying HZ, Dong Z. Hyperthermia improves immune function and radiotherapy efficacy in patients with recurrent colorectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(12): 1768-1772
- URL: https://www.wjgnet.com/1009-3079/full/v22/i12/1768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i12.1768
直肠癌是常见恶性肿瘤, 在欧美国家直肠癌的发病率很高, 为恶性肿瘤死亡率的第3位, 在我国的发病率有上升趋势. 直肠癌的治疗主要根据临床分期的多学科综合治疗, 治疗失败原因主要是局部未控或复发, 对于复发直肠癌的再治疗成为临床治疗的难点和挑战. 许多临床研究表明放疗和热疗联合在食道癌、肝癌、肺癌、鼻咽癌等的抗癌治疗中有协同作用[1,2]. 周华娟[3]也对调强放疗联合热疗治疗食管癌进行研究, 结果显示与单纯调强放疗相比, 有效率分别为89.2%和67.8%. Franckena等[4]报道放疗和热疗联合治疗宫颈癌取得77%的完全缓解率. 但局部热疗在复发直肠癌的研究, 国内外文献报道尚少, 把放热疗联合治疗直肠癌的报道更少. 本课题收集了2009-2012年间本院接收的直肠癌术后复发病例, 比较三维适形放疗联合盆腔热疗与单纯三维适形放射治疗的疗效、安全性以及对患者免疫功能的影响.
2009-01/2012-01本院收治的46例经病理组织学确诊, 术后盆腔复发的直肠癌患者, 其中男28例, 女18例, 年龄30-74岁, 中位年龄52岁. 既往均未行化放疗. 有可测量病灶, PS评分0-1分, 预期生存期超过3 mo, 血液学检查及心电图结果基本正常. 按照知情同意原则患者按收治的时间顺序交替分为三维适形放疗联合盆腔热疗组(A组)和单纯三维适形放射治疗组(B组). 两组患者年龄, 性别, 病理类型, 一般状况均具有可比性(表1). 肿瘤射频热疗机, 深圳先科医疗设备有限公司生产, 型号: SR1000. 流式细胞仪, Becton Dickinson公司, 型号: FACScan. 三标荧光抗体CD4+ FITC/CD8+ R-PE/CD3+ Cy-Q购自IQ Products公司.
| 单纯三维适形放射治疗组 | 三维适形放疗联合盆腔热疗组 | |
| 中位年龄(岁) | 50 | 54 |
| 性别(男/女) | 15/8 | 13/10 |
| PS | ||
| 0分 | 10 | 9 |
| 1分 | 13 | 14 |
| 腺癌(不包括黏液腺癌) | 16 | 15 |
| 黏液腺癌 | 6 | 8 |
| 非腺癌 | 1 | 0 |
1.2.1 治疗: 三维适形放疗联合盆腔热疗组放射治疗采用直线加速器6MV-X线, 通过CT 0.5 cm薄层扫描, 根据ICRU62定义来勾画靶区, 包括复发病灶及肿大淋巴结, 盆腔放疗剂量50 Gy, 2 Gy/次, 25次; 肿瘤区剂量至66-70 Gy, 2 Gy/次, 共33-35次. 盆腔热疗频率40.68 MHz, 极板直径15、20、25 cm, 根据病灶部位、大小及深度采用不同极板治疗, 极板和皮肤之间置特制水袋耦合降温. 将测温探头分别置于直肠和阴道内, 根据患者一般状况调节功率, 使肿瘤达到所需温度(41 ℃-43 ℃), 每次热疗持续时间60 min, 每次均于盆腔热疗20 min后, 再实施放射治疗, 频次为2次/wk, 总计12次. 单纯放射治疗组盆腔放疗剂量50 Gy, 2 Gy/次, 25次; 肿瘤区剂量至66-70 Gy, 2 Gy/次, 共33-35次.
1.2.2 外周血T淋巴细胞亚群检测: 所有患者分别于治疗前1 d及疗程最后1 d抽取清晨空腹外周静脉血2 mL EDTA抗凝. 采用直接免疫荧光法, 加入CD4+/CD8+/CD3+三标荧光抗体25 μL, 流式细胞术检测并用Ce11quest软件进行分析, 获得T淋巴细胞亚群的百分数.
1.2.3 复查和随访: 治疗结束后前3 mo每月复查1次, 之后每3 mo复查1次, 随访至2013-07.
统计学处理 使用SPSS13.0统计软件, 生存率分析采用方法Log-rank检验组间差异. P<0.05为差异统计学意义.
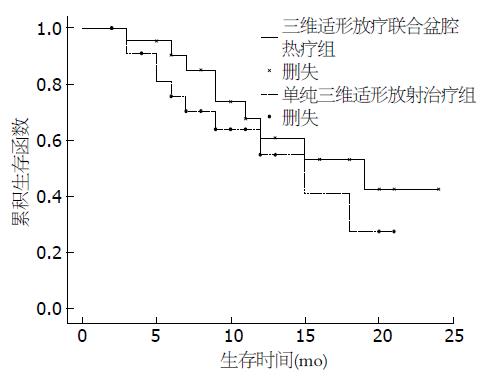
三维适形放疗联合盆腔热疗组治疗后局部症状缓解率为91.3%, 单纯放射治疗组局部症状缓解率为82.6%; 1年生存率三维适形放疗联合盆腔热疗组和单纯放射治疗组分别为73.9%和65.2%; 2年生存率三维适形放疗联合盆腔热疗组和单纯放射治疗组分别为60.9%和56.5%; 两组比较差异均无统计学意义(P>0.05). 中位局部无进展生存期(local progression-free survival, LPFS)三维适形放疗联合盆腔热疗组为16.3 mo, 单纯放射治疗组为14.1 mo, 两组比较差异有显著统计学意义(P<0.05)(表2, 图1).
不良反应主要为直肠急性放射性反应, 表现为排便次数增多或排便习惯改变, 腹泻、腹痛、黏液便、脓血便等情况. 三维适形放疗联合盆腔热疗组和单纯放射治疗组中43例患者出现直肠急性放射反应, 其中Ⅰ级26例, Ⅱ级14例, Ⅲ级3例, 予以对症支持治疗后均缓解. 三维适形放疗联合盆腔热疗组和单纯放射治疗组比较, 不良反应差异无统计学意义(P>0.05)(表3).
| 不良反应 | 三维适形放疗联合盆腔热疗组 | 单纯三维适形放射治疗组 |
| 排便次数增多(无需用药) | 60.9(14/23) | 52.2(12/23) |
| 腹泻、 腹痛(需药物) | 26.1(6/23) | 34.8(8/23) |
| 腹泻、需肠胃外营养; 重度黏液便、脓血便, 需卫生垫 | 4.3(1/23) | 8.7(2/23) |
两治疗组T淋巴细胞亚群指标(CD3+、CD4+、CD8+及CD4+/CD8+比值)治疗前的同质性t检验均显示两组的差异无统计学意义(P>0.05). 三维适形放疗联合盆腔热疗组治疗后与治疗前比较CD3+、CD4+水平以及CD4+/CD8+均增加, 差异均有显著统计学意义(P<0.05). 而单纯三维适形放射治疗组治疗后与治疗前比较CD3+、CD4+水平以及CD4+/CD8+差异无统计学意义(P>0.05)(表4).
热疗(hyperthermia)是通过加热使肿瘤组织的温度达到40 ℃-44 ℃, 引起肿瘤细胞生长受阻与死亡的一种治疗方式. 实验研究表明: 热疗可直接杀伤肿瘤细胞和诱导细胞凋亡, 更重要的是, 热疗抑制放射诱导的DNA损伤的修复, 抑制肿瘤血管生成, 降低乏氧细胞的比例, 使多数细胞停滞在S期和G2期, 提高细胞的放射敏感性[5]. Zolzer等[6]研究发现, 热疗联合放疗会延长人黑色素瘤细胞G2期的时间, 导致更多的人黑色素瘤细胞凋亡. 热疗对肿瘤的杀伤主要为肿瘤中央的细胞, 放射治疗对肿瘤的杀伤主要为肿瘤周边的细胞. 放疗可减少肿瘤细胞的热耐受性, 提高热疗效果. 合理的应用热疗和放射治疗, 可以克服放疗, 热疗之间的缺陷, 起到优势互补、协同增敏的作用. 明显增加常规治疗手段对肿瘤的局部控制率, 改善远期生存率, 具有其他治疗手段不可比拟的作用[7,8].
Juffermans等[9]回顾性研究显示热疗联合再次放射治疗不能切除或复发的直肠癌获得满意疗效. 87%患者能完成治疗计划, 不良反应最大2级. 72%患者获得理想的联合治疗效果, 中位无进展期为6 mo. 本研究应用三维适形放疗联合盆腔热疗与单纯放射治疗复发的直肠癌进行对比, 分析结果表明, 热疗在不增加放疗不良反应的基础上可有效地提高症状缓解率, 但两组比较差异无统计学意义; 热疗和放疗联合可增加中位LPFS两组比较差异有显著统计学意义(P<0.05). 这与Schildkopf[10]的研究是一致的.
热疗有助于解除恶性肿瘤患者的免疫抑制, 增强机体抗肿瘤免疫, 防止和抑制肿瘤的转移和复发[11,12]. 肿瘤患者自身存在免疫功能低下, 手术和常规化疗、放疗均不能纠正恶性肿瘤患者的免疫水平低下的状态, 加上恶性肿瘤对宿主免疫抑制, 从而使肿瘤逃避了机体的免疫监视, 促进了肿瘤的生长[13], 这也是临床上常规治疗后复发的原因之一. 热疗可改变肿瘤细胞膜脂质双分子层的流动性[14], 激活抗肿瘤的细胞免疫反应; 此外, 热疗可破坏、解除肿瘤细胞分泌的封闭因子, 巨噬细胞移动抑制因子等对免疫系统的抑制, 使机体恢复对肿瘤的免疫应答反应[15]; 且热疗可以促进肿瘤组织合成热休克蛋白, 刺激机体免疫系统, 增强抗肿瘤免疫功能, 以及引起非特异性炎症诱发免疫反应[16]. 本资料的研究结果表明, 放射治疗后CD3+、CD8+、CD4+、CD4+/CD8+与放疗前变化不明显(P>0.05), 这与李云峰等[17]研究一致; 而热放疗后CD3+、CD4+、CD4+/CD8+比值较治疗前明显升高(P<0.05). 我们的观察发现, 热放疗患者的细胞免疫得到改善, 在一定程度上逆转了患者免疫水平低下的状态, 进而延长患者的LPFS.
总之, 本研究认为, 三维适形放疗联合盆腔热疗与单纯三维适形放射治疗相比可延长患者中位局部无进展生存期, 耐受性好, 可明显提高患者免疫功能. 由于本研究病例数有限, 有待开展大规模的随机对照研究以进一步证实.
直肠癌是常见恶性肿瘤之一, 在我国发病率有逐年上升趋势. 直肠癌的三维适形放射治疗目前已成为热点. 局部热疗在膀胱癌, 恶性腹腔积液中应用较多, 而复发直肠癌的研究, 国内外文献报道尚少, 把两者联合治疗直肠癌的报道更少.
李革, 副教授, 延边大学附属医院
直肠癌的治疗失败原因主要是局部未控或复发, 对于复发直肠癌的再治疗成为临床治疗的难点和挑战. 本课题主要是研究三维适形放疗与盆腔热疗联合起来治疗复发直肠癌的疗效, 安全性, 以及对患者免疫功能的影响.
目前已有研究证实局部放热疗后CD3+、CD4+、CD4+/CD8+较放热疗前明显升高,主要集中于乳腺癌、胃癌、宫颈癌等, 而对于其在复发直肠癌的研究尚少.
把三维适形放疗与盆腔热疗联合起来治疗复发直肠癌患者, 取得很好的疗效, 改善了患者免疫功能, 耐受性好.
本文对复发的直肠癌应用放疗联合热疗治疗, 取得很好的疗效, 有一定的科学性和先进性, 结果对临床有意义, 特别是能提高患者的免疫力. 有一定的科学性和先进性, 有学术价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Shi JF, Canfell K, Lew JB, Qiao YL. The burden of cervical cancer in China: synthesis of the evidence. Int J Cancer. 2012;130:641-652. [PubMed] [DOI] |
| 2. | Franckena M, van der Zee J. Use of combined radiation and hyperthermia for gynecological cancer. Curr Opin Obstet Gynecol. 2010;22:9-14. [PubMed] [DOI] |
| 4. | Franckena M, Lutgens LC, Koper PC, Kleynen CE, van der Steen-Banasik EM, Jobsen JJ, Leer JW, Creutzberg CL, Dielwart MF, van Norden Y. Radiotherapy and hyperthermia for treatment of primary locally advanced cervix cancer: results in 378 patients. Int J Radiat Oncol Biol Phys. 2009;73:242-250. [PubMed] [DOI] |
| 5. | Wust P, Hildebrandt B, Sreenivasa G, Rau B, Gellermann J, Riess H, Felix R, Schlag PM. Hyperthermia in combined treatment of cancer. Lancet Oncol. 2002;3:487-497. [PubMed] [DOI] |
| 6. | Zölzer F, Streffer C. G2-phase delays after irradiation and/or heat treatment as assessed by two-parameter flow cytometry. Radiat Res. 2001;155:50-56. [PubMed] [DOI] |
| 7. | van der Zee J. Heating the patient: a promising approach? Ann Oncol. 2002;13:1173-1184. [PubMed] [DOI] |
| 8. | Vermaas M, Nuyttens JJ, Ferenschild FT, Verhoef C, Eggermont AM, de Wilt JH. Reirradiation, surgery and IORT for recurrent rectal cancer in previously irradiated patients. Radiother Oncol. 2008;87:357-360. [PubMed] [DOI] |
| 9. | Juffermans JH, Hanssens PE, van Putten WL, van Rhoon GC, van Der Zee J. Reirradiation and hyperthermia in rectal carcinoma: a retrospective study on palliative effect. Cancer. 2003;98:1759-1766. [PubMed] [DOI] |
| 10. | Schildkopf P, Frey B, Mantel F, Ott OJ, Weiss EM, Sieber R, Janko C, Sauer R, Fietkau R, Gaipl US. Application of hyperthermia in addition to ionizing irradiation fosters necrotic cell death and HMGB1 release of colorectal tumor cells. Biochem Biophys Res Commun. 2010;391:1014-1020. [PubMed] [DOI] |
| 11. | Mace TA, Zhong L, Kokolus KM, Repasky EA. Effector CD8+ T cell IFN-γ production and cytotoxicity are enhanced by mild hyperthermia. Int J Hyperthermia. 2012;28:9-18. [PubMed] [DOI] |
| 12. | Frey B, Weiss EM, Rubner Y, Wunderlich R, Ott OJ, Sauer R, Fietkau R, Gaipl US. Old and new facts about hyperthermia-induced modulations of the immune system. Int J Hyperthermia. 2012;28:528-542. [PubMed] [DOI] |
| 14. | Hildebrandt B, Wust P, Ahlers O, Dieing A, Sreenivasa G, Kerner T, Felix R, Riess H. The cellular and molecular basis of hyperthermia. Crit Rev Oncol Hematol. 2002;43:33-56. [PubMed] [DOI] |
| 16. | Ito A, Shinkai M, Honda H, Yoshikawa K, Saga S, Wakabayashi T, Yoshida J, Kobayashi T. Heat shock protein 70 expression induces antitumor immunity during intracellular hyperthermia using magnetite nanoparticles. Cancer Immunol Immunother. 2003;52:80-88. [PubMed] |