修回日期: 2014-03-15
接受日期: 2014-03-19
在线出版日期: 2014-04-28
目的: 观察高尔基体磷蛋白3(Golgi phospho-protein 3, GOLPH3)基因过表达后胃癌细胞增殖的情况.
方法: 构建GOLPH3基因过表达重组慢病毒颗粒pGC-FU-GOLPH3-EGFP, 用慢病毒法感染胃癌细胞株SGC-7901, 利用荧光显微镜(Axiovert200)观察感染后细胞内EGFP表达的情况, 利用流式细胞技术检测慢病毒的感染效率, 采用实时荧光定量PCR(quantitative real-time polymerase chain reaction)和蛋白质印迹(Western blot)技术分别在基因水平和蛋白水平检测GOLPH3在SGC-7901-GOLPH3组(感染pGC-FU-GOLPH3-EGFP质粒的SGC-7901)、SGC-7901-empty-vector组(感染pGC-FU-EGFP质粒的SGC-7901)和SGC-7901-blank组(未感染慢病毒的SGC-7901)的表达水平; 以四唑蓝比色法(MTT)检测GOLPH3基因过表达后胃癌细胞增殖的情况; Westernblot技术检测胃癌细胞SGC-7901稳转细胞株中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)的表达水平.
结果: 建立了慢病毒感染率接近100%的胃癌细胞株SGC-7901, 在体外能够长期稳定表达绿色荧光蛋白; SGC-7901-GOLPH3组GOLPH3 mRNA和蛋白表达水平明显高于SGC-7901-empty-vector组和SGC-7901-blank组(均P<0.05); MTT法结果显示胃癌细胞GOLPH3基因过表达后, 增殖能力明显增强, 与SGC-7901-empty-vector组和SGC-7901-blank组相比差别有统计学意义(均P<0.05); SGC-7901-GOLPH3组、SGC-7901-empty-vector组和SGC-7901-blank组中mTOR总蛋白的表达无明显变化, 而SGC-7901-GOLPH3组p-mTOR蛋白表达量较SGC-7901-empty-vector组和SGC-7901-blank组明显升高, 与两对照组相比, 上调GOLPH3能明显促进SGC-7901-GOLPH3组p-mTOR蛋白的表达(均P<0.05).
结论: GOLPH3基因可能是通过上调mTOR信号通路中mTOR蛋白磷酸化水平来促进胃癌细胞增殖.
核心提示: 本研究通过胃癌细胞株SGC-7901体外研究, 表明高尔基体磷蛋白3(Golgi phospho-protein 3)基因可能是通过上调哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路中mTOR蛋白磷酸化水平来促进胃癌细胞生长增殖.
引文著录: 农云翠, 赖铭裕, 苏婷. 高尔基体磷蛋白3基因过表达对胃癌细胞增殖的影响. 世界华人消化杂志 2014; 22(12): 1669-1675
Revised: March 15, 2014
Accepted: March 19, 2014
Published online: April 28, 2014
AIM: To observe the effect of GOLPH3 gene overexpression on the proliferation of gastric cancer cells.
METHODS: The lentivirus containing the GOLPH3 gene was infected into gastric cancer cells, fluorescence microscopy was used to detect the expression of EGFP, and flow cytometry was applied to verify the infection efficiency. GOLPH3 overexpression was verified by quantitative real-time PCR (at the mRNA level) and Western blot (at the protein level). The expression of mTOR and p-mTOR proteins was detected by Western blot, and cell proliferation was assessed by MTT assay.
RESULTS: Gastric cancer cells expressing high levels of EGFP were successfully obtained, with an infection rate of 100%. GOLPH3 expression was significantly up-regulated in SGC-7901 cells infected with the lentivirus containing the GOLPH3 gene compared with SGC-7901 cells transduced with the empty vector or non-infected SGC-7901 cells (P < 0.05 for both). MTT assay showed that up-regulated GOLPH3 could significantly enhance the proliferation of gastric cancer cells (P < 0.05). Although the mTOR protein expression did not significantly differ between different groups of cells, but p-mTOR protein expression was enhanced in SGC-7901 cells infected with the lentivirus containing the GOLPH3 gene compared with control cells (P < 0.05), suggesting that up-regulated GOLPH3 could promote the protein expression of p-mTOR in SGC-7901 cells.
CONCLUSION: GOLPH3 gene overexpression could promote the proliferation of gastric cancer cells by up-regulating the expression of p-mTOR in SGC-7901 cells.
- Citation: Nong YC, Lai MY, Su T. GOLPH3 gene overexpression promotes proliferation of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(12): 1669-1675
- URL: https://www.wjgnet.com/1009-3079/full/v22/i12/1669.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i12.1669
胃癌是人类常见的恶性肿瘤, 是全世界第2个最常见的肿瘤相关死亡原因[1-3]. 尽管近年来胃癌发病机制的研究取得了一定的进展, 但大多数患者确诊时已处于晚期并出现远处转移, 失去了手术治疗的机会, 导致胃癌病死率及复发率逐年升高. 高尔基体磷蛋白3(Golgi phosphoprotein 3, GOLPH3)是近年来才发现的一个可能致癌基因. Scott等[4]对多种实体肿瘤进行分析, 发现在肺癌、乳腺癌、卵巢癌、前列腺癌等多种恶性肿瘤中存在GOLPH3过量表达. Hu等[5]采用实时荧光定量PCR(quantitative real-time polymerase chain reaction, qPCR)和免疫组织化学法分别对40例胃癌组织标本进行检测, 发现胃癌组织中存在GOLPH3基因过表达, 认为GOLPH3在胃癌发生发展中起着重要作用, 但其机制尚不清楚. 为探讨GOLPH3基因在胃癌细胞中的生物学作用, 本实验用含GOLPH3过表达的重组慢病毒颗粒感染胃癌细胞, 观察GOLPH3过表达后胃癌细胞增殖的情况, 为阐明胃癌发病机制及临床治疗应用奠定理论基础.
人胃癌细胞株SGC-7901(中南大学湘雅细胞库); RPMI 1640培养基(HyClone公司); 胎牛血清(杭州四季青公司); 含GOLPH3基因过表达的重组慢病毒颗粒(上海吉凯基因化学技术有限公司构建); 兔抗人GOLPH3多克隆抗体ab91492(Abcam公司); 兔抗人哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)单克隆抗体、兔抗人p-mTOR单克隆抗体(CST公司); β-actin抗体KC-5A08(康成生物有限公司); 辣根过氧化物酶标记山羊抗兔二抗IgG(北京金桥公司); TRIzol总RNA提取试剂(Invitrogen公司); 逆转录试剂盒DRR047A(TaKaRa公司); 实时荧光定量PCR试剂(TaKaRa公司); GOLPH3和β-actin内参基因引物合成(宝生物工程公司); MTT(Solarbio公司).
1.2.1 GOLPH3基因过表达重组慢病毒颗粒的构建和鉴定: 根据NCBI GenBank上登录的人类GOLPH3基因mRNA序列资料(登录号: NM-022130), 由上海吉凯基因化学技术有限公司合成设计, 并进行测序鉴定. 构建的GOLPH3基因过表达重组慢病毒颗粒命名pGC-FU-GOLPH3-EGFP.
1.2.2 细胞培养及慢病毒颗粒稳定感染: 胃癌细胞用含10%胎牛血清的1640培养基, 在37 ℃、5%CO2培养条件下进行培养. 选用对数生长期的人胃癌细胞SGC-7901按4×104个/孔密度接种于6孔板, 培养至细胞密度达50%左右, 将细胞分为3组: SGC-7901-blank组(只含10%血清的培养基)、SGC-7901-empty-vector组(含空载体慢病毒颗粒5.0×108 TU/mL)、SGC-7901-GOLPH3组(含GOLPH3基因过表达重组慢病毒颗粒2.0×108 TU/mL), 然后按照慢病毒使用说明书进行感染, 感染24 h后常规换液.
1.2.3 流式细胞仪检测慢病毒感染率: 以SGC-7901-blank组细胞作为阴性对照, 慢病毒感染96 h后取各组细胞, 用0.25%胰酶消化细胞, 离心, 弃掉上清液, 用冷PBS洗涤2次(2000 r/min, 5 min), 最后用冷PBS吹打均匀至单细胞悬液, 细胞计数, 过滤, 上机检测.
1.2.4 qPCR检测慢病毒感染后各组胃癌细胞GOLPH3 mRNA的表达: TRIzol法提取SGC-7901-blank组、SGC-7901-empty-vector组、SGC-7901-GOLPH3组总RNA, 测定其浓度及纯度(A260/280为1.8-2.0). GOLPH3上游引物: 5'-ATCTGGATTACGTGGCTGTATGTTA-3', 下游引物: 5'-CGTTTCTGGAGGCTGAGTTTC-3', 扩增产物大小为187 bp; β-actin上游引物: 5'-TGGCACCCAGCACAATGAA-3', 下游引物: 5'-CTAAGTCATAGTCCGCCTAGAAGCA-3', 扩增产物大小为186 bp. 逆转录反应采用20 µL反应体系, 条件为95 ℃ 2 min, 42 ℃ 15 min. 以逆转录产物为模板进行qPCR反应: 采用20 µL反应体系, 95 ℃ 30 s, 1个循环(预变性)95 ℃ 5 s、60 ℃ 30 s, 40个循环(PCR反应). 以β-actin作为内参, 采用2-∆∆CT法检测各组细胞GOLPH3 mRNA的相对表达量.
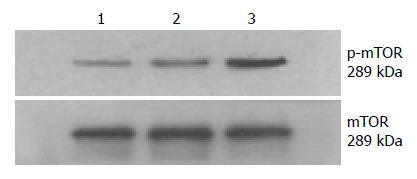
1.2.5 Western blot检测各组细胞中GOLPH3蛋白、mTOR蛋白、p-mTOR蛋白的表达: 用RIPA裂解液裂解细胞, 离心, 取上清液, 加入蛋白上样缓冲液混合(4:1), 沸水煮5 min, 即得蛋白质样品. 将等量样品加入凝胶孔道中进行电泳, 100 mA稳流状态下转膜, 将蛋白转至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF膜), 用5%BSA封闭液封闭, 将膜放入一抗(1:1000)稀释液中4 ℃孵育过夜, 次日置于二抗(1:5000)稀释液中室温摇床1 h, TBST洗膜(5次×5 min), 胶片曝光显影, 以β-actin为内参.
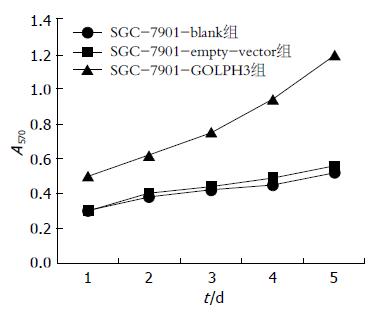
1.2.6 MTT法: 取SGC-7901-blank组、SGC-7901-empty-vector组、SGC-7901-GOLPH3组细胞分别接种于96孔板, 种板密度为每孔4×103个/100 µL, 置于培养箱中培养. 分别于1、2、3、4、5 d加20 µL MTT溶液(5 mg/mL), 继续孵育, 4 h后吸净上清液, 加150 µL的DMSO, 室温避光振荡10 min, 酶标仪检测570 nm波长处每孔细胞的吸光度值, 绘制各组细胞生长曲线.
统计学处理 采用SPSS16.0软件统计数据, 计量资料以mean±SD表示, 多组均数比较采用单因素方差分析, 多个样本均数间多重比较采用SNK检验, P<0.05为差异有统计学意义.
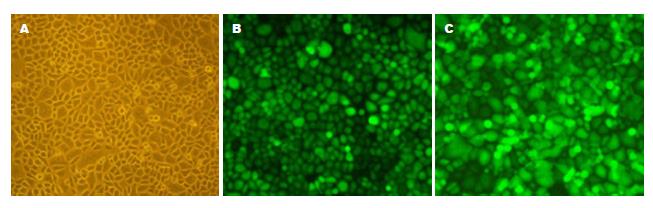
将重组慢病毒颗粒pGC-FU-EGFP、pGC-FU-GOLPH3-EGFP分别感染胃癌细胞SGC-7901, 采用荧光显微镜观察EGFP在SGC-7901-blank组、SGC-7901-empty-vector组、SGC-7901-GOLPH3组细胞中的表达(图1).
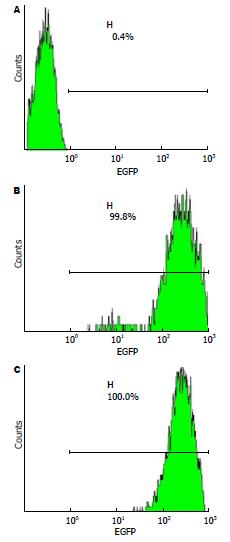
结果显示SGC-7901-blank组、SGC-7901-empty-vector组和SGC-7901-GOLPH3组细胞慢病毒感染率分别为0.4%、99.8%、100.0%(图2). 为此, 我们建立了目的基因感染率接近100%的胃癌SGC-7901稳转细胞株, 在体外能够长期稳定表达绿色荧光蛋白.
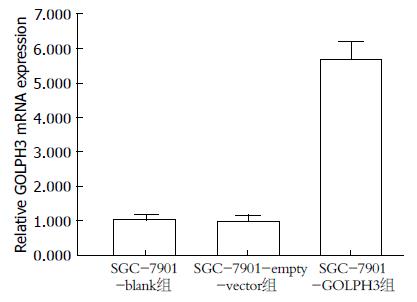
以2-∆∆Ct法统计相对表达量, SGC-7901-GOLPH3组GOLPH3 mRNA的表达强度(5.70±0.25)是SGC-7901-empty-vector组的5.88倍(P<0.05), 而SGC-7901-empty-vector组(0.97±0.09)与SGC-7901-blank组(1.01±0.07)GOLPH3 mRNA相对表达量无明显差异(P>0.05)(图3).
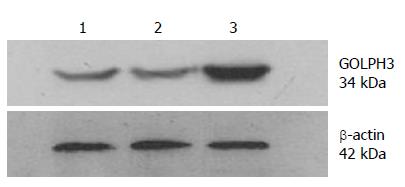
与SGC-7901-empty-vector组(0.65±0.03)和SGC-7901-blank组(0.64±0.04)相比, SGC-7901-GOLPH3组(1.71±0.53) GOLPH3蛋白量表达明显增强(P<0.05), 而SGC-7901-empty-vector组和SGC-7901-blank组表达值差异无统计学意义(P>0.05)(图4).
结果显示两对照之间细胞生长状态无明显差异, 而SGC7901-GOLPH3组细胞增殖速度明显加快(62.45%±2.25% vs 4.68%±0.72%, P<0.05), 且随着时间延长, 差异逐渐加大, 证明GOLPH3基因过表达后近远期胃癌细胞的增殖能力显著增强(图5).
结果显示3组细胞中mTOR蛋白表达量无明显差异, SGC-7901-blank组、SGC-7901-empty-vector组和SGC-7901-GOLPH3组中p-mTOR蛋白表达量分别为0.27±0.01、0.24±0.02、0.52±0.02, 与SGC-7901-empty-vector组和SGC-7901-blank组相比, SGC-7901-GOLPH3组中p-mTOR蛋白表达明显增强, 差异有统计学意义(P<0.05, 图6).
GOLPH3, 又称GPP34、GMx33、MIDAS, 由人染色体5p13基因编码, 是在对高尔基体进行蛋白质组学分析时发现的, 他属于高尔基体基质蛋白, 从酵母到人类高度保守[6]. 以往研究表明, GOLPH3参与高尔基体正常形态的保持[7], 与蛋白质的糖基化修饰密切相关[8,9], 在高尔基体的分泌和囊泡转运中起着重要作用[10]. 越来越多的研究证实囊泡转运、蛋白质糖基化修饰在癌症中起着重要作用[11], GOLPH3参与囊泡转运、高尔基体的分泌和转运等生理过程, 提示GOLPH3在肿瘤发生发展过程起着重要作用.
Scott等[4]对多种实体肿瘤分析发现, GOLPH3在肺癌、乳腺癌、卵巢癌、前列腺癌和黑色素瘤等多种恶性肿瘤中存在过表达, 提出GOLPH3可能是一个全新的致癌基因. Li等[12]在研究舌癌的过程中发现, GOLPH3在舌癌细胞中存在过表达. Wang等[13]应用免疫组织化学技术对正常食管组织及食管鳞状细胞癌组织分析发现, GOLPH3在食管鳞状细胞癌组织中亦存在过表达, 是食管癌预后的一个独立危险因素. 越来越多的研究发现GOLPH3在多种实体瘤中存在高表达, 包括舌癌[12]、食管癌[13]、胶质瘤[14]、前列腺癌[15]、乳腺癌[16]等, 提示GOLPH3在肿瘤发生发展中发挥着重要作用. 然而, GOLPH3在胃癌方面的研究甚少, 因此, 本实验通过构建GOLPH3基因过表达重组慢病毒颗粒, 拟探讨该基因过表达后对胃癌细胞SGC-7901增殖情况的影响.
慢病毒(lentivirus)载体是在人类免疫缺陷型病毒(human immunodeficiency virus)的基础上发展起来的基因治疗载体. 本实验所用的慢病毒载体系统由GV慢病毒载体系列、pHelper1.0载体和pHelper2.0载体三质粒组成, 通过对GV慢病毒载体的改造和病毒包装, 获得GOLPH3基因过表达重组慢病毒颗粒pGC-FU-GOLPH3-EGFP. 我们将其感染胃癌细胞, 感染复数(multiplicity of infection)值为70, 应用qPCR及Western blot技术检测胃癌细胞中GOLPH3在转染前后的表达差异. 结果发现, SGC-7901-GOLPH3组胃癌细胞中GOLPH3 mRNA及蛋白的表达较转染前有显著的升高(P<0.05), 而SGC-7901-blank组和SGC-7901-empty-vector组GOLPH3 mRNA及蛋白的表达无明显的改变(P>0.05), 提示GOLPH3基因过表达重组慢病毒载体构建成功, 并能明显上调胃癌细胞中GOLPH3的表达,可用于后续实验.
研究表明, 肿瘤的发生发展、浸润转移常涉及癌细胞的异常增殖. 我们的实验结果显示, GOLPH3基因的表达上调可促进胃癌细胞增殖, 由此表明GOLPH3基因对胃癌细胞的生物学行为有重要的影响, 但其具体的分子机制尚不清楚. Zhou等[17]体外实验发现, 下调GOLPH3基因后多形性胶质母细胞瘤细胞的迁移和侵袭能力明显降低, RhoA表达量也随之下降, 认为GOLPH3可能是通过调节RhoA的表达从而影响细胞的侵袭迁移能力. Zeng等[16]研究发现当下调或过表达乳腺癌细胞株MCF-7和MDA-MB-231中GOLPH3基因表达时, 细胞增殖能力相应地下降或增强, 并认为GOLPH3可能是通过减少转录因子FOXO1的表达来实现对乳腺癌细胞生长增殖的调控. 细胞生长受到多种信号通路复杂精细的调控, 信号传导系统的异常活化可引起细胞增殖凋亡改变、细胞去分化甚至恶变[18,19]. 越来越多的研究证实, PI3K-AKT-mTOR信号转导通路在多种肿瘤中处于活化状态, 在肿瘤细胞增殖、凋亡和侵袭转移方面发挥重要作用[20-22]. mTOR是PI3K-AKT-mTOR信号通路下游的一个关键分子, 其活性状态的改变与多种肿瘤的形成与进展密切相关[23-25]. 通常认为mTOR能够通过PI3K-AKT途经来感受外在信号的变化, 并发生磷酸化改变, 故通过检测其磷酸化状态能更好地反映mTOR在肿瘤细胞中的功能状态. 孙丹凤等[26]采用免疫组织化学方法分析p-mTOR和p-4EBP1在胃癌组织中的表达, 发现两者在胃癌组织的阳性表达率均高于匹配的癌旁及正常组织, 认为mTOR信号通路在胃癌中存在被激活现象. 张志永等[27]亦采用免疫组织化学方法探讨p-mTOR在正常结肠组织及结肠癌组织中的表达, 结果发现相对于正常的结肠组织, 结肠癌组织中p-mTOR蛋白明显增加, 他们还发现, 被敲除mTOR后的结肠癌细胞增殖能力受到明显的抑制.
我们的研究结果显示, SGC-7901-GOLPH3组上调GOLPH3基因后细胞增殖能力明显增强, p-mTOR蛋白表达量也随之增加, 与SGC-7901-blank组和SGC-7901-empty-vector组相比差别有统计学意义(P<0.05), 而3组细胞中mTOR总蛋白表达量无明显变化(P>0.05), 表明SGC-7901-GOLPH3组胃癌细胞中存在mTOR信号转导通路高度活化, GOLPH3基因过表达能够上调胃癌细胞mTOR信号通路中mTOR蛋白磷酸化水平. Aronova等[28]研究发现mTOR与retromer转运复合体存在相关性, TOR与retromer的亚单位Vps35、Vps29活性有关. Scott等[29]进一步研究发现: GOLPH3作为一个新的癌基因也能与retromer转运复合体中的Vps35相互结合, 并能提高mTOR的活性, 进而激活mTOR下游关键信号分子, 认为GOLPH3是通过mTORC1和mTORC2途经促进人类肿瘤细胞生长增殖的. 这一新的发现提示我们GOLPH3基因可能是通过mTOR信号通路促进胃癌细胞SGC-7901的生长增殖的. 鉴于GOLPH3与蛋白质的糖基化、高尔基体的分泌和囊泡转运密切相关, 因此我们猜想GOLPH3可能是通过糖基化或囊泡运转来影响mTOR信号通路的, 但具体的机制尚不清楚.
由于传统的胃癌治疗方法难以达到好的治疗效果, 故胃癌的基因治疗是目前的研究热点之一. 我们的研究结果提示GOLPH3过表达后能促进胃癌细胞的增殖, 其可能是通过上调mTOR信号通路中mTOR蛋白磷酸化水平来实现的. 但本实验主要针对mTOR和p-mTOR蛋白进行检测, 而mTOR信号通路中还有很多相关信号分子没有做到相关检测, 还有GOLPH3基因是通过什么机制导致mTOR高度活化等方面没有做相关的研究, 阐明这一机制将会为胃癌患者的诊断、治疗及预后等提供参考价值. 因此, 我们期望通过对GOLPH3及其信号通路进行更加深入的研究, 揭示GOLPH3调控胃癌的具体机制, 为胃癌的基因治疗提供更多的依据.
高尔基体磷蛋白3(Golgi phospho-protein 3, GOLPH3)基因, 是近年来才发现的一个可能致癌基因, 在多种恶性肿瘤中存在GOLPH3基因的高表达, GOLPH3基因导致肿瘤发生的具体机制仍不十分清楚, 尤其在胃癌中的研究甚少.
葛海燕, 教授, 同济大学附属第十人民医院普外科
目前已有研究发现GOLPH3基因在胃癌组织中高表达, 对胃癌的发生发展起着重要作用, 但其具体的作用机理还不清楚.
有研究显示GOLPH3基因可能是通过下调FOXO1转录因子的表达从而促进卵巢癌细胞增殖, 同时也有研究报道GOLPH3主要是通过调控RhoA的表达从而影响肿瘤细胞的侵袭和迁移.
本研究结果显示GOLPH3基因过表达后能明显促进胃癌细胞的增殖, 其可能是通过上调mTOR信号通路中mTOR蛋白磷酸化水平来实现的, 具体的作用机制有待进一步研究.
本实验阐述了GOLPH3基因可能是通过上调mTOR信号通路中mTOR蛋白磷酸化水平从而影响胃癌细胞生长增殖, 为阐明胃癌发病机制及临床治疗应用奠定理论基础, 同时也能为肿瘤分子靶向治疗提供一个突破点.
本文实验方法较先进, 研究结果对深入理解GOLPH3基因在胃癌发生发展中的作用提供了实验资料.
编辑: 田滢 电编:都珍珍
| 1. | Brenner B, Hoshen MB, Purim O, David MB, Ashkenazi K, Marshak G, Kundel Y, Brenner R, Morgenstern S, Halpern M. MicroRNAs as a potential prognostic factor in gastric cancer. World J Gastroenterol. 2011;17:3976-3985. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Lee KW, Park SR, Oh DY, Park YI, Khosravan R, Lin X, Lee SY, Roh EJ, Valota O, Lechuga MJ. Phase I study of sunitinib plus capecitabine/cisplatin or capecitabine/oxaliplatin in advanced gastric cancer. Invest New Drugs. 2013;31:1547-1558. [PubMed] [DOI] |
| 4. | Scott KL, Kabbarah O, Liang MC, Ivanova E, Anagnostou V, Wu J, Dhakal S, Wu M, Chen S, Feinberg T. GOLPH3 modulates mTOR signalling and rapamycin sensitivity in cancer. Nature. 2009;459:1085-1090. [PubMed] [DOI] |
| 5. | Hu BS, Hu H, Zhu CY, Gu YL, Li JP. Overexpression of GOLPH3 is associated with poor clinical outcome in gastric cancer. Tumour Biol. 2013;34:515-520. [PubMed] [DOI] |
| 6. | Bell AW, Ward MA, Blackstock WP, Freeman HN, Choudhary JS, Lewis AP, Chotai D, Fazel A, Gushue JN, Paiement J. Proteomics characterization of abundant Golgi membrane proteins. J Biol Chem. 2001;276:5152-5165. [PubMed] [DOI] |
| 7. | Dippold HC, Ng MM, Farber-Katz SE, Lee SK, Kerr ML, Peterman MC, Sim R, Wiharto PA, Galbraith KA, Madhavarapu S. GOLPH3 bridges phosphatidylinositol-4- phosphate and actomyosin to stretch and shape the Golgi to promote budding. Cell. 2009;139:337-351. [PubMed] [DOI] |
| 8. | Schmitz KR, Liu J, Li S, Setty TG, Wood CS, Burd CG, Ferguson KM. Golgi localization of glycosyltransferases requires a Vps74p oligomer. Dev Cell. 2008;14:523-534. [PubMed] [DOI] |
| 9. | Wood CS, Schmitz KR, Bessman NJ, Setty TG, Ferguson KM, Burd CG. PtdIns4P recognition by Vps74/GOLPH3 links PtdIns 4-kinase signaling to retrograde Golgi trafficking. J Cell Biol. 2009;187:967-975. [PubMed] [DOI] |
| 10. | D'Angelo G, Vicinanza M, Di Campli A, De Matteis MA. The multiple roles of PtdIns(4)P -- not just the precursor of PtdIns(4,5)P2. J Cell Sci. 2008;121:1955-1963. [PubMed] [DOI] |
| 11. | Mosesson Y, Mills GB, Yarden Y. Derailed endocytosis: an emerging feature of cancer. Nat Rev Cancer. 2008;8:835-850. [PubMed] [DOI] |
| 12. | Li H, Guo L, Chen SW, Zhao XH, Zhuang SM, Wang LP, Song LB, Song M. GOLPH3 overexpression correlates with tumor progression and poor prognosis in patients with clinically N0 oral tongue cancer. J Transl Med. 2012;10:168. [PubMed] [DOI] |
| 13. | Wang JH, Chen XT, Wen ZS, Zheng M, Deng JM, Wang MZ, Lin HX, Chen K, Li J, Yun JP. High expression of GOLPH3 in esophageal squamous cell carcinoma correlates with poor prognosis. PLoS One. 2012;7:e45622. [PubMed] [DOI] |
| 14. | Zhou J, Xu T, Qin R, Yan Y, Chen C, Chen Y, Yu H, Xia C, Lu Y, Ding X. Overexpression of Golgi phosphoprotein-3 (GOLPH3) in glioblastoma multiforme is associated with worse prognosis. J Neurooncol. 2012;110:195-203. [PubMed] [DOI] |
| 15. | Hua X, Yu L, Pan W, Huang X, Liao Z, Xian Q, Fang L, Shen H. Increased expression of Golgi phosphoprotein-3 is associated with tumor aggressiveness and poor prognosis of prostate cancer. Diagn Pathol. 2012;7:127. [PubMed] [DOI] |
| 16. | Zeng Z, Lin H, Zhao X, Liu G, Wang X, Xu R, Chen K, Li J, Song L. Overexpression of GOLPH3 promotes proliferation and tumorigenicity in breast cancer via suppression of the FOXO1 transcription factor. Clin Cancer Res. 2012;18:4059-4069. [PubMed] [DOI] |
| 17. | Zhou X, Zhan W, Bian W, Hua L, Shi Q, Xie S, Yang D, Li Y, Zhang X, Liu G. GOLPH3 regulates the migration and invasion of glioma cells though RhoA. Biochem Biophys Res Commun. 2013;433:338-344. [PubMed] [DOI] |
| 18. | Iwamoto K, Tashima Y, Hamada H, Eguchi Y, Okamoto M. Mathematical modeling and sensitivity analysis of G1/S phase in the cell cycle including the DNA-damage signal transduction pathway. Biosystems. 2008;94:109-117. [PubMed] [DOI] |
| 19. | Klinke DJ. Signal transduction networks in cancer: quantitative parameters influence network topology. Cancer Res. 2010;70:1773-1782. [PubMed] [DOI] |
| 20. | Carson JD, Van Aller G, Lehr R, Sinnamon RH, Kirkpatrick RB, Auger KR, Dhanak D, Copeland RA, Gontarek RR, Tummino PJ. Effects of oncogenic p110alpha subunit mutations on the lipid kinase activity of phosphoinositide 3-kinase. Biochem J. 2008;409:519-524. [PubMed] [DOI] |
| 21. | Dai R, Chen R, Li H. Cross-talk between PI3K/Akt and MEK/ERK pathways mediates endoplasmic reticulum stress-induced cell cycle progression and cell death in human hepatocellular carcinoma cells. Int J Oncol. 2009;34:1749-1757. [PubMed] |
| 22. | Park CM, Park MJ, Kwak HJ, Lee HC, Kim MS, Lee SH, Park IC, Rhee CH, Hong SI. Ionizing radiation enhances matrix metalloproteinase-2 secretion and invasion of glioma cells through Src/epidermal growth factor receptor-mediated p38/Akt and phosphatidylinositol 3-kinase/Akt signaling pathways. Cancer Res. 2006;66:8511-8519. [PubMed] [DOI] |
| 23. | Annovazzi L, Mellai M, Caldera V, Valente G, Tessitore L, Schiffer D. mTOR, S6 and AKT expression in relation to proliferation and apoptosis/autophagy in glioma. Anticancer Res. 2009;29:3087-3094. [PubMed] |
| 24. | Seeliger H, Guba M, Kleespies A, Jauch KW, Bruns CJ. Role of mTOR in solid tumor systems: a therapeutical target against primary tumor growth, metastases, and angiogenesis. Cancer Metastasis Rev. 2007;26:611-621. [PubMed] [DOI] |
| 25. | Yu K, Shi C, Toral-Barza L, Lucas J, Shor B, Kim JE, Zhang WG, Mahoney R, Gaydos C, Tardio L. Beyond rapalog therapy: preclinical pharmacology and antitumor activity of WYE-125132, an ATP-competitive and specific inhibitor of mTORC1 and mTORC2. Cancer Res. 2010;70:621-631. [PubMed] [DOI] |
| 28. | Aronova S, Wedaman K, Anderson S, Yates J, Powers T. Probing the membrane environment of the TOR kinases reveals functional interactions between TORC1, actin, and membrane trafficking in Saccharomyces cerevisiae. Mol Biol Cell. 2007;18:2779-2794. [PubMed] [DOI] |
| 29. | Scott KL, Chin L. Signaling from the Golgi: mechanisms and models for Golgi phosphoprotein 3-mediated oncogenesis. Clin Cancer Res. 2010;16:2229-2234. [PubMed] [DOI] |