修回日期: 2014-02-12
接受日期: 2014-02-18
在线出版日期: 2014-04-18
目的: 分析慢性丙型肝炎(chronic hepatitis C, CHC)患者外周血髓系来源抑制细胞(myeloid-derived suppressor cells, MDSCs)的特征及其与病毒复制的关系.
方法: 采用流式细胞术检测了61例CHC患者[包括14例快速病毒学应答(rapid virological response, RVR)患者、22例早期病毒学应答患者(early virological response, EVR)]和25例健康对照(healthy control, HC)的外周血MDSCs频率, 并分析其与临床病毒载量和肝脏生化指标之间的相关性.
结果: 基线水平CHC组MDSCs的频率高于健康组(1.33% vs 0.7%, P<0.001), 且与HCV RNA载量呈正相关(r = 0.636, P<0.001), 与谷丙转氨酶水平无关(r = 0.156, P = 0.229); CD8 T细胞表面的T细胞受体(T cell receptor, TCR) ζ链表达降低与CHC组MDSCs频率升高呈负相关(r = 0.690, P<0.001), 在体外加入L-精氨酸可使其恢复; 抗病毒治疗后, MDSCs频率呈下降趋势, 且RVR组基线水平的MDSCs频率高于EVR组(P = 0.024).
结论: CHC患者外周血MDSCs频率升高可能通过下调CD8 TCR ζ链表达抑制机体的抗病毒应答, 从而引起病毒的复制, 抗病毒治疗可使CD8 TCR ζ链的表达部分恢复.
核心提示: 本文研究了慢性丙型肝炎(chronic hepatitis C)患者外周血髓系来源抑制细胞(myeloid-derived suppressor cells, MDSCs)与病毒复制及抗病毒应答的关系, 发现丙型肝炎病毒(hepatitis C virus, HCV)感染者中MDSCs频率升高, 与HCV RNA载量呈线性正相关, 且快速病毒学应答(rapid virological response)组MDSCs基线频率高于早期病毒学应答患者(early virological response)组.
引文著录: 金磊, 张学秀, 曾庆磊, 冯国华, 张纪元, 陈黎明, 徐向升, 张政, 王福生. 慢性丙型肝炎患者外周血髓系来源抑制细胞增加与病毒复制的相关性. 世界华人消化杂志 2014; 22(11): 1574-1580
Revised: February 12, 2014
Accepted: February 18, 2014
Published online: April 18, 2014
AIM: To investigate the characteristics and clinical significance of myeloid-derived suppressor cells (MDSCs) in patients with chronic hepatitis C (CHC).
METHODS: The frequencies and phenotypes of peripheral blood MDSCs were analyzed in 61 patients with CHC, including 14 rapid virological response (RVR) cases and 22 early virological response (EVR) cases, and 25 healthy controls (HC). The correlations between the characteristics of MDSCs and clinical markers were analyzed.
RESULTS: The frequencies of peripheral MDSCs in CHC patients at baseline were significantly higher than those in the HC group (1.33% vs 0.7%, P < 0.001), which were positively correlated with HCV RNA load (r = 0.636, P < 0.001). T cell receptor (TCR) ζ expression on CD8 T cells was negatively correlated with the frequencies of MDSCs in CHC patients at baseline (r = 0.690, P < 0.001), and could be restored by L-arginine in vitro. The frequencies of MDSCs decreased after antiviral therapy, which were higher in the RVR group than in the EVR group (P = 0.024). TCR ζ expression on CD8 T cells increased in both RVR and EVR cases.
CONCLUSION: In CHC patients, MDSCs may suppress immune response by down-regulating TCR ζ expression on CD8 T cells, resulting in viral persistence.
- Citation: Jin L, Zhang XX, Zeng QL, Feng GH, Zhang JY, Chen LM, Xu XS, Zhang Z, Wang FS. Increased myeloid-derived suppressor cells correlate with viral persistence in patients with chronic hepatitis C. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1574-1580
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1574
丙型肝炎病毒(hepatitis C virus, HCV)感染严重威胁人类健康, 全球约有1.6亿例慢性丙型肝炎(chronic hepatitis C, CHC)患者, 是肝硬化和肝癌的主要原因之一[1]. 急性HCV感染患者能够产生功能完整、多特异性的免疫应答, 从而清除病毒; 但多数患者在感染HCV后转为慢性丙型肝炎, 而且HCV特异性CD8 T细胞应答明显减弱, 且常因病毒逃逸和突变而失去作用, 或被调节性T细胞或抑制分子所抑制[2-5].
髓系来源抑制细胞(myeloid-derived suppressor cells, MDSCs)是未成熟的髓系细胞亚群[6], 在人类常表达髓系标记CD11b和CD33, 但不表达人白细胞DR抗原(human leukocyte antigen-DR, HLA-DR)及CD3、CD19、CD56等淋巴细胞表面的分子[7,8]. 目前研究认为, MDSCs可抑制机体对肿瘤、病毒和细菌感染等疾病的免疫应答, 且主要通过半胱氨酸剥夺[9]、活性氧上调[10]、诱导调节性T细胞[11]和增加L-精氨酸的代谢[12]等途径发挥作用. 研究发现, HBV转基因小鼠肝脏中MDSCs频率明显高于健康小鼠, 这可抑制自身T细胞和乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)特异性淋巴细胞的增殖[13]. 在人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染患者中, MDSCs频率与HIV-1病毒载量呈正相关, 并可通过诱导精氨酸酶抑制CD8 T细胞的增殖[14,15]. 最近, 有研究提示MDSCs可能通过下调T细胞的功能而促进肝病的进展. 但是, MDSCs在CHC患者中的变化特点尚不清楚. 因此, 该研究选择CHC患者作为研究对象, 分析其外周血MDSCs的表达特点及其与临床指标的相关性.
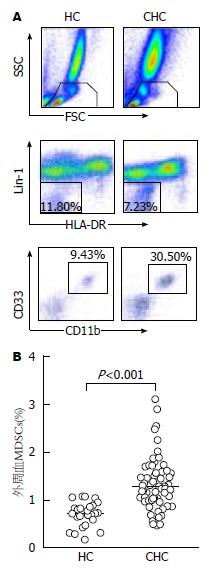
选择我院2011-11/2012-11收治的CHC患者61例, 其中男38例, 女23例, 年龄19-70岁. 诊断符合2000年西安会议修订的《病毒性肝炎防治方案》标准和2004年中华医学会肝病学分会、传染病与寄生虫病学分会修订的《丙型肝炎防治指南》标准[16,17]. CHC患者均经血液感染, 入院前6 mo内未进行抗病毒治疗, 入院前1 mo内未进行保肝、降酶治疗, 临床检查排除其他类型病毒感染、自身免疫性疾病、酒精性肝病, 近期无外伤和感染性疾病等. 入院后接受聚乙二醇干扰素α/利巴韦林治疗, 其中14例发生快速病毒学应答(rapid virological response, RVR), 22例发生早期病毒学应答(early virological response, EVR). 此外, 同时纳入25例健康志愿者作为健康对照(healthy control, HC)组, 均身体健康, 既往无肝脏相关疾病, 近期无外伤、感染性疾病及自身免疫性疾病. HC组年龄、性别与CHC组均衡. CHC组患者和健康志愿者均签署知情同意书, 并获得本单位伦理委员会批准. 研究对象基本资料如表1. 藻红蛋白(phycoerythrin, PE)标记的鼠抗人CD33抗体购自美国的PharMingen公司; PE标记的T细胞受体(T cell receptor, TCR)ζ抗体购自法国的Beckman Coulter Immunotech SAS公司; 异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的鼠抗人CD3抗体购自中国的SungeneBiotect公司; 其余抗体购自美国BD公司; 髓系来源抑制细胞的表型为Lin-1-HLA-DR-CD33+CD11c+.
| 分组 | n | 性别(男/女) | 年龄(岁) | ALT(U/L) | HCV RNA(×106 IU/mL) |
| HC | 25 | 18/9 | 28(20-35) | ND | ND |
| CHC | 61 | 38/23 | 45(19-70) | 72(11-254) | 5.975(0.003-47.980) |
| CHC-RVR | 14 | 10/4 | 40(19-56) | 86(27-193) | 14.966(0.022-48.000) |
| CHC-EVR | 22 | 13/9 | 42(20-63) | 74(27-202) | 3.710(0.028-11.570) |
1.2.1 外周血MDSCs的检测: 取全血200 μL置于流式管中, 加入FITC标记的鼠抗人Lin-1抗体、多甲藻黄素叶绿素蛋白(peridinin chlorophyll protein, PerCp)标记的鼠抗人HLA-DR抗体、别藻蓝蛋白(allophycocyanin, APC)标记的鼠抗人CD11b抗体和PE标记的鼠抗人CD33抗体, 避光孵育30 min后, 裂解红细胞, 用磷酸盐缓冲液(phosphate-buffered saline, PBS)洗涤2遍, 加入170 μL 1%多聚甲醛固定, 置于4 ℃冰箱保存, 24 h内经流式细胞仪检测.
1.2.2 CD8 T细胞TCR ζ链的检测: 取部分外周血单核细胞(peripheral blood mononuclear cells, PBMCs)加入FITC标记的鼠抗人CD3抗体和APC标记的鼠抗人CD8抗体, 混匀后分为2管, 避光孵育30 min后, PBS洗涤2遍; 固定破膜, 再分别加入PE标记的鼠抗人TCR ζ链抗体和同型对照, PBS洗涤2遍, 加入170 μL 1%多聚甲醛固定, 置于4 ℃冰箱保存, 24 h内经流式细胞仪检测.
1.2.3 细胞培养和CD8 T细胞TCR ζ链的检测: 按Das已报道的方案进行PBMCs培养, 取PBMCs置于96孔板, 加或不加L-精氨酸, 置于37 ℃, 5%CO2温箱孵育1 h后, 加入阻断剂monensin (2 μmol/L), 再孵育10 h. 孵育结束后, 分别加入FITC标记的鼠抗人CD3抗体和APC标记的鼠抗人CD8抗体, 避光孵育30 min后, PBS洗涤2遍; 固定破膜, 再分别加入PE标记的鼠抗人TCR ζ抗体和同型对照, PBS洗涤2遍, 加入170 μL 1%多聚甲醛固定, 置于4 ℃冰箱保存, 24 h内经流式细胞仪检测.
统计学处理 采用SPSS16.0软件进行统计学分析, 2组资料比较用Mann-Whitney U检验, 多组间指标比较用Kruskal-Wallis秩和检验, 两个变量间相关性分析用Spearman秩相关性分析. P<0.05为差异有统计学意义.
MDSCs圈门策略如图1A所示. 流式细胞仪检测结果显示, 与HC组比较, CHC组外周血MDSCs基线频率明显升高, 且有统计学差异(P<0.001), 如图1B所示.
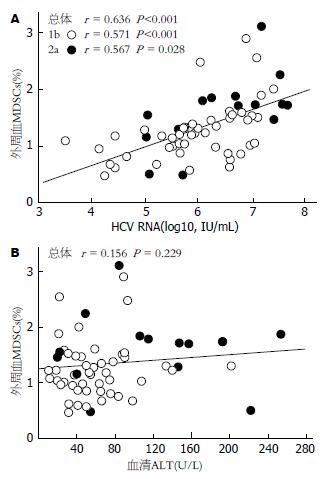
临床上反映HCV感染疾病进程的2个重要指标是HCV RNA载量和转氨酶水平. 我们将CHC组MDSCs基线频率与HCV RNA载量和谷丙转氨酶(alanine aminotransferase, ALT)水平进行了相关性分析. 结果提示, CHC组MDSCs基线频率与HCV RNA定量水平呈线性正相关(r = 0.636, P<0.001), 而与基因分型无关, 如图2A所示; 与ALT水平无相关性(r = 0.156, P = 0.229), 如图2B所示.
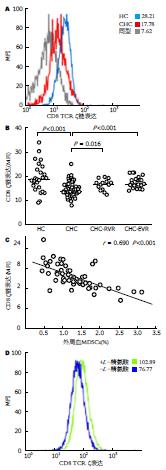
CHC组和HC组CD8 T细胞TCR ζ链的圈门策略如图3A, CHC组CD8 T细胞TCR ζ链基线表达水平明显低于HC组(P<0.001)(图3B), 而且与MDSCs频率呈负相关(r = 0.690, P<0.001)(图3C); 抗病毒治疗后RVR组和EVR组MDSCs频率较基线水平增加(P = 0.016, P<0.001)(图3B). 有报道称, L-精氨酸缺乏可下调CD8 T细胞TCR ζ链的表达, 因此我们对PBMCs加或不加精氨酸进行体外培养, 结果显示, 加入L-精氨酸后可使CD8 T细胞TCR ζ链的表达增加(图3D).
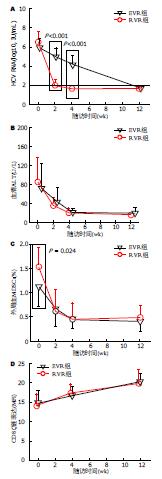
抗病毒治疗随访中, RVR组在抗病毒治疗第4周即检测不到HCV RNA, 而EVR组在第12周检测不到HCV RNA, 但ALT水平变化趋势在两组之间无统计学差异(图4A, B). RVR组MDSCs的基线频率高于EVR组(P = 0.024)(图4C), 在抗病毒治疗后两组间MDSCs频率均降低, 但无统计学差异; 两组CD8 T细胞TCR ζ链的表达水平在抗病毒治疗后呈上升趋势, 但无统计学差异(图4D).
MDSCs是免疫调节细胞, 可负性调节适应性免疫应答[10,18,19], 本研究的目的主要是了解其在CHC患者中的表达特点及其与病毒复制和抗病毒应答的关系. 有研究发现, MDSCs在HIV-1感染中的频率与高效抗逆转录病毒治疗的疗效密切相关: 在初治患者中, MDSCs频率与HIV-1病毒载量呈正相关, 在抗病毒治疗后, 其频率逐渐下降[15]. 本研究发现, CHC组MDSCs基线频率高于HC组, 且其水平与HCV RNA载量呈线性正相关; 在抗病毒治疗后, 随HCV RNA载量降低, MDSCs水平亦呈下降趋势. 在CHC患者抗病毒治疗中, EVR和RVR用来评价短期抗病毒效果: 抗病毒治疗4 wk检测不到HCV RNA(<100 IU/mL)定义为RVR, 提示实现持续病毒学应答(sustained virological response, SVR)的可能性较大; 抗病毒治疗12 wk血浆HCV RNA消失或与基线水平相比下降值≥2log定义为EVR[20], EVR是实现SVR最精确的预测指标[20]. 在本研究中, 我们发现MDSCs频率高低与CHC患者的抗病毒应答可能相关, RVR组MDSCs基线频率高于EVR组, 而且有效的抗病毒应答常伴随MDSCs频率的下降和CD8 T细胞TCR ζ链表达的恢复, 这提示较高频率的MDSCs可能有潜在预测SVR的价值, 但尚需大规模的研究来证实.
L-精氨酸代谢发生于MDSCs中, 其可通过下调CD8 T细胞TCR ζ链的表达来介导T细胞发挥抑制功能, 这是重要的抑制机制之一. 在本研究中, 我们检测了CD8 T细胞TCR ζ链的表达, 以评估在不同疾病阶段MDSCs的变化情况. 我们发现CHC患者中外周血CD8 T细胞TCR ζ链的表达低于健康人, 且与MDSCs频率呈负相关; 而且, CD8 T细胞TCR ζ链的降低通过补充L-精氨酸进行恢复. 重要的是, EVR和RVR患者中CD8 T细胞TCR ζ链的恢复与MDSCs的频率下降密切相关. 这些数据提示, MDSCs可能参与了HCV感染的发病过程. 最近的研究提示MDSCs主要通过诱导精氨酸酶清除L-精氨酸发挥抑制功能[19,21,22], 这可能有助于阐述MDSCs发挥作用的机制, 但需要进一步的研究去证实.
总之, CHC患者外周血中MDSCs频率升高与病毒复制相关, 并可能对抗病毒应答有一定的预测性, 对未来制定优化治疗方案有一定的参考价值.
丙型肝炎病毒(hepatitis C virus, HCV)感染是肝硬化和肝癌的主要原因之一. 多数患者在感染HCV后转为慢性丙型肝炎(chronic hepatitis C, CHC). 在CHC患者, HCV特异性的CD8 T细胞应答明显减弱, 并常因病毒逃逸和突变而失去作用, 或被调节性T细胞或抑制分子所抑制, 但是尚不完全清楚造成CD8 T细胞功能失调的抑制机制. 目前研究发现, 髓系来源抑制细胞(myeloid-derived suppressor cells, MDSCs)对机体的抗病毒免疫应答有抑制作用, 但其在CHC中的特点尚不清楚.
陈汝福, 教授, 中山大学第二附属医院肝胆胰外科
MDSCs在乙型肝炎病毒(hepatitis B virus)感染小鼠中频率升高, 并发现其可通过下调CD8 TCR ζ链的表达而促进病毒复制和肝病进展.
MDSCs可抑制机体对肿瘤、病毒和细菌感染等疾病的免疫应答, 主要通过半胱氨酸剥夺、活性氧上调和增加L-精氨酸的代谢等来发挥作用.
本研究对CHC患者MDSCs频率升高与病毒复制及抗病毒应答的关系进行了研究, 结果发现MDSCs频率与HCV RNA载量呈线性正相关, 并可能与抗病毒应答相关.
本研究发现CHC患者外周血MDSCs频率升高可能通过下调CD8 TCR ζ链表达抑制机体的抗病毒应答, 从而造成病毒的复制, 抗病毒治疗可部分恢复CD8 TCR ζ链的表达, 对临床预测CHC抗病毒应答有一定意义.
本本研究从MDSCs角度探讨其在CHC感染患者病毒复制和抗病毒治疗过程中的作用, 具有一定的创新性和潜在的临床应用价值. 研究设计合理, 实验方法应用得当, 实验数据可信度高.
编辑 郭鹏 电编 鲁亚静
| 1. | Lavanchy D. Evolving epidemiology of hepatitis C virus. Clin Microbiol Infect. 2011;17:107-115. [PubMed] [DOI] |
| 2. | Lechner F, Gruener NH, Urbani S, Uggeri J, Santantonio T, Kammer AR, Cerny A, Phillips R, Ferrari C, Pape GR. CD8+ T lymphocyte responses are induced during acute hepatitis C virus infection but are not sustained. Eur J Immunol. 2000;30:2479-2487. [PubMed] [DOI] |
| 3. | Thimme R, Oldach D, Chang KM, Steiger C, Ray SC, Chisari FV. Determinants of viral clearance and persistence during acute hepatitis C virus infection. J Exp Med. 2001;194:1395-1406. [PubMed] [DOI] |
| 4. | Neumann-Haefelin C, Thimme R. Adaptive immune responses in hepatitis C virus infection. Curr Top Microbiol Immunol. 2013;369:243-262. [PubMed] [DOI] |
| 5. | Lauer GM. Immune responses to hepatitis C virus (HCV) infection and the prospects for an effective HCV vaccine or immunotherapies. J Infect Dis. 2013;207 Suppl 1:S7-S12. [PubMed] [DOI] |
| 6. | Young MR, Newby M, Wepsic HT. Hematopoiesis and suppressor bone marrow cells in mice bearing large metastatic Lewis lung carcinoma tumors. Cancer Res. 1987;47:100-105. [PubMed] |
| 7. | Zea AH, Rodriguez PC, Atkins MB, Hernandez C, Signoretti S, Zabaleta J, McDermott D, Quiceno D, Youmans A, O'Neill A. Arginase-producing myeloid suppressor cells in renal cell carcinoma patients: a mechanism of tumor evasion. Cancer Res. 2005;65:3044-3048. [PubMed] |
| 8. | Filipazzi P, Valenti R, Huber V, Pilla L, Canese P, Iero M, Castelli C, Mariani L, Parmiani G, Rivoltini L. Identification of a new subset of myeloid suppressor cells in peripheral blood of melanoma patients with modulation by a granulocyte-macrophage colony-stimulation factor-based antitumor vaccine. J Clin Oncol. 2007;25:2546-2553. [PubMed] [DOI] |
| 9. | Srivastava MK, Sinha P, Clements VK, Rodriguez P, Ostrand-Rosenberg S. Myeloid-derived suppressor cells inhibit T-cell activation by depleting cystine and cysteine. Cancer Res. 2010;70:68-77. [PubMed] [DOI] |
| 10. | Tacke RS, Lee HC, Goh C, Courtney J, Polyak SJ, Rosen HR, Hahn YS. Myeloid suppressor cells induced by hepatitis C virus suppress T-cell responses through the production of reactive oxygen species. Hepatology. 2012;55:343-353. [PubMed] [DOI] |
| 11. | Hoechst B, Ormandy LA, Ballmaier M, Lehner F, Krüger C, Manns MP, Greten TF, Korangy F. A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4(+)CD25(+)Foxp3(+) T cells. Gastroenterology. 2008;135:234-243. [PubMed] [DOI] |
| 12. | Ochoa AC, Zea AH, Hernandez C, Rodriguez PC. Arginase, prostaglandins, and myeloid-derived suppressor cells in renal cell carcinoma. Clin Cancer Res. 2007;13:721s-726s. [PubMed] [DOI] |
| 13. | Chen S, Akbar SM, Abe M, Hiasa Y, Onji M. Immunosuppressive functions of hepatic myeloid-derived suppressor cells of normal mice and in a murine model of chronic hepatitis B virus. Clin Exp Immunol. 2011;166:134-142. [PubMed] [DOI] |
| 14. | Macatangay BJ, Landay AL, Rinaldo CR. MDSC: a new player in HIV immunopathogenesis. AIDS. 2012;26:1567-1569. [PubMed] [DOI] |
| 15. | Vollbrecht T, Stirner R, Tufman A, Roider J, Huber RM, Bogner JR, Lechner A, Bourquin C, Draenert R. Chronic progressive HIV-1 infection is associated with elevated levels of myeloid-derived suppressor cells. AIDS. 2012;26:F31-F37. [PubMed] [DOI] |
| 18. | Yang B, Wang X, Ren X. Amino acid metabolism related to immune tolerance by MDSCs. Int Rev Immunol. 2012;31:177-183. [PubMed] [DOI] |
| 19. | Kong YY, Fuchsberger M, Xiang SD, Apostolopoulos V, Plebanski M. Myeloid derived suppressor cells and their role in diseases. Curr Med Chem. 2013;20:1437-1444. [PubMed] [DOI] |
| 20. | European Association of the Study of the Liver. 2011 European Association of the Study of the Liver hepatitis C virus clinical practice guidelines. Liver Int. 2012;32 Suppl 1:2-8. [PubMed] [DOI] |
| 21. | Rodríguez PC, Ochoa AC. Arginine regulation by myeloid derived suppressor cells and tolerance in cancer: mechanisms and therapeutic perspectives. Immunol Rev. 2008;222:180-191. [PubMed] [DOI] |
| 22. | Sandalova E, Laccabue D, Boni C, Watanabe T, Tan A, Zong HZ, Ferrari C, Bertoletti A. Increased levels of arginase in patients with acute hepatitis B suppress antiviral T cells. Gastroenterology. 2012;143:78-87. e3. [PubMed] [DOI] |