修回日期: 2014-02-23
接受日期: 2014-02-28
在线出版日期: 2014-04-18
目的: 分析转录因子Sp3表达下调后人肝癌细胞株HepG2基因表达谱的变化.
方法: 使用siRNA干扰技术下调人肝癌细胞株HepG2中Sp3表达, 人全基因组表达谱芯片筛查Sp3沉默后的差异表达基因, qRT-PCR验证部分差异表达基因, 流式细胞术检测细胞周期.
结果: Sp3表达下调后, 筛查出差异表达基因1789个, 其中上调基因1007个, 下调基因782个, 涉及细胞增殖、分化、凋亡、黏附、代谢等多方面功能, qRT-PCR结果表明周期相关基因CCND1、CCNE2、转化生长因子B1(transforming growth factor B1, TGFB1)、CDKN2A的表达变化与芯片结果一致, 流式细胞术结果显示Sp3表达下调后细胞主要分布在G1期.
结论: Sp3表达下调后人肝癌细胞株HepG2的基因表达谱发生明显变化, 并出现G0/G1期阻滞, Sp3可能通过细胞周期因子参与肝癌的发生发展过程.
核心提示: 通过基因芯片与qRT-PCR发现Sp3表达下调后Cyclin D1、Cyclin E2、转化生长因子-β(transforming growth factor-β, TGF-β)mRNA表达亦下调, 而细胞周期蛋白依赖激酶抑制因子(cyclin-dependent inhibitor)2A mRNA表达上调, 流式细胞术分析提示G0/G1期阻滞, Sp3可能通过细胞周期参与肝癌的发生发展.
引文著录: 黄兰姗, 李海荣, 陈罡, 陆会平, 李佳, 冯振博. Sp3表达下调后肝癌细胞株HepG2基因表达谱的变化. 世界华人消化杂志 2014; 22(11): 1495-1503
Revised: February 23, 2014
Accepted: February 28, 2014
Published online: April 18, 2014
AIM: To analyze the alteration of gene expression profile in hepatocellular carcinoma cell line HepG2 with Sp3 downregulation.
METHODS: RNA interference was performed to downregulate Sp3 mRNA in HepG2 cells and NimbleGen Human Gene Expression Microarray was used for gene expression profile analysis. Real-time quantitative PCR was employed to confirm the expression of several differentially expressed genes. The cell cycle was analyzed by flow cytometry.
RESULTS: A total of 1789 genes was found to be differentially expressed in HepG2 cells with Sp3 downregulation, including 1007 up-regulated and 782 down-regulated ones. These genes were involved in many cellular biological process such as proliferation, differentiation, programmed death, adhesion, and metabolic process. Real-time quantitative PCR confirmed the alteration of several cell cycle related genes (CCND1, CCNE2, TGFB1, and CDKN2A). Flow cytometry analysis showed that the percentage of cells in G1 phase increased significantly after Sp3 downregulation.
CONCLUSION: Gene expression profile alters in HepG2 with Sp3 downregulation. Sp3 knockdown induces cell cycle arrest in G0/G1 phase in HepG2 cells. Sp3 may play an essential role in the pathogenesis of hepatocellular carcinoma as a transcription factor via regulating cell cycle progression.
- Citation: Huang LS, Li HR, Chen G, Lu HP, Li J, Feng ZB. Alteration of gene expression profile in hepatocellular carcinoma HepG2 cells with Sp3 downregulation. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1495-1503
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1495
随着Sp(special protein)1作为第一个真核转录因子被发现[1], Sp转录因子家族也渐渐被科学界认识. Sp家族属于特殊转录因子, 含有高度保守的DNA结合区域, 在羧基端有3个串联的Cys2His2型锌指结构域, 能与GC/GT盒及基本的转录元件结合. 已有研究发现, 脂联素、阿司匹林、二甲双胍[2-4]的抑癌作用与抑制Sp蛋白的转录调控密切相关. 目前发现该家族包括Sp1等9个成员, Sp3作为家族成员之一, 其转录调控作用具有特殊性, 扮演转录激活或转录抑制的双重角色[5-8], 在胰腺癌、乳腺癌、食管癌等多种肿瘤中异常高表达[9-11]. 本课题组前期研究发现, 在原发性肝细胞癌(hepatocellular carcinoma, HCC)的癌组织中Sp3表达高于癌旁肝组织, 且Sp3与临床病理特征及预后存在联系[12], 在肝癌细胞株HepG2中运用siRNA干扰沉默Sp3后, 细胞增殖能力明显减弱[13], 上述研究结果均提示在肝癌的发生发展中Sp3可能作为促癌因子而发挥作用, 然而目前对于Sp3调控的下游基因及其参与肝癌发生发展的机制仍存在许多未知. 基因芯片技术是一种高通量、高度并行性、自动、快速的微量分析技术. 本研究在前期的研究基础上利用基因芯片检测Sp3表达下调后人肝癌细胞基因表达谱的变化, 分析Sp3在肝癌中相关的基因功能及细胞信号通路网络, 进而为肝细胞癌的研究奠定基础.
HepG2肝癌细胞株(中国科学院上海细胞库); DMEM培养基和胎牛血清(Wisent公司); 细胞总RNA提取试剂盒(Axygen公司); 逆转录试剂盒(Fermentas公司); 实时荧光定量PCR试剂盒(Roche公司); 流式细胞术检测细胞周期试剂盒(南京凯基生物公司); 慢病毒质粒Lv-shRNA-Sp3、Lv-shRNA-NC由上海吉凯生物公司构建; 引物合成及测序由Invitrogen公司提供; Roche NimbleGen人全基因组表达谱芯片检测由上海康成生物公司完成.
1.2.1 细胞培养与慢病毒转染: 人肝癌HepG2细胞培养于10%胎牛血清的高糖DMEM培养液, 于37 ℃、5%CO2和饱和湿度的CO2恒温孵育箱. 细胞分3组: 实验组(Lv-shRNA-Sp3慢病毒沉默组)、阴性对照组(Lv-shRNA-NC空载质粒组)和空白对照组(未处理的HepG2细胞). 转染过程同前期实验所述[13].
1.2.2 基因芯片检测与分析: 收获实验组与阴性对照组细胞(每组包含3个重复样本), 由上海康成生物公司进行基因芯片检测和数据分析. (1)总RNA抽提及质检: TRIzol法抽提样本总RNA, 浓度与纯度由NanoDrop ND-1000检测, 总RNA完整性通过甲醛变性凝胶电泳评估; (2)基因表达谱芯片检测: 本实验采用Roche NimbleGen 12×135K人全基因组表达谱芯片, 包含45033个基因. 首先将RNA逆转录成ds-cDNA, 用配套试剂纯化ds-cDNA, 然后标记cDNA Cy3荧光信号(NimbleGen One-Color DNA labling kit), Cy3标记的cDNA与芯片杂交(Hybridization System-NimbleGen Systems), 杂交结束后洗涤(NimbleGen Wash Buffer kit), 最后用Axon GenePix 4000B microarray scanner扫描芯片信号, 所用软件为GenePix Pro 6.0 software. 芯片扫描信号图由NimbleScan software(version 2.5)转化为数据结果并校正; (3)数据分析: 校正后的数据由Agilent GeneSpring GX software(version 11.5)分析, 通过Volcano Plot筛选出显著差异表达基因(上调或下调倍数≥2.0, P<0.05), GO-Analysis(基于Gene Ontology数据库)和Pathway-Analysis(基于KEGG数据库)分析基因相关功能及生物学通路, Hierarchical clustering比较样本间差异基因表达水平.
1.2.3 实时荧光定量PCR: 将实验组、阴性对照组和空白对照组细胞提取总RNA并逆转录为cDNA, 以β-actin为内参进行qRT-PCR. 引物如表1, 反应体系为: Mix 10 μL, 上下游引物各0.5 μL, RNase-free water 8 μL, cDNA 1 μL(共计20 μL). 扩增条件为: 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 40个循环. 结果采用2-∆∆Ct法计算相对表达量.
| 基因名称 | 引物序列 | 产物长度(bp) |
| Sp3 | F: 5'-GCTTGCACCTGTCCCAACTGTA-3' | 148 |
| R: 5'-CTCCAGAATGCCAACGCAGA-3' | ||
| Cyclin D1 | F: 5'-GGGCCACTTGCATGTTCGT-3' | 149 |
| R: 5'-CAGGTTCCACTTGAGCTTGTTCAC-3' | ||
| Cyclin E2 | F: 5'-TGGGAACTTTGTCCTGTAACAATCA-3' | 200 |
| R: 5'-CACAAGGCAGCAGCAGTCAGTA-3' | ||
| TGF-β1 | F: 5'-CGCATCCTAGACCCTTTCTCCTC-3' | 133 |
| R: 5'-GGTGTCTCAGTATCCCACGGAAAT-3' | ||
| CKI 2A | F: 5'-TGAGGCGCCCTTTGGTTATC-3' | 156 |
| R: 5'-GAGGTTTCTCAGAGCCTCTCTGGT-3' | ||
| β-actin | F: 5'-GCACCACACCTTCTACAATGAGC-3' | 166 |
| R: 5'-GGATAGCACAGCCTGGATAGCAAC-3' |
1.2.4 流式细胞术检测细胞周期: 实验组、阴性对照组和空白对照组细胞经胰酶消化后, 调整细胞量为1×106个/管, 预冷的PBS重悬细胞, 离心去上清后加100 μL RNase, 37 ℃水浴30 min, 再加入PI染液500 μL, 混匀后室温避光反应30 min, 最后流式细胞仪上机检测.
统计学处理 采用SPSS16.0软件进行统计学分析, 结果以mean±SD表示, 各组样本均数比较用单因素方差分析, 组间比较用t检验, 检验水准α = 0.05, P<0.05为差异有统计学意义. 以上实验结果重复3次以上.
qRT-PCR结果显示, 相对于空白对照组, 实验组细胞的Sp3 mRNA表达水平明显下降(0.49±0.04, P<0.05), 阴性对照组则无明显变化(0.96±0.08, P>0.05), 与前期实验RT-PCR结果一致[13].
实验组与阴性对照组细胞的总RNA A260/280介于1.93-2.03, 浓度>900 ng/μL, 经甲醛变性凝胶电泳可见28、18S条带清晰且强度比值约2:1, 检测结果表明总RNA质量完好.
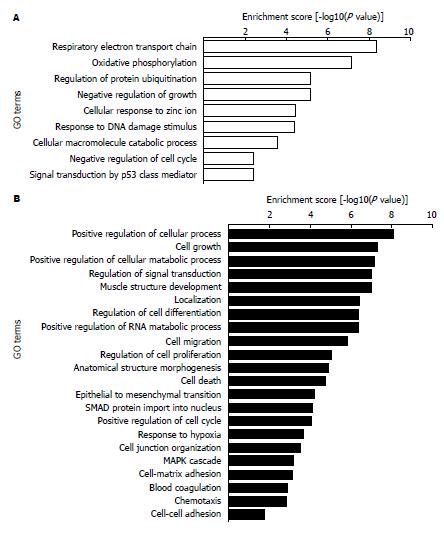
Sp3表达下调后, 发现显著差异表达基因1789个, 其中上调基因1007个, 下调基因782个, 涉及细胞增殖、分化、凋亡、黏附、代谢等多方面功能. 与肿瘤相关的重要基因的差异表达情况如表2, 3.
| NCBI基因号 | 基因名称 | 基因描述 | 变化倍数 | P值 |
| 1029 | CDKN2A | 细胞周期蛋白依赖激酶抑制因子2A(黑色素瘤, p16, CDK4抑制因子) | 2.2447672 | 0.0484199 |
| 604 | BCL6 | B细胞慢性淋巴细胞白血病/淋巴瘤因子6(锌指蛋白51) | 2.192251 | 0.0445856 |
| 5684 | PSMA3 | 蛋白酶体亚组, α型, 3 | 2.4935203 | 0.0036072 |
| 5710 | PSMD4 | 蛋白酶体26S亚组, 非ATP酶, 4 | 2.2616875 | 0.0004508 |
| 246184 | CDC26 | 细胞分裂周期因子26 | 2.8350668 | 0.0116091 |
| 7046 | TGFBR1 | 转化生长因子β受体Ⅰ (激活素A Ⅱ型受体样激酶, 53 kDa) | 2.5749626 | 0.0311112 |
| 2296 | FOXC1 | 叉头框转录因子C1 | 2.364293 | 0.0034894 |
| 3265 | HRAS | v-Ha-ras鼠Harvey肉瘤病毒致癌基因同源物 | 2.1287968 | 0.0021295 |
| 3429 | IFI27 | 干扰素α诱导蛋白27 | 2.8439498 | 0.0225853 |
| 27113 | BBC3 | BCL2结合物3 | 2.2185693 | 0.049462 |
| NCBI基因号 | 基因名称 | 基因描述 | 变化倍数 | P值 |
| 595 | CCND1 | 细胞周期蛋白D1 | -2.107 | 0.047 |
| 9134 | CCNE2 | 细胞周期蛋白E2 | -2.383 | 0.037 |
| 1027 | CDKN1B | 细胞周期蛋白依赖激酶抑制因子1B(p27, Kip1) | -2.764 | 0.024 |
| 1030 | CDKN2B | 细胞周期蛋白依赖激酶抑制因子2B(p15, CDK4抑制因子) | -2.302 | 0.037 |
| 4089 | SMAD4 | SMAD家族成员4 | -2.024 | 0.033 |
| 7040 | TGFB1 | 转化生长因子β1(Camurati-Engelmann病) | -2.124 | 0.010 |
| 5155 | PDGFB | 血小板源性生长因子β(v-sis类人猿肉瘤病毒致癌基因同源物) | -2.249 | 0.004 |
| 7422 | VEGF | 血管内皮生长因子 | -2.181 | 0.020 |
| 1956 | EGFR | 上皮生长因子受体(v-erb-b鸟类有核红细胞白血病病毒致癌基因同源物) | -2.290 | 0.007 |
| 3488 | IGFBP5 | 胰岛素样生长因子结合蛋白5 | -3.122 | 0.011 |
| 7157 | TP53 | 肿瘤蛋白p53(Li-Fraumeni 综合征) | -2.192 | 0.012 |
| 5594 | MAPK1 | 丝裂原活化蛋白激酶1 | -2.699 | 0.008 |
| 1499 | CTNNB1 | 连环蛋白β1(钙黏蛋白相关蛋白), 88 kDa | -2.323 | 0.001 |
| 8313 | AXIN2 | 轴蛋白2(conductin, axil) | -2.289 | 0.015 |
| 3725 | JUN | v-jun鸟类肉瘤病毒17致癌基因同源物 | -3.517 | 0.002 |
基于Gene Ontology数据库富集生物学过程, 按富集指数(enrichment score, ES)排列出部分显著富集条目(图1). 其中, 上调基因的富集条目涉及细胞氧化呼吸链、氧化磷酸化、蛋白泛素化、细胞生长负向调控、细胞对锌离子应答、DNA损伤应答等; 下调基因的富集条目涉及细胞生理过程正向调控、细胞生长、细胞代谢过程正向调控、信号传导调控、肌组织发育等.
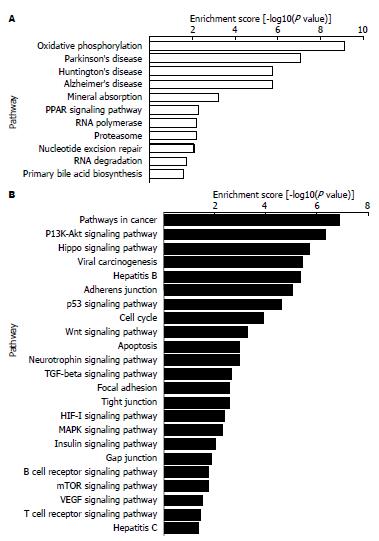
基于KEGG数据库富集信号通路, 按ES排列出部分显著富集的信号通路(图2). 其中, 上调基因富集的信号通路涉及氧化磷酸化、帕金森病、Huntington病、阿兹海默病、矿质元素吸收、PPAR通路等; 下调基因富集的信号通路涉及PI3K/Akt通路、Hippo通路、病毒性致癌、乙型肝炎、细胞黏附连接、p53通路、细胞周期、Wnt通路等.
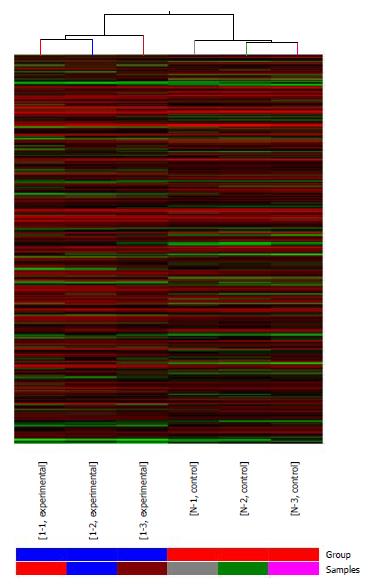
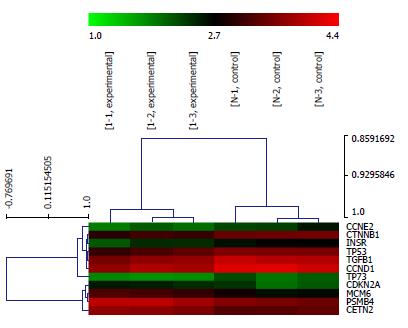
对所有差异表达基因进行分层聚类分析(图3). 其中, 实验组样本与阴性对照组样本分别聚类在一起, 说明聚类结果可靠. 对细胞周期相关的部分基因进行分层聚类分析(图4), CCNE2、CTNNB1、INSR、TP53、TGFB1、CCND1和TP73基因在实验组表达下调, CDKN2A、MCM6、PSMB4和CETN2基因则表达上调.
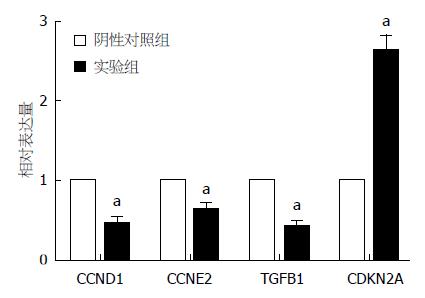
结合课题组前期研究结果, 选取周期相关的差异表达基因进行qRT-PCR验证, 结果显示, 相对于阴性对照组, 实验组CCND1、CCNE2、TGFB1 mRNA表达下调, CDKN2A mRNA表达上调, 与基因芯片结果一致(图5).
原发性肝细胞癌是我国最常见的恶性肿瘤之一, 发病机制涉及抑癌基因的染色质杂合性缺失(TP53、RB1、AXIN1、CDKN2A、IGF2R), 基因突变(p53、CTNNB1、 PTEN)以及他们所引起的信号通路异常(HGF/MET、EGFR/RAS/MAPK、Wnt/β-catenin、PIK3CA/AKT、IGF信号链)等[14], 具体的分子机制仍未明了. 转录因子Sp3作为Sp家族成员之一, 因其转录激活或转录抑制的双重作用的特殊性而倍受关注. 目前, 关于Sp3在肝癌中作用的研究甚少. Porntadavity等[15]在研究人类免疫缺陷病毒(human immunodeficiency virus, HIV)-1感染与肝癌发生的关系中发现, HIV-1 Tat通过改变Sp1/Sp3比例调节MnSOD基因的转录. Choi等[16]发现在肝癌细胞株Hep3B中, Sp1/Sp3/HDAC1蛋白复合体对于曲古菌素A诱导的IGFBP-3启动子激活起重要作用. 本课题组前期在肝癌组织及细胞株中的研究发现, Sp3在HCC癌组织中的表达明显高于癌旁肝组织, 在伴有转移、分化程度低、直径大的病例中, Sp3的表达进一步增强, 并且发现Sp3与VEGF的表达存在正相关性; 同时, 在肝癌细胞株HepG2中运用siRNA干扰沉默Sp3后, 细胞增殖能力明显减弱, 出现G0/G1期周期阻滞.
本研究通过人全基因组表达谱芯片检测, 筛查出Sp3沉默组与阴性对照组的差异表达基因1789个, 其中上调基因1007个, 下调基因782个, 涉及广泛的生物学功能, 与其他学者的研究报道相似, Sp家族可调控细胞生长相关因子(Cyclin D1、EGFR)、凋亡相关因子(survivin、Bcl-2)及血管形成相关因子(VEGF、VEGFR1/VEGFR2)等[17-19]. 与此同时, Sp3下调后也引起多个信号传导通路的改变, 如PI3K/Akt通路、病毒性致癌、乙型肝炎、p53通路、Wnt通路等, 其中p53、Rb、Wnt/β-catenin及转化生长因子-β(transforming growth factor β, TGF-β)信号通路异常均已被认为与肝癌的发生密切相关[20]. 由此推测, Sp3在肝癌中的促癌作用可能是通过芯片结果所提示的众多的基因、复杂的信号通路网络调控实现的.
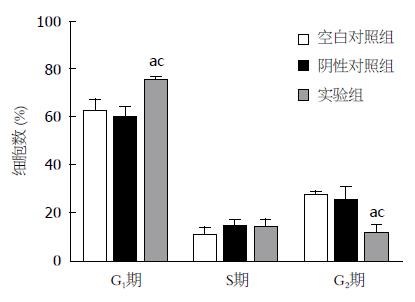
在本课题组前期研究中我们发现, 通过siRNA干扰技术下调肝癌细胞株HepG2中Sp3的表达后, 细胞的生长明显受到抑制, 而在此次芯片结果的众多差异表达基因中, 我们关注到细胞周期因子的变化, 即通过siRNA干扰技术下调肝癌细胞株HepG2中Sp3的表达后, 细胞生长、周期负向调控因子上调, 而正向调控因子下调. 于是通过qRT-PCR验证CCND1、CCNE2、TGFB1和CDKN2A, 其结果与芯片结果相一致, 说明芯片结果具有较高的可信度, 这些周期调控基因确实随着Sp3表达下调而在mRNA水平发生变化. 随后, 我们通过流式细胞术检测细胞周期的变化情况, 发现Sp3表达下调后G1期细胞数明显增多, G2期细胞数明显减少, 出现G0/G1期阻滞, 与前期结果一致. 由此可见, Sp3可以通过影响细胞周期而干扰肝癌细胞的生长和增殖.
细胞周期, 又称细胞分裂周期, 是指细胞从一次分裂结束到下一次分裂结束所经历的全过程, 依次分为G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和M期(有丝分裂期)[21]. 细胞周期调控的核心因子主要分为3类: 细胞周期蛋白(Cyclin)[22]、细胞周期蛋白依赖激酶(cyclin-dependent kinase, CDK)[23]以及细胞周期蛋白依赖激酶抑制因子(cyclin-dependent inhibitor, CKI)[24]. 其中, Cyclin与CDK结合后形成复合物, 促进细胞周期进展, 而CKI通过与CDK或Cyclin-CDK复合物结合, 抑制细胞进程[25]. 肿瘤最主要的特征是细胞异常增殖, 与细胞周期调控密切相关, 研究发现在肿瘤中CyclinD、Cyclin E、CDK4、p16等[26,27]许多周期相关因子出现蛋白表达水平或基因异常.
通常情况下, 处于G0期细胞在生长因子和生长因子受体的作用下, 通过相关的信号传导通路使Cyclin D在Gl早期表达增加, Cyclin D与细胞中存在的CDK4、CDK6结合, 从而使RB蛋白磷酸化, 释放转录因子E2F, 诱导Cyclin E和CDK2的表达, 并形成对RB蛋白磷酸化的阳性反馈回路, 使RB进一步磷酸化, 促使细胞越过Gl/S转折点[28]. 在肿瘤的发生过程中, 细胞周期的调控机制破坏, 可出现Gl期、S期、G2期阻滞[29]. 与Abdelrahim等[30]沉默胰腺癌细胞株Panc-1中Sp3基因表达的研究结果相似, 在本研究中, 沉默Sp3基因表达使细胞停留在Gl期, 从而抑制癌细胞的增殖. 由此我们推测, 在本研究中, Sp3下调后, TGFβ也下调, 由此导致处于G0期的细胞缺少信号刺激, 周期启动受限; 与此同时, 一并下调的Cyclin D促使G1期延长, CKI 2A的升高抑制G1期进展; 并且, Cyclin E下调, 限制细胞跨越G1/S转折点, 从而解释Sp3下调后G1期细胞数明显增多这个现象.
总之, 本研究在课题组前期的工作基础上通过基因芯片发掘了丰富的Sp3与肝癌相关的基因信息, 在后续研究中我们将进一步通过体外细胞及体内动物实验等方法探索Sp3与部分基因的具体联系及作用机制, 特别是与肿瘤发生发展密切相关的细胞周期和相关信号通路, 以期为肝癌的发病机制研究奠定实验基础, 为肝癌的预防与治疗提供新的思路.
转录因子Sp家族包括Sp1等9个成员, Sp3作为家族成员之一, 可扮演转录激活或转录抑制的双重角色, 在胰腺癌、乳腺癌、食管癌等多种肿瘤中异常高表达. 目前对于Sp3调控的下游基因及其参与肝癌发生发展的机制仍存在许多未知. 本研究利用基因芯片检测Sp3表达下调后人肝癌细胞基因表达谱的变化, 可以为肝细胞癌的研究奠定基础.
何敏, 教授, 广西医科大学医学科学实验中心
Sp家族具有重要的转录调控作用, 目前关于其肿瘤药物作用以及调控基因表达的机制为研究热点, 然而关于Sp3调控下游基因情况及具体机制尚未明了, 基因芯片技术可以高通量、高度并行性、自动、快速地进行Sp3调控信息研究, 提供系统的实验基础.
本课题组陆会平等应用RNAi技术沉默Sp3基因后, 肝癌HepG2细胞增殖减弱. Abdelrahin等沉默胰腺癌细胞株Panc-1中Sp3基因后, 细胞停留在G0/Gl期. Jutooru等应用RNAi技术发现在胰腺癌细胞中Cyclin D1、VEGF等受Sp1、Sp3、Sp4调节.
在转录因子Sp家族中, 关于Sp1的研究与发现较多, 而关于Sp3的研究较少, 特别是对于Sp3调控的下游基因与影响的信号通路未见有系统报道, 本研究通过基因芯片系统性研究Sp3相关基因信息.
本文揭示了Sp3在肝细胞癌中影响的众多基因与信号通路, 并重点分析Sp3与细胞周期的关系, 为肝癌的发病机制研究奠定实验基础, 为肝癌的分子靶向治疗提供理论依据.
目前在肝癌中转录因子Sp3的研究仍不多见, 本文具有一定创新性.
编辑 田滢 电编 鲁亚静
| 1. | Dynan WS, Tjian R. The promoter-specific transcription factor Sp1 binds to upstream sequences in the SV40 early promoter. Cell. 1983;35:79-87. [PubMed] |
| 2. | Liu J, Lam JB, Chow KH, Xu A, Lam KS, Moon RT, Wang Y. Adiponectin stimulates Wnt inhibitory factor-1 expression through epigenetic regulations involving the transcription factor specificity protein 1. Carcinogenesis. 2008;29:2195-2202. [PubMed] [DOI] |
| 3. | Pathi S, Jutooru I, Chadalapaka G, Nair V, Lee SO, Safe S. Aspirin inhibits colon cancer cell and tumor growth and downregulates specificity protein (Sp) transcription factors. PLoS One. 2012;7:e48208. [PubMed] [DOI] |
| 4. | Nair V, Pathi S, Jutooru I, Sreevalsan S, Basha R, Abdelrahim M, Samudio I, Safe S. Metformin inhibits pancreatic cancer cell and tumor growth and downregulates Sp transcription factors. Carcinogenesis. 2013;34:2870-2879. [PubMed] [DOI] |
| 5. | Hagen G, Müller S, Beato M, Suske G. Sp1-mediated transcriptional activation is repressed by Sp3. EMBO J. 1994;13:3843-3851. [PubMed] |
| 6. | Philipsen S, Suske G. A tale of three fingers: the family of mammalian Sp/XKLF transcription factors. Nucleic Acids Res. 1999;27:2991-3000. [PubMed] |
| 7. | Ammanamanchi S, Brattain MG. Sp3 is a transcriptional repressor of transforming growth factor-beta receptors. J Biol Chem. 2001;276:3348-3352. [PubMed] [DOI] |
| 8. | Kim H, Lee S, Park B, Che L, Lee S. Sp1 and Sp3 mediate basal and serum-induced expression of human CENP-W. Mol Biol Rep. 2010;37:3593-3600. [PubMed] [DOI] |
| 9. | Abdelrahim M, Baker CH, Abbruzzese JL, Safe S. Tolfenamic acid and pancreatic cancer growth, angiogenesis, and Sp protein degradation. J Natl Cancer Inst. 2006;98:855-868. [PubMed] [DOI] |
| 10. | Mertens-Talcott SU, Chintharlapalli S, Li X, Safe S. The oncogenic microRNA-27a targets genes that regulate specificity protein transcription factors and the G2-M checkpoint in MDA-MB-231 breast cancer cells. Cancer Res. 2007;67:11001-11011. [PubMed] [DOI] |
| 11. | Papineni S, Chintharlapalli S, Abdelrahim M, Lee SO, Burghardt R, Abudayyeh A, Baker C, Herrera L, Safe S. Tolfenamic acid inhibits esophageal cancer through repression of specificity proteins and c-Met. Carcinogenesis. 2009;30:1193-1201. [PubMed] [DOI] |
| 14. | Nejak-Bowen KN, Monga SP. Beta-catenin signaling, liver regeneration and hepatocellular cancer: sorting the good from the bad. Semin Cancer Biol. 2011;21:44-58. [PubMed] [DOI] |
| 15. | Porntadavity S, Nath A, Prachayasittikul V, Cota-Gomez A, Flores SC, St Clair DK. Different roles of Sp family members in HIV-1 Tat-mediated manganese superoxide dismutase suppression in hepatocellular carcinoma cells. DNA Cell Biol. 2005;24:299-310. [PubMed] [DOI] |
| 16. | Choi HS, Lee JH, Park JG, Lee YI. Trichostatin A, a histone deacetylase inhibitor, activates the IGFBP-3 promoter by upregulating Sp1 activity in hepatoma cells: alteration of the Sp1/Sp3/HDAC1 multiprotein complex. Biochem Biophys Res Commun. 2002;296:1005-1012. [PubMed] |
| 17. | Chadalapaka G, Jutooru I, Chintharlapalli S, Papineni S, Smith R, Li X, Safe S. Curcumin decreases specificity protein expression in bladder cancer cells. Cancer Res. 2008;68:5345-5354. [PubMed] [DOI] |
| 18. | Jutooru I, Chadalapaka G, Sreevalsan S, Lei P, Barhoumi R, Burghardt R, Safe S. Arsenic trioxide downregulates specificity protein (Sp) transcription factors and inhibits bladder cancer cell and tumor growth. Exp Cell Res. 2010;316:2174-2188. [PubMed] [DOI] |
| 19. | Jutooru I, Chadalapaka G, Abdelrahim M, Basha MR, Samudio I, Konopleva M, Andreeff M, Safe S. Methyl 2-cyano-3,12-dioxooleana-1,9-dien-28-oate decreases specificity protein transcription factors and inhibits pancreatic tumor growth: role of microRNA-27a. Mol Pharmacol. 2010;78:226-236. [PubMed] [DOI] |
| 20. | Zender L, Villanueva A, Tovar V, Sia D, Chiang DY, Llovet JM. Cancer gene discovery in hepatocellular carcinoma. J Hepatol. 2010;52:921-929. [PubMed] [DOI] |
| 22. | Gopinathan L, Ratnacaram CK, Kaldis P. Established and novel Cdk/cyclin complexes regulating the cell cycle and development. Results Probl Cell Differ. 2011;53:365-389. [PubMed] [DOI] |
| 23. | Malumbres M, Harlow E, Hunt T, Hunter T, Lahti JM, Manning G, Morgan DO, Tsai LH, Wolgemuth DJ. Cyclin-dependent kinases: a family portrait. Nat Cell Biol. 2009;11:1275-1276. [PubMed] [DOI] |
| 24. | Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1-phase progression. Genes Dev. 1999;13:1501-1512. [PubMed] |
| 25. | Lim S, Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation. Development. 2013;140:3079-3093. [PubMed] [DOI] |
| 27. | Carnero A. Targeting the cell cycle for cancer therapy. Br J Cancer. 2002;87:129-133. [PubMed] [DOI] |
| 29. | Kastan MB, Bartek J. Cell-cycle checkpoints and cancer. Nature. 2004;432:316-323. [PubMed] [DOI] |
| 30. | Abdelrahim M, Smith R, Burghardt R, Safe S. Role of Sp proteins in regulation of vascular endothelial growth factor expression and proliferation of pancreatic cancer cells. Cancer Res. 2004;64:6740-6749. [PubMed] [DOI] |