修回日期: 2013-11-27
接受日期: 2013-11-29
在线出版日期: 2014-01-08
目的: 探讨缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)在胃癌中的作用及其与胃癌术后复发的相关性与影响因素.
方法: 选取行根治切除手术后复发的80例胃癌患者为研究对象, 另选取行根治切除手术后经随访5年以上无复发的50例胃癌患者为对照组, 采用免疫组织化学法测定两组HIF-1α、血管内皮生长因子(vascular endothelial growth factor, VEGF)阳性表达情况, 采用单因素及Cox风险模型对影响胃癌患者预后的危险因素进行分析, HIF-1α与VEGF相关性采用Spearman相关分析.
结果: 观察组胃组织中HIF-1α、VEGF表达阳性率分别为77.50%、73.75%显著高于对照组12.00%、10.00%. 经单因素分析可知, 分化程度、浸润程度、淋巴结是否转移、血管侵袭性、TNM临床分期、VEGF表达情况与胃癌HIF-1α阳性表达相关. 经Spearman相关分析可知HIF-1α与VEGF呈正相关(r = 0.458, P = 0.000). HIF-1α阳性组1年生存率为45.16%, 平均生存时间为8.62 mo±2.32 mo显著低于阴性组1年生存率77.77 mo及平均生存时间18.96 mo±3.14 mo. 经Cox风险模型可知, HIF-1α与VEGF阳性表达是影响胃癌患者预后的独立危险因素.
结论: HIF-1α高水平表达与胃癌复发及血管生成具有密切的关系, 其可作为胃癌术后复发及预后的评价测指标.
核心提示: 本文观察了根治术后复发胃癌及未复发胃癌组织中缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)、血管内皮生长因子(vascular endothelial growth factor, VEGF)表达情况, 并与临床病理、患者生存时间进行了相关性分析, 结果显示与胃癌复发组患者胃组织中HIF-1α表达相关的因素包括分化程度、浸润程度、淋巴结是否转移、血管侵袭性、TNM临床分期、VEGF表达情况, HIF-1α阳性组1年生存率、平均生存时间显著低于阴性组, 研究结论对胃癌的预后研究具有较重要的意义.
引文著录: 周晓刚, 陈宁波, 沈小钢. HIF-1α表达在胃癌中的作用及其与胃癌术后复发的相关性. 世界华人消化杂志 2014; 22(1): 96-100
Revised: November 27, 2013
Accepted: November 29, 2013
Published online: January 8, 2014
AIM: To investigate the relationship between hypoxia inducible factor -1α (HIF-1α) expression and gastric cancer recurrence and to analyze factors affecting HIF-1α expression in gastric cancer.
METHODS: Eighty patients with gastric cancer recurrence after radical resection were included in the study, and 50 patients without recurrence after radical resection for more than 5 year were selected as a control group. The expression of HIF-1α and VEGF was compared between the two groups. Risk factors for gastric cancer were analyzed with univariate and Cox proportional hazards models. The correlation between HIF-1α and VEGF expression was investigated by Spearman correlation analysis.
RESULTS: The positive rates of HIF-1α (77.50% vs 12.00%) and VEGF (73.75% vs 10.00%) expression were higher in the recurrence group than in the control group. The degree of differentiation, depth of invasion, lymph node metastasis, vascular invasion, TNM clinical stage, VEGF expression were factors affecting HIF-1α expression in gastric tissue. There was a positive correlation between HIF-1α and VEGF expression (r = 0.458, P = 0.000). The 1-year survival rate (45.16% vs 77.77%) and average survival time (8.62 ± 2.32 vs 18.96 ± 3.14) were significantly lower in the HIF-1α-positive group than in the HIF-1α-negative group. HIF-1α and VEGF expression were independent prognostic factors for gastric cancer.
CONCLUSION: HIF-1α expression is closely related to recurrence of gastric cancer and tumor angiogenesis, and can be used as a parameter for assessing gastric cancer recurrence and prognosis.
- Citation: Zhou XG, Chen NB, Shen XG. Correlation between gastric HIF-1α expression and gastric cancer recurrence. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 96-100
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/96.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.96
胃癌是消化系常见的恶性肿瘤之一, 尽管近年综合治疗使得胃癌5年生存率有所提高, 但患者总体预后效果仍较差[1]. 研究表明[2], 血管生成与胃癌发生及发展有密切的关系, 缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)、血管内皮生长因子(vascular endothelial growth factor, VEGF)过度表达是促使肿瘤细胞生成、增殖及凋亡的重要因素之一, 尤其是HIF-1α作为新近发现的促血管生长因子, 可为抗血管生成治疗提供新的作用机制. 为此本研究将采用免疫组织化学法测定胃癌组织中HIF-1α、VEGF表达情况, 并对两者与胃癌复发及预后的相关性进行分析, 旨在为临床胃癌的治疗提供新的思路.
选取2008-01/2011-12收治的行胃癌根治切除手术术后复发者80例为观察组, 患者均经超声、胃镜、CT等影像学或经病理组织学检查确诊, 患者临床病理资料完整, 且排除第二原发癌. 另选取同期行常规性检查的曾行胃癌根治手术术后随访5年无复发的50例患者为对照组. 本研究中所有患者均签署知情同意书, 且均经本院伦理医学委员会审批通过.
采用免疫荧光组化法检测两组根治术后复发胃癌HIF-1α、VEGF表达情况, 兔抗人VEGF多克隆体购自福州迈新生物技术公司, HIF-1α鼠抗人多克隆抗体购于北京金桥生物技术公司. HIF-1α采用EDTA热修复处理20 min, VEGF采用柠檬酸缓冲液于高压锅中热修复处理2 min后采用冷水洗涤, 并采用PBS缓冲液对样品进行冲洗, 经苏木精复染后采用乙醇对样本脱水并制成中性树胶封片, 并与已知的阳性切片进行对比, 阴性对照采用PBS缓冲液替代一抗的样本为参照. 免疫组织结果的判断: (1)HIF-1α阳性表达为棕黄色颗粒见于细胞核内, VEGF阳性表达为棕黄色颗粒见于细胞质及细胞核内; (2)在倍数为100的显微镜下观察细胞着色情况, 根据着色程度由轻至重可分别记为0、1、2、3分. 随机选取5个视野点, 采用倍数为400的显微镜进行观察, 每个视野进行细胞计数, 以500个细胞作为一组计算单位, 细胞阳性百分率: 1分为小于10%, 2分为10%-50%, 3分为大于50%. 积分计算: (1)与(2)计算所得的分值相乘. 0分为阴性"-", 1-3分为弱阳性"+", 4-6分为中度阳性"++", 7-9分为强阳性"+++"[3].
统计学处理 应用SPSS17.0软件进行统计学分析, 计数资料采用百分比表示; 组间计数资料的比较采用χ2检验, HIF-1α与VEGF相关性采用Spearman相关分析, 多因素分析采用Cox风险模型分析, P<0.05为差异有统计学意义.
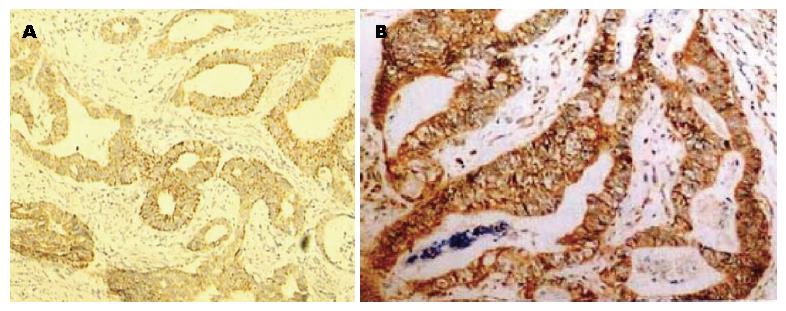
观察组胃组织中HIF-1α、VEGF表达阳性率显著高于对照组(表1, 图1).
经单因素分析可知, 影响胃癌复发组患者胃组织中HIF-1α阳性率的因素包括分化程度、浸润程度、淋巴结是否转移、血管侵袭性、TNM临床分期、VEGF表达情况. 经Spearman相关分析可知HIF-1α与VEGF呈正相关(r = 0.458, P = 0.000)(表2).
HIF-1α阳性组1年生存率、平均生存时间显著低于阴性组. 经Cox风险模型可知, HIF-1α(OR = 3.145, 95%CI: 1.665-4.027)与VEGF(OR = 3.012, 95%CI: 1.244-3.886)阳性表达是影响胃癌患者预后的独立危险因素(表3, 表4).
| 病理特征 | n | HIF-1α阳性率 | χ2 | P值 |
| 性别 | 0.916 | 0.339 | ||
| 男 | 52 | 42(80.77) | ||
| 女 | 28 | 20(71.43) | ||
| 年龄(岁) | 0.058 | 0.809 | ||
| <60 | 38 | 29(76.31) | ||
| ≥60 | 42 | 33(78.57) | ||
| 分化程度 | 5.792 | 0.016 | ||
| 未分化/低分化 | 47 | 32(68.08) | ||
| 中分化/高分化 | 33 | 30(90.91) | ||
| 病理组织分型 | 0.087 | 0.768 | ||
| 管状腺癌 | 38 | 30(78.95) | ||
| 乳头腺癌 | 32 | 25(78.12) | ||
| 其他类型 | 10 | 7(70.00) | ||
| 肿瘤直径(cm) | 0.015 | 0.904 | ||
| <5 | 39 | 30(76.92) | ||
| ≥5 | 41 | 32(78.05) | ||
| 浸润程度 | 20.452 | 0.000 | ||
| 未及浆膜层 | 34 | 18(52.94) | ||
| 侵入浆膜层 | 46 | 44(95.65) | ||
| 淋巴结转移 | 12.333 | 0.0004 | ||
| 有 | 38 | 36(94.74) | ||
| 无 | 42 | 26(61.90) | ||
| 血管侵袭 | 13.207 | 0.0003 | ||
| 有 | 29 | 29(100.00) | ||
| 无 | 51 | 33(64.70) | ||
| TNM临床分期 | 21.701 | 0.000 | ||
| I、II期 | 37 | 20(54.05) | ||
| III、IV期 | 43 | 42(97.67) | ||
| VEGF | 14.580 | 0.000 | ||
| 阴性 | 21 | 10(47.62) | ||
| 阳性 | 59 | 52(88.13) |
| 分组 | n | 1年生存率(%) | 平均生存时间(mo) |
| HIF-1α阳性组 | 62 | 28(45.16) | 8.62±2.32 |
| HIF-1α阴性组 | 18 | 14(77.77) | 18.96±3.14 |
| χ2/t值 | 8.225 | 7.265 | |
| P值 | 0.000 | 0.000 |
胃癌是我国常见的消化系肿瘤, 根治手术是目前治疗胃癌最常用的方法, 但仍有部分患者行根治手术治疗后预后效果不理想, 术后复发仍是胃癌患者死亡的主要原因[4]. 由于胃癌早期症状比较隐蔽, 部分患者接受手术治疗是已是进展期, 患者术后复发率较高[5]. 施华等[6]对早期胃癌患者行根治手术患者进行观察, 其结果表明早期胃癌患者术后复发率仅为12.24%, 而对于进展期患者其术后复发率则为74.58%. 因此对影响胃癌患者术后复发的相关因素进行分析可延长患者生存期限, 提高患者生存率.
目前普遍认为胃癌术后复发是由于内外因素共同作用引起的, 血管生成是肿瘤发展的首要条件[7]. 石燕等[8]认为肿瘤周围微环境中抑制因子及促进因子调控失衡是导致肿瘤血管生成的重要因素. VEGF是血管内皮细胞有丝分裂素, 属于重要的血管生成促进因子, 其在血管生成过程中处于核心地位[9]. 大量研究表明[10], 在正常成年人群中VEGF的表达水平非常低, 而在恶性肿瘤患者中VEGF表达水平异常高. 此外, VEGF可诱导血管、淋巴管内皮细胞迁移及增殖, 从而促使淋巴血管及生成, 并可增加淋巴血管通透性, 加速淋巴血管转移, 因此与肿瘤恶性程度具有密切的关系. 肿瘤患者体内普遍存在免疫识别障碍的情况, 机体在此情况下可将肿瘤组织误认为自身组织, 从而产生应激反应, 并诱导HIF-1α生成HIF-1α表达增强可刺激肿瘤蛋白及基因转录, 并促使VEGF大量生成. 目前相关研究[11]表明HIF-1α与肿瘤的发生发展具有密切的关系, 在肿瘤发生发展过程中起到重要的调控作用. Lu等[12]采用免疫组织化学法测定53例胃癌患者组织中HIF-1α表达情况, 结果显示其阳性表达与胃癌肝转移及肿瘤大小有关. Zhan等[13]检测60例胃癌组织HIF-1α的表达, 其结果显示, HIF-1α表达与胃癌远处转移及术后复发有关. Zhang等[14]研究证实HIF-1α阳性表达与癌细胞淋巴结转移有关. 曾楷峰等[15]研究指出HIF-1α表达强度与癌症患者总体生存期及术后复发率显著相关, HIF-1α表达水平可作为胃癌患者根治手术术后复发的预测指标. Jia等[16]对胃癌患者预后情况进行分析, 其结果显示胃癌患者己糖激酶-Ⅱ及HIF-1α表达强度与肿瘤大小、分化程度、临床分期有密切关系, 是影响患者术后预后的独立危险因素.
本研究结果显示, 复发组患者VEGF、HIF-1α表达强度较强, 浸润程度较深, 患者存在淋巴结转移, 血管浸润显著, TNM分期较晚, 经Cox风险模型分析可知, VEGF、HIF-1α是胃癌术后复发的独立危险因素. VEGF表达、肿瘤浸润、淋巴结是否转移、血管侵袭性、TNM临床分期可作为胃癌患者根治术后预后的预测指标. 此外, 对复发组患者随访1年发行, HIF-1α阳性组1年生存率、平均生存时间显著低于阴性组, 从而提示HIF-1α阳性表达强度与患者生存率及生存期限具有密切的关系, 通过测定胃癌患者HIF-1α阳性表达情况, 对预测患者病情进展具有重要的意义.
总之, HIF-1α高水平表达与胃癌复发及血管生成具有密切的关系, 其可作为胃癌术后复发及预后的评价测指标.
由于胃癌早期症状比较隐蔽, 部分患者接受手术治疗是已是进展期, 患者术后复发率较高. 施华等对早期胃癌患者行根治手术患者进行观察, 其结果表明早期胃癌患者术后复发率仅为12.24%, 而对于进展期患者其术后复发率则为74.58%. 因此对影响胃癌患者术后复发的相关因素进行分析可延长患者生存期限, 提高患者生存率.
沈克平, 主任医师, 上海中医药大学附属龙华医院
胃癌是我国常见的消化系肿瘤, 根治手术是目前治疗胃癌最常用的方法, 但仍有部分患者行根治手术治疗后预后效果不理想, 术后复发仍是胃癌患者死亡的主要原因.
Zhang等研究证实HIF-1α阳性表达与癌细胞淋巴结转移有关. 曾楷峰等研究指出HIF-1α表达强度与癌症患者总体生存期及术后复发率显著相关, HIF-1α表达水平可作为胃癌患者根治手术术后复发的预测指标.
HIF-1α高水平表达与胃癌复发及血管生成具有密切的关系, 其可作为胃癌术后复发及预后的评价测指标.
本文设计合理, 结果可靠, 具有一定的学术参考价值.
编辑: 田滢 电编:鲁亚静
| 4. | Zhu CL, Huang Q, Liu CH, Lin XS, Xie F. Prognostic value of HIF-1α expression in patients with gastric cancer. Mol Biol Rep. 2013;40:6055-6062. [PubMed] [DOI] |
| 6. | 施 华, 王 爱军, 郑 宝军, 冯 俊伟, 王 红钰, 吴 肖. siRNA沉默缺氧诱导因子-2α对胃癌细胞SGC7901凋亡的影响和机制. 中华实验外科杂志. 2013;30:248-251. |
| 10. | Miyake S, Kitajima Y, Nakamura J, Kai K, Yanagihara K, Tanaka T, Hiraki M, Miyazaki K, Noshiro H. HIF-1α is a crucial factor in the development of peritoneal dissemination via natural metastatic routes in scirrhous gastric cancer. Int J Oncol. 2013;43:1431-1440. [PubMed] |
| 11. | Jung JH, Im S, Jung ES, Kang CS. Clinicopathological implications of the expression of hypoxia-related proteins in gastric cancer. Int J Med Sci. 2013;10:1217-1223. [PubMed] [DOI] |
| 12. | Lu XX, Chen YT, Feng B, Mao XB, Yu B, Chu XY. Expression and clinical significance of CD73 and hypoxia-inducible factor-1α in gastric carcinoma. World J Gastroenterol. 2013;19:1912-1918. [PubMed] [DOI] |
| 13. | Zhan H, Liang H, Liu X, Deng J, Wang B, Hao X. Expression of Rac1, HIF-1α, and VEGF in gastric carcinoma: correlation with angiogenesis and prognosis. Onkologie. 2013;36:102-107. [PubMed] [DOI] |
| 14. | Zhang ZG, Zhang QN, Wang XH, Tian JH. Hypoxia-inducible factor 1 alpha (HIF-1α) as a prognostic indicator in patients with gastric tumors: a meta-analysis. Asian Pac J Cancer Prev. 2013;14:4195-4198. [PubMed] [DOI] |
| 15. | 曾 楷峰, 金 海林, 张 伟锋, 肖 斌, 朱 宏, 郝 波, 施 瑞华. RNA干扰缺氧诱导因子1α对食管鳞癌和胃腺癌细胞生物学行为的影响. 中华肿瘤杂志. 2011;33:260-264. |
| 16. | Jia YF, Xiao DJ, Ma XL, Song YY, Hu R, Kong Y, Zheng Y, Han SY, Hong RL, Wang YS. Differentiated embryonic chondrocyte-expressed gene 1 is associated with hypoxia-inducible factor 1α and Ki67 in human gastric cancer. Diagn Pathol. 2013;8:37. [PubMed] [DOI] |