修回日期: 2013-11-04
接受日期: 2013-11-19
在线出版日期: 2014-01-08
目的: 探讨沉默信息调节因子-1(silent information regulator 1, SIRT1)去乙酰化酶抑制剂Sirtinol体外应用对胰腺癌PNAC-1细胞增殖和5-FU化疗敏感的影响.
方法: 应用不同浓度的Sirtinol(25, 50和100 μmol/L)处理PNAC-1细胞48 h, Western blot测定SIRT1表达的变化情况, MTT法检测PANC-1细胞增殖变化, 流式细胞术观察细胞凋亡变化, MTT法检测Sirtinol对5-氟尿嘧啶(5-fluorouracil, 5-FU)化疗敏感性的变化.
结果: Sirtinol显著降低SIRT1的表达量, 明显抑制了PANC-1细胞的增殖, 促进了凋亡, 且呈浓度依赖性. 与Sirtinol(A = 0.546±0.020)或5- FU(A = 0.526±0.023)单药作用相比, 两药联合应用可显著降低PANC-1细胞的增殖(A = 0.251±0.017, P<0.01).
结论: Sirtinol通过下调SIRT1表达可抑制胰腺癌细胞增殖和促进其凋亡, 同时增强化疗药5-FU敏感性, 这为胰腺癌的化疗提供了一种新的方案.
核心提示: 沉默信息调节因子-1(silent information regulator 1, SIRT1)信号通路与胰腺癌密切相关, 设计合成SIRT1特异性的抑制剂可以沉默SIRT1基因, 有效抑制胰腺癌细胞生长, 促进胰腺癌细胞的凋亡, 增强化疗药物的敏感性, 为分子靶向阻断SIRT1信号通路治疗胰腺癌奠定了基础.
引文著录: 张军港, 石英, 王知非, 洪德飞. Sirtinol对胰腺癌PANC-1细胞增殖和5-FU敏感性的影响. 世界华人消化杂志 2014; 22(1): 86-90
Revised: November 4, 2013
Accepted: November 19, 2013
Published online: January 8, 2014
AIM: To investigate the effects of SIRT1 specific inhibitor Sirtinol on proliferation and 5-FU chemosensitivity of pancreatic cancer PANC-1 cells.
METHODS: PANC-1 cells were treated with 25, 50 and 100 μmol/L Sirtinol for 48 h. The expression levels of SIRT1 were measured by Western blot. Cell proliferation was detected by MTT assay. Cell apoptosis was detected by flow cytometry (FCM). 5-FU chemosensitivity was measured by MTT assay.
RESULTS: Sirtinol obviously decreased the expression of SIRT1, inhibited cell proliferation and induced cell apoptosis in a dose-dependent manner. Moreover, compared with Sirtinol alone (A = 0.546 ± 0.020) or 5-FU alone (A = 0.526 ± 0.023), Sirtinol combined with 5-FU more significantly inhibited the proliferation of PANC-1 cells (A = 0.251 ± 0.017, both P < 0.01).
CONCLUSION: Sirtinol could induce cell proliferation inhibition and apoptosis, and enhance anti-cancer effects of chemotherapy on PANC-1 cells possibly via mechanisms associated with down-regulating SIRT1 expression.
- Citation: Zhang JG, Shi Y, Wang ZF, Hong DF. Effects of Sirtinol on proliferation and 5-FU chemosensitivity of pancreatic cancer PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 86-90
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/86.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.86
化疗是治疗胰腺癌最主要的辅助手段之一, 但不论是单药化疗还是联合化疗, 肿瘤对化疗药物的反应率都不高[1], 因此寻找新的靶点进行干预以增强化疗的效果是胰腺癌治疗研究的关键点之一. 沉默信息调节因子-1(silent information regulator 1, SIRT1)是一种依赖于NAD+的Ⅲ型组蛋白去乙酰化酶, 作为代谢应激感受因子, 在细胞对抗衰老及凋亡中发挥重要作用[2-4]. 最近研究发现, SIRT1在多种肿瘤细胞表达上调, 下调SIRT1的活性可抑制肿瘤的增殖[5,6], 我们前期的研究结果表明SIRT1在胰腺癌中高表达, 这种表达趋势与胰腺癌患者的年龄、肿瘤大小、TNM分期、淋巴结侵袭和远处转移密切相关[7]. 但SIRT1抑制剂在胰腺癌细胞的作用尚未明确. 本研究设想通过应用SIRT1抑制剂Sirtinol, 观察胰腺癌细胞增殖及凋亡改变; 进一步联合应用5-氟尿嘧啶(5-fluorouracil, 5-FU), 初步探讨以SIRT1为干预靶点对于5-FU化疗的增敏效应.
Sirtinol、5-FU、MTT、PMSF及二甲基亚砜(dimethylsulfoxide, DMSO)购自Sigma-Aldrich Chemical Company, Sirtinol用DMSO溶解, 配制成浓度为100 mmol/L储存液, -20 ℃避光保存, 胎牛血清、RPMI 1640购自美国Gibco BRL公司; 兔抗人SIRT1和GAPDH第一抗体购自美国Santa Cruz公司; 辣根过氧化物酶结合的第二抗体、免疫细胞化学试剂购自武汉博士德公司; 凋亡检测试剂盒(ANT0002)购自Antgene公司; RIPA裂解液、ECL发光试剂盒购自Beyotime公司; 胰腺细胞系PANC-1购自中国科学院上海细胞库.
1.2.1 细胞培养: 胰腺癌PANC-1细胞用含有10%胎牛血清的RPMI 1640培养基, 置于37 ℃、5%CO2饱和湿度的CO2培育箱下常规培养.
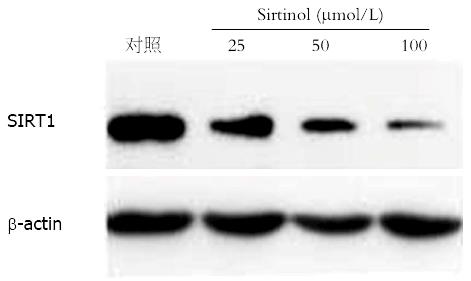
1.2.2 Western blot检测SIRT1蛋白变化: 各组细胞培养48 h后, 提取细胞总蛋白. 总蛋白提取参照Beyotime公司提取方法进行. 分别将相同含量的蛋白样品和2×蛋白上样缓冲液等体积混合, 100 ℃水中煮沸5 min使蛋白变性, 10%SDS-PAGE电泳后电转移至硝酸纤维素膜上, 5 g/L脱脂奶粉封闭后, 加入1:500稀释的第一抗体, 4 ℃孵育过夜, TBS漂洗膜后, 加入1:2000稀释的第二抗体, 室温90 min, TBS漂洗膜后, ECL增强发光, X线曝光5 min. 以GAPDH蛋白作内参照, Bandscan图像分析软件进行光密度积分值分析.
1.2.3 MTT法细胞增殖抑制的测定: 取对数生长期细胞, 消化后计数, 按每孔5×103个接种于96孔培养板中贴壁生长后, 无血清培养细胞24 h, 使细胞同步化, 不同浓度Sirtinol(100 μmol/L)或Sirtinol(100 μmol/L)联合5-FU(50 μg/mL)处理细胞48 h, 阴性对照组无药物作用, 各组DMSO体积分数不超过0.1%. 然后每孔加入浓度为5 mg/mL的MTT 20 μL, 37 ℃孵育4 h后, 小心吸除培养液, 再加入DMSO 200 μL, 混匀后用酶标仪测定570 nm处吸收度(A)值. 每检测点取6个平行孔的平均值, 绘制图, 实验重复3次, 观察药物对细胞生长的抑制作用.
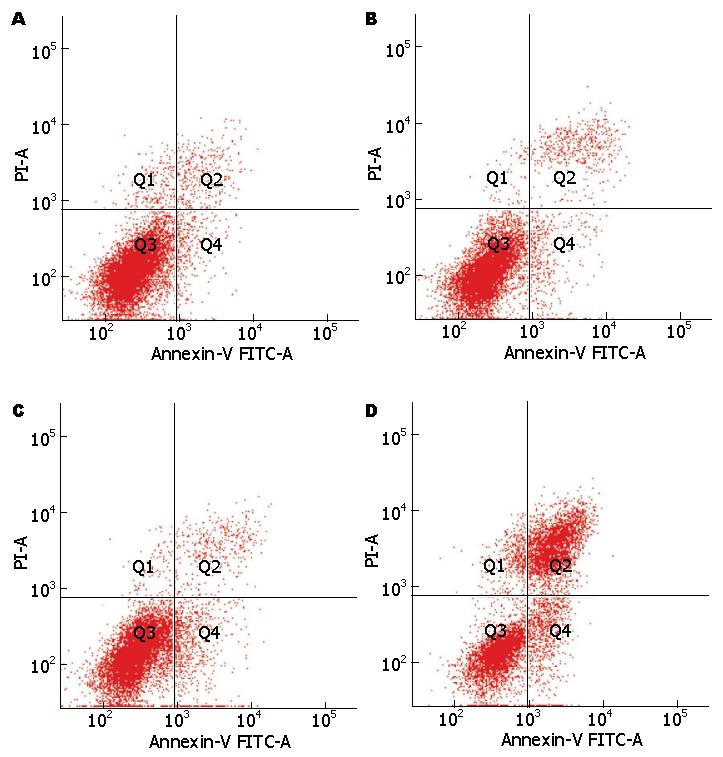
1.2.4 流式细胞术检测细胞凋亡变化: 细胞以每孔4×105个接种于6孔板中, 各组处理细胞48 h后, 收集细胞, 制成单细胞悬液, 消化收集经药物处理过的细胞制成细胞悬液, 按检测试剂盒的说明书(ANT0002)操作, 经药物处理后的细胞, 用带有荧光素FITC的Annexin V和PI同时染色后, 2 h内用流式细胞仪检测. 细胞发生凋亡时, 位于细胞膜内侧的磷脂酰丝氨酸外翻, 由于Annexin-V能特异地与磷脂酰丝氨酸结合, 根据结合量的变化可反映凋亡细胞的百分率.
统计学处理 应用统计学软件SPSS13.0进行统计学分析, 数据经方差齐性检验, 符合正态分布, 以数据以mean±SD表示, 组间比较采用t检验, i<0.05为差异具有统计学意义.
我们采用Western blot的方法, 结果发现不同浓度Sirtinol(25、50、100 μmol/L)作用PANC-1细胞48 h后, SIRT1蛋白的表达明显下降, 且成浓度依赖性, 差异具有显著性(P<0.05)(图1).
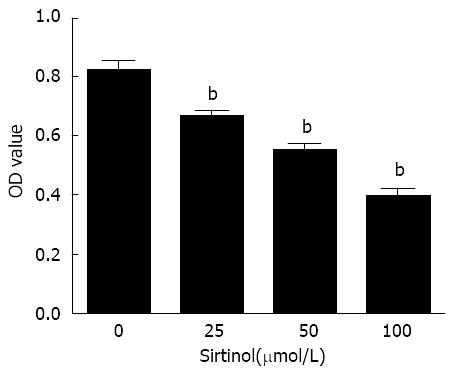
不同浓度Sirtinol作用PANC-1细胞48 h后, 采用MTT法检测其增殖情况. 结果显示, 不同药物组(25、50、100 μmol/L)与对照组(A = 0.816±0.034)相比, 细胞增殖率分别明显降低(A = 0.663±0.025, 0.546±0.029, 0.396±0.027), 有显著差异(P<0.01)(图2).
不同浓度Sirtinol作用PANC-1细胞48 h后, 采用流式细胞术检测细胞凋亡变化. 结果显示, 与对照组(2.70%±0.42%)相比, 25、50和100 μmol/L的Sirtinol引起的细胞凋亡率明显增加(4.85%±0.50%, 7.95%±0.35%和11.05%±0.64%), 差异非常具有显著性(P<0.05)(图3).
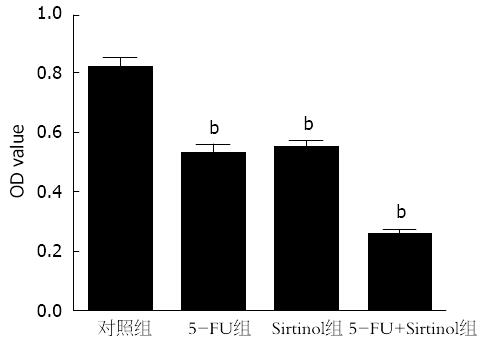
5-FU(25 μg/mL)、Sirtinol(50 μmol/L)以及Sirtinol联合5-FU作用PANC-1细胞48 h后, 细胞增殖A值分别为0.526±0.023、0.546±0.020、0.251±0.017, 明显低于对照组(0.816±0.034, P<0.01), 并且Sirtinol联合5-FU后细胞增殖率也明显低于Sirtinol或5-FU(P<0.01)(图4).
SIRT1是与酵母菌长寿基因SIR2(silent information regulator 2)同源的基因, 主要分布在细胞核中, 其功能是催化在蛋白赖氨酸ε位上的去乙酰化, 调控细胞增殖、凋亡、衰老等过程[8,9]. 多项研究提示SIRT1与肿瘤发生发展密切相关, 但其确切作用则尚未明确. Wang等[10]研究发现SIRT1在胶质母细胞瘤、膀胱癌及卵巢癌中的表达明显低于正常组织, 提出SIRT1可能是抑癌因子. Firestein等[11]证实在老鼠的结肠癌模型中, 通过热量限制在增加SIRT1表达的同时抑制了肿瘤的增殖. 而与此相反, Huffman等[12]研究发现人类前列腺癌组织中的SIRT1表达量比邻近的正常组织表达量高很多, 指示SIRT1可能是一种促癌基因. 同时Ota等[6]观察到发现下调SIRT1表达可以抑制人乳腺癌和肺癌细胞增殖. 我们前期的研究结果表明SIRT1在胰腺癌中高表达, 使用ShRNA干扰SIRT1表达可以抑制胰腺癌细胞增殖[7]. 本研究观察到应用SIRT1抑制剂Sirtinol作用胰腺癌PANC-1细胞株后, SIRT1的表达明显下降, 细胞增殖明显受到抑制而凋亡率增加, 进一步提示SIRT1可能在胰腺癌中发挥促癌作用. 上述多个研究结果的不一致性, 提示SIRT1的具体作用可能有肿瘤异质性.
SIRT1通过P53的去乙酰化来阻止DNA损伤后P53依赖的CDKN1A(编码P21)和BAX的反式激活, 对调控细胞增殖和凋亡起关键的作用[13]. 人类SIRT1的过度表达会通过阻断p53的乙酰化阻断细胞的衰老凋亡[14]. 本研究中应用流式细胞术观察到PANC-1细胞应用Sirtinol后凋亡率显著增加, 同时Western blot检测到应用Sirtinol后细胞SIRT1表达显著降低, 表明Sirtinol抑制PANC-1细胞增殖机制与下调SIRT1表达从而促进细胞凋亡密切相关.
本研究前期结果证实Sirtinol可抑制SIRT1表达从而促进胰腺癌细胞凋亡, 而胰腺癌细胞耐药与凋亡信号密切相关, 因而本研究进一步观察了Sirtinol与5-FU的联合作用. 结果显示, Sirtinol联合5-FU对胰腺癌细胞增殖抑制效应较单独应用Sirtinol和5-FU更为显著, 进一步抑制癌细胞增殖, 表明Sirtnol增加了5-FU化疗敏感性. 与此相似, Kojima等[15]研究发现siRNA干扰技术下调SIRT1的表达, 可能通过诱导凋亡增强了PC3和DU145细胞对喜树碱和顺铂的敏感性. Chu等[16]等发现ShRNA干扰SIRT1能逆转多种肿瘤的耐药性, 其机制是通过降低耐药基因P-glycoprotein的表达. 上述研究结果提示, SIRT1可以作为具有化疗增敏作用的潜在靶点, 其机制可能是通过诱导凋亡通路或降低耐药相关基因, 有待于进一步研究.
本研究结果表明SIRT1可能是胰腺癌的促癌因子, 使用SIRT1抑制剂Sirtinol抑制SIRT1表达可抑制胰腺癌细胞增殖促进凋亡, 同时可通过抑制SIRT1发挥化疗增敏作用, 提高胰腺癌化疗效果.
沉默信息调节因子-1(silent information regulator 1, SIRT1)是一种依赖于NAD+的Ⅲ型组蛋白去乙酰化酶, 在细胞对抗衰老及凋亡中发挥重要作用. SIRT1在多种肿瘤细胞表达上调, 调控癌细胞的生物学行为, 同时与胰腺癌病理特征密切相关. 可见SIRT1是胰腺癌靶向治疗的有效靶点.
潘阳林, 副教授, 副主任医师, 中国人民解放军第四军医大学西京医院消化病医院消化六科
胰腺癌高度耐药, 寻找新的靶点进行干预以增强化疗的效果是胰腺癌治疗研究的热点. SIRT1与胰腺癌耐药密切相关, 寻求沉默SIRT1的有效抑制剂或分子生物学技术是当前亟待解决的问题.
研究报道SIRT1在人乳腺癌, 肺癌和胰腺癌细胞中高表达. Keitaro等发现siRNA干扰SIRT1的表达增强了前列腺癌细胞对化疗的敏感性. Chu等发现ShRNA干扰SIRT1能逆转多种肿瘤的耐药性.
本研究利用SIRT1抑制剂Sirtinol抑制SIRT1表达, 体外研究SIRT1与胰腺癌细胞增殖, 凋亡及5-FU化疗敏感性的关系, 该结果为胰腺癌的化疗提供了一种新的方案.
本文选题有一定的价值, 设计合理, 研究结果较为丰富, 结论可靠.
编辑: 田滢 电编:鲁亚静
| 1. | Berlin JD, Rothenberg ML. Chemotherapeutic advances in pancreatic cancer. Curr Oncol Rep. 2003;5:219-226. [PubMed] [DOI] |
| 2. | Portmann S, Fahrner R, Lechleiter A, Keogh A, Overney S, Laemmle A, Mikami K, Montani M, Tschan MP, Candinas D. Antitumor effect of SIRT1 inhibition in human HCC tumor models in vitro and in vivo. Mol Cancer Ther. 2013;12:499-508. [PubMed] [DOI] |
| 3. | Kozako T, Aikawa A, Shoji T, Fujimoto T, Yoshimitsu M, Shirasawa S, Tanaka H, Honda S, Shimeno H, Arima N. High expression of the longevity gene product SIRT1 and apoptosis induction by sirtinol in adult T-cell leukemia cells. Int J Cancer. 2012;131:2044-2055. [PubMed] [DOI] |
| 4. | Saunders LR, Verdin E. Sirtuins: critical regulators at the crossroads between cancer and aging. Oncogene. 2007;26:5489-5504. [PubMed] [DOI] |
| 5. | Wang J, Kim TH, Ahn MY, Lee J, Jung JH, Choi WS, Lee BM, Yoon KS, Yoon S, Kim HS. Sirtinol, a class III HDAC inhibitor, induces apoptotic and autophagic cell death in MCF-7 human breast cancer cells. Int J Oncol. 2012;41:1101-1109. [PubMed] [DOI] |
| 6. | Ota H, Tokunaga E, Chang K, Hikasa M, Iijima K, Eto M, Kozaki K, Akishita M, Ouchi Y, Kaneki M. Sirt1 inhibitor, Sirtinol, induces senescence-like growth arrest with attenuated Ras-MAPK signaling in human cancer cells. Oncogene. 2006;25:176-185. [PubMed] [DOI] |
| 7. | Zhao G, Cui J, Zhang JG, Qin Q, Chen Q, Yin T, Deng SC, Liu Y, Liu L, Wang B. SIRT1 RNAi knockdown induces apoptosis and senescence, inhibits invasion and enhances chemosensitivity in pancreatic cancer cells. Gene Ther. 2011;18:920-928. [PubMed] [DOI] |
| 8. | Liu T, Liu PY, Marshall GM. The critical role of the class III histone deacetylase SIRT1 in cancer. Cancer Res. 2009;69:1702-1705. [PubMed] [DOI] |
| 9. | Chung S, Yao H, Caito S, Hwang JW, Arunachalam G, Rahman I. Regulation of SIRT1 in cellular functions: role of polyphenols. Arch Biochem Biophys. 2010;501:79-90. [PubMed] [DOI] |
| 10. | Wang RH, Sengupta K, Li C, Kim HS, Cao L, Xiao C, Kim S, Xu X, Zheng Y, Chilton B. Impaired DNA damage response, genome instability, and tumorigenesis in SIRT1 mutant mice. Cancer Cell. 2008;14:312-323. [PubMed] [DOI] |
| 11. | Firestein R, Blander G, Michan S, Oberdoerffer P, Ogino S, Campbell J, Bhimavarapu A, Luikenhuis S, de Cabo R, Fuchs C. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth. PLoS One. 2008;3:e2020. [PubMed] [DOI] |
| 12. | Huffman DM, Grizzle WE, Bamman MM, Kim JS, Eltoum IA, Elgavish A, Nagy TR. SIRT1 is significantly elevated in mouse and human prostate cancer. Cancer Res. 2007;67:6612-6618. [PubMed] |
| 13. | Tang Y, Zhao W, Chen Y, Zhao Y, Gu W. Acetylation is indispensable for p53 activation. Cell. 2008;133:612-626. [PubMed] [DOI] |
| 14. | Langley E, Pearson M, Faretta M, Bauer UM, Frye RA, Minucci S, Pelicci PG, Kouzarides T. Human SIR2 deacetylates p53 and antagonizes PML/p53-induced cellular senescence. EMBO J. 2002;21:2383-2396. [PubMed] [DOI] |
| 15. | Kojima K, Ohhashi R, Fujita Y, Hamada N, Akao Y, Nozawa Y, Deguchi T, Ito M. A role for SIRT1 in cell growth and chemoresistance in prostate cancer PC3 and DU145 cells. Biochem Biophys Res Commun. 2008;373:423-428. [PubMed] [DOI] |
| 16. | Chu F, Chou PM, Zheng X, Mirkin BL, Rebbaa A. Control of multidrug resistance gene mdr1 and cancer resistance to chemotherapy by the longevity gene sirt1. Cancer Res. 2005;65:10183-10187. [PubMed] |