修回日期: 2013-10-24
接受日期: 2013-11-06
在线出版日期: 2014-01-08
低氧诱导因子1(hypoxia inducible factor 1, HIF-1)是细胞在低氧环境下调控的关键因子. 当肝癌的失控生长导致细胞缺氧时, HIF-1的活性显著增强. 为了使肝癌细胞适应低氧微环境, HIF-1通过激活多种与肿瘤生长相关的靶基因, 参与调节了细胞增殖和凋亡、能量代谢、血管生成、侵袭转移以及耐受放疗和化疗等过程, 最终促进了肝癌的发生和发展. 由于HIF-1在肝癌细胞中的特异性表达以及介导肿瘤生长的特性, 以HIF-1为新靶点的药物治疗和基因治疗已经成为目前的热门研究. 这也为今后研发出肝癌的新辅助治疗技术提供了更广阔的思路.
核心提示: 低氧诱导因子1(hypoxia inducible factor 1, HIF-1)在肝癌细胞的增殖凋亡、血管生成、侵袭转移和放化疗耐受性等方面都发挥了重要作用, 因此以HIF-1为新靶点的肝癌辅助治疗得到了人们的广泛关注.
引文著录: 罗东君, 吴俊华. HIF-1在肝癌中作用的研究进展. 世界华人消化杂志 2014; 22(1): 1-8
Revised: October 24, 2013
Accepted: November 6, 2013
Published online: January 8, 2014
Hypoxia inducible factor-1 (HIF-1) is a key regulator of the cellular response to hypoxia. Since cell growth is out of control in hepatocellular carcinoma (HCC), HIF-1 activity is significantly enhanced in HCC to help cells adapt to the hypoxic microenvironment. HIF-1 plays a critical role in the occurrence and development of HCC through activating the target genes that participate in the regulation of cell proliferation and apoptosis, energy metabolism, angiogenesis, invasion and metastasis, resistance to chemotherapy and radiotherapy. Given the specific expression and regulation of HIF-1 in HCC growth, HIF-1 may become a new target for drug therapy and gene therapy, which provides a new avenue for neoadjuvant therapy of HCC in the future.
- Citation: Luo DJ, Wu JH. Roles of HIF-1 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 1-8
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/1.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.1
原发性肝癌是最常见的消化系恶性肿瘤之一, 其发病率和死亡率在我国均排名前3位. 与其他很多恶性肿瘤一样, 肝癌细胞由于增殖失控, 导致供氧不足, 使细胞处于低氧的微环境中. 而低氧诱导因子1(hypoxia inducible factor 1, HIF-1)是低氧条件下最为重要的转录调节因子. 目前, 针对HIF-1的研究主要集中在两方面: 一方面是HIF-1的转录调节机制; 另一方面是以HIF-1为靶点的肿瘤治疗. 而研究HIF-1与肝癌发生发展的关系在肝癌治疗中就具有了重要的意义. 已有临床实验发现, 肝癌患者血清中检测出的HIF-1明显高于其他肝病, 而HIF-1的表达对肝癌的诊断和预后都存在价值[1]. 近几年来, 很多研究显示HIF-1参与了肝癌的细胞增殖、血管生成、侵袭转移等过程, 并且针对HIF-1的肝癌靶向治疗也获得了进展. 因此, 本文综述了HIF-1的调节激活过程, 着重探讨了其在肝癌领域的研究进展.
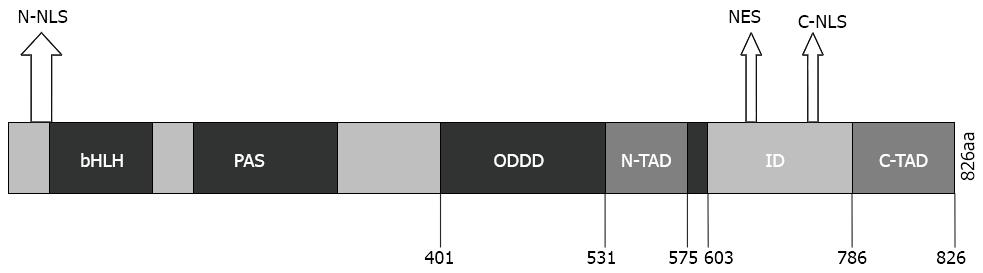
HIF-1是生物细胞为适应低氧条件而产生的一种关键转录因子, 在生理和病理过程中都发挥着重要作用. HIF-1作为一个异源二聚体, 是由功能型α亚基和构成型b亚基共同组成的, 而其生物效应主要是由HIF-1α来完成实现的. HIF-1α由826个氨基酸组成, N端具有一个碱性螺旋-环-螺旋结构域(basic-helix-loop-helix domain, bHLH)和一个PAS(Per-ARNT-Sim)结构域, 这两个结构域共同参与了HIF-1α和HIF-1b的异二聚化以及与靶基因上的低氧反应元件(hypoxia response element, HRE)结合. HIF-1的C端包括两个反式激活区(transactivation domain, TAD), 即N-TAD和C-TAD, 研究表明N-TAD在特异性调节HIF-1靶基因上起主要作用[2], 而C-TAD的主要功能是富集p300/CBP[3]等多种辅助转录因子. 这两个TAD之间的区域称为抑制结构域(inhibitory domain, ID), 在常氧情况下明显抑制HIF-1α的蛋白活性. 此外, 在结构中还存在氧依赖性降解结构域(oxygen-dependent-degradation domain, ODDD), 主要负责常氧下的蛋白降解. 而与介导HIF-1α进出细胞核相关的结构则是两个核定位信号(nuclear localization signal, NLS)及一个细胞核输出信号(nuclear export signal, NES), 其结构分布详如图1. HIF-1b亚基又称芳香烃受体核转运蛋白(ary1 hydrocarbon receptor nuclear translocator, ARNT), 在细胞核内不受氧浓度的影响, 表达稳定.
在常氧条件下, HIF-1α蛋白的合成主要受磷脂酰肌醇-3激酶(phosphatidyl inositol 3-kinase, PI3K)及促分裂源活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路调节. 两条通路分别通过Akt(protein kinase B)mTOR[4](mammalian target of rapamycin)和细胞外信号调节激酶(extracellular regulated protein kinases, ERK)来介导和启动HIF-1α的翻译. 而在缺氧情况下, 大部分蛋白质的合成会受到明显抑制, 但是HIF-1α mRNA的翻译仍可以连续进行, 其机制尚不清楚. 有研究发现, miRNAs可以调节HIF-1α mRNA的翻译过程, 这些小的RNA分子通过与靶基因mRNA碱基配对, 来降解mRNA并阻碍其翻译[5].
合成后的HIF-1α在常氧状态下迅速在细胞质中降解. HIF-1α主要是在脯氨酸羟化酶(proly1 hydroxylases domain-containing protein, PHD)的作用下, ODDD区中第402位和第564位的脯氨酸残基发生羟基化, 羟基化的HIF-1α与肿瘤抑制蛋白VHL(von Hippel-Lindau tumour suppressor protein, pVHL)结合, 后者募集elonginB、elonginC、cullin-2和RBX1(ring-box 1)形成E3泛素连接酶复合体, 使HIF-1α泛素化, 最终被26S蛋白酶体介导降解. 在这个降解过程中, PHD是起关键作用的酶. 经研究, PHD2在调节HIF-1α方面, 比其他3种PHD成员(PHD1、PHD2、P4H-TM)更占优势[6]. PHD2具有氧依赖性, 在缺氧条件下不具有活性, 最终导致了HIF-1α在细胞质中的稳定聚集.
HIF-1α的降解除了受氧依赖性通路的调节外, 其他一些调节因子也影响着HIF-1α的稳定性. 乙酰基转移酶可以使HIF-1α 532位的赖氨酸残基乙酰化, 从而加强pVHL与HIF-1α的结合能力, 使其最终降解. 此外, 接头蛋白RACK1(receptor for activated protein C kinase 1)和热休克蛋白90(heat shock protein 90, Hsp90)通过竞争结合HIF-1α的PAS区域, RACK1增强了HIF-1α与E3连接酶的结合从而促进降解的发生, 而Hsp90则阻止其降解, 起到了稳定HIF-1α的作用. 总之, HIF-1α的稳定性受多方面因素的影响, 目前还有待进一步的研究以完善其调节机制.
HIF-1α可以通过经典的C-NLS-importin α/b通路进入细胞核[7], 此外importin 4和7也可以介导HIF-1α的细胞核输入[8]. 在p42/p44 MAPK的作用下, HIF-1α发生磷酸化, 使其在细胞核中积累, 并增强了转录活性. 磷酸化的HIF-1α与HIF-1b异二聚化形成HIF-1, 然后通过其活化结构域N-TAD和C-TAD与p300/CBP等辅助激活因子结合, 最后形成能识别靶基因的转录复合物.
在常氧状态下, 低氧诱导因子-1抑制因子(factor-inhibiting HIF-1α, FIH-1)可以催化C-TAD上的803位天冬酰胺(Asn803)羟基化, 使HIF-1α不能与CBP/p300相互作用, 抑制其转录活性. 然而, FIH-1的催化作用同PHD类似, 也需要氧气和2-酮戊二酸作为底物. 因此, 在缺氧状态下, FIH-1活性明显下降, 进而允许HIF-1α与辅助因子的结合, 从而发挥转录活性. Lim等[9]研究发现Sirtuin1是一种组蛋白去乙酰酶, 可以抑制HIF-1α的乙酰化水平. 缺氧时细胞内NAD+的减少导致Sirt1活性降低, 间接升高HIF-1α的乙酰化水平, 最终增强HIF-1α对靶基因的转录激活.
HIF-1通过与低氧反应元件结合, 激活一百多种下游靶基因的转录表达, 目前大致可以分为5个方面(表1). 这些靶基因除参与缺氧时细胞稳态的维持、胚胎发育和细胞分化外, 他们在肿瘤生长中发挥的作用成为目前研究的重点.
| 相关类型 | 靶基因或其产物(举例) |
| 血管发生 | 血管内皮生长因子、一氧化氮合酶-2、血小板衍生生长因子B |
| 红细胞生成 | 促红细胞生成素、铁传递蛋白、血浆Í蓝蛋白、亚铁氧化酶 |
| 糖代谢 | 糖酵解酶-1、醛缩酶A、葡萄糖载体1和3 |
| 细胞增殖、分化 | 胰岛素样生长因子-2、转化生长因子、成纤维细胞生长因子 |
| 细胞凋亡 | 细胞凋亡蛋白酶-3、p53、BNIP3 |
肿瘤细胞的快速增殖, 需要消耗大量的能量和氧, 从而导致肿瘤组织处于低氧环境. 在低氧条件下, 肿瘤细胞发生从有氧代谢到无氧代谢的转变. 研究表明, 这种细胞通过无氧糖酵解产生ATP以提供能量的过程, 主要是由HIF-1来调控的[10,11]. HIF-1通过激活相关靶基因, 转录表达出的产物加快肿瘤细胞的糖酵解途径, 大致可分为3个方面: (1)HIF-1激活转录与葡萄糖代谢和糖酵解相关的关键酶类, 如磷酸甘油酸酯激酶1(phosphoglycerate kinase 1, PGK1)、丙酮酸激酶M2(pyruvate kinase M2, PKM2)、己糖激酶2、醛缩酶A等; (2)低氧环境下, HIF-1的高表达会上调其下游靶基因葡萄糖转运蛋白GLUT1和GLUT3, 从而增加肝癌细胞对葡萄糖的摄入量; (3)HIF-1转录表达线粒体相关的酶类, 如丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1, PDK1)可以抑制丙酮酸转化为乙酰辅酶A, 使线粒体氧化磷酸化的水平降低, 减少对氧气的消耗[12]. HIF-1除了能调控肿瘤细胞的糖代谢以外, 还可以上调诸如EPO、胰岛素样生长因子2、转化生长因子α、细胞周期素D1等多种生长因子, 使肝癌细胞得以增殖分化, 适应低氧微环境.
HIF-1对肿瘤细胞的凋亡存在双重的作用. 一方面, 凋亡前体蛋白BNIP3可被HIF-1激活表达, 前者作为促凋亡因子, 诱导细胞的凋亡[13]. 经研究, p53作为一种抑癌基因, 可以直接与HIF-1的ODDD区相结合, 从而诱导细胞程序性死亡[14]. 另一方面, 目前也有很多的报道认为, HIF-1具有抗肝癌细胞凋亡作用. Xu等[15,16]研究发现, Omi/HtrA2在参与肝癌细胞凋亡过程中发挥重要作用, 可能成为肝细胞癌的一个预后指标. 而HIF-1通过阻止Omi/HtrA2从线粒体中释放, 抑制了Omi/HtrA2的表达, 达到抗肝癌细胞凋亡的作用. 研究发现, 针对在低氧条件下培养的HepG2肝癌细胞, HIF-1通过影响细胞周期素A、D的表达, 可促进细胞增殖和阻滞细胞周期, 同时HIF-1也通过诱导生存素和Bcl-2的表达, 抑制了细胞凋亡[17]. Jeon等[18]发现萝卜硫酸可以诱导包括肝癌在内的一些肿瘤细胞发生凋亡, 其作用机制是下调了HIF-1的表达, 从而间接说明了HIF-1具有抗肝癌细胞凋亡能力. 总之, HIF-1对于细胞凋亡的影响, 到底是促凋亡还是抗凋亡, 可能与肿瘤类型, 细胞分化水平以及细胞缺氧程度有关, 目前尚不清楚, 还需要做更多的研究来证实.
肿瘤的迅速生长需要通过新生的血管来运输并获取氧气和营养物质, 而新血管的生成是一个复杂的过程[19], 包括细胞外基质的降解, 血管内皮细胞的激活、增殖、迁移, 重建形成新的血管网. 在血管生成的各个阶段中, 最重要的调节因子是血管内皮生长因子(vascular endothelial growth factor, VEGF) , 其特异性地促进了血管内皮细胞分裂、增殖和迁移. 在肿瘤低氧条件下, 大量累积的HIF-1上调了一系列以VEGF为代表的促血管生成因子的表达, 并且增强了VEGF mRNA的稳定性, 最终实现其对肿瘤血管生成的调控. Lee等[20]用吖啶黄素抑制HIF-1α与HIF-1b的异二聚化结合, 发现肿瘤细胞VEGF表达量明显下降, 再次证明了HIF-1对VEGF的激活调控作用. Wang等[21]通过小鼠模型实验发现, 在肝癌发生20 wk后检测出的HIF-1α、VEGF蛋白及mRNA水平比20 wk前明显增高, 提示了HIF-1和VEGF在肝癌发展中发挥了重要作用. 索拉菲尼作为一种多重激酶的抑制剂, 在肝癌临床试验上发挥了明显的抗癌能力, 其作用机制也被证实与抗肿瘤血管生成密切相关. Liu等[22]研究发现, 索拉菲尼通过有效抑制HIF-1α的表达, 从而降低了VEGF蛋白的表达, 最终导致了肿瘤血管生成的减少.
除了VEGF外, 如血管生成素2(angiopoietin 2)、胎盘生长因子(placental growth factor)、血小板衍生生长因子B(platelet derived growth factor B)和基质衍生因子1(stromal derived factor 1)等许多促血管生成因子也会在低氧条件下, 通过HIF信号通路呈现高表达, 促进肿瘤新血管的生成[23]. Li等[24]研究发现血管生成素相关蛋白4是HIF-1的一个目的靶基因产物, 其通过血管细胞黏附分子和整合素b1, 在肝癌的血管生成和转移方面都发挥了重要作用.
肝癌细胞发生肝内和肝外转移是肝癌患者预后不佳的主要原因. 肿瘤的侵袭转移是一个复杂的过程, 首先要经历的就是一个从上皮细胞向间充质细胞的转化(epithelial-mesenchymal transition, EMT), 在EMT过程中, 具有极性的上皮细胞转化成为具有移动性的间质细胞, 从而获得了可以向远处转移的能力. 在低氧状态下, HIF-1对EMT的进程发挥了关键性作用, 其主要是通过表达调控一系列的相关基因来实现的[25]. 钙黏蛋白E作为一种细胞黏附因子, 一旦失活, 细胞间的黏附性减弱, 移动性增强, 从而导致EMT的发生. HIF-1通过上调钙黏蛋白E的转录抑制因子SNAI1和SIP1, 二者抑制钙黏蛋白E的表达, 使肿瘤细胞易于发生侵袭转移[26]. 针对肝癌, Zhang等[27]最新研究表明, HIF-1可以通过与SNAI1基因启动子上的两个低氧反应元件(hypoxia response elements, HREs)相结合, 来调控SNAI1, 影响着钙黏蛋白E、钙黏蛋白N以及波形蛋白的表达水平, 使肝癌细胞发生EMT, 促进肝癌的转移和侵袭.
细胞基质的降解也是肿瘤转移的重要环节. 低氧条件下, HIF-1会诱导细胞分泌很多的基质金属蛋白酶(matrix metallopreteinases, MMPs), 其通过降解细胞外基质分子, 使肿瘤细胞向基底层浸润[28,29]. 赖氨酰氧化酶(lysyl oxidase, LOX)存在于细胞外基质中, 也影响着基质的结构以促进EMT, 而LOX同样是直接由HIF-1来调节的[30]. Xiang等[31]通过临床分组实验, 分别对36例肝癌淋巴结转移阳性和阴性的患者进行基因检测, 结果发现阳性组中瘤内的HIF-1α、VEGF和MMP-2蛋白水平明显高于阴性组, 从而推测出这3个基因可能是肝癌淋巴结转移的生物学标志物. 研究证明腺病毒介导的短发夹RNA可以抑制肝癌的生长和转移, 其机制也是通过抑制HIF-1来减少血管生成因子和MMP蛋白的表达[32].
最新研究发现PROX1是一个促进肝癌转移的重要因子, 而其促转移活性是由于上调了HIF-1α转录, 并通过招募组蛋白脱乙酰基酶1(histone deacetylase 1, HDAC1)阻止HIF-1α乙酰化, 从而稳定了HIF-1α蛋白, 最终诱导肝癌细胞EMT发生所致[33]. Zhang等[34]最近发现Wnt/b-catenin信号通路可以提高HIF-1α转录活性和阻止肝癌细胞凋亡, 诱导肝癌细胞发生EMT, 参与肝癌转移. 这些研究不仅为我们提供了有潜力的肝癌预后标记物及治疗新靶点, 也再次验证了HIF-1在肝癌侵袭转移方面不可替代的作用.
2.4.1 放疗耐受性: 低氧与肿瘤的研究最初是在肿瘤放射治疗方面获得进展的. 在放疗过程中氧气被激发产生氧自由基, 通过杀伤肿瘤靶细胞来达到放疗的效果. 然而在肿瘤低氧区, 细胞因缺氧产生较少的氧自由基, 从而对放疗产生耐受. 研究表明, 低氧状态下的关键因子HIF-1在肿瘤细胞放疗耐受方面起到了重要作用, 其机制可能与HIF-1促进VEGF及其他血管因子的大量表达, 使血管内皮细胞免受放射线的损伤有关[35]. 而在肝癌方面, 也有研究显示, 用RNA干扰技术抑制HIF-1的表达后, 肝癌细胞对放射的敏感性明显增强[36]. 这也启示我们, 在肝癌临床治疗中, 放疗合并抑制HIF-1的方法可能会起到一个更好的抗癌效果.
2.4.2 化疗耐受性: 实体肿瘤细胞由于处在缺血缺氧的微环境中, 对多种化学药物产生了耐药抵抗作用. 在这个耐药机制中, HIF-1的活性影响了肿瘤细胞的微环境, 并且调控着与耐药相关的因子. Comerford等[37]在10年前就发现HIF-1可以与多药耐药基因(multiple drug resistance 1, MDR1)启动子上的HRE相结合, 从而转录激活MDR1, 最终用来抵抗化疗药物对肿瘤细胞的损伤. Zhu等[38]最近也证实在肝癌细胞中, HIF-1α由ERK/MAPK通路调节, 并且调控表达了多种MDR相关基因, 而后者参与了耐药反应. 三氧化二砷(arsenic trioxide, ATO)作为肝癌的化疗药, 可以起到诱导细胞凋亡, 抑制转移的作用. 然而研究表明, HIF-1参与了肝癌对ATO的耐药, 这一结果也为今后如何克服ATO耐药提供了分子靶点[39].
HIF-1在低氧条件下肝癌细胞发生发展的各个环节中都起到了非常重要的作用. 因此以HIF-1作为分子靶点的抗癌药物和基因治疗成为目前研究的两个热点.
现今, 我们已经筛选出了很多能够有效抑制HIF-1的化学物质. 这些药物有的已经进入临床试验阶段, 而更多的还在实验室阶段. 他们的作用机制包括了抑制HIF-1α蛋白的合成、降解水平、与DNA的结合能力以及转录活性等各个方面[40]. 此外, 有些药物则是阻止诸如PI3K/Akt通路、MAPK通路等HIF-1信号通路的抑制剂[41]. 3-(5'-羟甲基-2'-呋喃基)-1-苯甲基吲唑[3-(5'-hydroxymethyl-2'-furyl)-1-benzyl indazole, YC-1]作为这类抑制剂的代表, 近年来成为研究的重点. Shin等[42]发现YC-1可以降低肝癌细胞中HIF-1α蛋白及其多种下游靶基因的表达, 从而有效抑制了肝癌的侵袭和转移.
近几年来, 研究者把肝癌细胞作为实验对象, 研制出了不少的HIF-1抑制剂. 最近, 有研究发现EF24作为一种与姜黄素相似的分子, 通过上调pVHL来降解HIF-1α, 从而克服肝癌对索拉菲尼的耐药作用. 这表明了EF24与索拉菲尼联合用药可以增强抗癌效果[43]. Yamasaki等[44]利用HepG2人类肝癌细胞, 首次提出了共轭亚油酸可以抑制HIF-1α的稳定性, 从而为今后研发出这类药物提供了思路. Tanaka等[45]发现LS081是促进铁摄入的小分子, 他能够通过增强PHD的活性, 来降解HIF-1α蛋白以达到抗肝癌的作用. 经导管动脉栓塞术(transcatheter arterial embolization, TAE)是一种肝癌非手术的姑息治疗, Liang等[46]通过动物模型, 对白兔VX2肝癌细胞进行了分组试验, 结果发现肝癌细胞在TAE术后其HIF-1α蛋白水平有明显升高. 而羟基喜树碱(hydroxycamptothecin, HCPT)作为HIF-1的抑制剂, 能有效抑制HIF-1的表达, 并且抵抗TAE术后肝癌的血管生成, 增强TAE的治疗效果[47].
随着生物分子学技术的迅速发展, 以各种功能基因作为靶点的肿瘤治疗方法成为目前研究的一个热点. 针对HIF-1与肝癌的关系, 研究者把HIF-1α作为目的基因, 抑制其过表达以及对下游靶基因的激活, 使得以HIF-1α为靶点的基因治疗成为肝癌治疗的一种新辅助手段.
RNA干扰(RNA interfering, RNAi)技术是一种基因沉寂新技术, 其通过构建HIF-1编码基因的小干扰RNA(siRNA)并转染到肿瘤细胞中, 与目的基因mRNA结合使其降解, 以此来抑制HIF-1α的表达. Xu等[48]最近用HIF-1α的siRNA转染小鼠的CBRH-7919肝癌细胞, 结果显示HIF-1α失去活性, 抑制了肝癌细胞的增殖生长. 有研究表明, 靶向HIF-1α和VEGF的siRNA共转染入Hep3B肝癌细胞, 可以起到抗血管生成的作用, 阻止肝癌的转移[49]. 在动物模型实验中, Chen等[50]利用RNAi技术灭活HIF-1α, 发现可以增强TAE术治疗肝癌的效果. MicroRNA(miRNA)是内源性大小与siRNA相似的非编码RNAs, 关于miRNA负性调节肝癌细胞中的HIF-1α, Wang等[51]在临床实验中发现体内呈高水平miRNA-199b的肝癌患者, 存活率较高. 而且miRNA-199b能抵抗肿瘤细胞生长, 提高放疗的敏感性. 这些作用机制都是通过抑制HIF-1α蛋白来实现的.
反义寡核苷酸(antisense oligonucleotides, ASO)技术也是目前研究的重点. ASO是和mRNA完全互补的一个寡聚核苷酸片段, 能够特异性阻断目的mRNA的翻译. 研究发现, HIF-1α的ASO技术可以抑制肝癌细胞增殖, 而且降低了HIF-1α的mRNA表达和蛋白质合成, 这一发现也证明了ASO技术在肝癌治疗中的发展前景[52]. 此外, 也有研究证实, 在小鼠体内反义HIF-1α基因疗法可增强化疗药阿霉素对抗肝癌的疗效, 两者结合可以更加有效地下调VEGF的表达, 抑制肿瘤血管生成和细胞增殖, 促进细胞凋亡[53].
HIF-1作为肝癌细胞适应低氧微环境的重要调节因子, 通过调控下游多个靶基因, 在肝癌细胞的增殖凋亡、血管生成、侵袭转移和放化疗耐受性等方面都起到了重要作用. 而HIF-1作为肝癌治疗的一个新靶点, 也得到了广泛关注. 但是目前针对HIF-1的药物治疗尚处在实验室或临床前研究阶段, 要想真正应用到临床中去, 仍有不少现实问题亟待解决. 如很多研发出的HIF-1抑制剂特异性不高, 对肿瘤的杀伤作用不明显, 尚需要开发或筛选出特异性更高的抑制剂, 方能在临床上应用. 而对于YC-1等研究较为成熟的抑制剂来说, 仍需进一步研究他们的药理和毒理作用, 探讨对正常细胞的不良反应, 以及临床疗效的评估. 以HIF-1为靶点的基因治疗虽然给肝癌治疗带来了新的希望, 但是寻找目的基因只是第一步, 接下来如何去构建安全高效的载体, 如何寻找肝癌的特异性转录调控元件, 如何合理应用多基因联合治疗, 只有真正解决了这些问题, 才能使肝癌的基因治疗从动物实验转向临床应用. 因此, HIF-1在肝癌中的作用仍需进一步深入研究, 而HIF-1的肝癌靶向治疗依然任重道远.
低氧诱导因子1(hypoxia inducible factor 1, HIF-1)作为细胞在低氧条件下调控的关键因子, 通过转录激活多种与肿瘤生长相关的靶基因, 参与调节了肿瘤发生发展的多个环节. 研究HIF-1与肝癌的关系, 一直是被人们所关注. 而HIF-1作为肝癌治疗靶点的可能性使得这方面研究更具临床意义.
杨家和, 教授, 中国人民解放军第二军医大学附属东方肝胆外科医院综合治疗三科
目前, 除了进一步探讨HIF-1的调节转录机制外, 针对HIF-1的肿瘤靶向治疗一直是研究的重点和热点. 而以HIF-1为靶点的药物治疗和基因治疗有望成为肝癌辅助治疗的新策略.
HIF-1在恶性肿瘤发病机制中的研究是近几年来研究的热点, 目前有大量文献报道了HIF-1与消化系肿瘤的关系, 特别是肝癌、结直肠癌的研究较多, 而胃癌、胰腺癌的研究相对较少.
本文系统的介绍了HIF-1的蛋白结构, 合成及降解过程, 转录活性的调节, 并且着重探讨了其在肝癌发生发展各个环节中的作用, 最后提出了研发靶向HIF-1的肝癌药物治疗和基因治疗具有广阔的前景和临床价值.
随着HIF-1抑制剂的不断研发, 以及针对HIF-1的基因疗法如RNA干扰、反义寡核苷酸技术的不断成熟,HIF-1将成为肝癌防治研究的一个新靶点, 这对肝癌的辅助治疗具有新应用前景.
本文选题新颖, 有一定的临床价值. 内容阐述明确, 将HIF-1与肝癌的相关性联系起来, 并引用最新文献, 具有一定的前瞻性.
编辑: 田滢 电编:鲁亚静
| 1. | Li S, Yao D, Wang L, Wu W, Qiu L, Yao M, Yao N, Zhang H, Yu D, Ni Q. Expression characteristics of hypoxia-inducible factor-1α and its clinical values in diagnosis and prognosis of hepatocellular carcinoma. Hepat Mon. 2011;11:821-828. [PubMed] [DOI] |
| 2. | Hu CJ, Sataur A, Wang L, Chen H, Simon MC. The N-terminal transactivation domain confers target gene specificity of hypoxia-inducible factors HIF-1alpha and HIF-2alpha. Mol Biol Cell. 2007;18:4528-4542. [PubMed] [DOI] |
| 3. | Arany Z, Huang LE, Eckner R, Bhattacharya S, Jiang C, Goldberg MA, Bunn HF, Livingston DM. An essential role for p300/CBP in the cellular response to hypoxia. Proc Natl Acad Sci U S A. 1996;93:12969-12973. [PubMed] [DOI] |
| 4. | Jiang BH, Liu LZ. Role of mTOR in anticancer drug resistance: perspectives for improved drug treatment. Drug Resist Updat. 2008;11:63-76. [PubMed] [DOI] |
| 5. | Cha ST, Chen PS, Johansson G, Chu CY, Wang MY, Jeng YM, Yu SL, Chen JS, Chang KJ, Jee SH. MicroRNA-519c suppresses hypoxia-inducible factor-1alpha expression and tumor angiogenesis. Cancer Res. 2010;70:2675-2685. [PubMed] [DOI] |
| 6. | Berra E, Benizri E, Ginouvès A, Volmat V, Roux D, Pouysségur J. HIF prolyl-hydroxylase 2 is the key oxygen sensor setting low steady-state levels of HIF-1alpha in normoxia. EMBO J. 2003;22:4082-4090. [PubMed] [DOI] |
| 7. | Depping R, Steinhoff A, Schindler SG, Friedrich B, Fagerlund R, Metzen E, Hartmann E, Köhler M. Nuclear translocation of hypoxia-inducible factors (HIFs): involvement of the classical importin alpha/beta pathway. Biochim Biophys Acta. 2008;1783:394-404. [PubMed] [DOI] |
| 8. | Chachami G, Paraskeva E, Mingot JM, Braliou GG, Görlich D, Simos G. Transport of hypoxia-inducible factor HIF-1alpha into the nucleus involves importins 4 and 7. Biochem Biophys Res Commun. 2009;390:235-240. [PubMed] [DOI] |
| 9. | Lim JH, Lee YM, Chun YS, Chen J, Kim JE, Park JW. Sirtuin 1 modulates cellular responses to hypoxia by deacetylating hypoxia-inducible factor 1alpha. Mol Cell. 2010;38:864-878. [PubMed] [DOI] |
| 10. | Semenza GL. HIF-1: upstream and downstream of cancer metabolism. Curr Opin Genet Dev. 2010;20:51-56. [PubMed] [DOI] |
| 11. | Semenza GL. Regulation of cancer cell metabolism by hypoxia-inducible factor 1. Semin Cancer Biol. 2009;19:12-16. [PubMed] [DOI] |
| 12. | Denko NC. Hypoxia, HIF1 and glucose metabolism in the solid tumour. Nat Rev Cancer. 2008;8:705-713. [PubMed] [DOI] |
| 13. | Zhang H, Bosch-Marce M, Shimoda LA, Tan YS, Baek JH, Wesley JB, Gonzalez FJ, Semenza GL. Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia. J Biol Chem. 2008;283:10892-10903. [PubMed] [DOI] |
| 14. | Sermeus A, Michiels C. Reciprocal influence of the p53 and the hypoxic pathways. Cell Death Dis. 2011;2:e164. [PubMed] [DOI] |
| 15. | Xu ZQ, Chen XP, Niu J, Liu EY, Li CH, Peng C. [The prognostic significance of Omi/HtrA2 expression, and correlation between Omi/HtrA2 and hypoxia-inducible factor-1α in primary hepatocellular carcinoma cells]. Zhonghua Waike Zazhi. 2012;50:49-52. [PubMed] |
| 16. | Xu Z, Chen X, Peng C, Liu E, Li Y, Li C, Niu J. Hypoxia-inducible factor-1alpha suppressed hepatocellular carcinoma cell apoptosis through influencing on Omi/HtrA2 expression and its releasing from the mitochondrion. Oncol Res. 2012;20:213-220. [PubMed] [DOI] |
| 17. | Xu Z, Liu E, Peng C, Li Y, He Z, Zhao C, Niu J. Role of hypoxia-inducible-1α in hepatocellular carcinoma cells using a Tet-on inducible system to regulate its expression in vitro. Oncol Rep. 2012;27:573-578. [PubMed] [DOI] |
| 18. | Jeon YK, Yoo DR, Jang YH, Jang SY, Nam MJ. Sulforaphane induces apoptosis in human hepatic cancer cells through inhibition of 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase4, mediated by hypoxia inducible factor-1-dependent pathway. Biochim Biophys Acta. 2011;1814:1340-1348. [PubMed] [DOI] |
| 19. | Payne SJ, Jones L. Influence of the tumor microenvironment on angiogenesis. Future Oncol. 2011;7:395-408. [PubMed] [DOI] |
| 20. | Lee K, Zhang H, Qian DZ, Rey S, Liu JO, Semenza GL. Acriflavine inhibits HIF-1 dimerization, tumor growth, and vascularization. Proc Natl Acad Sci U S A. 2009;106:17910-17915. [PubMed] [DOI] |
| 21. | Wang W, Xu GL, Jia WD, Wang ZH, Li JS, Ma JL, Ge YS, Xie SX, Yu JH. Expression and correlation of hypoxia-inducible factor-1alpha, vascular endothelial growth factor and microvessel density in experimental rat hepatocarcinogenesis. J Int Med Res. 2009;37:417-425. [PubMed] [DOI] |
| 22. | Liu LP, Ho RL, Chen GG, Lai PB. Sorafenib inhibits hypoxia-inducible factor-1α synthesis: implications for antiangiogenic activity in hepatocellular carcinoma. Clin Cancer Res. 2012;18:5662-5671. [PubMed] [DOI] |
| 23. | Semenza GL. Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics. Oncogene. 2010;29:625-634. [PubMed] [DOI] |
| 24. | Li H, Ge C, Zhao F, Yan M, Hu C, Jia D, Tian H, Zhu M, Chen T, Jiang G. Hypoxia-inducible factor 1 alpha-activated angiopoietin-like protein 4 contributes to tumor metastasis via vascular cell adhesion molecule-1/integrin β1 signaling in human hepatocellular carcinoma. Hepatology. 2011;54:910-919. [PubMed] [DOI] |
| 25. | Lu X, Kang Y. Hypoxia and hypoxia-inducible factors: master regulators of metastasis. Clin Cancer Res. 2010;16:5928-5935. [PubMed] [DOI] |
| 26. | Evans AJ, Russell RC, Roche O, Burry TN, Fish JE, Chow VW, Kim WY, Saravanan A, Maynard MA, Gervais ML. VHL promotes E2 box-dependent E-cadherin transcription by HIF-mediated regulation of SIP1 and snail. Mol Cell Biol. 2007;27:157-169. [PubMed] [DOI] |
| 27. | Zhang L, Huang G, Li X, Zhang Y, Jiang Y, Shen J, Liu J, Wang Q, Zhu J, Feng X. Hypoxia induces epithelial-mesenchymal transition via activation of SNAI1 by hypoxia-inducible factor -1α in hepatocellular carcinoma. BMC Cancer. 2013;13:108. [PubMed] [DOI] |
| 28. | Erdozain OJ, Pegrum S, Winrow VR, Horrocks M, Stevens CR. Hypoxia in abdominal aortic aneurysm supports a role for HIF-1α and Ets-1 as drivers of matrix metalloproteinase upregulation in human aortic smooth muscle cells. J Vasc Res. 2011;48:163-170. [PubMed] [DOI] |
| 29. | Du R, Lu KV, Petritsch C, Liu P, Ganss R, Passegué E, Song H, Vandenberg S, Johnson RS, Werb Z. HIF1alpha induces the recruitment of bone marrow-derived vascular modulatory cells to regulate tumor angiogenesis and invasion. Cancer Cell. 2008;13:206-220. [PubMed] [DOI] |
| 30. | Erler JT, Giaccia AJ. Lysyl oxidase mediates hypoxic control of metastasis. Cancer Res. 2006;66:10238-10241. [PubMed] [DOI] |
| 31. | Xiang ZL, Zeng ZC, Fan J, Tang ZY, Zeng HY, Gao DM. Gene expression profiling of fixed tissues identified hypoxia-inducible factor-1α, VEGF, and matrix metalloproteinase-2 as biomarkers of lymph node metastasis in hepatocellular carcinoma. Clin Cancer Res. 2011;17:5463-5472. [PubMed] [DOI] |
| 32. | Choi SH, Shin HW, Park JY, Yoo JY, Kim do Y, Ro WS, Yun CO, Han KH. Effects of the knockdown of hypoxia inducible factor-1α expression by adenovirus-mediated shRNA on angiogenesis and tumor growth in hepatocellular carcinoma cell lines. Korean J Hepatol. 2010;16:280-287. [PubMed] [DOI] |
| 33. | Liu Y, Zhang JB, Qin Y, Wang W, Wei L, Teng Y, Guo L, Zhang B, Lin Z, Liu J. PROX1 promotes hepatocellular carcinoma metastasis by way of up-regulating hypoxia-inducible factor 1α expression and protein stability. Hepatology. 2013;58:692-705. [PubMed] [DOI] |
| 34. | Zhang Q, Bai X, Chen W, Ma T, Hu Q, Liang C, Xie S, Chen C, Hu L, Xu S. Wnt/β-catenin signaling enhances hypoxia-induced epithelial-mesenchymal transition in hepatocellular carcinoma via crosstalk with hif-1α signaling. Carcinogenesis. 2013;34:962-973. [PubMed] [DOI] |
| 35. | Schwartz DL, Bankson J, Bidaut L, He Y, Williams R, Lemos R, Thitai AK, Oh J, Volgin A, Soghomonyan S. HIF-1-dependent stromal adaptation to ischemia mediates in vivo tumor radiation resistance. Mol Cancer Res. 2011;9:259-270. [PubMed] [DOI] |
| 36. | Yang W, Sun T, Cao J, Fan S. Hypoxia-inducible factor-1α downregulation by small interfering RNA inhibits proliferation, induces apoptosis, and enhances radiosensitivity in chemical hypoxic human hepatoma SMMC-7721 cells. Cancer Biother Radiopharm. 2011;26:565-571. [PubMed] [DOI] |
| 37. | Comerford KM, Wallace TJ, Karhausen J, Louis NA, Montalto MC, Colgan SP. Hypoxia-inducible factor-1-dependent regulation of the multidrug resistance (MDR1) gene. Cancer Res. 2002;62:3387-3394. [PubMed] |
| 38. | Zhu H, Luo SF, Wang J, Li X, Wang H, Pu WY, Zhang H, Zhuang ZX. Effect of environmental factors on chemoresistance of HepG2 cells by regulating hypoxia-inducible factor-1α. Chin Med J (Engl). 2012;125:1095-1103. [PubMed] [DOI] |
| 39. | Tung JN, Cheng YW, Hsu CH, Liu TZ, Hsieh PY, Ting LL, Ko HL, Chang YJ, Chiou JF, Wu AT. Normoxically overexpressed hypoxia inducible factor 1-alpha is involved in arsenic trioxide resistance acquisition in hepatocellular carcinoma. Ann Surg Oncol. 2011;18:1492-1500. [PubMed] [DOI] |
| 40. | Onnis B, Rapisarda A, Melillo G. Development of HIF-1 inhibitors for cancer therapy. J Cell Mol Med. 2009;13:2780-2786. [PubMed] [DOI] |
| 41. | Wilson WR, Hay MP. Targeting hypoxia in cancer therapy. Nat Rev Cancer. 2011;11:393-410. [PubMed] [DOI] |
| 42. | Shin DH, Kim JH, Jung YJ, Kim KE, Jeong JM, Chun YS, Park JW. Preclinical evaluation of YC-1, a HIF inhibitor, for the prevention of tumor spreading. Cancer Lett. 2007;255:107-116. [PubMed] [DOI] |
| 43. | Liang Y, Zheng T, Song R, Wang J, Yin D, Wang L, Liu H, Tian L, Fang X, Meng X. Hypoxia-mediated sorafenib resistance can be overcome by EF24 through Von Hippel-Lindau tumor suppressor-dependent HIF-1α inhibition in hepatocellular carcinoma. Hepatology. 2013;57:1847-1857. [PubMed] [DOI] |
| 44. | Yamasaki M, Nagatomo T, Matsuyama T, Ikeho Y, Kato E, Nishiyama K, Sakakibara Y, Suiko M, Nishiyama K. Conjugated linoleic acids inhibit hypoxia inducible factor-1α stabilization under hypoxic condition in human hepatocellular carcinoma cells. J Oleo Sci. 2012;61:491-496. [PubMed] |
| 45. | Tanaka H, Li Z, Ikuta K, Addo L, Akutsu H, Nakamura M, Sasaki K, Ohtake T, Fujiya M, Torimoto Y. Iron facilitator LS081 reduces hypoxia-inducible factor-1α protein and functions as anticancer agent in hepatocellular carcinoma. Cancer Sci. 2012;103:767-774. [PubMed] [DOI] |
| 46. | Liang B, Zheng C, Feng G, Wang Y, Zhao H, Liang H, Xiao E. Expression of hypoxia-inducible factor-1alpha in liver tumors after transcatheter arterial embolization in an animal model. J Huazhong Univ Sci Technolog Med Sci. 2009;29:776-781. [PubMed] [DOI] |
| 47. | Liang B, Zheng C, Feng G, Wu H, Wang Y, Zhao H, Li X, Qian J, Liang H. Experimental evaluation of inhibitory effect of 10-hydroxycamptothecin on hypoxia-inducible factor-1α expression and angiogenesis in liver tumors after transcatheter arterial embolization. J Vasc Interv Radiol. 2010;21:1565-1572. [PubMed] [DOI] |
| 48. | Xu LF, Ni JY, Sun HL, Chen YT, Wu YD. Effects of hypoxia-inducible factor-1α silencing on the proliferation of CBRH-7919 hepatoma cells. World J Gastroenterol. 2013;19:1749-1759. [PubMed] [DOI] |
| 49. | Forooghian F, Das B. Anti-angiogenic effects of ribonucleic acid interference targeting vascular endothelial growth factor and hypoxia-inducible factor-1alpha. Am J Ophthalmol. 2007;144:761-768. [PubMed] [DOI] |
| 50. | Chen C, Wang J, Liu R, Qian S. RNA interference of hypoxia-inducible factor-1 alpha improves the effects of transcatheter arterial embolization in rat liver tumors. Tumour Biol. 2012;33:1095-1103. [PubMed] [DOI] |
| 51. | Wang C, Song B, Song W, Liu J, Sun A, Wu D, Yu H, Lian J, Chen L, Han J. Underexpressed microRNA-199b-5p targets hypoxia-inducible factor-1α in hepatocellular carcinoma and predicts prognosis of hepatocellular carcinoma patients. J Gastroenterol Hepatol. 2011;26:1630-1637. [PubMed] [DOI] |
| 52. | WeiXing C, Tiantian H, Qun N, Chaohui Y, Ping X. Inhibitory effect of hypoxia inducible factor-1 antisense oligonucleotide on growth of human hepatocellular carcinoma cells. Med Oncol. 2008;25:88-92. [PubMed] [DOI] |
| 53. | Liu F, Wang P, Jiang X, Tan G, Qiao H, Jiang H, Krissansen GW, Sun X. Antisense hypoxia-inducible factor 1alpha gene therapy enhances the therapeutic efficacy of doxorubicin to combat hepatocellular carcinoma. Cancer Sci. 2008;99:2055-2061. [PubMed] [DOI] |