修回日期: 2013-02-18
接受日期: 2013-02-26
在线出版日期: 2013-03-28
目的: 研究KAP-1在胰腺癌组织和细胞株中的表达及意义.
方法: 采用免疫组织化学方法检测46例胰腺癌标本(高分化15例, 中分化17例,低分化14例)及9例正常胰腺标本中的KAP-1表达; 采用RT-qPCR和Western blot的方法检测8对胰腺癌组织和配对癌旁组织标本中KAP-1的mRNA和蛋白质水平; 采用RT-qPCR和Wsetern blot检测胰腺癌细胞株BxPC3、PANC-1、AsPC-1、SW1990、MIAPaCa-2、CFPAC-1、Capan-1和Capan-2中KAP-1 mRNA和蛋白的表达水平.
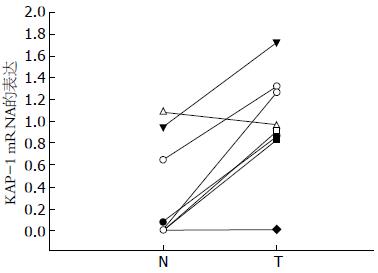
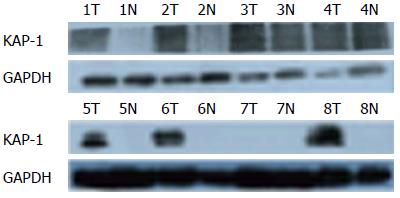
结果: 免疫组织化学结果显示KAP-1在胰腺癌组织中阳性表达率为45.6%(21/46例), 正常胰腺组织中阳性表达率为11.1%(1/9); 在低分化胰腺癌组织中阳性表达率为78.6%(11/14), 中分化胰腺癌组织为47.1%(8/17), 高分化胰腺癌组织为13.3%(2/15); RT-qPCR和Western blot显示在胰腺癌组织中KAP-1的mRNA和蛋白质水平较癌旁正常胰腺组织高, KAP-1的mRNA水平在Panc-1中最高, 在BXPC-3和CFPAC-1中较高, 在SW1990、Capan-1和MIAPaCa-2中较低, 在AsPC-1和Capan-2中最低. KAP-1蛋白质水平在低分化胰腺癌细胞株MIAPaCa-2和Panc-1中高, 来源于肝转移的胰腺癌细胞系CFPAC-1中较高, 其余细胞株中不表达.
结论: KAP-1在胰腺癌组织中高表达, 正常胰腺组织中几乎不表达, 其表达与胰腺癌细胞分化相关; KAP-1可能在胰腺癌发生发展中发挥重要作用.
引文著录: 江建新, 詹磊, 黄洋, 何燕浙, 孙诚谊. KAP-1在胰腺癌中的表达及临床意义. 世界华人消化杂志 2013; 21(9): 829-834
Revised: February 18, 2013
Accepted: February 26, 2013
Published online: March 28, 2013
AIM: To investigate the expression of KAP-1 in pancreatic carcinoma.
METHODS: The expression of KAP-1 protein in 46 pancreatic cancer specimens (including 15 cases of highly differentiated cancer, 17 cases of moderately differentiated cancer, and 14 cases of poorly differentiated cancer) and 9 normal pancreas specimens was detected by immunohistochemistry. The mRNA and protein expression of KAP-1 in 8 cases of pancreatic cancer and matched tumor-adjacent pancreatic tissue and in pancreatic carcinoma cell lines (BxPC3, CAPAN-1, PANC-1, AsPC-1, SW1990, MiaPaCa-2 and CFPAC-1) was also detected by RT-qPCR and Western blot.
RESULTS: The positive rate of KAP-1 expression was 45.6% (21/46) in pancreatic cancer and 11.1% (1/9) in normal pancreatic tissue, and was 78.6% (11/14) in poorly differentiated pancreatic cancer, 47.1% (8/17) in moderately differentiated pancreatic cancer, and 13.3% (2/15) in highly differentiated pancreatic cancer. The mRNA and protein expression of KAP-1 was higher in pancreatic cancer than in matched tumor-adjacent pancreatic tissue. The mRNA expression of KAP-1 was highest in poorly differentiated pancreatic cancer line Panc-1, higher in BXPC-3 and CFPAC-1, lower in SW1990, Capan-1 and MIAPaCa-2, and lowest in AsPC-1 and Capan-2. The protein expression of KAP-1 was highest in poorly differentiated pancreatic cancer line MIAPaCa-2 and Panc-1, higher in CFPAC-1 which is derived from liver metastases of pancreatic cancer cell, and was undetectable in other cell lines.
CONCLUSION: The expression of KAP-1 in human pancreatic cancer tissue is significantly higher than that in normal pancreatic tissue, and KAP-1 expression is involved in pancreatic cancer cell differentiation. KAP-1 may play an important role in the development of pancreatic cancer.
- Citation: Jiang JX, Zhan L, Huang Y, He YZ, Sun CY. Clinical significance of expression of KAP-1 in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 829-834
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/829.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.829
胰腺癌是高度恶性、预后最差的恶性肿瘤之一, 其5年生存率不到5%[1]. 大多数患者因确诊时伴有局部和/或远处的侵袭、转移而丧失手术时机[2], 即使临床手术根治性切除的胰腺癌患者术后也大多数因出现复发和远处转移预后极差, 其原因为术前就有微转移灶形成及其化疗抵抗[3], 胰腺癌的早期转移、对传统的治疗抵抗以及较易复发是其致死的关键因素. 肿瘤干细胞理论解释了上述现象. 胰腺癌干细胞研究表明[4]: 在原发肿瘤里存在一个亚群细胞, 这群细胞具有自我更新、分化潜能以及在异位重新成瘤能力. 同时, 这群细胞还具有侵袭转移和化疗抵抗特性. 最新的研究表明: 胰腺癌在形成之前通过上皮-间质转化(epithelial-to-mesenchymal transition, EMT)形成胰腺癌干细胞, 是其早期发生转移, 治疗抵抗, 复发的根本原因[5]. 我们前期依据文献以MIA-PaCa2(TIChigh)与BxPc-3(TIClow)作为研究胰腺癌干细胞的工具细胞[6], 通过蛋白质组学筛选胰腺癌干细胞相关差异蛋白, 发现KAP-1(KRAB-associated protein 1)在前者表达较后者高10倍多, 并通过检索文献提示KAP-1与EMT和干细胞的"干性"相关[7]. KAP-1是一个97 kDa的核磷蛋白. 人KAP-1基因位于19号染色体, 位置是19q13.4, 共16个外显子. 小鼠KAP-1基因位于7号染色体, 位置是7A2, 共17个外显子. KAP-1具有TIF1家族中常见的保守结构域: N端的RBCC(RING-B box-coiled-coil)结构域、C端保守的PHD型锌指和紧随其后的Bromodomain(BrD)结构域, 中部是该家族内保守度最低的区域, 一般情况下富含脯氨酸, 甘氨酸和丝氨酸[8]. 为了进一步研究KAP-1在胰腺癌及胰腺癌干细胞中的作用, 我们首先检测KAP-1在胰腺癌组织和细胞株中的表达, 探讨其可能的临床意义.
人胰腺癌细胞系PANC-1、AsPC-1、SW1990、MIA-PaCa2、CFPAN-1、BxPC3、Capan-1以及Capan-2购自American Tissue Culture Collection(ATCC); 兔抗人TIF1β单克隆抗体购自美国Cell Signaling公司; 小鼠抗β-actin单克隆抗体购自美国Abcam公司; 荧光定量PCR仪为美国Bio-Rad公司(型号: CFX96); DAB显色试剂盒(武汉百奥斯生物科技有限公司); SP免疫组织化学试剂盒(北京中杉金桥生物技术有限公司).
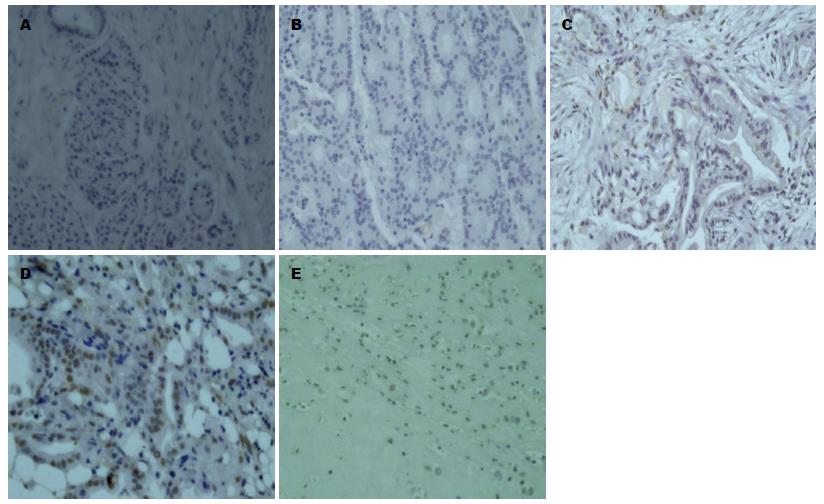
1.2.1 免疫组织化学法检测KAP-1在胰腺癌组织中的表达: 46例胰腺癌标本(高分化15例, 中分化17例, 低分化14例)及9例正常胰腺标本取自本院接受胰十二指肠切除和胰体尾部切除术住院患者术后的胰腺癌和正常胰腺组织石蜡块标本. 均经常规病理检查证实为胰腺癌, 包括胰头部32例、胰尾部14例; 男36例, 女20例, 年龄36-68岁(中位年龄52岁). 手术标本经5 μm厚连续切片, 脱腊、脱水、高温修复抗原、3%双氧水和山羊血清封闭非特异性蛋白后, TIF1β的免疫组织化学染色行链霉素亲和素-过氧化酶复合物法(SP法), TIF1β mAb工作液浓度为1:100, 实验程序严格按照说明书进行, PBS代替一抗作为阴性对照. 结果判断每张切片在400倍光学显微镜下连续找10个视野, 每个视野计数50个肿瘤细胞. KAP-1阳性判断标准以肿瘤细胞内出现棕黄色染色为阳性. 免疫组织化学结果以阳性细胞数所占百分比来表示, 考虑到KAP-1阳性染色的肿瘤细胞较少, 只要在肿瘤细胞中发现KAP-1的阳性染色则判断为KAP-1阳性表达细胞[9].
1.2.2 RT-qPCR检测KAP-1的mRNA表达: 上述8种胰腺癌细胞株按照ATCC提供的培养条件, 进行细胞培养. 按照试剂盒说明书进行操作, 提取8例胰腺癌和癌旁组织以及8种胰腺癌细胞株的总mRNA、去除基因组DNA并合成cDNA后; 根据实时定量PCR试剂盒说明书进行加样. 反应条件: 95 ℃ 5 min, 95 ℃ 30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 45个循环. 实验重复3次. 由随机附带软件LCS480 1.5.039计算Ct值和拷贝数, 利用2-△△Ct法对其进行计算分析(2-△△Ct法以管家基因GAPDH为参照基因, 以BXPC-3样本数据为校准样本, 其他细胞株Ct值与之相比较, 相对分析mRNA表达水平), 其中KAP-1引物: 上游5'-AAGTCTCGGGATGGTGAACG-3', 下游: 5'-CAGACACCTGGCGGATTGA-3', 长度262 bp; GAPDH引物: 上游: 5'-TGACTTCAACAGCGACACCCA-3', 下游: 5'-CACCCTGTTGCTGTAGCCAAA-3', 长度121 bp. (引物序列由软件Beacon designer 7设计, 上海生工生物工程技术服务有限公司合成).
1.2.3 Wsetern blot检测KAP-1的蛋白表达: 上述8种胰腺癌细胞株按照ATCC提供的培养条件, 进行细胞培养. 分别提取上述8例胰腺癌和配对癌旁组织以及8种胰腺癌细胞株的总蛋白; 将提取的蛋白质样本按每孔30 μg上样于12% SDS-PAGE后进行电泳; 用电转移法转移蛋白质至PVDF膜, 然后用5%脱脂奶粉封闭膜1 h. 加入小鼠抗TIF1β单克隆抗体(1:600)后4 ℃孵育过夜, 辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗鼠IgG孵育1 h. 参照免疫印迹化学发光试剂盒说明进行化学发光法显示结果, X线胶片曝光. 实验重复3次, 条带密度采用QuantityOne Program(Bio-Rad)软件进行分析. 目的蛋白的相对表达水平 = 目的蛋白的灰度值/β-actin蛋白的灰度值, 取3次平均值. 采用GAPDH为参照.
统计学处理 采用SPSS17.0对数据进行统计, 计数资料采用两个或多个样本的t检验, P<0.05具有统计学意义.
KAP-1主要为核表达, 在胰腺癌组织中阳性表达率为45.6%(21/46例), 正常胰腺组织中阳性表达率为11.1%(1/9例); 在低分化胰腺癌组织中阳性表达率为78.6%(11/14例), 中分化胰腺癌组织为47.1%(8/17例), 高分化胰腺癌组织为13.3%(2/15例)(图1), 差异有统计学意义(P<0.05).
KAP-1是一种转录中介因子, 在诸多转录调控复合体中起桥梁作用[8]. 他通过其N端RBCC结构域与含KRAB结构域的锌指蛋白、MDM2、MM1、C/EBPβ等相互作用; 通过C端的PHD及BrD结构域与SETDB1、Mi-2α等分子相互作用, 参与形成具有组蛋白甲基化酶或组蛋白去乙酰化酶活性的复合体; 通过中间的HP1BD区域与HP1蛋白相互作用, 进而与组蛋白相结合. 许多研究表明, KAP-1在肿瘤细胞中高表达. Ho等[10]采用蛋白质组学技术筛选KAP-1在乳腺癌中高表达, 且与乳腺癌侵袭转移相关. Yokoe
等[11]证实KAP-1在胃癌中高表达, 且和胃癌的腹腔播散及不良预后相关. 研究也表明KAP-1是维持干细胞的"干性"关键基因之一. Hu等[12]研究表明KAP-1在胚胎干细胞(embryonic stem cell, ES)和胚胎组织中高表达, 在ES分化组织中表达下调, 在胰腺组织中表达极低; RNAi抑制KAP-1的表达能增加分化细胞的百分率. 采用Trim28 ChIP证实KAP-1通过靶向具有多向分化潜能性基因Cnot3、Nanog、Sox2、Tcf3、Il6st和Lefty2启动子区域调节其表达(Trim28-binding sites: GCCGCGXX), 从而维持干细胞的自我更新能力, 是ES自我更新的关键基因之一. Fazzio等[13]的研究也证实了KAP-1在ES的"干性"维持方面发挥重要作用. Wolf等[14]研究表明: F9胚胎癌细胞(embryonal carcinoma, EC)发生分化时, KAP-1的表达水平下调; RNAi抑制KAP-1的表达, F9 EC和JM1 ES生长抑制, 细胞发生分化. Seki等[15]研究证实: KAP-1能改变ES的多向分化潜能或是分化状态, 是这两种状态的临界关卡点. KAP-1在具有多向分化潜能的鼠ES高表达; RNAi抑制KAP-1的表达, 鼠ES显示分化状态. 此外, 磷酸化的KAP-1和特异性多向分化潜能转录因子Oct3/4形成复合物, 能抑制ES的分化, 维持其多向分化潜能, 诱导iPS细胞(诱导多能干细胞iPS Cell). Cammas等[16]也证实了KAP-1在F9 EC分化中的作用. 此外, KAP-1参与EMT发生, 与肿瘤的侵袭转移、化疗耐药相关. Venkov等[17]以SJL/J小鼠肾近端小管上皮细胞株MCT(mIMCD)为研究对象, 采用凝胶迁移或电泳迁移率实验和DNA亲和层析法及后续的质谱分析, 在纤维母细胞特异性蛋白1(fibroblast specific protein 1, FSP1)的近端顺式作用子元件域绑定的蛋白复合物中鉴定出两个蛋白质, 分别为CBF-A和KAP-1. FSP1在人肿瘤细胞中称为S100A4, 在EMT发挥重要作用; S100A4能增加肿瘤细胞的运动和侵袭能力, 导致转移瘤的发生. 最近有研究表明[18]: 在人畸胎瘤细胞系NTera2D1中, KAP-1能在mRNA水平上激活许多EMT相关基因, 如ACTA2、S100A4、SNAI2、TJP1、TJP2、TWIST1、VIM等. KAP-1与乳腺癌的侵袭转移相关[10]. Han等[19]比较结肠癌细胞株HCT-116(具有结肠癌干细胞特性, 对化疗药NSC 724998不敏感)和恶性黑色素瘤细胞株A375(对化疗药NSC 724998敏感)NSC 724998处理前后不同蛋白质表达的变化, 发现KAP-1在治疗后的表达上调, 且KAP-1的Ser824发生磷酸化. 上述这些研究充分表明KAP-1不仅在肿瘤的发生发展中发挥重要作用, 而且与肿瘤干细胞及其生物学功能密切相关.
我们的实验结果显示KAP-1在胰腺癌组织中高表达, 正常胰腺组织中几乎不表达; 在低分化胰腺癌组织中表达最高, 中分化胰腺癌组织中表达较高, 高分化胰腺癌组织中低表达; 这表明KAP-1在胰腺癌的发生发展过程中可能发挥重要作用, 与胰腺癌细胞分化相关. 我们的RT-qPCR、Wsetern blot检测8例胰腺癌和配对癌旁组织中KAP-1的mRNA和蛋白表达结果也证实了上述结果. 在不同分化的细胞系中, KAP-1的蛋白表达在未分化或低分化胰腺癌细胞株MIAPaCa-2和Panc-1中高, 来源于肝转移的胰腺癌细胞系CFPAC-1中表达较高, 其余细胞系中不表达. 这也表明KAP-1与胰腺癌细胞的分化相关. KAP-1的mRNA表达在Panc-1中表达最高, 在BXPC-3和CFPAC-1中较高, 在SW1990、Capan-1和MIAPaCa-2中较低, 在ASPC-1和Capan-2中最低. 这表明KAP-1的蛋白表达可能还受转录后调控. 此外, 我们的研究也表明在具有多药耐药和EMT特性的胰腺癌细胞株MIA-PaCa2、Panc-1中[20]KAP-1高表达, 在而在多药敏感, 且不具有EMT特性的胰腺癌细胞株BxPc-3、Capan-1及Capan-2中无表达. 由于胰腺癌干细胞具有多药耐药和EMT特性, 这也从一个侧面提示KAP-1与胰腺癌干细胞相关.
总之, KAP-1在胰腺癌细胞中高表达, 其表达与胰腺癌细胞的分化相关, KAP-1作为一种转录中介因子, 在诸多转录调控复合体中所起的桥梁作用可能和胰腺癌干细胞"干性"维持相关. 探讨KAP-1的生物学功能及其调控机制, 有助于揭示胰腺癌的发生机制, 发现新的胰腺癌治疗靶点.
胰腺癌的早期转移、对传统的治疗抵抗以及较易复发是其致死的关键因素, 胰腺癌干细胞具有不同分化潜能, 以及侵袭转移和治疗抵抗能力.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 郭俊明, 教授, 宁波大学医学院生物化学与分子生物学研究所
KAP-1在胰腺癌组织及胰腺癌细胞系中的表达和作用未见文献报道, 本文初步研究表明KAP-1在胰腺癌组织中高表达, 正常胰腺组织中几乎不表达, 其表达与胰腺癌细胞分化相关; 为后续的探讨KAP-1在胰腺癌干细胞中的作用及其作用机制研究奠定基础.
Ho等采用蛋白质组学技术证明KAP-1在乳腺癌中高表达, 且与乳腺癌侵袭转移相关. Takeshi等证实KAP-1在胃癌中高表达, 且和胃癌的腹腔播散及不良预后相关. Bingnan等发现KAP-1与化疗耐药相关, 且KAP-1的Ser824发生磷酸化.
本研究检测不同分化程度的临床胰腺癌标本和8种不同分化程度的胰腺癌细胞系中KAP-1的表达水平, 探讨其在胰腺癌与癌旁的表达以及与胰腺癌细胞分化的关系.
研究KAP-1在胰腺癌组织和细胞系中表达与意义, 为后续探讨KAP-1在胰腺癌干细胞中的作用及其作用机制研究奠定基础.
本文研究创新性较好, 具有一定的指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Tuveson DA, Neoptolemos JP. Understanding metastasis in pancreatic cancer: a call for new clinical approaches. Cell. 2012;148:21-23. [PubMed] [DOI] |
| 3. | Lim KH, Chung E, Khan A, Cao D, Linehan D, Ben-Josef E, Wang-Gillam A. Neoadjuvant therapy of pancreatic cancer: the emerging paradigm? Oncologist. 2012;17:192-200. [PubMed] [DOI] |
| 4. | Rasheed ZA, Matsui W. Biological and clinical relevance of stem cells in pancreatic adenocarcinoma. J Gastroenterol Hepatol. 2012;27 Suppl 2:15-18. [PubMed] [DOI] |
| 5. | Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349-361. [PubMed] [DOI] |
| 6. | Kallifatidis G, Rausch V, Baumann B, Apel A, Beckermann BM, Groth A, Mattern J, Li Z, Kolb A, Moldenhauer G. Sulforaphane targets pancreatic tumour-initiating cells by NF-kappaB-induced antiapoptotic signalling. Gut. 2009;58:949-963. [PubMed] [DOI] |
| 8. | Yang D, Jiang Y, He FC. [KAP-1, a scaffold protein in transcription regulation]. Yi Chuan. 2007;29:131-136. [PubMed] [DOI] |
| 10. | Ho J, Kong JW, Choong LY, Loh MC, Toy W, Chong PK, Wong CH, Wong CY, Shah N, Lim YP. Novel breast cancer metastasis-associated proteins. J Proteome Res. 2009;8:583-594. [PubMed] [DOI] |
| 11. | Yokoe T, Toiyama Y, Okugawa Y, Tanaka K, Ohi M, Inoue Y, Mohri Y, Miki C, Kusunoki M. KAP1 is associated with peritoneal carcinomatosis in gastric cancer. Ann Surg Oncol. 2010;17:821-828. [PubMed] [DOI] |
| 12. | Hu G, Kim J, Xu Q, Leng Y, Orkin SH, Elledge SJ. A genome-wide RNAi screen identifies a new transcriptional module required for self-renewal. Genes Dev. 2009;23:837-848. [PubMed] [DOI] |
| 13. | Fazzio TG, Huff JT, Panning B. An RNAi screen of chromatin proteins identifies Tip60-p400 as a regulator of embryonic stem cell identity. Cell. 2008;134:162-174. [PubMed] [DOI] |
| 14. | Wolf D, Goff SP. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 2007;131:46-57. [PubMed] [DOI] |
| 15. | Seki Y, Kurisaki A, Watanabe-Susaki K, Nakajima Y, Nakanishi M, Arai Y, Shiota K, Sugino H, Asashima M. TIF1beta regulates the pluripotency of embryonic stem cells in a phosphorylation-dependent manner. Proc Natl Acad Sci U S A. 2010;107:10926-10931. [PubMed] [DOI] |
| 16. | Cammas F, Herzog M, Lerouge T, Chambon P, Losson R. Association of the transcriptional corepressor TIF1beta with heterochromatin protein 1 (HP1): an essential role for progression through differentiation. Genes Dev. 2004;18:2147-2160. [PubMed] [DOI] |
| 17. | Venkov CD, Link AJ, Jennings JL, Plieth D, Inoue T, Nagai K, Xu C, Dimitrova YN, Rauscher FJ, Neilson EG. A proximal activator of transcription in epithelial-mesenchymal transition. J Clin Invest. 2007;117:482-491. [PubMed] [DOI] |
| 18. | Iyengar S, Ivanov AV, Jin VX, Rauscher FJ, Farnham PJ. Functional analysis of KAP1 genomic recruitment. Mol Cell Biol. 2011;31:1833-1847. [PubMed] [DOI] |
| 19. | Han B, Stockwin LH, Hancock C, Yu SX, Hollingshead MG, Newton DL. Proteomic analysis of nuclei isolated from cancer cell lines treated with indenoisoquinoline NSC 724998, a novel topoisomerase I inhibitor. J Proteome Res. 2010;9:4016-4027. [PubMed] [DOI] |
| 20. | Arumugam T, Ramachandran V, Fournier KF, Wang H, Marquis L, Abbruzzese JL, Gallick GE, Logsdon CD, McConkey DJ, Choi W. Epithelial to mesenchymal transition contributes to drug resistance in pancreatic cancer. Cancer Res. 2009;69:5820-5828. [PubMed] [DOI] |