修回日期: 2013-03-05
接受日期: 2013-03-16
在线出版日期: 2013-03-28
目的: 探讨SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用.
方法: 健康成年SD大鼠36只, 随机分为对照组(12只)、模型组(12只)和模型恢复组(12只). 对照组大鼠生理盐水灌胃, 模型组和模型恢复组大鼠采用"大黄酸混悬液灌胃法"制作"泻剂结肠"动物模型. 模型组造模结束后取材, 模型恢复组造模结束正常饲养30 d后取材. 各组大鼠处死前观察首粒黑便排出时间以检测肠道传输功能. 逆转录聚合酶链反应(RT-PCR)和Western blot技术分别检测各组大鼠结肠组织中c-Kit和SCF的mRNA水平和蛋白水平表达.
结果: 模型组大鼠首粒黑便排出时间明显延长, 与对照组差别显著(491.5±40.2 vs 373.4±46.5, P<0.01); 模型恢复组与模型组相比, 首粒黑便排出时间没有统计学差异(477.9±39.6 vs 491.5±40.2, P>0.05). 与对照组相比, 模型组及模型恢复组的c-Kit和SCF的mRNA水平和蛋白水平表达均明显减弱(P<0.01), 而模型恢复组与模型组相比, c-Kit和SCF的mRNA水平和蛋白水平表达无明显差异(P>0.05).
结论: "泻剂结肠"的结肠动力减退可能与结肠组织中SCF/c-Kit信号通路的表达下调有关.
引文著录: 霍明东, 丁曙晴, 丁义江, 江滨, 张波. SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用. 世界华人消化杂志 2013; 21(9): 809-813
Revised: March 5, 2013
Accepted: March 16, 2013
Published online: March 28, 2013
AIM: To investigate the role of SCF/c-Kit signaling pathway in the pathogenesis of cathartic colon.
METHODS: Thirty-six healthy adult SD rats were randomly divided into three groups (12 rats per group): control group, model group, and recovery group. The control group was given normal saline by gavage, and the model group and recovery group were given rhein suspension by gavage to induce cathartic colon. Specimens were taken immediately after modeling in the model group and 30 days after modeling in the recovery group. The intestinal transit function was assessed in each rats of each group by detecting the first melena discharge time. RT-PCR and Western blot were used to detect SCF/c-Kit mRNA and protein expression levels in colon tissue.
RESULTS: Compared to the control group, the first melena discharge time was significantly prolonged in the model group (491.5 ± 40.2 vs 373.4 ± 46.5, P < 0.01); however, there was no significant difference in the first melena discharge time between the model group and recovery group (477.9 ± 39.6 vs 491.5 ± 40.2, P > 0.05). Compared to the control group, c-Kit and SCF mRNA and protein expression levels were significantly decreased in both the model group and recovery group (all P < 0.01); however, there were no significant differences in c-Kit and SCF mRNA and protein expression levels between the model group and recovery group (both P > 0.05).
CONCLUSION: Reduced colonic motility in rats with cathartic colon may be associated with down-regulation of SCF/c-Kit signaling in colon tissue.
- Citation: Huo MD, Ding SQ, Ding YJ, Jiang B, Zhang B. Role of SCF/c-Kit signaling pathway in the pathogenesis of cathartic colon. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 809-813
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.809
慢传输型便秘(slow transit constipation, STC)是临床上常见的一类以结肠动力减弱为主要特点的顽固性便秘. 该病病因不清, 症状顽固, 常诱发急性心肌梗塞、脑血管意外, 危机患者生命[1]. STC患者往往长期服用番泻叶、大黄等刺激性泻剂, 依赖泻剂排便, 剂量越用越大而效果越来越差, 不服泻剂不排便, 形成"泻剂结肠". 目前, "泻剂结肠"的发病机制尚不清楚, 尚无有效的治疗方法. Cajal间质细胞(interstitial cells of cajal, ICC)是胃肠道起搏细胞, 介导神经递质的产生和作用, ICC异常可导致胃肠动力障碍[2,3]. ICC特异性表达酪氨酸激酶受体c-Kit, c-Kit与其配体干细胞因子(stem cell factor, SCF)组成的SCF/c-Kit信号通路已被证实对ICC具有重要调控作用[4,5]. SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用尚不清楚. 本研究中, 我们通过给予大鼠大黄酸灌胃建立"泻剂结肠"动物模型, 观察停用泻剂后, 肠动力能否恢复, 并探讨SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用, 为"泻剂结肠"的防治提供理论依据.
健康成年SD大鼠36只, 雌雄各半, 体质量180-220 g, 由东南大学医学院实验动物中心提供. 大黄酸(南京泽朗医药科技有限公司). 2%大黄酸混悬液: 每100 mL生理盐水加入大黄酸2 g. 3%戊巴比妥钠溶液: 每40 mL生理盐水加入戊巴比妥钠1.2 g. 逆转录聚合酶链反应(RT-PCR)试剂盒购自大连TAKARA公司. BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶配置试剂盒购自北京碧云天生物技术有限公司. 兔来源GAPDH和c-Kit、SCF多克隆一抗及羊抗兔HRP二抗均购自美国Santa Cruz公司. ECL发光液购自北京博奥森生物技术有限公司.
1.2.1 "泻剂结肠"大鼠模型的建立: 参照文献[6,7]并加以改进, 24只大鼠应用"大黄酸混悬液灌胃法"制作大鼠"泻剂结肠"动物模型. 造模时间共110 d, 经历3个循环. 第1循环隔日灌胃, 1.2 mL/(100 g/次)(即每次每100 g大鼠用1.2 mL大黄酸混悬液灌胃); 第2循环灌胃5 d停2 d, 1.2 mL/(100 g/次); 第3循环灌胃5 d停2 d, 1.6 mL/(100 g/次). 每个循环结束以80%的大鼠稀便消失为标准.
1.2.2 分组: 36只大鼠随机分为: (1)模型组: 12只大鼠, 造模结束后取材; (2)模型恢复组: 12只大鼠, 造模结束正常饲养30 d后取材; (3)对照组: 12只大鼠, 生理盐水灌胃, 生理盐水灌胃频率及用量同模型组, 与模型组同时取材.
1.2.3 首粒黑便排出时间的检测: 各组大鼠处死前均停止灌胃1 wk后, 以10%活性炭悬液3 mL灌胃, 记录从灌胃到首粒黑便排出的时间以反映肠道传输功能.
1.2.4 取材: 3%戊巴比妥钠1 mL/kg腹腔注射麻醉大鼠, 固定, 消毒, 铺无菌孔巾. 取腹部正中切口约3.0 cm切开腹壁各层, 观察腹腔内情况. 取中段结肠组织两块, 迅速投入-180 ℃液氮罐中, 5 h后转移到-70 ℃冰箱冻存, 待RT-PCR和Western blot检测.
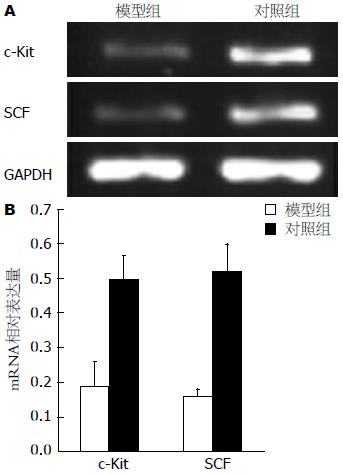
1.2.5 RT-PCR法检测大鼠结肠组织c-Kit和SCF mRNA表达: 总RNA的提取按照异硫氰酸胍法, 稍作改进. 简而言之, 将组织研碎、置于异硫氰酸胍裂解液, 裂解后依次以酚、氯仿、异丁醇抽提, 加入醋酸钠, 在-20 ℃冷异丙醇中沉淀1次, 而后溶于不含RNA酶的水中, -80 ℃冰箱保存. 上述RNA经过DNA酶处理后, 总RNA被逆转录成cDNA, 逆转录所得cDNA在-20 ℃保存. 引物由英骏公司合成, 序列如下: c-Kit(798 bp)的上游引物为: 5'-AGACCGAACGCAACTT-3', 下游引物为: 5'-GGTGCCATCCACTTCA-3'; SCF(756 bp)上游引物: 5'-AAACTGGTGGCGAATC-3', 下游引物: 5'-CACGGGTAGCAAGAAC-3'; GAPDH(609 bp)基因被用作管家基因, 以衡量加样的一致性. GAPDH的上游引物为: 5'-GCCAGCCTCGTCTCA-3', 下游引物为: 下游引物: 5'-CACGCCACAGCTTTCC-3'. PCR反应条件: 94 ℃预变性4 min, 94 ℃变性30 s, 56 ℃(退火温度根据不同引物条件而定)退火30 s, 72 ℃延伸90 s, 共25个循环, 之后72 ℃延伸7 min. PCR产物鉴定: 配制1.7%的琼脂糖凝胶, 加入浓度0.5 μg/mL的溴化乙锭(EB), 每个样本取5 μL PCR产物和2 μL GAPDH PCR产物与2 μL 6×Loading Buffer上样缓冲液混合均匀加入至同一加样孔, 以0.5×TBE为缓冲液, 电压80 V, 电泳约20 min. 上海复日公司Smartview 2001图像分析处理系统对电泳区带进行光密度扫描制片.
1.2.6 Western blot法检测结肠组织中c-Kit及SCF的含量: 200 mg组织经研磨粉碎, 加入1 000 μL新鲜配制的、冷的蛋白裂解液(50 mmol/L Tris-HCl, pH 7.5, 150 mmol/L NaCl, 2 mmol/L EDTA, 1%SDS, 每10 mL加入一片蛋白酶抑制剂), 充分裂解后, 裂解液经4 ℃、14 000 r/min离心10 min, 上清液经BSA蛋白试剂盒测定总蛋白浓度后进行Western blot分析. 取40 μg蛋白与上样缓冲液混合, 煮沸5 min, 置于12%SDS变性聚丙烯酰胺凝胶电泳, 电泳结束后半干电转移法转移至PVDF膜, 室温下1%BSA封闭1h. 加入稀释度1:1 000的羊抗大鼠多克隆抗体(Santa Cruz公司)4 ℃孵育过夜, 第2天用羊抗兔二抗(1:5 000稀释)室温孵育1 h. TBST洗膜, 化学发光法显色, X线底片曝光. GAPDH作为内参照, 实验重复
3次.
统计学处理 采用SAS软件对数据进行统计学分析, 各组数据以mean±SD表示, 组间比较采用单因素方差分析, 包括正态分布检验和方差齐性分析, 如果不符合正态分布改用非参数检验分析. P<0.05被认为有显著性差异.
模型组大鼠首粒黑便排出时间明显延长, 与对照组相比差别显著, 有统计学意义(491.5±40.2 vs 373.4±46.5, P<0.01). 而模型恢复组大鼠与模型组相比, 首粒黑便排出时间没有统计学差异(477.9±39.6 vs 491.5±40.2, P>0.05).
模型组和对照组结肠组织中c-Kit和SCF mRNA表达结果见图1. 在结肠组织中, c-Kit(798 bp)、SCF(756 bp)和GAPDH(609 bp)都得到了有效扩增, 各个标本中GAPDH基因的扩增基本一致, 证实各样本的加样基本均衡. 模型组c-Kit和SCF的mRNA表达较弱, 与对照组相比, 差别显著(P<0.01).
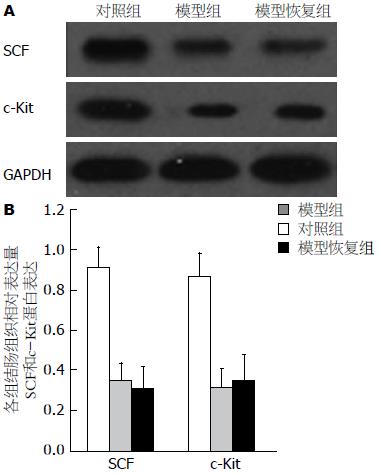
提取各组结肠组织的蛋白作Western blot分析, 比较c-Kit和SCF的蛋白表达(图2). 结果表明, 对照组有较强的c-Kit及SCF蛋白表达. 与对照组相比, 模型组及模型恢复组的c-Kit及SCF蛋白表达明显减弱(P<0.01), 而模型恢复组与模型组相比, c-Kit及SCF蛋白表达均无明显差异(P>0.05).
"泻剂结肠"是STC的一种重要临床类型, 患者长期服用刺激性泻剂如大黄、番泻叶等, 便秘症状逐渐加重, 结肠动力进行性减退, 到后期多是依靠大剂量泻剂维持排便, 最终导致"泻剂结肠". 结肠动力减退和依赖泻剂排便是"泻剂结肠"的主要特点. 目前, "泻剂结肠"的发病机制尚不清楚, 治疗难度很大, 临床上多以对症治疗为主, 停药后症状改善不明显, 部分患者最终须行结肠切除术等毁损性治疗措施, 但治疗效果常不理想, 因此建立"泻剂结肠"动物模型进行结肠动力减退机制的研究对于"泻剂结肠"的防治具有极其重要的意义.
大黄酸是从中药大黄中提取的单体, 化学名"1.8-二羟基-3-羧基蒽醌", 为大黄泻下作用的主要有效成分. 本实验中, 我们采用"大黄酸混悬液灌胃法"制作大鼠"泻剂结肠"动物模型, 结果显示, 模型组大鼠肠道传输时间明显延长, 与对照组相比差别显著(P<0.01), "泻剂结肠"模型成功建立, 同时也提示, 刺激性泻剂可使肠动力减退, 损伤肠道传输功能. 那么, "泻剂结肠"大鼠停用刺激性泻剂后, 肠道传输功能能否改善?本实验中, 模型恢复组大鼠经停用刺激性泻剂30 d后, 与模型组相比, 首粒黑便排出时间未见明显改善(P>0.05).
肠神经系统主要指消化道壁内由大量神经元所构成的巨大神经网络, 包括黏膜下丛、深肌丛及肌间神经丛等, 感知、启动和调控胃肠的运动和分泌功能, 其作用可不依赖中枢神经系统的调控. ICC是介于肠神经系统和平滑肌细胞之间的一类极其特殊的间质细胞, 是胃肠道慢波的起搏细胞, 对肠神经信号传递到效应器平滑肌细胞起重要的调控作用[8,9]. 研究发现, STC患者肠道ICC数量减少,不规则的慢波形成, 结肠传输减慢, 但ICC的减少是疾病进程中的因还是果仍难以确定[10,11]. 酪胺酸激酶受体c-Kit是ICC的特异性标志物, SCF是c-Kit的天然配体, SCF与c-Kit结合后所启动的信号通路, 对ICC的增殖、分化及表型维持至关重要[12,13]. 编码c-Kit的小鼠w位点突变及编码干细胞因子的sl位点突变均可导致胃肠道肌间丛ICC缺失, 肠慢波消
失[14]. 林琳等[15]利用吗啡诱导STC小鼠模型, 发现结肠组织ICC数量减少, c-Kit蛋白和c-Kit mRNA表达均减少. Brading等[16]研究发现微环境中SCF浓度对ICC的培养至关重要, ICC的培养必须依赖SCF才能成活, 不加SCF的培养基ICC基本不能存活. 这些研究结果说明正常的SCF/c-Kit信号通路对ICC的表型维持和生理功能的实现具有不可替代的作用, 而c-Kit和SCF基因的正常表达是维持这一信号通路的必要条件.
我们通过RT-PCR法来观察对照组和模型组中c-Kit和SCF的mRNA水平表达的差异, 研究发现, 与对照组相比, 模型组c-Kit和SCF的mRNA水平表达均明显降低(P<0.01). 同时, 我们通过Western blot技术检测结肠组织中c-Kit和SCF的蛋白表达水平, 结果显示, 模型组c-Kit和SCF的蛋白表达水平也明显降低(P<0.01). 据此可以推测, 刺激性泻剂的长期使用可引起结肠组织中c-Kit和SCF的mRNA和蛋白水平表达的下调, 破坏了正常的SCF/c-Kit信号通路, 进而引起ICC细胞的异常改变, 导致结肠动力减退, 最终形成"泻剂结肠". 本研究还观察了模型恢复组的SCF/c-Kit信号通路情况, 发现与模型组相比, 模型恢复组的c-Kit和SCF的蛋白表达水平均无明显改善(P>0.05), 由此我们推测, 停用泻剂30 d后, SCF/c-Kit信号通路不能恢复正常是"泻剂结肠"大鼠肠道传输功能未见明显改善的重要原因. 因此, 如何能修复SCF/c-Kit信号传导通路, 促进ICC增殖和修复, 从而改善"泻剂结肠"的结肠动力, 值得进一步研究.
便秘是临床常见病与多发病, 随着生活节奏的加快, 饮食结构的改变, 精神和社会因素的影响, 其发病率逐年上升.我国患病率约为10%-15%. "泻剂结肠"是慢传输型便秘的重要临床类型, 目前尚无有效的治疗药物, 其发病机制的研究已经越来越引起人们的重视.
赵铁建, 教授, 广西中医药大学基础医学院生理学教研室; 侯风刚, 副主任医师, 副教授, 上海中医药大学附属市中医医院肿瘤科
ICC对胃肠动力的重要调控作用是近年来关于胃肠动力研究的突破性进展, 有关ICC的调控机制是当今乃至今后的研究热点.
已有研究表明, SCF/c-Kit信号通路对ICC的发育、分化及表型维持至关重要, 但SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用尚未阐明.
本研究通过"大黄酸混悬液灌胃法"制作"泻剂结肠"动物模型, 探讨SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用, 为"泻剂结肠"的防治提供理论依据.
本研究表明, 刺激性泻剂的长期使用引起结肠组织中SCF/c-Kit信号通路的异常改变参与了"泻剂结肠"的发病机制, 对临床"泻剂结肠"的治疗及刺激性泻剂的使用有一定指导意义.
本文以大黄酸复制"泻剂结肠"动物模型, 探讨SCF/c-Kit信号通路在"泻剂结肠"发病机制中的作用, 有一定的创新性.
编辑: 田滢 电编: 鲁亚静
| 1. | El-Salhy M. Chronic idiopathic slow transit constipation: pathophysiology and management. Colorectal Dis. 2003;5:288-296. [PubMed] [DOI] |
| 2. | Davidson RA, McCloskey KD. Morphology and localization of interstitial cells in the guinea pig bladder: structural relationships with smooth muscle and neurons. J Urol. 2005;173:1385-1390. [PubMed] [DOI] |
| 3. | Biers SM, Reynard JM, Doore T, Brading AF. The functional effects of a c-kit tyrosine inhibitor on guinea-pig and human detrusor. BJU Int. 2006;97:612-616. [PubMed] [DOI] |
| 4. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 8. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 9. | Streutker CJ, Huizinga JD, Driman DK, Riddell RH. Interstitial cells of Cajal in health and disease. Part I: normal ICC structure and function with associated motility disorders. Histopathology. 2007;50:176-189. [PubMed] [DOI] |
| 10. | Farrugia G. Interstitial cells of Cajal in health and disease. Neurogastroenterol Motil. 2008;20 Suppl 1:54-63. [PubMed] [DOI] |
| 11. | Lee JI, Park H, Kamm MA, Talbot IC. Decreased density of interstitial cells of Cajal and neuronal cells in patients with slow-transit constipation and acquired megacolon. J Gastroenterol Hepatol. 2005;20:1292-1298. [PubMed] |
| 12. | Li J, Goodyer CG, Fellows F, Wang R. Stem cell factor/c-Kit interactions regulate human islet-epithelial cluster proliferation and differentiation. Int J Biochem Cell Biol. 2006;38:961-972. [PubMed] [DOI] |
| 13. | Bashamboo A, Taylor AH, Samuel K, Panthier JJ, Whetton AD, Forrester LM. The survival of differentiating embryonic stem cells is dependent on the SCF-KIT pathway. J Cell Sci. 2006;119:3039-3046. [PubMed] [DOI] |
| 14. | Seki K, Komuro T. Distribution of interstitial cells of Cajal and gap junction protein, Cx 43 in the stomach of wild-type and W/Wv mutant mice. Anat Embryol (Berl). 2002;206:57-65. [PubMed] [DOI] |
| 16. | Brading AF, McCloskey KD. Mechanisms of Disease: specialized interstitial cells of the urinary tract--an assessment of current knowledge. Nat Clin Pract Urol. 2005;2:546-554. [PubMed] [DOI] |