修回日期: 2013-01-02
接受日期: 2013-03-01
在线出版日期: 2013-03-18
目的: 检测结直肠癌组织中c-Met蛋白表达情况并计数其微血管密度(microvessel density, MVD)值, 探讨两者之间的相互关系, 评价其与结直肠癌临床病理特征的关系.
方法: 对我院病理科2009-2010年经手术切除经病理证实的结直肠癌、癌旁组织及正常组织标本各40例, 采用Western blot和SP法分别检测3种组织中c-Met蛋白表达和CD34标记的MVD.
结果: c-Met蛋白在结直肠癌组织中阳性表达率明显高于结直肠癌旁组织与正常黏膜组织(χ2 = 29.39, P≤0.01). 结直肠癌组织中MVD明显高于结直肠癌旁组织和正常黏膜组织(H = 90.468, P≤0.01). 结直肠癌组织c-Met蛋白表达和MVD与浸润深度(P<0.05)、Dukes分期(P<0.05)、淋巴结转移及远处转移(P<0.05)密切相关, c-Met阳性表达的结直肠癌组织中MVD显著高于c-Met阴性者(t = 3.126, P<0.01).
结论: 结直肠癌患者的c-Met及MVD值高于癌旁组织及正常黏膜组织, 且随着结直肠癌的不断进展, 两者在结直肠癌的侵袭和转移中发挥着重要作用, 联合检测c-Met的表达及MVD可能有助于结直肠癌临床评价和预后判断.
引文著录: 侯雷, 赵明明, 孙宝明, 田艳涛. C-Met蛋白在结直肠癌中的表达及其与肿瘤血管生成的关系. 世界华人消化杂志 2013; 21(8): 734-738
Revised: January 2, 2013
Accepted: March 1, 2013
Published online: March 18, 2013
AIM: To investigate the correlation between expression of c-Met protein and microvessel density (MVD) in colorectal carcinoma and to assess their clinical significance.
METHODS: Immunohistochemical SP method was used to detect the expression of c-Met protein and CD34 (for assessment of MVD) in 40 cases of colorectal carcinoma, 40 cases of tumor-adjacent neoplastic tissue and 40 cases of normal colorectal tissue.
RESULTS: The positive rate of c-Met expression in colorectal carcinoma was significantly higher than that in adenoma and normal tissue (χ2 = 29.39, P < 0.01). The MVD in colorectal carcinoma was also significantly higher than that in adenoma and normal tissue (H = 90.468, P < 0.01). C-Met expression and MVD had no correlation with tumor site and histological stage, but were closely related to Dukes stage, depth of invasion, lymph node metastasis and distant metastasis (all P < 0.05). The MVD in c-Met-positive rectal cancer was higher than that in c-Met-negative rectal cancer (t = 3.126, P < 0.01).
CONCLUSION: C-Met possibly plays an important role in the invasion and metastasis of colorectal carcinoma. Combined detection of c-Met expression and MVD may be helpful for judging prognosis in colorectal carcinoma.
- Citation: Hou L, Zhao MM, Sun BM, Tian YT. Correlation between c-Met expression and tumor angiogenesis in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 734-738
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.734
近年来, 我国结直肠癌发病率呈快速上升趋势, 严重威胁着人们的身体健康. 目前虽然治疗手段多样, 但效果及预后欠佳. 因此确定合理的治疗靶点, 制定更为完善的治疗策略成为目前研究的热点问题. 近年来, 对肿瘤组织微血管密度(microvessel density, MVD)的定量研究表明, MVD与肿瘤的生长、转移和复发有着显著相关性[1]. 原癌基因(c-met)编码的蛋白产物c-Met是肝细胞生长因子(hepatocyte growth factor, HGF)的一个酪氨酸激酶受体, HGF/met信号系统有多种功能, 能促进肿瘤组织的微血管形成和肿瘤细胞的增殖与分裂, c-Met蛋白的异常表达与肿瘤的发生、发展有着密切关系[2]. 结直肠癌组织中MVD与c-Met蛋白表达的相关性及其与临床病理特征关系的研究文献较少, 本实验探讨了结直肠癌组织中MVD值与c-Met蛋白表达的相关性及与结直肠癌临床病理特征的关系.
随机选取2009-09/2010-10在承德医学院附属医院手术切除的结直肠癌标本40例, 其中男22例, 女18例, 年龄38-82岁, 中位年龄62岁. 病理分期按Dukes分期A期11例, B期7例, C期12例, D期10例. 按分化程度分为3组, 高分化腺癌10例, 中分化腺癌14例, 低分化腺癌12例; 根据浸润深度分为两组, 无周围软组织浸润17例, 有周围软组织浸润23例; 根据有无淋巴结转移分为两组, 无淋巴结转移19例, 有淋巴结转移21例. 所有病例均经病理证实, 均无其他严重内科疾病或伴发其他恶性肿瘤, 术前均未接受放疗或化疗. 标本离体30 min内, 经40 g/L甲酫固定后, 常规脱水, 石蜡包埋, 4 μm厚连续切片备用. 鼠抗人CD34单克隆抗体, 浓缩型、SP免疫组织化学试剂盒及多聚赖氨酸防脱片剂均购自北京中山生物技术有限公司. c-Met一抗购自美国Santa Cruz公司, 使用时按1:100稀释.
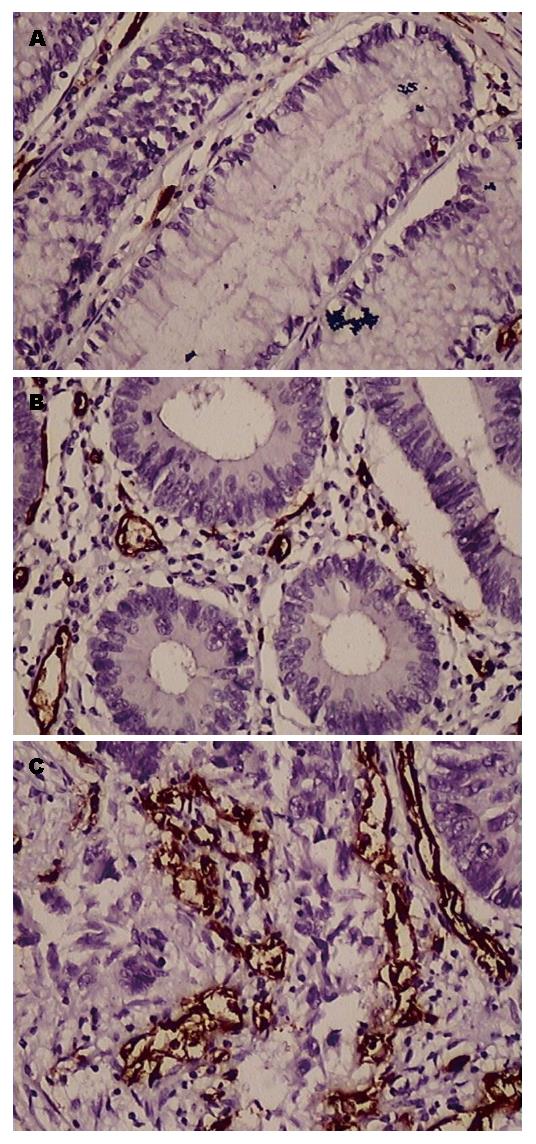
1.2.1 免疫组织化学检测: 按SP试剂盒说明书进行免疫组织化学染色, 4 μm连续切片, 常规脱蜡至水化, 3%H2O2室温孵育20 min, PBS浸泡5 min, 枸橼酸盐缓冲液(0.01 mol/L, pH6.4)孵化(100 ℃)20 min暴露抗原决定簇, 血清封闭, 滴加一抗, 4 ℃过夜, 加二抗、三抗, DAB染色, 苏木素复染, 脱水, 封片. 检测c-Met和CD34在各标本中的表达情况, 以上实验同时设阴性和阳性对照, 阴性对照采用PBS代替一抗.
1.2.2 免疫组织化学结果判断: c-Met呈棕黄色, 主要定位于细胞胞浆. 高倍镜下(400倍)至少选择5个视野, 计数阳性细胞, 并计算阳性细胞百分率. 阳性细胞数<25%为0分, 26%-50%为1分, 51%-75%为2分, >75%为3分. 染色程度根据多数细胞的呈色反应为准, 不着色为0分, 浅棕黄色为1分, 棕黄色为2分, 黄褐色为3分. 根据c-Met染色程度与阳性细胞数评分之和综合判断: 0分为阴性(-), 1-2分为弱阳性(+), 3-4分为阳性(6), 5-6分为强阳性(7).
CD34: CD34的阳性表达位于血管内皮细胞, 呈棕褐色, 深染, 形状不规则. 参照Weidner标准[3]计数MVD. 以同一张切片3个选定区域(200倍光镜视野)视野内微血管数的平均值表示所要测量的微血管密度.
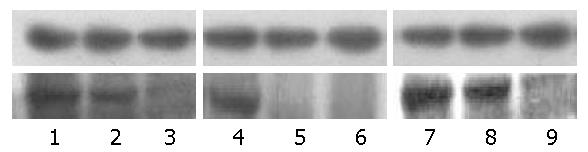
1.2.3 Western blot检测: 提取组织中的总蛋白, BCA法检测蛋白含量. SDS聚丙烯酰胺凝胶电泳, 转膜, 5%脱脂奶粉封闭, TBST洗膜后一抗孵育, 4 ℃过夜, TBST洗膜后二抗室温孵育2 h, DAB显色试剂盒进行显色, 拍照记录实验结果. 用Gel Pro-Analyzer 3.1软件进行分析, 计算目的蛋白与β-actin的光密度比值.
统计学处理 所有数据采用SPSS11.5统计学软件进行统计分析, 实验结果以mean±SD表示, 两个独立样本组间均数比较用t检验, 多组的组间比较用方差分析, P<0.05表示差异有显著性, P>0.05为差异无显著性.
c-Met主要表达在结直肠癌细胞的细胞浆中, 呈棕黄色. 在结直肠癌、结直肠癌旁组织和正常黏膜组织中, c-Met的阳性表达水平分别为0.82±0.21、2.53±0.47和4.12±0.87. c-Met蛋白在结直肠癌组织中表达最高, 在结直肠癌旁组织及正常黏膜组织中表达量依次降低, 三者之间c-Met蛋白的表达情况差异有显著性(P<0.01, 表1, 图1).
| c-Met | P值 | |
| 正常黏膜 | 0.82±0.21 | <0.01 |
| 癌旁组织 | 2.53±0.47 | |
| 癌组织 | 4.12±0.87 |
CD34标记的微血管呈棕褐色. 结直肠癌、结直肠癌旁组织以及正常黏膜组织MVD分别为33.85±8.68、30.00±7.81、12.80±4.09, 差异有统计学意义(H = 90.468, P≤0.01, 表2, 图2).
| 微血管密度 | P值 | |
| 正常黏膜 | 12.80±4.09 | <0.01 |
| 癌旁组织 | 30.00±7.81 | |
| 癌组织 | 33.85±8.68 |
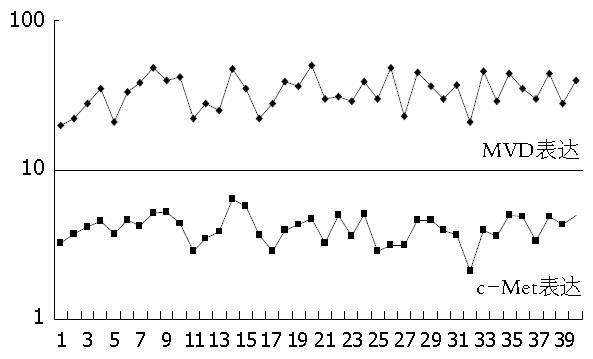
我们对结直肠癌组织中c-Met蛋白的表达情况与微血管密度值进行相关性研究, 经统计学处理, 发现结直肠癌中c-Met蛋白的表达水平与癌组织中微血管密度值有正相关性(R = 0.618, P<0.01). 提示在结直肠癌组织中, 随着c-Met蛋白表达水平的升高, 微血管密度值也相应升高(图3).
结直肠癌组织中c-Met蛋白表达及MVD的水平与肿瘤位置、分化程度、大小及患者的性别、年龄无关, 但与肿瘤浸润深度、Dukes分期、淋巴结转移及远处转移有关(表3).
| 临床病理特征 | n | c-Met | P值 | 微血管密度 | P值 |
| 年龄(岁) | >0.05 | >0.05 | |||
| ≥60 | 17 | 4.08±0.69 | 34.88±8.45 | ||
| <60 | 23 | 4.17±1.10 | 33.8±8.95 | ||
| 性别 | >0.05 | >0.05 | |||
| 男 | 22 | 4.13±0.81 | 33.09±7.45 | ||
| 女 | 18 | 4.12±0.97 | 34.44±10.46 | ||
| 肿瘤部位 | >0.05 | >0.05 | |||
| 直肠 | 18 | 4.35±0.81 | 30.83±8.25 | ||
| 结肠 | 22 | 3.82±0.90 | 35.868.52 | ||
| 病理分级 | <0.05 | >0.05 | |||
| 高分化 | 10 | 3.03±0.87 | 35.10±9.68 | ||
| 中分化 | 14 | 3.73±0.78 | 26.45±9.14 | ||
| 低分化 | 12 | 4.48±0.99 | 35.31±13.17 | ||
| 浸及深度 | <0.05 | <0.05 | |||
| 未及浆膜 | 17 | 3.28±0.87 | 28.41±7.00 | ||
| 浆膜以外 | 23 | 4.37±0.81 | 37.86±7.62 | ||
| Dukes分级 | <0.01 | <0.01 | |||
| A+B | 18 | 3.44±0.54 | 26.44±3.58 | ||
| C+D | 22 | 4.69±0.68 | 40.36±5.44 | ||
| 淋巴结转移 | <0.01 | <0.01 | |||
| 无 | 19 | 3.41±0.55 | 25.88±3.77 | ||
| 有 | 21 | 4.68±0.66 | 40.36±5.44 |
c-met基因是国外学者Cooper于1984年发现的由原癌基因c-met编码的具有酪氨酸激酶活性的跨膜分子[4], 具有调节细胞生长、分化功能. c-met广泛存在于肿瘤细胞和血管内皮细胞, 但不存在于间质细胞[5]. 在国内外关于肿瘤中c-met基因表达的研究发现, 许多恶性肿瘤c-met表达增多, 包括非小细胞肺癌、胃癌、卵巢癌、前列腺癌、甲状腺癌、乳腺癌、头颈部癌、结肠癌和肾癌等[6]. 本次研究结果显示: 随着结直肠癌分化程度的降低、浸润层次的深入、淋巴转移的发生和临床分期的进展, c-Met蛋白表达水平不断升高, 提示了c-Met蛋白的高表达与结直肠癌的发展、浸润、转移有关, 这可能是c-Met蛋白高表达促使肿瘤细胞增殖、分化, 运动能力增强, 增加了肿瘤组织的侵袭性. 国外学者Fazekas等[7]研究也证实, 约50%的结肠癌c-Met蛋白表达增加了5-10倍, 仅10%的结肠癌原发灶有c-met基因扩增, 而转移灶则88%发生了基因扩增. 国内学者吴子刚等[8]研究表明, c-met高表达组淋巴转移多, 说明浸润转移机会大, 与本研究结果与国内外学者研究结果一致. 所以, 监测c-Met蛋白的表达水平有可能为评价结直肠癌生物学行为提供较有价值的评价指标.
近些年来关于有关研究发现肿瘤血管生成是一个多步骤、多因素共同作用的复杂过程, 涉及一系列生理病理及生物化学的改变. 促血管生成因子与血管生成抑制因子之间的共同作用, 决定着肿瘤血管生成表型. 肿瘤组织中的微血管有两种来源: (1)肿瘤细胞产生的血管内皮细胞生长因子, 如血管内皮生长因子(vascular endothelial growth factor, VEGF)等, 诱导瘤体生成微血管; (2)残存于瘤体内的宿主血管逐渐变为肿瘤血管, 即宿主血管的肿瘤化[9]. 肿瘤微血管生成反映恶性肿瘤生物学行为的重要参数, 与多种肿瘤的预后相关[10], 常用特异性高的CD31、CD34[11]荧光标记血管内皮细胞, 来反映MVD的数值. CD34抗体对肿瘤内毛细血管、小血管内皮细胞稳定性及敏感性都较强, 是一种相对分子质量为115×103的糖基化跨膜糖蛋白. CD34抗体是目前检验微血管构筑的较好方法,可重复性强. 本研究显示, MVD在结直肠癌组织中较腺瘤组织和正常黏膜显著增加, 与肿瘤的Dukes分期、浸润深度、淋巴结转移及远处转移密切相关, Takebayashi等[12]研究结果同样也显示, 结直肠癌的MVD与Dukes分期、浸润深度以及淋巴结转移均有明显相关性. 与本组研究相似. 但Bossi与White等[13]研究却认为结直肠癌的MVD与肿瘤临床分期、淋巴结转移之间无显著性相关. 考虑是否与所选取的实验对象的分期与病理类型差异有关. 因此, 结直肠癌的MVD与其浸润、转移的关系尚需进一步研究.
因此我们认为肿瘤的微血管数量是肿瘤患者的危险因素, 数量越多预后越差, 越容易发生转移. 本实验通过联合检测c-Met、MVD, 结果c-Met蛋白在癌组织中明显高于癌旁组织和正常组织, 表明HGF/c-Met信号传导系统很可能参与了结直肠癌的发生发展过程, 并与结直肠癌微血管的生成有一定关系, 且对结直肠癌的浸润、转移可能存在影响. 由于在HGF/c-Met信号传导系统中参与的因子众多, 因此相互之间的关系复杂, 仍然存在着很多问题, 有待于今后的研究. 进一步的研究应对术后的患者进行长期的随访以及复查, 评价c-Met蛋白的表达水平及MVD值与预后生存率、生存时间等远期指标的相关性, 以便更深入的认识结直肠癌的发生发展机制, 为判断患者的预后引进新的指标, 也为肿瘤的药物治疗提供新靶点和新思路.
c-met基因是国外学者Cooper于1984年发现的由原癌基因c-met编码的具有酪氨酸激酶活性的跨膜分子, 具有调节细胞生长、分化的功能. c-met广泛存在于肿瘤细胞和血管内皮细胞, 但不存在于间质细胞.
肖秀英, 副主任医师, 上海市徐汇区中心医院肿瘤科
研究表明, 在许多恶性肿瘤中c-Met的表达量上升, 包括非小细胞肺癌、胃癌、卵巢癌、前列腺癌、甲状腺癌、乳腺癌、头颈部癌、结肠癌和肾癌等.
结直肠癌组织中MVD与c-Met蛋白表达的相关性及其与临床病理特征关系的研究较少, 本实验探讨了结直肠癌组织中MVD值与c-Met蛋白表达的相关性及与结直肠癌临床病理特征的关系.
本文数据可靠, 结果可信, 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Sundov Z, Tomic S, Alfirevic S, Sundov A, Capkun V, Nincevic Z, Nincevic J, Kunac N, Kontic M, Poljak N. Prognostic Value of MVD, LVD and Vascular Invasion in Lymph Node-Negative Colon Cancer. Hepatogastroenterology. 2013; Jan 16. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Goyal L, Muzumdar MD, Zhu AX. Targeting the HGF/c-MET Pathway in Hepatocellular Carcinoma. Clin Cancer Res. 2013; Feb 6. [Epub ahead of print]. [PubMed] |
| 3. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] |
| 4. | Mahtouk K, Tjin EP, Spaargaren M, Pals ST. The HGF/MET pathway as target for the treatment of multiple myeloma and B-cell lymphomas. Biochim Biophys Acta. 2010;1806:208-219. [PubMed] [DOI] |
| 5. | Liu CM, Lin MH, Ying MZ, Lin MH, Wang J, Mao M. The significance of proto-oncogene HGF/SF receptor c-met mRNA expression in nasopharyngeal carcinoma. Chiese-German J Clin Oncol. 2007;6:278-280. |
| 6. | Sierra JR, Tsao MS. c-MET as a potential therapeutic target and biomarker in cancer. Ther Adv Med Oncol. 2011;3:S21-S35. [PubMed] [DOI] |
| 7. | Fazekas K, Csuka O, Köves I, Rásó E, Tímár J. Experimental and clinicopathologic studies on the function of the HGF receptor in human colon cancer metastasis. Clin Exp Metastasis. 2000;18:639-649. [PubMed] |
| 8. | 吴 子刚, 贾 文婷, 陈 东燕, 杨 丽莉, 何 敏, 邹 兵, 王 俊懿, 高 锦. C-met基因表达与大肠腺瘤演化与癌变过程相关性的研究. 中华肿瘤防治杂志. 2008;15:1780-1782. |
| 10. | Matsuda Y, Hagio M, Ishiwata T. Nestin: a novel angiogenesis marker and possible target for tumor angiogenesis. World J Gastroenterol. 2013;19:42-48. [PubMed] [DOI] |
| 11. | Bădescu A, Georgescu CV, Vere CC, Crăiţoiu S, Grigore D. Correlations between Her2 oncoprotein, VEGF expression, MVD and clinicopathological parameters in gastric cancer. Rom J Morphol Embryol. 2012;53:997-1005. [PubMed] |
| 12. | Takebayashi Y, Aklyama S, Yamada K, Akiba S, Aikou T. Angiogenesis as an unfavorable prognostic factor in human colorectal carcinoma. Cancer. 1996;78:226-231. [PubMed] |
| 13. | White JD, Hewett PW, Kosuge D, McCulloch T, Enholm BC, Carmichael J, Murray JC. Vascular endothelial growth factor-D expression is an independent prognostic marker for survival in colorectal carcinoma. Cancer Res. 2002;62:1669-1675. [PubMed] |