修回日期: 2013-02-21
接受日期: 2013-03-01
在线出版日期: 2013-03-18
目的: 探讨粪便miR34b/c甲基化状态的检测在结直肠癌早期诊断中的意义.
方法: 从126例结直肠癌患者癌组织、癌旁组织、粪便和64例正常对照者的粪便中分别提取DNA, 采用多重置换扩增(multiple displacement amplification, MDA)技术对经过亚硫酸氢盐修饰样本进行全基因组扩增, 结合甲基化特异性PCR(methylation-specific PCR, MSP)检测组织和粪便中miR34b/c基因甲基化状态.
结果: 结直肠癌癌组织miR34b/c基因的甲基化阳性率为95.2%(120/126), 对应的癌旁正常组织为11.9%(15/126), 两者比较有显著差异(P<0.01); miR34b/c甲基化状态与各临床病理参数无显著相关(P>0.05). 结直肠癌粪便miR34b/c甲基化阳性率为90.2%(111/123), 显著高于正常对照7.8%(5/64), 差异有统计学意义(P<0.01). 粪便DNA miR34b/c用于结直肠癌早期诊断的敏感性为91.2%, 特异性为92.2%.
结论: miR34b/c甲基化是结直肠癌的重要分子特征, 检测粪便miR34b/c甲基化有望成为结直肠癌早期诊断的一个全新的肿瘤标志物. MDA结合MSP为miRNA的甲基化分析提供了一种较理想的研究手段.
引文著录: 张丰云, 管静芝, 赵慧霞, 李秋文, 董伟伟, 段昕妤, 朱建华, 王如良, 郝怡鑫, 叶明, 肖文华. USP22和Nanog在结肠癌组织中的表达及临床意义. 世界华人消化杂志 2013; 21(8): 724-728
Revised: February 21, 2013
Accepted: March 1, 2013
Published online: March 18, 2013
AIM: To investigate the value of detection of stool miR34b/c methylation in the diagnosis of colorectal cancer.
METHODS: Multiple displacement amplification (MDA) was used to amplify bisulfite modified genomic DNA, and methylation-specific PCR (MSP) was used to analyze methylation of miR34b/c in colorectal cancer tissue and stool DNA from 126 patients with colorectal cancer and stool DNA in 64 patients with benign diseases.
RESULTS: In 126 cancer specimens and matched tumor-adjacent tissue specimens, 95.2% (120/126) and 11.9% (15/126) showed methylation of miR34b/c, and there is a significant difference in the rate of methylation between them (P < 0.01). There was no significant correlation between methylation of miR34b/c and clinicopathologic parameters (all P > 0.05). The rate of methylation of miR34b/c in stool DNA was significantly higher in cancer patients than in patients with benign disease (90.2% vs 7.8%, P < 0.01). The sensitivity and specificity of detection of miR34b/c methylation in diagnosis of colorectal cancer were 90.2% and 92.2%, respectively.
CONCLUSION: The hypermethylation of miR34b/c is frequent in colorectal cancer and may be used as a novel diagnostic biomarker for colorectal cancer. MDA and MSP techniques provide ideal tools for analysis of methylation in trace DNA samples.
- Citation: Zhang FY, Guan JZ, Zhao HX, Li QW, Dong WW, Duan XY, Zhu JH, Wang RL, Hao YX, Ye M, Xiao WH. Clinical significance of detection of stool miR34b/c methylation by MDA-MSP in patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 724-728
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/724.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.724
结直肠癌(colorectal cancer, CRC)是我国最常见的恶性肿瘤之一, 其发病率呈上升趋势, 且晚期患者预后很差, 5年总体生存率较低. 因此, 早期诊断是提高临床治愈率的关键. 然而, 到目前为止尚无理想的早期筛查或诊断结直肠癌的非侵入性手段[1]. 近年来研究认为miRNAs通过对多种基因的调节广泛参与恶性肿瘤的发生和发展, 还发现大约50%的miRNAs基因组富含CpG序列, 是表观遗传沉默的重要靶点[2-4]. 前期研究表明: 在结直肠癌中, miR34b/c存在高频率的甲基化异常, 是结直肠癌的一重要分子特征[5,6]. 结直肠癌脱落的癌细胞或分泌的游离DNA通过粪便排出体外, 粪便DNA中也存在较高比例的肿瘤DNA. 因此, 检测粪便miR34b/c基因甲基化有可能成为新的结直肠癌早期诊断或筛查的生物标志物. 本文采用多重置换扩增(multiple displacement amplification, MDA)技术联合巢式甲基化特异性PCR(methylation-specific PCR, MSP)技术分析了126例结直肠癌患者粪便miR34b/c基因甲基化状态, 以探讨其在结直肠癌早期诊断中的应用价值.
1.1.1 标本收集: 肿瘤组织标本均来自我院普外科和肝胆外科2011-06/2012-08住院结直肠患者, 男67例, 女59例, 年龄为38-82岁, 中位年龄52岁. 所有组织标本均经病理学检查证实. 术前取肿瘤患者粪便, 半小时之内送实验室提取DNA, -20 ℃保存; 并同期选择年龄相匹配的64例正常对照者(37例腹股沟疝患者, 27例下肢静脉曲张患者)作为粪便检测的对照. 大肠癌患者术后立即取癌组织、癌旁组织标本, 分装并-80 ℃保存. 所有患者在术前均未接受过化疗或放疗, 所有研究对象均知情同意并签署知情同意书. 组织DNA提取试剂盒: 天根组织基因组DNA提取试剂盒; 全血DNA提取试剂盒: 天根全血基因组DNA提取试剂盒; 亚硫酸盐处理试剂: Wizard DNA Clean-up system(Promega公司)、EZ DNA MethylationTM-Direct Kit; X-SssI内切酶(英国NEB公司); 对亚硫酸氢盐转化的DNA进行全基因组扩增试剂盒: EpiTect Whole Bisulfitome Kit(德国Qiagen); PCR扩增试剂: HotstarTaq DNA polymerase(德国Qiagen).
1.2.1 基因组DNA的提取: (1)组织DNA的提取: 组织应先打碎处理为细胞悬液, 蛋白酶K消化, 然后参照说明书提取DNA; (2)粪便DNA的提取: 取100-200 mg粪便, 用stool DNA Extraction Kit提取DNA, 操作按说明进行, 最后用紫外分光光度仪检测纯度及含量; (3)全血DNA的提取: 用天根生化的全血基因组DNA提取试剂盒提取正常人外周血样本中基因组DNA, 操作步骤按说明书进行. 提取DNA后用SssⅠ处理的正常人淋巴细胞基因组作为阳性对照, 未经处理的淋巴细胞基因组作为阴性对照.
1.2.2 基因组DNA的亚硫酸氢盐修饰: 组织基因组DNA参照"Wizard DNA Clean-up system"试剂盒进行修饰; 全血和粪便基因组DNA的亚硫酸氢钠修饰: 参照"EZ DNA Methylation TM-Direct Kit"试剂盒说明书进行.
1.2.3 MDA对亚硫酸氢盐转化的DNA进行全基因组扩增: 使用EpiTect Whole Bisulfitome Kit扩增试剂盒进行全基因组扩增, 即取5 μL亚硫酸氢钠修饰的DNA, 加入5 μL 灭菌水, 再加入在冰上配制的1 μL REPLI-g Midi DNA polymerase和29 μL EpiTect WBA Reaction Buffer反应混合液, 振荡混匀, 在28 ℃等温全基因组扩增反应8 h, 然后95 ℃ 5 min终止反应, 4 ℃保存.
1.2.4 甲基化特异性PCR和电泳分析: miR34b/c甲基化及非甲基化引物参照参考文献[7], 引物序列、退火温度和扩增产物长度(表1); PCR引物由上海生工生物工程有限公司合成. 取2 μL经过MDA扩增的基因组DNA为模板, PCR反应体系为25 μL: 10×Buffer 2.5 μL, Mg2+ 0.5 μL, TaqDNA聚合酶0.2 μL, dNTP 2 μL, 甲基化和未甲基化上、下游引物各1 μL, 经过MDA扩增的基因组DNA 2 μL为模板, 灭菌用水15.8 μL. 同时设立阳性对照、阴性对照和空白对照. PCR循环参数: 95 ℃ 10 min, 95 ℃ 30 s, 59 ℃ 30 s, 72 ℃ 30 s, 以上步骤共40个循环, 72 ℃延伸7 min. 经上述PCR扩增后, 将5 μL PCR产物在2%琼脂糖凝胶上进行电泳, 用凝胶成像系统观察结果并拍照.
| 基因 | 引物序列 | 退火温度(℃) | 片段大小(bp) |
| miR34b/c-UF | 5'-TGGTTTGTGGGGTTTTAAGG-3' | 59 | 147 |
| miR34b/c-UR | 5'-TCCCAACCCCAAACCCTA-3' | ||
| miR34b/c-MF | 5'-ATTCGTTTCGTTTCGCGTTCGTTTC-3' | 59 | 128 |
| miR34b/c-MR | 5'-CTAAAACTAACTCTCTCGACCCCG-3' |
统计学处理 采用SPSS13.0统计软件进行数据分析; 各标本miR34b/c甲基化检出率之间的比较, 采用χ2检验, P<0.05认为统计学具有显著性差异; P>0.05则认为统计学上无显著性差异. 诊断的敏感性和特异性的计算采用相应公式计算.
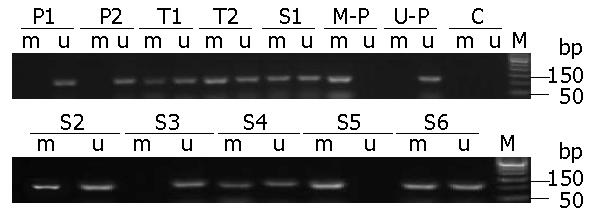
在126例结直肠癌组织中, 95.2%(120/126)检测出miR34b/c基因甲基化, 在对应的癌旁正常组织只有11.9%(15/126)检出甲基化, 二者比较有极显著性差异(P<0.01, 图1).
在126例结直肠癌患者粪便标本中, 有3例未能有效扩增; 在剩余123例标本中, 90.2%(111/123)检测出miR34b/c基因甲基化, 而对照粪便miR34b/c甲基化检出率为7.8%(5/64). 与肿瘤组织标本miR34b/c甲基化检出情况相比, 在所有120例miR34b/c甲基化阳性的癌组织标本中, 只有111例粪便标本为阳性; 癌组织为阴性的标本, 对应的粪便标本也均为阴性, 提示粪便标本miR34b/c甲基化检出率的敏感性稍有下降, 但特异性无改变. 粪便miR34b/c基因甲基化诊断结直肠癌的敏感性为91.2%, 特异性为90.2%.
本实验对所有120例结直肠癌组织和111例结直肠癌患者粪便miR34b/c基因甲基化与患者性别、年龄、肿瘤位置、临床分期和病理分级的相关性进行了检验分析, 未发现他们之间的相关性(P>0.05, 表2).
| 观察项目 | 组织标本 | 粪便标本 | ||||||
| n | 甲基化 | 未甲基化 | P值 | n | 甲基化 | 未甲基化 | P值 | |
| 性别 | 0.795 | 0.789 | ||||||
| 男 | 67 | 63 | 4 | 66 | 60 | 6 | ||
| 女 | 59 | 57 | 2 | 57 | 51 | 6 | ||
| 年龄(岁) | 0.523 | 0.212 | ||||||
| >65 | 47 | 46 | 1 | 46 | 44 | 2 | ||
| ≤65 | 79 | 74 | 5 | 77 | 66 | 10 | ||
| 肿瘤位置 | 0.747 | 0.132 | ||||||
| 近端 | 39 | 38 | 1 | 39 | 38 | 1 | ||
| 远端 | 87 | 82 | 5 | 84 | 73 | 11 | ||
| 临床分期 | 0.555 | 0.766 | ||||||
| I | 12 | 11 | 1 | 11 | 9 | 2 | ||
| II | 52 | 50 | 2 | 52 | 47 | 5 | ||
| III | 48 | 46 | 2 | 47 | 43 | 4 | ||
| IV | 14 | 13 | 1 | 13 | 12 | 1 | ||
| 病理分级 | 0.342 | 0.645 | ||||||
| I | 38 | 37 | 1 | 36 | 34 | 2 | ||
| II | 52 | 49 | 3 | 51 | 45 | 6 | ||
| III | 36 | 34 | 2 | 36 | 32 | 4 | ||
miRNA是一类19-25 bp的保守非编码、单链RNA, 具有高效率的调节基因表达的作用. 一个miRNA可与多个, 甚至上百个靶基因mRNA 3'端特异性结合, 导致mRNA的降解或蛋白质翻译的抑制, 在转录后水平调节基因的表达, 参与调控细胞增殖和凋亡等重要的细胞生命活动, 提示miRNA在肿瘤形成过程中可能扮演着重要的角色[8,9]. 许多研究发现部分miRNA在结直肠癌组织中是低表达或不表达, 进一步研究发现这些miRNA是由于高甲基化而失去表达的[10,11]. 2008年Toyota等[5]发现miR34b/c在结直肠癌中存在高频率的高甲基化, 100%(9/9)的结肠癌细胞系被甲基化, 90%(101/111)的结肠癌组织被甲基化, 采用DNA甲基转移酶抑制剂5-脱氧杂氮胞苷可通过去甲基化作用诱导结肠癌细胞株miR34b/c的表达, 证实了miR34b/c甲基化和其低表达的因果关系. 2011年Kalimutho等[7]进一步证实了Toyota的发现, 在82例结直肠癌中, 97.5%的病例显示miR34b/c甲基化, 并发现75%的粪便DNA miR34b/c甲基化. 该研究表明: 尽管粪便DNA miR34b/c的甲基化的检出率明显低于组织的甲基化检出率, 但75%的阳性率仍可作为结直肠癌早期筛查分子标志物. 粪便DNA甲基化检出率较低的原因主要是模板DNA含量较低, 尤其是经亚硫酸氢盐处理后, 模板DNA含量更低和粪便中存在的PCR反应抑制因子. 因此, 如何进一步提高粪便靶DNA含量和减少粪便中的抑制因子是提高肿瘤基因的检出率的关键. 近几年发展起来的MDA技术是专门用于低含量DNA的扩增, 他是基于环状滚动扩增(strand displacement amplification, SDA)方法创建的链置换扩增技术. 该技术利用phi29DNA聚合酶和6聚体随机引物在30 ℃恒温下对基因组进行大量扩增, 是一种扩增效率高, 保真性能好的新兴的全基因组扩增技术, 在单基因遗传病研究领域发挥了重要作用[12-14]. 近几年也用于亚硫酸氢盐处理的DNA全基因组扩增, 取得了非常理想的效果[7]. 此外, 粪便要新鲜, 放置不能过长, 采用粪便DNA提取专用试剂盒也有利于高质量粪便DNA的提取. 本文采用敏感的MDA技术联合MSP技术发现95.2%的结肠癌组织存在miR34b/c基因甲基化, 与Kalimutho等[7]报道结果一致. 但粪便的阳性率(90.2%)却明显高于Kalimutho报道的75%的阳性率. 分析其原因可能是本实验除了采用增加模板DNA的MDA技术外, 更重要的是在本实验中新鲜粪便标本的取材到DNA的提取时间短, DNA破坏少, 可获得更多的粪便DNA. 此外, 在本研究中, 远端结肠癌, 尤其是直肠癌病例较多, 是否会影响miR34b/c检出结果, 尚需进一步研究. 尽管我们采用了高敏感的MDA技术, 但特异性并没有受到影响. 尽管有文献报道: 老年人正常细胞的甲基化水平较高, 尤其是右半结肠低分化黏液癌的发生与微卫星不稳定和甲基化异常有关. 但是, 在本实验中, 我们未发现miR34b/c甲基化与年龄、性别、临床分期、病理分级和癌位置有相关性. 总之, 优化甲基化检测的各个环节, 将显著提高miR34b/c甲基化的检出率. 粪便miR34b/c甲基化将成为新的结直肠癌早期诊断的生物标志物.
结直肠癌的发病率呈现出逐年上升的趋势, 其发病率已上升至第3位; 早期结直肠癌治愈率较高, 但晚期预后差. 因此, 寻找结肠癌的早期诊断方法对提高结直肠癌的治愈率极为关键. 研究发现miR34b/c在结直肠癌中存在高频甲基化异常, 因此检测结直肠癌组织和粪便中的miR34b/c有助于早期诊断或筛查结直肠癌.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
利用粪便中miRNA作为筛查或诊断结直肠癌的标志物, 已成为目前研究热点, 如何提高粪便中靶DNA高检出率是关键.
Kalimutho等在82例结直肠癌中, 97.5%的病例显示miR34b/c甲基化, 并发现75%的血浆DNA miR34b/c甲基化. 75%的阳性率对于结直肠癌早期具有重要的诊断价值.
目前尚无报道粪便中miR34b/c甲基化用于结直肠癌早期诊断. 本文利用检测粪便miR34b/c甲基化, 同时采用MDA-MSP技术, 大大提高了miR34b/c甲基化的检出率.
本文选题较好, 创意新颖, 内容丰富, 具有一定的可读性.
编辑: 田滢 电编: 闫晋利
| 2. | Yan H, Choi AJ, Lee BH, Ting AH. Identification and functional analysis of epigenetically silenced microRNAs in colorectal cancer cells. PLoS One. 2011;6:e20628. [PubMed] [DOI] |
| 3. | Suzuki H, Takatsuka S, Akashi H, Yamamoto E, Nojima M, Maruyama R, Kai M, Yamano HO, Sasaki Y, Tokino T. Genome-wide profiling of chromatin signatures reveals epigenetic regulation of MicroRNA genes in colorectal cancer. Cancer Res. 2011;71:5646-5658. [PubMed] [DOI] |
| 4. | Baylin SB. DNA methylation and gene silencing in cancer. Nat Clin Pract Oncol. 2005;2 Suppl 1:S4-11. [PubMed] [DOI] |
| 5. | Toyota M, Suzuki H, Sasaki Y, Maruyama R, Imai K, Shinomura Y, Tokino T. Epigenetic silencing of microRNA-34b/c and B-cell translocation gene 4 is associated with CpG island methylation in colorectal cancer. Cancer Res. 2008;68:4123-4132. [PubMed] [DOI] |
| 6. | Bandres E, Agirre X, Bitarte N, Ramirez N, Zarate R, Roman-Gomez J, Prosper F, Garcia-Foncillas J. Epigenetic regulation of microRNA expression in colorectal cancer. Int J Cancer. 2009;125:2737-2743. [PubMed] [DOI] |
| 7. | Kalimutho M, Di Cecilia S, Del Vecchio Blanco G, Roviello F, Sileri P, Cretella M, Formosa A, Corso G, Marrelli D, Pallone F. Epigenetically silenced miR-34b/c as a novel faecal-based screening marker for colorectal cancer. Br J Cancer. 2011;104:1770-1778. [PubMed] |
| 8. | Lovat F, Valeri N, Croce CM. MicroRNAs in the pathogenesis of cancer. Semin Oncol. 2011;38:724-733. [PubMed] [DOI] |
| 9. | Calin GA, Croce CM. MicroRNA signatures in human cancers. Nat Rev Cancer. 2006;6:857-866. [PubMed] |
| 10. | Schetter AJ, Harris CC. Alterations of microRNAs contribute to colon carcinogenesis. Semin Oncol. 2011;38:734-742. [PubMed] [DOI] |
| 11. | Motoyama K, Inoue H, Takatsuno Y, Tanaka F, Mimori K, Uetake H, Sugihara K, Mori M. Over- and under-expressed microRNAs in human colorectal cancer. Int J Oncol. 2009;34:1069-1075. [PubMed] |
| 12. | Hughes S, Jones JL. The use of multiple displacement amplified DNA as a control for methylation specific PCR, pyrosequencing, bisulfite sequencing and methylation-sensitive restriction enzyme PCR. BMC Mol Biol. 2007;8:91. [PubMed] [DOI] |
| 13. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 14. | Ronaghi M, Pettersson B, Uhlén M, Nyrén P. PCR-introduced loop structure as primer in DNA sequencing. Biotechniques. 1998;25:876-878, 880-882, 884. [PubMed] |