修回日期: 2013-01-30
接受日期: 2013-02-01
在线出版日期: 2013-03-08
目的: 探讨Wnt3、Wnt3a、Wnt5a、Wnt8a和β-catenin基因在胃癌及慢性萎缩性胃炎(chronic atrophic gastritis, CAG)组织中的表达及在胃癌发生、发展中的作用.
方法: 应用Real-time RT-PCR方法检测26例CAG和40例胃癌组织中Wnt3、Wnt3a、Wnt5a、Wnt8a mRNA的表达情况, Western blot检测β-catenin蛋白的表达.
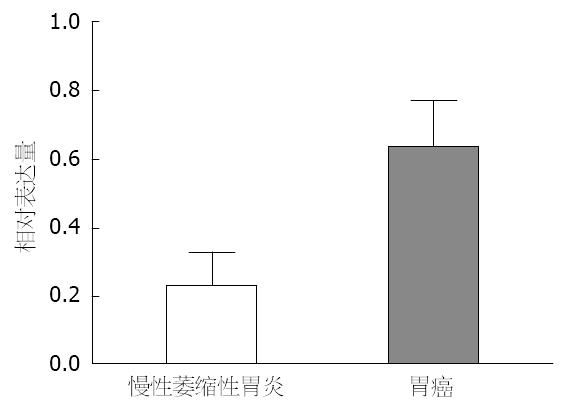
结果: Wnt3和Wnt3a mRNA的表达在胃癌组织中较CAG中升高(1.9940±0.1311 vs 1.3349±0.2487, P<0.05; 2.3033±0.3979 vs 1.2835±0.2815, P<0.05), 并与胃癌的淋巴结转移及TNM分期具有相关性, 而Wnt5a和Wnt8a在两种组织中的表达无显著差异(P>0.05), Western blot结果显示β-catenin蛋白在胃癌中表达升高(0.6290±0.1369, 0.2341±0.0975, P<0.05).
结论: Wnt/β-catenin信号通路在胃癌组织中呈活化状态, 而Wnt3和Wnt3a可能在启动此通路的激活过程中起到了主要作用, 并参与了胃癌的发生发展.
引文著录: 官文华, 杨堃, 赵文君, 刘希双, 王秀娟. Wnt3、Wnt3a在胃癌组织中的表达及意义. 世界华人消化杂志 2013; 21(7): 624-628
Revised: January 30, 2013
Accepted: February 1, 2013
Published online: March 8, 2013
AIM: To detect the expression of Wnt3, Wnt3a, Wnt5a, Wnt8a and β-catenin in chronic atrophic gastritis (CAG) and gastric carcinoma (GC), and to investigate the role of the Wnt signaling pathway in the pathogenesis of GC.
METHODS: The mRNA expression of Wnt3, Wnt3a, Wnt5a and Wnt8a in 26 fresh CAG and 40 GC tissue samples was examined using Real-time RT-PCR. The protein expression of β-catenin was detected by Western blot.
RESULTS: The mRNA expression levels of Wnt3 and Wnt3a were significantly increased in GC (1.9940 ± 0.1311 vs 1.3349 ± 0.2487, P < 0.05; 2.3033 ± 0.3979 vs 1.2835 ± 0.2815, P < 0.05) and were associated with lymph node metastasis and TNM stage. The expression of Wnt5a and Wnt8a did not significantly differ between CAG and GC (both P > 0.05). Western blot analysis showed that the relative expression of β-catenin protein was significantly elevated in GC compared with CAG (0.6290 ± 0.1369 vs 0.2341 ± 0.0975, P < 0.05).
CONCLUSION: Our results suggest that Wnt3 and Wnt3a may be critically involved in the activation of the Wnt signaling pathway and in the carcinogenesis and progression of GC.
- Citation: Guan WH, Yang K, Zhao WJ, Liu XS, Wang XJ. Significance of expression of Wnt3 and Wnt3a in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(7): 624-628
- URL: https://www.wjgnet.com/1009-3079/full/v21/i7/624.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i7.624
胃癌是我国最常见的恶性肿瘤之一, 大部分患者在确诊时已处于中晚期, 其病死率居各种肿瘤第2位, 5年生存率较低. 胃癌的发生发展是一个多因素、多基因、多阶段共同作用的复杂过程, 其具体的致病机制仍不清楚. 目前已有研究发现, 在包括胃癌在内的多种人类肿瘤中都存在Wnt通路的异常激活[1-6]. Wnt通路是细胞中一条重要的、保守的信号转导途径, 参与了胚胎发育、细胞增殖、分化与凋亡等多种生物学过程的调控. Wnt通路的失调与许多人类疾病有着密切的联系. 当细胞中存在异常Wnt信号时, 可导致其下游成分β-catenin不能经过正常磷酸化及降解而在胞质中过度累积. 而β-catenin是一种多功能胞浆蛋白, 既是经典Wnt通路的关键枢纽分子, 也参与正常细胞中黏着复合体的形成, 介导同型细胞间的黏附. 本研究对40例胃癌及26例慢性萎缩性胃炎(chronic atrophic gastritis, CAG)组织中Wnt家族成员Wnt3、Wnt3a、Wnt5a和Wnt8a的表达情况进行观察, 初步探讨几种Wnt蛋白在Wnt信号通路的激活以及胃癌发生发展中的作用.
收集 2011-05/2011-12青岛大学医学院附属医院普外科胃癌手术标本40例. 其中男29例, 女11例, 年龄36-79岁, 中位年龄62.5岁, 男女比例2.64:1, 经病理诊断低分化腺癌27例, 高中分化腺癌12例, 印戒细胞癌1例. 患者术前均未接受放化疗. 另外胃镜普通活检钳取26例胃窦组织, 经病理诊断为CAG. 其中男14例, 女12例, 年龄43-70岁, 中位年龄57岁. 所有组织取出后立即置于液氮冻存, 并迅速转移至-80 ℃冰箱保存. RNAiso RNA抽提试剂、逆转录试剂盒和SYBR Green荧光定量PCR试剂盒均购自TaKaRa公司; PCR引物使用ABI公司Primer Express软件设计, 由上海生工生物工程公司合成; 蛋白酶抑制剂Halt™ Protease Inhibitor Cocktail购自Thermo Scientific公司; β-catenin和GAPDH一抗、HRP标记羊抗兔二抗购自美国Cell Signaling公司.
1.2.1 总RNA提取及Real-time RT-PCR检测: TRIzol法提取组织总RNA, 紫外分光光度仪测定RNA的纯度和含量. 逆转录反应依照TaKaRa公司逆转录试剂盒说明书进行操作. 将逆转录产物进行PCR反应, 反应体系如下: cDNA 2 µL, 2×SYBR Premix Ex Taq Ⅱ 10 µL, 5 µmol/L上、下游引物各1.6 µL, ddH2O 4.8 µL(PCR引物序列见表1). 于Roche LightCycler Real-time PCR仪中进行PCR反应, 反应条件为: 95 ℃变性30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环. 反应结束后分析融解曲线, 并由扩增曲线得到各产物的Ct值, 2-∆∆Ct法计算目的基因和内参基因之间的相对含量.
| 上游序列 | 下游序列 | 扩增产物片段(bp) | |
| Wnt3 | AGCGCCTCGGAGATGGTAGTA | CTGGGTTGGGCTCACAAAAGT | 148 |
| Wnt3a | CAGGGTGAAGACATGCTGGTG | CGAGGCGCTGTCGTACTTGT | 82 |
| Wnt5a | TCGACTATGGCTACCGCTTTG | CGTTGTTGTGCAGGTTCATGA | 114 |
| Wnt8a | GTGAGAGCCACCATGAAAAGGA | ATTTCAATTTTCAGCGCCTGG | 146 |
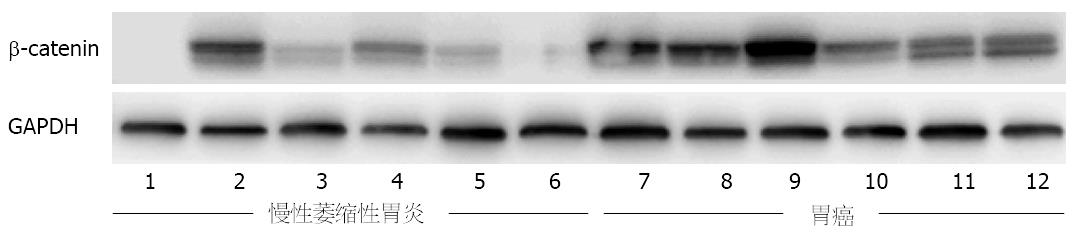
1.2.2 蛋白抽提及Western blot分析: 于20 mg组织中加入150 µL含有蛋白酶抑制剂的RIPA裂解液, 低温下匀浆提取总蛋白. BCA法测定蛋白浓度后, 保存在-80 ℃冰箱备用. 电泳前取50 µg蛋白标本加入上样缓冲液于100 ℃加热变性5 min, 10%SDS-PAGE胶中电泳2 h后将蛋白转移至PVDF膜. 将膜置于含有5%脱脂奶粉的PBST中封闭1 h, 加入1:1 000稀释的β-catenin或GAPDH一抗于4 ℃孵育过夜, 再与1:3 000稀释的HRP标记羊抗兔二抗室温孵育1 h, PBST洗膜3次后ECL化学发光显色. Vilber Fusion Fx7凝胶成像仪摄取图像, Quantity One软件测定条带灰度值, 计算β-catenin/GAPDH灰度比值.
统计学处理 使用SPSS19.0软件进行统计学分析, 应用非配对t检验分析各组间的差异. 以P<0.05为差异有统计学意义.
Real-time PCR结果显示, 胃癌组织中Wnt3和Wnt3a mRNA的相对表达量与CAG组相比较分别升高了49.37%和79.45%, 差异均具有统计学意义(P<0.05). 而Wnt5a和Wnt8a mRNA在两种组织中的表达量未发现明显差异(P<0.05, 表2).
| 慢性萎缩性胃炎 | 胃癌 | P值 | |
| Wnt3 | 1.3349±0.2487 | 1.9940±0.1311 | 0.0174 |
| Wnt3a | 1.2835±0.2815 | 2.3033±0.3979 | 0.0497 |
| Wnt5a | 1.8269±0.1781 | 1.7802±0.1772 | 0.8545 |
| Wnt8a | 1.5263±0.2302 | 1.0229±0.2238 | 0.1255 |
我们应用Western blot方法检测了β-catenin蛋白的表达, 结果显示β-catenin蛋白在CAG及胃癌组织中的相对表达量分别为0.2341±0.0975和0.6290±0.1369, 胃癌组较CAG组升高1.69倍, 差异具有统计学意义(P = 0.0407, 图1, 图2).
Wnt3a和Wnt5a在50岁以上以及TNM Ⅲ-Ⅳ期的胃癌患者中的表达显著高于50岁以下以及TNMⅠ-Ⅱ期的患者; Wnt3a在淋巴结转移组中的表达量较无转移组升高0.97倍, 而Wnt3和Wnt8a在淋巴结转移组中的表达量则较无转移组分别降低了19.73%和67.28%, 差异均具有统计学意义; Wnt3、Wnt3a和Wnt5a的表达与胃癌的浸润深度无显著关联, 而Wnt8a在未侵及浆膜层的患者中表达升高(表3).
| 年龄(岁) | 侵及浆膜层 | 淋巴结转移 | TNM分期 | |||||
| ≤50 | >50 | 无 | 有 | 无 | 有 | Ⅰ-Ⅱ | Ⅲ-Ⅳ | |
| Wnt3 | 2.01±0.21 | 1.95±0.17 | 2.26±0.07 | 1.87±0.18 | 2.23±0.14a | 1.79±0.19 | 2.26±0.13b | 1.61±0.17 |
| Wnt3a | 1.49±0.26 | 2.67±0.55a | 1.66±0.23 | 2.58±0.56 | 1.50±0.21 | 2.95±0.66a | 1.41±0.21 | 3.64±0.89a |
| Wnt5a | 1.17±0.38 | 1.99±0.18a | 1.50±0.39 | 1.90±0.18 | 1.56±0.29 | 1.95±0.21 | 1.43±0.31 | 2.40±0.12a |
| Wnt8a | 0.82±0.49 | 1.03±0.25 | 1.52±0.47a | 1.90±0.18 | 1.62±0.35a | 0.53±0.22 | 1.46±0.37 | 0.64±0.31 |
Wnt家族是一类富含半胱氨酸的分泌性糖蛋白, 目前在人类中已发现19种Wnt蛋白家族成员, 他们通过与细胞表面基质及其特异性受体卷曲蛋白(Frizzled, Fz)相互作用, 激活下游的Wnt信号转导通路[7]. β-catenin是经典Wnt信号通路的关键枢纽分子, β-catenin的氨基末端有数个酪氨酸蛋白激酶(CK1α)和糖原合成酶激酶3β(GSK-3β)的磷酸化位点, 这些位点的磷酸化与去磷酸化对调控β-catenin的功能转换起到重要作用[8,9]. 当Wnt信号通路激活时, 细胞中的β-catenin不能经过正常磷酸化及降解而导致其在胞质中累积并转移到细胞核中激活下游靶基因转录, 从而产生特定的生物学效应[10].
目前研究发现在多种人类肿瘤中都存在一种或多种Wnt基因家族成员的异常表达, 这些基因的表达失调可能参与了下游Wnt信号通路的激活, 从而导致了肿瘤的发生、发展[11-13]. 也有研究发现, 正常成熟细胞中缺乏Wnt信号, 在导入异常外源性Wnt信号或突变的β-catenin基因后, 细胞的转录活性提高, 进而导致正常细胞发生癌变[14]. Benhaj等[15]发现Wnt3a在部分人类乳腺癌细胞系中表达增高, 而Wnt3、Wnt8a则没有明显变化. Katoh等[16]在对37种人类癌细胞系的研究中发现Wnt3在A549肺癌细胞系和MNK45胃癌细胞系中的表达水平相对较高. 上述结果提示Wnt3、Wnt3a表达失调导致的Wnt信号通路活化与肿瘤的发生有着密切的关系. 本研究检测了Wnt3、Wnt3a、Wnt5a、Wnt8a mRNA以及β-catenin蛋白在CAG和胃癌组织中的表达情况, 发现在胃癌组织中Wnt3、Wnt3a及β-catenin的表达量明显增高, 这些结果提示Wnt/β-catenin通路在胃癌中处于活化状态, 且Wnt3、Wnt3a可能在启动胃癌中Wnt通路的活化过程中起到了主要作用. 本研究同时发现Wnt3a的高表达与胃癌患者的年龄、淋巴结转移及TNM分期相关, 说明其参与了胃癌的发展过程, 并且与胃癌转移以及较差的预后具有相关性. 我们推测这可能与胃癌中高表达的Wnt3a激活Wnt通路导致大量β-catenin在胞质中累积有关. 正常细胞中无Wnt信号时, 胞质内β-catenin大部分与细胞膜上E-钙黏蛋白(E-cadherin)结合形成黏着复合体, 介导同型细胞间的黏附, 对维持上皮形态结构的完整性和细胞极性起到重要作用[17]. 在癌组织中可能存在黏着复合体异常表达, 使癌细胞丧失极性, 具备侵袭性. 肿瘤细胞间黏附功能减弱是肿瘤浸润和转移的关键. 而李俊国等[18]应用免疫组织化学法发现Wnt3a在胃溃疡和胃癌组织中无表达, 推测Wnt3a蛋白仅对细胞的分化成熟起重要作用, 并未作为分泌蛋白参与胃癌的发病与转移. 本研究与此相反, 可能是由于实验的局限性而未能完全反应表达情况, 因此尚需进一步全面深入的研究.
另外, 我们的研究结果显示Wnt5a和Wnt8a的表达在胃癌组织和CAG组织中无显著差异, 提示Wnt5a和Wnt8a可能不是启动胃癌中Wnt通路活化的主要分子. Saitoh等[19,20]在研究中发现Wnt8a在多种人类胚胎癌细胞系中存在高表达, 而在胰腺癌、乳腺癌及脑瘤细胞系中并未检测到其表达. 而且他们还发现Wnt5a在部分胃癌组织中表达升高, 而在许多胃癌细胞系中Wnt5a表达水平却较低, 甚至未检测到[21,22]. 这些研究表明, 在不同的肿瘤发生、发展过程中, Wnt5a和Wnt8a可能发挥了不同甚至截然相反的作用, 其分子机制可能存在较大差异. 但也有相反的报道, Wnt5a mRNA在胃癌组织中高表达, 且与胃癌的分期、预后、组织学分型及淋巴结转移相关[23,24]. 我们推测这可能与Wnt5a参与非经典Wnt通路有关, 而其具体的分子机制仍不清楚.
综上所述, 本文对胃癌中Wnt家族成员Wnt3、Wnt3a、Wnt5a和Wnt8a的表达以及他们与胃癌各临床病理参数之间的关系进行了系统的研究, 结果表明相对Wnt5a和Wnt8a, Wnt3和Wnt3a可能在启动胃癌中Wnt信号通路的活化过程中起到了更为主要的作用, 并且其表达与胃癌转移及较差的预后相关, 参与了胃癌的发生发展. 这些发现可望为胃癌的早期诊断及基因治疗提供依据, 但目前关于胃癌中Wnt基因表达活化机制及其与胃癌发生发展之间的关系还远未明确, 其在胃癌诊断和治疗中的作用需要更深层次的研究.
Wnt信号通路与人类多种肿瘤的发生密切相关, 尤其在消化系肿瘤的发生、发展中. 目前, 在对胃癌的研究中, 已有较多关于Wnt信号通路异常活化的报道, 但更多着眼于β-catenin/TCF等关键环节, 因此Wnt信号通路在胃癌中的作用远未明确. 本文对胃癌组织中Wnt3、Wnt3a、Wnt5a、Wnt8a及β-catenin基因进行检测和分析. 目前相关研究报道较少.
冯志杰, 主任医师, 河北医科大学第二医院消化内科
Wnt信号通路在调控胚胎发育、参与细胞增殖、分化与凋亡中的作用已逐渐被人们认识, 其异常活化可以导致人类多种肿瘤的发生. 两者间的相关性已成为目前的研究热点.
Benhaj等发现Wnt3a在部分人类乳腺癌细胞系中表达增高, 而Wnt3、Wnt8a则没有明显变化. Katoh等在对37种人类癌细胞系的研究中发现Wnt3在A549肺癌细胞系和MNK45胃癌细胞系中的表达水平相对较高.
由于胃癌病因未明, 缺乏有效地一级预防, 二级预防成为重点, 因此早期诊断及治疗成为重点. 分子靶向治疗是目前肿瘤治疗的研究热点之一. 本文研究了Wnt信号通路中Wnt基因及β-catenin从慢性胃炎到胃癌的发生过程的表达量, 为胃癌的治疗提供新的思路.
本文技术路线可行, 方法先进, 对探讨胃癌的发生发展具有一定的理论价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Moravec M. [Colorectal cancer and canonical Wnt signalling pathway]. Cas Lek Cesk. 2012;151:335-342. [PubMed] |
| 2. | Lachenmayer A, Alsinet C, Savic R, Cabellos L, Toffanin S, Hoshida Y, Villanueva A, Minguez B, Newell P, Tsai HW. Wnt-pathway activation in two molecular classes of hepatocellular carcinoma and experimental modulation by sorafenib. Clin Cancer Res. 2012;18:4997-5007. [PubMed] [DOI] |
| 3. | Zhu J, Zhang S, Gu L, Di W. Epigenetic silencing of DKK2 and Wnt signal pathway components in human ovarian carcinoma. Carcinogenesis. 2012;33:2334-2343. [PubMed] [DOI] |
| 4. | Cai C, Zhu X. The Wnt/β-catenin pathway regulates self-renewal of cancer stem-like cells in human gastric cancer. Mol Med Report. 2012;5:1191-1196. [PubMed] [DOI] |
| 5. | Pan KF, Liu WG, Zhang L, You WC, Lu YY. Mutations in components of the Wnt signaling pathway in gastric cancer. World J Gastroenterol. 2008;14:1570-1574. [PubMed] [DOI] |
| 6. | Zhang H, Xue Y. Wnt pathway is involved in advanced gastric carcinoma. Hepatogastroenterology. 2008;55:1126-1130. [PubMed] |
| 7. | Dierick H, Bejsovec A. Cellular mechanisms of wingless/Wnt signal transduction. Curr Top Dev Biol. 1999;43:153-190. [PubMed] [DOI] |
| 8. | Kitagawa M, Hatakeyama S, Shirane M, Matsumoto M, Ishida N, Hattori K, Nakamichi I, Kikuchi A, Nakayama K, Nakayama K. An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of beta-catenin. EMBO J. 1999;18:2401-2410. [PubMed] [DOI] |
| 9. | Liu C, Li Y, Semenov M, Han C, Baeg GH, Tan Y, Zhang Z, Lin X, He X. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 2002;108:837-847. [PubMed] [DOI] |
| 10. | Boyer B, Vallés AM, Edme N. Induction and regulation of epithelial-mesenchymal transitions. Biochem Pharmacol. 2000;60:1091-1099. [PubMed] [DOI] |
| 11. | Carmon KS, Loose DS. Development of a bioassay for detection of Wnt-binding affinities for individual frizzled receptors. Anal Biochem. 2010;401:288-294. [PubMed] [DOI] |
| 12. | Yan L, Della Coletta L, Powell KL, Shen J, Thames H, Aldaz CM, MacLeod MC. Activation of the canonical Wnt/β-catenin pathway in ATF3-induced mammary tumors. PLoS One. 2011;6:e16515. [PubMed] [DOI] |
| 13. | Cheng JH, She H, Han YP, Wang J, Xiong S, Asahina K, Tsukamoto H. Wnt antagonism inhibits hepatic stellate cell activation and liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2008;294:G39-G49. [PubMed] [DOI] |
| 14. | Aoki M, Hecht A, Kruse U, Kemler R, Vogt PK. Nuclear endpoint of Wnt signaling: neoplastic transformation induced by transactivating lymphoid-enhancing factor 1. Proc Natl Acad Sci U S A. 1999;96:139-144. [PubMed] [DOI] |
| 15. | Benhaj K, Akcali KC, Ozturk M. Redundant expression of canonical Wnt ligands in human breast cancer cell lines. Oncol Rep. 2006;15:701-707. [PubMed] |
| 16. | Katoh M. Molecular cloning and characterization of human WNT3. Int J Oncol. 2001;19:977-982. [PubMed] |
| 17. | Tian X, Liu Z, Niu B, Zhang J, Tan TK, Lee SR, Zhao Y, Harris DC, Zheng G. E-cadherin/β-catenin complex and the epithelial barrier. J Biomed Biotechnol. 2011;2011:567305. [PubMed] [DOI] |
| 19. | Saitoh T, Mine T, Katoh M. Expression and regulation of WNT8A and WNT8B mRNAs in human tumor cell lines: up-regulation of WNT8B mRNA by beta-estradiol in MCF-7 cells, and down-regulation of WNT8A and WNT8B mRNAs by retinoic acid in NT2 cells. Int J Oncol. 2002;20:999-1003. [PubMed] |
| 20. | Saitoh T, Katoh M. Molecular cloning and characterization of human WNT8A. Int J Oncol. 2001;19:123-127. [PubMed] |
| 21. | Saitoh T, Mine T, Katoh M. Up-regulation of WNT8B mRNA in human gastric cancer. I. nt J Oncol. 2002;20:343-348. [PubMed] |
| 22. | Saitoh T, Mine T, Katoh M. Frequent up-regulation of WNT5A mRNA in primary gastric cancer. Int J Mol Med. 2002;9:515-519. [PubMed] |
| 23. | Kurayoshi M, Oue N, Yamamoto H, Kishida M, Inoue A, Asahara T, Yasui W, Kikuchi A. Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion. Cancer Res. 2006;66:10439-10448. [PubMed] [DOI] |