修回日期: 2013-01-26
接受日期: 2013-02-01
在线出版日期: 2013-03-08
目的: 探讨染料木黄酮对人结肠癌SW620细胞增殖的影响.
方法: 采用MTT法、Giemsa染色法及Hoechst 33258荧光染色法检测染料木黄酮对SW620细胞生长的影响及形态学变化.
结果: 在一定浓度范围内染料木黄酮可抑制人结肠癌SW620细胞的增殖, 其抑制率与作用时间和药物剂量呈依赖关系; 光镜下可见, 药物组细胞数量明显减少, 细胞膜边界不清, 胞浆内可见空泡样结构, 核膜不清晰, 染色质边缘化, 染色质分割成块状; 荧光显微镜下可见, 药物组部分细胞核呈现亮蓝色荧光的为凋亡细胞, 细胞核呈波纹状改变, 个别细胞核可见碎块状荧光信号, 凋亡指数为27.18%.
结论: 染料木黄酮对人结肠癌SW620细胞的增殖有明显的抑制作用, 诱导细胞凋亡可能是染料木黄酮抗结肠癌的作用机制之一.
引文著录: 梅庆步, 赵忠新, 郑立红, 陈萍, 刘丹. 染料木黄酮对人结肠癌SW620细胞生长的抑制. 世界华人消化杂志 2013; 21(7): 619-623
Revised: January 26, 2013
Accepted: February 1, 2013
Published online: March 8, 2013
AIM: To investigate the influence of genistein on cell proliferation in human colon cancer cell line SW620.
METHODS: MTT assay, Giemsa staining and Hoechst 33258 fluorescent staining were used to detect the effect of genistein on the growth and morphologic changes of SW620 cells.
RESULTS: Genistein could effectively inhibit the proliferation of SW620 cells in a dose- and time-dependent manner. Under a light microscope, cells treated with genistein showed significantly reduced number, unclear cell membrane and nuclear boundaries, chromatin marginalization, and chromatin segmentation. Under a fluorescence microscope, the nuclei of some cells treated with genistein presented light blue fluorescence and corrugated changes, which were characteristics of apoptotic cells. The nuclei of few cells presented fragmented fluorescence signal. Apoptosis index was 27.18%.
CONCLUSION: Genistein has an obvious inhibitory effect on the proliferation of SW620 cells, and inducing apoptosis may be one of the mechanisms that are related to anticarcinogenic action of genistein.
- Citation: Mei QB, Zhao ZX, Zheng LH, Chen P, Liu D. Genistein inhibits cell proliferation in human colon cancer cell line SW620. Shijie Huaren Xiaohua Zazhi 2013; 21(7): 619-623
- URL: https://www.wjgnet.com/1009-3079/full/v21/i7/619.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i7.619
结肠癌是消化系常见的恶性肿瘤之一. 近年来, 随着人们生活水平的提高, 饮食结构的改变, 结肠癌的发病率及死亡率呈逐年上升的趋势, 严重危害人类的健康. 流行病学研究发现, 结肠癌的发病率与大豆食品的摄入量呈明显的负相关[1-4], 而染料木黄酮(genistein, Gen)是大豆中抗癌的主要活性成分, 研究显示其具有显著防治肿瘤的效果. 本研究观察了染料木黄酮对体外培养的人结肠癌SW620细胞增殖的影响和形态学变化, 探讨染料木黄酮诱导结肠癌细胞凋亡的情况.
人结肠癌细胞SW620由哈尔滨医科大学遗传室馈赠. Gen(纯度为98%)、MTT和EDTA(Sigma公司), 优级胎牛血清(Hyclone公司), 胰蛋白酶和DMSO(Amresco公司), DMEM培养基(Gibco公司), hoechst33258(南京凯基生物科技公司), Giemsa stain(Applichem公司), 其余为进口或国产分析纯.
1.2.1 细胞培养: SW620细胞用含10 mL/L胎牛血清的DMEM培养液置于37 ℃、5 mL/L CO2培养箱中培养, 隔1 d换液, 细胞贴壁生长, 待满瓶底时, 用胰酶消化, 吹打成单细胞, 分瓶传代.
1.2.2 实验分组: 分培养基对照组、溶剂对照组(含0.04%DMSO)、Genistein药物组(10、20、40、80、160 μmol/L).
1.2.3 MTT: 取对数生长期的SW620细胞, 以4×103个/孔细胞浓度于接种于3块96孔板, 每孔100 μL细胞悬液, 每组设6个复孔, 培养24 h后, 分别加入不同处理因素, 配至200 μL, 3块板分别培养24、48、72 h后, 加入MTT(5 g/L), 每孔20 μL, 继续孵育4 h. 4 h后吸尽每孔中的培养液, 加DMSO 150 μL/孔, 振荡器上振荡10 min, 于自动酶标仪570 nm处测定每孔的吸光度(A)值, 实验重复3次, 计算抑制率(inhibition rate, IR). IR(%) = (1-药物组A值/对照组A值)×100%.
1.2.4 Giemsa染色法: 取对数生长期的SW620细胞, 以2×105个/孔细胞浓度接种于6孔板, 每孔2 mL细胞悬液, 每组设3个复孔, 培养24 h后, 加入含0.04%DMSO培养液、40 μmol/L Genistein, 处理72 h后, PBS洗3次, 100%甲醇固定10 min, Giemsa工作液(原液1:9稀释)染色1 min, 冲洗, 吹干, 光镜下观察细胞的密度及形态学变化.
1.2.5 Hoechst33258荧光染色法: 取对数生长期的SW620细胞, 以2×105个细胞浓度接种于直径为2.5 cm的2个培养皿中, 培养24 h后, 加入含0.04%DMSO培养液、40 μmol/L Genistein, 处理72 h后, 用冷Buffer A洗涤细胞2次, 加入1 mL的4%甲醛溶液, 4 ℃固定细胞10 min; 滴加200 μL Hoechst33258工作液, 室温避光染色10 min, 水冲净晾干, 置于荧光显微镜下, 选用340 nm的激发蓝光观察细胞凋亡情况, 实验重复3次, 随机计数不同视野的1 000个细胞核, 计算凋亡指数(AI). AI(%) = 具有明显凋亡特征的细胞核总数/1 000×100%.
统计学处理 数据用mean±SD表示, 采用SPSS16.0软件进行统计分析, 两组间均数比较采用t检验, P<0.05为差异有统计学意义.
DMSO对结肠癌细胞的增殖无明显的抑制作用, 在一定浓度范围内(10-40 μmol/L)随着染料木黄酮浓度的增加和作用时间的延长, 其对结肠癌细胞的抑制作用逐渐增强, 呈现出剂量和时间依赖性. 当浓度超过80 μmol/L时, 染料木黄酮对结肠癌细胞的抑制作用呈现出减弱的趋势, 浓度为160 μmol/L的染料木黄酮作用24 h时, 反而促进结肠癌细胞的生长, 但随着作用时间的延长, 逐渐体现出抑制生长的作用(表1).
| 分组(μmol/L) | A值 | 抑制率(%) | ||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| 对照组 | 0.254±0.011 | 0.569±0.012 | 0.858±0.015 | - | - | - |
| 溶剂对照组 | 0.252±0.023 | 0.563±0.018 | 0.851±0.026 | 0.79±0.021 | 1.05±0.015 | 0.82±0.024 |
| 10 | 0.248±0.014 | 0.523±0.034 | 0.728±0.012b | 2.36±0.016 | 8.08±0.028 | 15.15±0.017 |
| 20 | 0.237±0.006a | 0.471±0.016b | 0.651±0.013b | 6.69±0.008 | 17.22±0.012 | 24.13±0.015 |
| 40 | 0.230±0.013a | 0.430±0.014b | 0.468±0.013b | 9.45±0.011 | 24.43±0.015 | 45.45±0.011 |
| 80 | 0.242±0.014a | 0.451±0.013b | 0.634±0.016b | 4.72±0.017 | 20.74±0.011 | 26.11±0.014 |
| 160 | 0.299±0.035b | 0.521±0.012b | 0.746±0.011b | -17.72±0.029 | 8.44±0.016 | 13.05±0.013 |
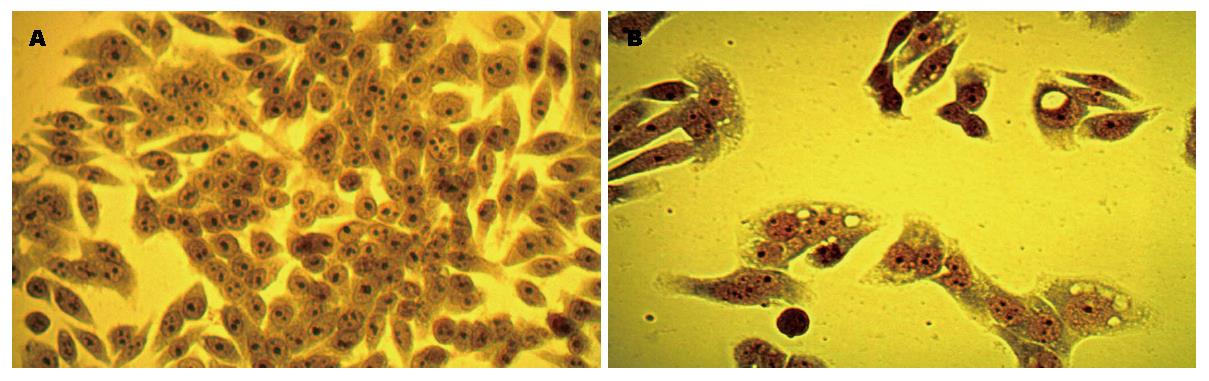
光学显微镜下, 药物组处理72 h后与对照组比较, 结果显示, 药物组细胞密度明显下降, 细胞膜边界不清, 胞浆内可见空泡样结构, 核膜不清晰, 染色质边缘化, 染色质分割成块状; 对照组细胞核染色均匀, 核仁清晰可见, 未见明显凋亡改变(图1).
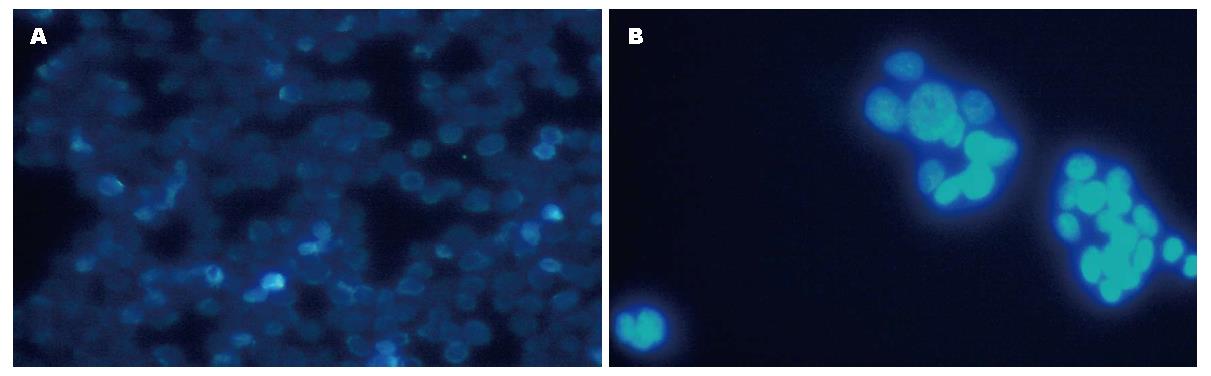
荧光显微镜药物组处理72 h后与对照组比较, 结果显示, 药物组部分细胞核呈现亮蓝色荧光的为凋亡细胞, 细胞核呈波纹状改变, 个别细胞核可见碎块状荧光信号, 凋亡指数为27.18%. 对照组细胞呈现均匀的低蓝色荧光信号(图2).
肿瘤的发生是在遗传易感性的基础上, 由于各种致癌因子的作用, 导致细胞凋亡受阻或增殖过度的结果, 细胞凋亡在肿瘤的发生、发展过程中起着重要作用. 因此, 诱导肿瘤细胞凋亡被视为抗肿瘤药物研究和开发的新靶点.
染料木黄酮是一种异黄酮类的植物雌激素, 其结构与17β-雌二醇相似[5], 具有多种生物学活性且基本无毒[6], 尤以显著的抗肿瘤效果[7-9]而备受关注. 研究显示, 染料木黄酮能有效抑制前列腺癌[10]、卵巢癌[11]、乳腺癌[12]、肝癌[13-16]等多种肿瘤细胞的增殖, 诱导凋亡是其主要作用机制之一. 为探讨染料木黄酮对结肠癌细胞的生长抑制作用, 本研究以体外培养的人结肠癌SW620细胞为模型, 检测染料木黄酮对SW620细胞增殖和凋亡的影响. 结果显示, 在一定浓度范围内(10-40 μmol/L)随着染料木黄酮浓度的增加和作用时间的延长, 其对结肠癌细胞的抑制作用逐渐增强, 呈现剂量和时间依赖性; 形态学检测是鉴定细胞凋亡最可靠的方法之一[17], Giemsa染色结果显示, 药物组细胞密度明显下降, 细胞膜边界不清, 胞浆内可见空泡样结构, 核膜不清晰, 染色质边缘化, 染色质分割成块状; Hoechst33258荧光结果显示, 药物组部分细胞核呈现亮蓝色荧光的为凋亡细胞, 细胞核呈波纹状改变, 个别细胞核可见碎块状荧光信号, 凋亡指数为27.18%. 此结果与国内外报道Genistein抑制结肠癌细胞增殖情况[18-21]一致.
近年来, 部分学者对染料木黄酮的抗结肠癌作用提出异议, Zhi等[22]的体外研究结果显示, 染料木黄酮可能促进结肠癌的形成. 作者在研究染料木黄酮的抗肿瘤作用时, 采用肝癌细胞MHCC97-L和结肠癌细胞SW620两类细胞, 在作用于肝癌细胞的实验中, 该药无双向作用[23]; 而在作用于结肠癌细胞时, 药物出现明显的高浓度促进癌细胞生长的现象. Nagata[24]指出, 大豆异黄酮预防乳腺癌受摄入异黄酮的类别、消耗量及个体雌激素水平和雌激素受体(ER)水平等因素的影响, 这些因素的不同可能产生不一致的结果. Choi等[25]发现, 染料木黄酮对ERα(+)乳腺癌细胞MCF7的增殖影响表现为双向作用(促进或抑制), 在一定浓度内可促进癌细胞的增殖并上调ERα的表达, 而对ERα/c-erbB-2(+)的乳腺癌细胞ZR751没有双向作用, 且可下调ERα和c-erbB-2的表达, 提示染料木黄酮对乳腺癌细胞的抗增殖作用与ERα和c-erbB-2受体表达有关. Hwang等[26]发现, 染料木黄酮对由17β-雌二醇(E2)诱导的卵巢癌细胞增殖有抑制作用, 并通过ER介导, 特别是ERα. Gaete等[27]报道, 染料木黄酮因刺激乳腺癌细胞生长而不是理想的雌激素替代产品. 结肠是雌激素的主要靶器官之一, 结肠癌是否为雌激素依赖性肿瘤目前尚无明确的定论, 但雌激素及ER在结肠癌的发生、发展中发挥一定的作用[28]. Caiazza等[29]研究发现, E2对ERβ的上调作用, 对ERβ的抗结肠作用起到了放大作用. Notarnicola等[30]发现, CB1受体可视为结肠癌SW620、DLD-1、HT-29细胞系的雌激素敏感基因, 通过17β-雌二醇上调CB1的表达可以进一步揭示雌激素控制结肠癌细胞增殖的机制. 另外, 当雌激素作用于靶组织后, 可在极短时间内发挥作用, 这种瞬时效应提示雌激素可能不需要通过活化基因的途径, 而是直接激活某些信号通路, 与ER的基因组效应协同发挥作用. 本研究出现的药物的双向作用与雌激素和ER水平是否相关, 是否存在其他因素的影响, 尚待进一步的研究. 因此, 不能排除染料木黄酮是结肠癌形成的促进因素, 有必要深入探讨内在的分子机制, 为染料木黄酮的临床治疗提供充分的理论依据.
结肠癌是消化系常见的恶性肿瘤之一. 近年来, 随着人们生活水平的提高, 饮食结构的改变, 结肠癌的发病率及死亡率呈逐年上升的趋势, 严重危害人类的健康. 流行病学研究发现, 结肠癌的发病率与大豆食品的摄入量呈明显的负相关, 如何正确利用丰富的大豆资源防治人类疾病成为一项重要课题.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
本文明确雌激素及其受体在结肠癌发生、发展中发挥怎样的作用, 为实现结肠癌的个体化治疗及预后评估提供依据.
近年来, 为明确染料木黄酮抗结肠癌的作用, 国内外学者进行了大量的实验研究, 发现结肠癌因其是雌激素的靶组织之一, 与异黄酮类防治激素依赖肿瘤有很多相似之处, 与癌细胞雌激素及其受体水平相关, 因此显示出更为复杂的分子机制.
国内外学者对染料木黄酮抗结肠癌细胞增殖的观点不一致, 体内外实验结果显示出抑制和促进两种相反的结论, 有必要进一步探讨染料木黄酮在结肠癌发生、发展中的分子机制, 为染料木黄酮用于临床治疗提供充分的理论依据.
本文观察染料木黄酮对体外结肠癌细胞增殖的影响和形态学变化, 探讨其诱导结肠癌细胞凋亡的情况, 药物的双向作用提示染料木黄酮预防结肠癌受摄入异黄酮的类别、消耗量及个体雌激素和ER水平等因素的影响.
本文设计合理, 方法恰当, 结果真实, 有一定的科研价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Oba S, Nagata C, Shimizu N, Shimizu H, Kametani M, Takeyama N, Ohnuma T, Matsushita S. Soy product consumption and the risk of colon cancer: a prospective study in Takayama, Japan. Nutr Cancer. 2007;57:151-157. [PubMed] |
| 2. | Murff HJ, Shrubsole MJ, Smalley WE, Wu H, Shyr Y, Ness RM, Zheng W. The interaction of age and hormone replacement therapy on colon adenoma risk. Cancer Detect Prev. 2007;31:161-165. [PubMed] |
| 3. | Spector D, Anthony M, Alexander D, Arab L. Soy consumption and colorectal cancer. Nutr Cancer. 2003;47:1-12. [PubMed] |
| 4. | Ollberding NJ, Lim U, Wilkens LR, Setiawan VW, Shvetsov YB, Henderson BE, Kolonel LN, Goodman MT. Legume, soy, tofu, and isoflavone intake and endometrial cancer risk in postmenopausal women in the multiethnic cohort study. J Natl Cancer Inst. 2012;104:67-76. [PubMed] [DOI] |
| 5. | Banerjee S, Li Y, Wang Z, Sarkar FH. Multi-targeted therapy of cancer by genistein. Cancer Lett. 2008;269:226-242. [PubMed] [DOI] |
| 6. | Wei H, Saladi R, Lu Y, Wang Y, Palep SR, Moore J, Phelps R, Shyong E, Lebwohl MG. Isoflavone genistein: photoprotection and clinical implications in dermatology. J Nutr. 2003;133:3811S-3819S. [PubMed] |
| 9. | Sarkar FH, Adsule S, Padhye S, Kulkarni S, Li Y. The role of genistein and synthetic derivatives of isoflavone in cancer prevention and therapy. Mini Rev Med Chem. 2006;6:401-407. [PubMed] |
| 10. | Hörmann V, Kumi-Diaka J, Durity M, Rathinavelu A. Anticancer activities of genistein-topotecan combination in prostate cancer cells. J Cell Mol Med. 2012;16:2631-2636. [PubMed] [DOI] |
| 11. | Ning Y, Li Q, Xiang H, Liu F, Cao J. Apoptosis induced by 7-difluoromethoxyl-5,4'-di-n-octyl genistein via the inactivation of FoxM1 in ovarian cancer cells. Oncol Rep. 2012;27:1857-1864. [PubMed] [DOI] |
| 12. | Li Y, Chen H, Hardy TM, Tollefsbol TO. Epigenetic regulation of multiple tumor-related genes leads to suppression of breast tumorigenesis by dietary genistein. PLoS One. 2013;8:e54369. [PubMed] [DOI] |
| 14. | Mansoor TA, Ramalho RM, Luo X, Ramalhete C, Rodrigues CM, Ferreira MJ. Isoflavones as apoptosis inducers in human hepatoma HuH-7 cells. Phytother Res. 2011;25:1819-1824. [PubMed] [DOI] |
| 15. | Gu Y, Zhu CF, Dai YL, Zhong Q, Sun B. Inhibitory effects of genistein on metastasis of human hepatocellular carcinoma. World J Gastroenterol. 2009;15:4952-4957. [PubMed] [DOI] |
| 16. | Jin CY, Park C, Kim GY, Lee SJ, Kim WJ, Choi YH. Genistein enhances TRAIL-induced apoptosis through inhibition of p38 MAPK signaling in human hepatocellular carcinoma Hep3B cells. Chem Biol Interact. 2009;180:143-150. [PubMed] [DOI] |
| 19. | 龚 军, 王 正文, 朱 明才, 汤 为学, 黄 义明, 彭 彬, 李 兴华. 金雀异黄素和5-FU对人结肠癌细胞株(SW480)的相互作用的体外观察. 中国现代医学杂志. 2006;16:873-876. |
| 20. | Zhu Q, Meisinger J, Van Thiel DH, Zhang Y, Mobarhan S. Effects of soybean extract on morphology and survival of Caco-2, SW620, and HT-29 cells. Nutr Cancer. 2002;42:131-140. [PubMed] |
| 21. | Arai N, Ström A, Rafter JJ, Gustafsson JA. Estrogen receptor beta mRNA in colon cancer cells: growth effects of estrogen and genistein. Biochem Biophys Res Commun. 2000;270:425-431. [PubMed] |
| 22. | Zhi H, Yamada Y, Hirose Y, Kato K, Sheng H, Zheng Q, Oyama T, Asano N, Kuno T, Hara A. Effect of 2-(carboxyphenyl) retinamide and genistein on the formation of early lesions in 1,2-dimethylhydrazine-induced colon carcinogenesis in rats. Asian Pac J Cancer Prev. 2007;8:33-38. [PubMed] |
| 24. | Nagata C. Factors to consider in the association between soy isoflavone intake and breast cancer risk. J Epidemiol. 2010;20:83-89. [PubMed] |
| 25. | Choi EJ, Kim GH. Antiproliferative activity of daidzein and genistein may be related to ERα/c-erbB-2 expression in human breast cancer cells. Mol Med Report. 2013; Jan 21. [Epub ahead of print]. [PubMed] [DOI] |
| 26. | Hwang KA, Kang NH, Yi BR, Lee HR, Park MA, Choi KC. Genistein, a soy phytoestrogen, prevents the growth of BG-1 ovarian cancer cells induced by 17β-estradiol or bisphenol A via the inhibition of cell cycle progression. Int J Oncol. 2013;42:733-740. [PubMed] [DOI] |
| 27. | Gaete L, Tchernitchin AN, Bustamante R, Villena J, Lemus I, Gidekel M, Cabrera G, Astorga P. Daidzein-estrogen interaction in the rat uterus and its effect on human breast cancer cell growth. J Med Food. 2012;15:1081-1090. [PubMed] [DOI] |
| 29. | Caiazza F, Galluzzo P, Lorenzetti S, Marino M. 17Beta-estradiol induces ERbeta up-regulation via p38/MAPK activation in colon cancer cells. Biochem Biophys Res Commun. 2007;359:102-107. [PubMed] |
| 30. | Notarnicola M, Messa C, Orlando A, Bifulco M, Laezza C, Gazzerro P, Caruso MG. Estrogenic induction of cannabinoid CB1 receptor in human colon cancer cell lines. Scand J Gastroenterol. 2008;43:66-72. [PubMed] |