修回日期: 2013-01-21
接受日期: 2013-01-30
在线出版日期: 2013-02-18
目的: 探讨利培酮对人结肠癌细胞株SW480生长抑制的作用机制及其相关研究.
方法: 表皮生长因子和利培酮单独或联合作用于SW480细胞, 通过蛋白印迹实验观察蛋白激酶B(protein kinase B, PKB)及细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)磷酸化程度, 利用RT-PCR判断细胞因子信号转导抑制因子基因表达水平, 利用显微镜及细胞计数方法判断细胞生长情况.
结果: 利培酮抑制人表皮生长因子诱导的结肠癌细胞株SW480细胞的生长; 其机制是通过激活ERK1/2的活性并诱导SOCS3的基因的表达, 从而抑制PKB的磷酸化, 最终抑制SW480的生长.
结论: 利培酮具有抑制表皮生长因子对人结肠癌细胞株的生长作用.
引文著录: 金永民, 韩哲洙, 孙红花, 崔海, 金文彪, 沈雄虎, 朴龙镇. 利培酮抑制结肠癌细胞株SW480生长的作用机制. 世界华人消化杂志 2013; 21(5): 381-385
Revised: January 21, 2013
Accepted: January 30, 2013
Published online: February 18, 2013
AIM: To investigate whether risperidone has an inhibitory effect on cell proliferation in human colon carcinoma cell line SW480 and to explore the possible mechanisms involved.
METHODS: SW480 cells were treated with epidermal growth factor (EGF) with and without risperidone. Phosphorylation levels of protein kinase B (PKB/Akt) and extracellular signal-regulated kinase 1/2 (ERK1/2) were determined by Western blot. Expression of suppressor of cytokine signaling 3 (SOCS3) mRNA was detected by RT-PCR. Cell proliferation was assessed using the trypan blue assay.
RESULTS: Risperidone could inhibit the proliferation of SW480 cells. Treatment with risperidone increased the phosphorylation of ERK1/2 and mRNA level of SOCS3, which may block EGF-induced EGF receptor phosphorylaiton and in turn inhibit PKB phosphorylation.
CONCLUSION: Treatment with risperidone significantly inhibited EGF-mediated proliferation of SW480 cells.
- Citation: Jin YM, Han ZZ, Sun HH, Cui H, Jin WB, Shen XH, Piao LZ. Mechanisms underlying risperidone-mediated inhibition of cell proliferation in human colon cancer cell line SW480. Shijie Huaren Xiaohua Zazhi 2013; 21(5): 381-385
- URL: https://www.wjgnet.com/1009-3079/full/v21/i5/381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i5.381
利培酮属苯丙异恶唑的衍生物, 是一种非典型的新型抗精神病药物[1], 具有对多巴胺D2受体和5羟色胺的5-HT2受体的双重阻滞作用[2]. 在临床上多用于精神分裂症病患者的治疗, 其主要不良反应为体质量增加, 目前其原因仍未能阐明[3]. 蛋白激酶B(protein kinase B, PKB)又称丝/苏氨酸蛋白酶(serine/threonine kinase, Akt)是一种60 kDa左右的蛋白激酶[4]. PKB参与的磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase, PI3K)介导的信号传导通路, 与细胞生长、代谢、凋亡、恶变密切相关[4,5]. 越来越多的研究表明, 在很多的肿瘤中发现PKB的表达及磷酸化水平不同程度的增多[6,7]. 本实验首次观察到利培酮可以抑制人结肠癌细胞株SW480细胞的生长, 同时阐明利培酮是通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)依赖性诱导SOCS3基因的表达, 从而阻断PKB磷酸化抑制其活性, 最终达到抑制SW480细胞的生长. 通过本实验首次阐明第二代非典型抗精神病药物-利培酮具有抑制肿瘤生长的新的药理学作用机制.
利培酮由R&D公司提供; 人结肠癌细胞株-SW480由ATCC公司提供; 总-PKB、磷酸化-PKB(Ser-473)、磷酸化-PKB(Thr-308)、总ERK1/2及磷酸化ERK1/2抗体由Cell Signaling提供.
1.2.1 细胞培养: SW480细胞株, 于37 ℃、50 mL/L CO2的条件下, 培养于含100 mL/L胎牛血清的DMEM培养基中. 每2-3 d传代1次.
1.2.2 蛋白印迹实验: SW480细胞接种于15 mL培养瓶内, 培养至80%满时, 更换无100 mL/L胎牛血清的DMEM培养液. 培养24 h之后处理100 nmol/L的利培酮及表皮生长因子. 各处理因素完成后, 用预冷的PBS冲洗2次, 加入细胞裂解液, 4 ℃静置30 min. 12 000 r/min离心10 min, 取上清液, 用Brad-ford法进行蛋白定量. 总蛋白经SDS-PAGE分离后, 转移至PVDF膜上. 用5%脱脂奶粉封闭1 h. 随后分别加入总PKB抗体、磷酸化PKB(Ser-473和Thr-308)、总ERK1/2及磷酸化ERK1/2等抗体(1:1 000), 室温孵育2 h, 用TBST漂洗3次, 再加入相应的二抗, 孵育1 h, 用TBST漂洗3次. ECL显色之后, 曝光于底片上.
1.2.3 RT-PCR: PCR检测SOCS mRNA收集利培酮、EGF、利培酮+EGF处理的细胞, 利用easy-BLUETM RNA提取试剂盒提取总RNA. 以1 μg总RNA作为模版, 用ReverTra Ace逆转录酶进行逆转录, PCR扩增SOCS1和SOCS3, 同时以GAPDH为内参照. SOCS1上游引物为5'-CAC GCA CTT CCG CAC ATT-3', 下游引物为5'-AGC AGC TCG AGG AGG CAG-3'; SOCS3上游引物为5'-GAG TAC CAC CTG AGT CTC CA-3', 下游引物为5'-GAC CTC TCT CTC TTC CAC CT-3'. PCR反应条件如下: 5 ℃预变性5 min后开始25个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min. PCR产物经1.5%琼脂糖凝胶电泳分离.
统计学处理 采用配对t检验分析在利培酮组与对照组之间相对细胞生长率的差异. 数据采用SPSS11.0统计软件包进行统计分析.
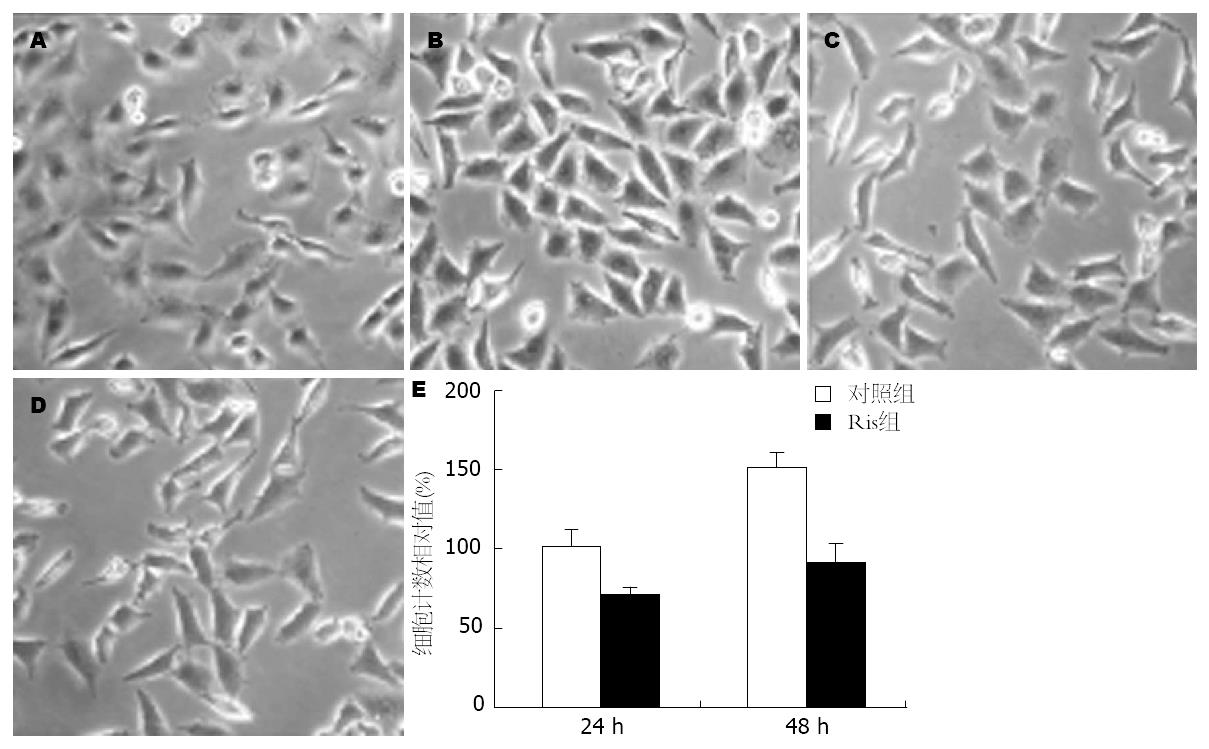
SW480细胞分别以EGF(对照组)或添加利培酮100 nmol/L(Ris组)培养24 h、48 h之后, 利用显微镜观察细胞生长情况. 如图1所示, 处理利培酮(Ris组)后细胞生长的密度明显低于EGF(对照组)处理组. 收集SW480细胞株, 利用台盼蓝拒染实验检测EGF诱导的SW480生长率. 比较两组的细胞生长率, Ris组SW480细胞生长率明显低于对照组, 差异具有统计学意义(P<0.05). 提示利培酮具有抑制EGF诱导SW480结肠癌细胞株生长的作用.
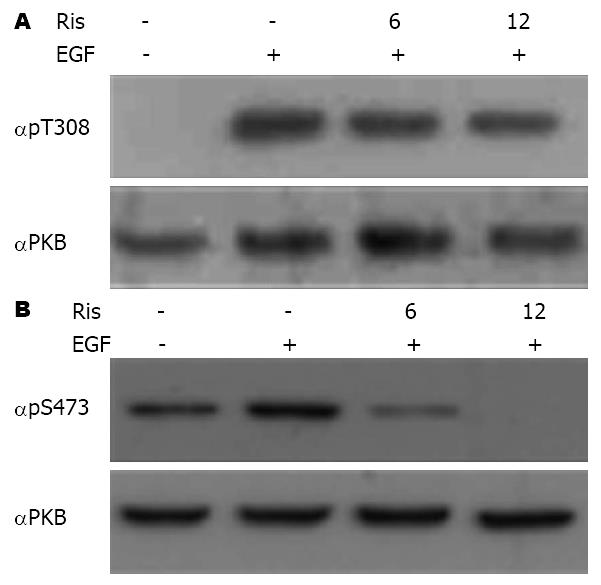
PKB, 即蛋白激酶B, 直接参与了细胞内各种生长因子的信号转导, 具有促进细胞的代谢及生长的生理学功能. PKB的活性需要两个氨基酸位点同时被磷酸化, 即苏氨酸磷酸化位点: 308(Thr308)和丝氨酸磷酸化位点: 473(Ser473), 从而得到激酶的活性[4]. 为观察利培酮是否影响PKB的磷酸化水平及, 进行了如下实验. 在SW480细胞中加入100 nmol/L利培酮培养6 h及12 h, 并加入100 ng/mL浓度的EGF. 分别收集细胞采用蛋白印迹法分别检测PKB-Thr308(图2A)和Ser473(图2B)位点磷酸化水平. SW480细胞单独处理EGF时PKB(Thr-308)位点的磷酸化水平明显增加, 而在预处理利培酮(Ris组)之后其磷酸化水平被抑制, 这种抑制随时间延长而逐渐增加(图2A). 同样利培酮抑制了PKB另外一个磷酸化位点-Ser473(图2B). 该实验结果表明利培酮具有抑制EGF诱导的PKB磷酸化水平的能力. 这可能是利培酮抑制PKB蛋白激酶活性, 最终导致抑制结肠癌细胞株SW480的生长.
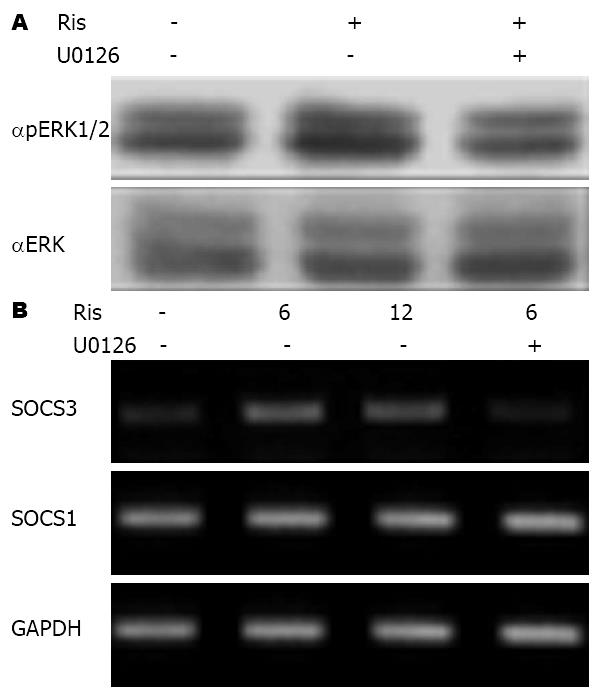
跨膜蛋白-G蛋白偶联受体作为细胞内信号转导的重要介质, 在细胞内参与多种信号传递的重要作用[8]. G蛋白偶联受体可通过影响细胞内的cAMP的浓度, 改变一些细胞内很多激酶的活性[9]. 相关文献报道显示, 随细胞内cAMP的浓度增加可激活ERK1/2的活性[10]. 为观察利培酮是否通过抑制G-蛋白偶联受体的功能, 改变ERK1/2的活性, 在SW480细胞中加入100 nmol/L利培酮或与ERK1/2激酶特异性抑制-U0126培养6 h, 收集细胞进行了蛋白印迹实验. Ris可激活ERK1/2的活性, 而这种激活可以被ERK1/2的特异性激酶抑制剂-U0126被抑制(图3A). SW480细胞加入利培酮6、12 h或与U0126共同处理之后, 采用RT-PCR方法检测SOCS1和SOCS3 mRNA水平. 如图3B所示, 利培酮可增加细胞内SOCS3 mRNA水平, 而SOCS1没有改变, 这种效应可被EKR1/2阻断剂-U0126所被抑制. 结果显示, 利培酮是通过激活ERK1/2活性, 从而诱导细胞内SOCS3 mRNA水平的表达.
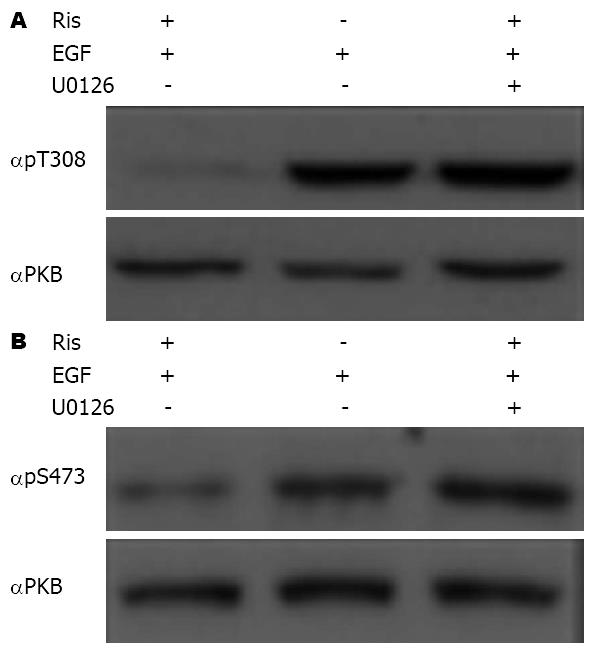
SOCS1和SOCS3蛋白可以与一些细胞因子受体结合, 阻断信号传导, 抑制相关因子的作用[11]. 为证明利培酮是通过增加SOCS3基因的表达, 与EGF受体结合从而抑制受体的磷酸化, 阻断PKB的活性及抑制细胞的生长, 进行了如下实验. 在SW480细胞中加入100 nmol/L利培酮或与U0126共培养12 h, 并加入100 ng/mL浓度的EGF. 分别收集细胞采用蛋白印迹法检测PKB-Thr308和Ser-473磷酸化水平. 当SW-480细胞株共同处理EGF和利培酮时, PKB-Thr-308(图4A)和Ser-473(图4B)的磷酸化水平完全被阻滞, 然而添加ERK1/2阻断剂-U0126时, PKB两个磷酸化位点的磷化水平可被恢复.
磷酸肌醇-3-激酶/蛋白激酶B(PI3K/PKB)信号转导通路参与很多生物学过程调节[12]. PKB被PI3K依赖激酶1(PI3K-dependent kinase 1, PDK1)在催化区的苏氨酸308位点(Thr-308)磷酸化, 同时被另一个未知的丝氨酸激酶(PDK2)在碳末端疏水区丝氨酸473位点(Ser-473)磷酸化, 这两个位点同时磷酸化是PKB激活的必要条件[8]. 激活后的PKB蛋白在胞质中或胞核内, 通过对一系列底物蛋白的磷酸化, 调节细胞的增值、分化及凋亡. 在正常组织细胞内PI3K/PKB信号转导途径处于活化状态, 但是许多研究结果表明在许多肿瘤组织中该通路被过度激活, 从而通过下调肿瘤抑制蛋白P53、刺激蛋白质合成、抑制细胞凋亡等导致肿瘤细胞的无限增值, 成为肿瘤预后差的标志, 因此抑制该通路的激活有利于肿瘤的治疗[13-15].
利培酮作为第二代抗精神病药物, 在临床上主要应用于精神分裂症患者的治疗. 最近一些研究表明第二代抗精神病药物利培酮、奥氮平及喹硫平的使用, 增加患2型糖尿病的风险[16]. PKB作为胰岛素信号传导中的关键因子, 其活性直接影响胰岛素在细胞中的作用, 但目前尚未阐明利培酮于与PKB活性之间的关系.
本文采用利培酮抑制结肠癌细胞的生长模型探讨利培酮是否抑制PKB的活性及其机制. SW480细胞作为人结肠癌细胞株, 许多研究以该细胞株作为结肠癌治疗药物的细胞模型. 本实验发现100 nmol/L的利培酮处理结肠癌细胞培养24 h和48 h后, 细胞生长缓慢、细胞体积变小、呈现出抑制细胞生长的特征. 同时利培酮可阻断PKB-S473和T308位点的磷酸化. 结果表明, 利培酮可能是通过阻断PKB的活性从而抑制结肠癌细胞的生长.
调节PKB的活性及细胞生长的机制非常复杂. 其中人们对ERK1/2信号传导通路与PKB的活性调节研究得较有深入. 然而, ERK1/2在调节PKB的活性还存在着争议, 一方面大量文献表明, ERK1/2可激活PKB的活性, 从而促进细胞存活与生长[17]; 另一方面, 最近研究表明ERK1/2通过诱导SOCS3, 抑制各种生长激素受体的磷酸化, 从而抑制PKB的活性及细胞生长. 利培酮可激活EKR1/2的活性, 且ERK1/2依赖性诱导SOCS3基因的表达. 上述结果提示, 利培酮可能是通过激活ERK1/2的活性诱导SOCS3基因的表达. 而增加的SOCS3蛋白与EGF受体结合, 抑制EGF诱导的受体磷酸化, 最终达到阻断PKB的活性及抑制细胞生长的作用.
为进一步证实上述假设, 采用EKR1/2特异性抑制剂-U0126, 判断是否抑制ERK1/2条件下, 利培酮同样可以阻断PKB磷酸化. 如图4A和4B所示, 当SW480细胞中添加U0126时利培酮抑制PKB的磷酸化的作用完全被阻断.
总之, 利培酮能抑制人结肠癌细胞株的生长, 其作用机制可能是通过激活ERK1/2的活性, 诱导SOCS3基因的表达, 阻断EGF受体的磷酸化, 从而抑制PKB的活性, 最终达到抑制结肠癌细胞的生长. 本实验结果提示, 利培酮作为第二代抗精神病药物, 不仅用于精神分裂症患者的治疗, 而且具有抑制肿瘤细胞的生长的作用, 其作用机制可能与抑制PKB活性有关.
最后, 本研究结果为研发结肠癌靶向治疗药物提供新的分子生物学理论基础, 进一步研究G偶联蛋白受体与SOCS3之间的作用关系, 可能会成为研究结肠癌靶向分子的新的热点.
利培酮属苯丙异恶唑的衍生物, 是一种非典型的新型抗精神病药物, 具有对多巴胺D2受体和5羟色胺的5-HT2受体的双重阻滞作用. 在临床上多用于精神分裂症患者的治疗, 其主要不良反应为体质量增加, 目前其原因仍未能阐明.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
探究G偶联蛋白受体与SOCS3相互之间的作用关系, 可能会成为靶向分子研究新的热点.
最近一些研究表明第二代抗精神病药物利培酮、奥氮平及喹硫平的使用, 增加患2型糖尿病的风险. 蛋白激酶B(PKB)作为胰岛素信号传导中的关键因子, 其活性直接影响胰岛素在细胞中的作用, 但目前利培酮与PKB活性之间关系尚未被阐明.
本文新颖性较好, 内容重要, 提供充足有意义的信息.
编辑: 李军亮 电编: 鲁亚静
| 1. | Chouinard G, Arnott W. Clinical review of risperidone. Can J Psychiatry. 1993;38 Suppl 3:S89-S95. [PubMed] |
| 2. | Kapur S, Seeman P. Does fast dissociation from the dopamine d(2) receptor explain the action of atypical antipsychotics?: A new hypothesis. Am J Psychiatry. 2001;158:360-369. [PubMed] |
| 3. | Scheen AJ, De Hert MA. Abnormal glucose metabolism in patients treated with antipsychotics. Diabetes Metab. 2007;33:169-175. [PubMed] [DOI] |
| 4. | Zou W, Li ZY, Li CL, Cui ZC. [Protein kinase B and its role in the signal transduction pathway mediated by phosphoinositide 3-kinase]. Shengli Kexue Jinzhan. 2000;31:120-124. [PubMed] |
| 5. | Cheng GZ, Park S, Shu S, He L, Kong W, Zhang W, Yuan Z, Wang LH, Cheng JQ. Advances of AKT pathway in human oncogenesis and as a target for anti-cancer drug discovery. Curr Cancer Drug Targets. 2008;8:2-6. [PubMed] |
| 6. | Kim D, Dan HC, Park S, Yang L, Liu Q, Kaneko S, Ning J, He L, Yang H, Sun M. AKT/PKB signaling mechanisms in cancer and chemoresistance. Front Biosci. 2005;10:975-987. [PubMed] [DOI] |
| 7. | Fresno Vara JA, Casado E, de Castro J, Cejas P, Belda-Iniesta C, González-Barón M. PI3K/Akt signalling pathway and cancer. Cancer Treat Rev. 2004;30:193-204. [PubMed] |
| 8. | Penela P, Ribas C, Mayor F. Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases. Cell Signal. 2003;15:973-981. [PubMed] [DOI] |
| 9. | 高 景霞, 吕 立夏, 李 静琪, 李 艳娜, 徐 磊, 李 学礼. G蛋白偶联受体激酶2对EGF诱导的cAMP生成的调控. 同济大学学报(医学版). 2005;26:25-28. |
| 10. | Gutkind JS. Regulation of mitogen-activated protein kinase signaling networks by G protein-coupled receptors. Sci STKE. 2000;2000:re1. [PubMed] |
| 11. | Glauser DA, Schlegel W. Sequential actions of ERK1/2 on the AP-1 transcription factor allow temporal integration of metabolic signals in pancreatic beta cells. FASEB J. 2007;21:3240-3249. [PubMed] |
| 12. | Chang F, Lee JT, Navolanic PM, Steelman LS, Shelton JG, Blalock WL, Franklin RA, McCubrey JA. Involvement of PI3K/Akt pathway in cell cycle progression, apoptosis, and neoplastic transformation: a target for cancer chemotherapy. Leukemia. 2003;17:590-603. [PubMed] [DOI] |
| 13. | Ogawara Y, Kishishita S, Obata T, Isazawa Y, Suzuki T, Tanaka K, Masuyama N, Gotoh Y. Akt enhances Mdm2-mediated ubiquitination and degradation of p53. J Biol Chem. 2002;277:21843-21850. [PubMed] [DOI] |
| 14. | Whiteman EL, Cho H, Birnbaum MJ. Role of Akt/protein kinase B in metabolism. Trends Endocrinol Metab. 2002;13:444-451. [PubMed] |
| 15. | Li Q, Zhu GD. Targeting serine/threonine protein kinase B/Akt and cell-cycle checkpoint kinases for treating cancer. Curr Top Med Chem. 2002;2:939-971. [PubMed] [DOI] |
| 16. | Tschoner A, Engl J, Laimer M, Kaser S, Rettenbacher M, Fleischhacker WW, Patsch JR, Ebenbichler CF. Metabolic side effects of antipsychotic medication. Int J Clin Pract. 2007;61:1356-1370. [PubMed] [DOI] |
| 17. | Rodrigues AR, Pignatelli D, Almeida H, Gouveia AM. Melanocortin 5 receptor activates ERK1/2 through a PI3K-regulated signaling mechanism. Mol Cell Endocrinol. 2009;303:74-81. [PubMed] [DOI] |