修回日期: 2013-01-18
接受日期: 2013-01-20
在线出版日期: 2013-02-08
目的: 探讨转化生长因子-β1(transforming growth factor-β1, TGF-β1)、早期基因1(transforming growth factor β-inducible early gene 1, TIEG1)和Stathmin蛋白在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)组织中的表达及临床意义.
方法: 应用免疫组织化学法检测62例ESCC、31例癌旁不典型增生组织及62例正常食管黏膜组织中TGF-β1、TIEG1和Stathmin蛋白的表达情况.
结果: 正常食管黏膜组织中TGF-β1和TIEG1蛋白表达的阳性率显著高于非典型增生组织和食管癌组织[TGF-β1: 62(100.0%) vs 22(71.0%), 41(66.1%), P<0.05]. 食管鳞癌组织和癌旁不典型增生组织中也检测到Stathmin蛋白表达, 但较TGF-β1和TIEG1表达范围窄. 正常食管黏膜组织中未检测到Stathmin的表达. 进一步统计分析表明Stathmin与TGF-β1、TIEG1在食管鳞癌的表达呈负相关[TGF-β1: r = -0.609, r = -0.459; TIEG1: P<0.05); 高表达Stathmin的病例中TGF-β1和TIEG1低表达或不表达. 统计结果还表明TGF-β1、TIEG1和Stathmin蛋白表达与癌的临床分级及淋巴结转移密切相关(P<0.05).
结论: TGF-β1和TIEG1蛋白可能结合Stathmin结合位点, 负性调节Stathmin蛋白, 抑制食管癌的转移.
引文著录: 庞霞, 李晟磊, 赵志华, 张红新, 高冬玲. TGF-β1、TIEG1和Stathmin蛋白在食管鳞状细胞癌组织中的表达及临床意义. 世界华人消化杂志 2013; 21(4): 327-331
Revised: January 18, 2013
Accepted: January 20, 2013
Published online: February 8, 2013
AIM: To analyze the clinical significance of expression of transforming growth factor-β1 (TGF-β1), transforming growth factor β-inducible early gene 1 (TIEG1) and stathmin in esophageal squamous cell carcinoma (ESCC).
METHODS: Immunohistochemistry was used to detect the expression of TGF-β1, TIEG1 and stathmin in 62 cases of ESCC, 31 cases of tumor-adjacent atypical hyperplasia epithelium and 62 cases of normal esophageal epithelium.
RESULTS: The positive rates of TGF-β1 and TIEG1 proteins in normal esophageal epithelium were significantly higher than those in tumor-adjacent atypical hyperplasia epithelium and ESCC [TGF-β1: 62 (100.0) vs 22 (71.0), 41 (66.1), P < 0.05]. The expression of stathmin was also noted in ESCC and tumor-adjacent atypical hyperplasia epithelium, but its expression was not as wide as that of TGF-β1 and TIEG1. In normal esophageal epithelium, the expression of stathmin was not detected. Expression of stathmin in ESCC had a negative correlation with TGF-β1 and TIEG1 expression (r = -0.609, -0.459, both P < 0.05)). The expression of TGF-β1, TIEG1 and stathmin proteins was closely correlated with clinical grade and lymph node metastasis in ESCC (all P < 0.05).
CONCLUSION: TGF-β1 and TIEG1 may bind to stathmin, down-regulate stathmin expression and inhibit the metastasis of ESCC.
- Citation: Pang X, Li SL, Zhao ZH, Zhang HX, Gao DL. Clinical significance of expression of TGF-β1, TIEG1 and stathmin proteins in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 327-331
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/327.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.327
食管癌是人类常见的恶性肿瘤之一, 食管癌的形成是一个复杂的过程, 其发生、发展存在着多种途径, 包括细胞的增殖、凋亡的抑制、肿瘤基质和肿瘤周围血管的形成等多个方面, 而这些方面又受到多种因素的调控, 其中细胞因子对肿瘤的作用越来越受到关注[1]. 目前的研究显示, 转化生长因子β(transforming growth factor β, TGF-β)能够抑制肿瘤细胞的增殖, 但又有促进肿瘤生长和浸润的作用[2]. TIEG1为TGF-β诱导的早期反应基因, 目前研究者认为TIEG1主要的生物学功能是抑制细胞增殖、诱导凋亡, 与TGF-β的诱导相似, TIEG1表达水平的降低与乳腺癌、胃癌和胰腺癌等多种肿瘤的发生、发展有关[3,4]. Stathmin为一种高度保守的胞质磷蛋白, 在多种肿瘤细胞中过表达[5]. 另有报道显示, TGF-β和TIEG1可以下调Stathmin的表达[6], 提示三者在肿瘤的发生发展中可能具有极其重要的内在联系. 然而, 迄今为止, 国内外尚未见食管癌中TGF-β1、TIEG1和Stathmin的研究报道, 本研究通过免疫组织化学技术检测食管癌组织、不典型增生组织和正常食管黏膜组织中TGF-β1、TIEG1和Stathmin蛋白的表达, 并分析三者表达的相关性, 以期为食管癌的分子诊断及临床治疗提供理论依据.
收集河南省安阳市肿瘤医院2006-02-26/2006-03-16食管癌新鲜切除的手术标本62例, 其中男36例, 女26例, 年龄在38-75岁之间, 所有患者术前均无化疗、放疗及免疫治疗史. 62例标本分别在无坏死区癌组织、癌旁3 cm以内及远端正常黏膜组织3处取材, 经40 g/L甲酫固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE和免疫组织化学染色. 经HE染色病理组织学证实, 癌灶组织均证实为鳞状细胞癌. 按WHO分类标准(1996)进行组织学分级: 高分化15例, 中分化25例, 低分化22例. 浸润深度: 深肌层55例, 浅肌层7例. 伴淋巴结转移者20例, 无淋巴结转移者42例. 癌旁组织中31例是不典型增生. 远端正常黏膜组织均为正常食管黏膜. 鼠抗人单克隆抗体TGF-β1、Stathmin工作液及S-P免疫组织化学试剂盒和DAB显色剂均购自北京中杉金桥生物技术开发公司; 兔抗人多克隆抗体TIEG1购自美国Santa Cruz公司, 稀释倍数为1:300.
采用SP法, DAB显色, 苏木素复染. 详细步骤严格按S-P试剂盒说明操作, 每批染色均用试剂公司提供的TGF-β1、TIEG1和Stathmin阳性切片作为阳性对照; 用PBS代替一抗作为阴性对照. 由两位病理医师对食管鳞癌、癌旁不典型增生及正常食管黏膜切片进行观察. 每张切片随机取5个(×400)高倍视野, 每个视野观察细胞数不少于100个. (1)按切片中TGF-β1、TIEG1和Stathmin染色程度评分: 0分, 基本不着色; 1分, 着色呈浅黄色; 2分, 着色呈棕黄色; 3分, 着色呈棕褐色; (2)按TGF-β、TIEG1和Stathmin阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分, >70%为3分; (3)阳性结果判断: 取(1)、(2)两项评分的乘积作为总积分, 0-1分为阴性(-), ≥2分为阳性(+)[7].
统计学处理 应用SPSS11.0统计学软件进行数据分析, 阳性率的比较采用χ2检验, 相关性检验用Spearman相关分析, 检验水准α = 0.05.
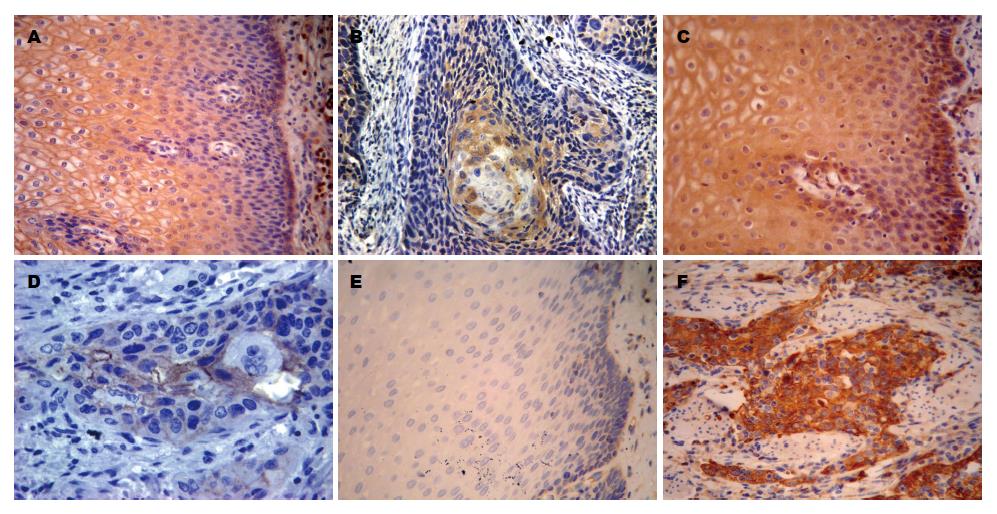
TGF-β1和TIEG1蛋白阳性表达主要位于细胞胞质及胞膜上, 呈浅黄色至深黄色(图1A-D). TGF-β1和TIEG1蛋白在正常黏膜组织中棘细胞层表达最强, 基底细胞层呈低表达; 而在食管癌组织中, TGF-β1和TIEG1蛋白在高分化的癌细胞中着色明显. 正常食管组织中TGF-β1和TIEG1蛋白的表达率高于不典型增生和食管癌的表达率, 3组间比较, 差异均具有统计学意义(均P<0.05, 表1). 此外, Stathmin蛋白阳性表达主要位于肿瘤细胞的胞质内, 呈棕黄色颗粒(图1E, F). Stathmin蛋白在食管癌组织中的表达率显著高于不典型增生组织和正常黏膜组织, 3组间比较, 差异具有统计学意义(P<0.05, 表1).
| 组织类型 | n | TGF-β1 | χ2值 | P值 | TIEG1 | χ2值 | P值 | Stathmin | χ2值 | P值 |
| 正常黏膜上皮 | 62 | 62(100.0) | 62(100.0) | 0(0.0) | ||||||
| 非典型增生 | 31 | 22(71.0) | 35.578 | 0.000 | 19(61.3) | 32.593 | 0.000 | 5(16.1) | 45.550 | 0.000 |
| 鳞癌 | 62 | 41(66.1) | 48(77.4) | 27(43.5) |
利用SPSS10.0软件分析TGF-β1、TIEG1和Stathmin蛋白的表达与食管癌临床病理参数之间的关系, 结果表明, TGF-β1、TIEG1和Stathmin蛋白的表达与食管癌的分化程度及淋巴结转移之间均有显著的相关性(均P<0.05, 表2), 提示TGF-β1、TIEG1和Stathmin蛋白可能与食管癌的发生发展关系密切.
| 病理学指标 | n | TGF-β1 | χ2值 | P值 | TIEG1 | χ2值 | P值 | Stathmin | χ2值 | P值 |
| 组织学分级 | ||||||||||
| 高分化 | 15 | 13(86.7) | 14(93.3) | 4(26.7) | ||||||
| 中分化 | 25 | 18(72.0) | 7.638 | 0.022 | 19(76.0) | 15.639 | 0.000 | 8(32.0) | 8.653 | 0.013 |
| 低分化 | 22 | 10(45.5) | 8(36.4) | 15(68.2) | ||||||
| 浸润深度 | ||||||||||
| 浅 层 | 7 | 4(57.1) | 0.012 | 0.913 | 5(71.4) | 0.000 | 1.000 | 2(28.6) | 0.197 | 0.657 |
| 深 层 | 55 | 37(67.3) | 43(78.2) | 25(45.5) | ||||||
| 淋巴结转移 | ||||||||||
| 无 | 42 | 32(76.2) | 4.574 | 0.032 | 38(90.5) | 10.487 | 0.001 | 12(28.6) | 10.066 | 0.002 |
| 有 | 20 | 9(45.0) | 10(50.0) | 15(75.0) |
TGF-β是由2个结构相同或相近多肽生长因子, TGF-β主要通过受体介导的Smad蛋白激活来调控下游基因转录, 发挥细胞的增殖和分化及肿瘤发生与进展等生物学功能[8,9]. TGF-β诱导的早期反应基因(TGF-β inducible early gene, TIEG)最早从人成骨细胞中得到的[10], TIEGl具有Spl样蛋白家族的典型特征, 羧基末端有3个锌指DNA结合元件, 能够直接调控其他基因的启动子中富含GC的DNA序列(SPl样结合位点), 从而参与细胞增生、凋亡、分化和肿瘤形成[11]. 很多研究者表明, TIEGl基因过表达可以促进TGF-β1诱导Smad2的磷酸化, 抑制Smad7基因表达水平, 在肿瘤的发生发展中起重要的作用[12]. Stathmin(又称OPl8)是一种高度保守的细胞内磷酸化蛋白,存在多个Sp1结合位点, 并受TIEG1基因直接调控, 由于其特有解聚活性, 在细胞的增殖和分化及肿瘤发生中有十分重要的作用[13]. Stathmin基因在多种恶性肿瘤中高度表达, 如白血病、神经胶质瘤、淋巴瘤、前列腺癌、乳腺癌、肺癌、卵巢癌、骨肉瘤及消化系统恶性肿瘤[14-16]. 以上研究提示: TGF-β1、TIEG1和Stathmin蛋白的联合检测可能在肿瘤细胞中具有重要的价值.
目前在食管癌研究中, 王辉等[17]报道, 48例食管癌病例中仅发现有30例TGF-β1基因的高表达, 而10例正常黏膜组织中都表达; 此外王峰等[18]对Stathmin的研究发现, 在75例食管癌患者中Stathmin的表达阳性率为81.3%, 明显高于正常食管黏膜组织; 结果还显示, Stathmin表达与食管癌的分化程度、浸润深度及淋巴结转移均密切相关; 并且研究发现TIEG1表达低与乳腺癌、胃癌和胰腺癌等多种肿瘤的发生、发展密切相关[3,4]. 然而这些研究尚未同时在食管癌中检测TGF-β1、TIEG1和Stathmin蛋白的表达及分析三者可能的关系. 在本实验中发现正常食管黏膜中TGF-β1和TIEG1蛋白表达均显著高于癌旁及食管癌, 具有显著性差异(均P = 0.000). 提示高表达TGF-β1和TIEG1蛋白可能是抑制肿瘤增殖, Stathmin蛋白在食管癌组织中的阳性率为43.5%, 明显高于不典型增生组织和正常黏膜组织中的阳性率(分别为16.1%、0%)(χ2 = 45.550, P = 0.000), 提示Stathmin蛋白在食管癌的发生发展中起重要的作用. Jiang等[6]利用染色质免疫共沉淀实验发现: TIEGl可能直接结合Stathmin启动子的Spl样DNA结合位点, 抑制启动子活性, 下调Stathmin的表达. 我们进一步经相关分析表明, 高表达Stathmin的病例中TGF-β1和TIEG1低表达或不表达. Stathmin与TGF-β1和TIEG1蛋白表达均呈负相关关系, 我们假想: TGF-β1和TIEG1基因可能结合Stathmin启动子的Spl样DNA结合位点, 抑制启动子活性, 从而负性调节Stathmin基因, 抑制肿瘤增殖. 此外, 我们进一步分析TGF-β1、TIEG1及Stathmin蛋白的表达与临床病理学参数之间的关系, 发现TGF-β1、TIEG1及Stathmin蛋白与食管癌的分化程度及淋巴结转移之间均有显著的相关性(均P<0.05), 提示TGF-β1、TIEG1及Stathmin蛋白的表达可能与食管癌的浸润转移关系密切.
总之, 肿瘤的发生发展及侵袭转移是一个多因素参与的复杂过程. 本实验研究了TGF-β1、TIEG1及Stathmin蛋白在食管癌中的表达并探讨了三者之间的相关性. 结果提示, TGF-β1、TIEG1及Stathmin蛋白在食管癌的发生发展及转移中起重要的作用, TGF-β1和TIEG1基因可能结合Stathmin结合位点, 负性调节Stathmin基因, 抑制食管癌增殖. 本实验结果可能为探讨食管癌发病机制, 寻找新的治疗靶点提供实验依据.
食管癌是人类常见的恶性肿瘤之一, 我国河南省更为常见. 食管癌的发生发展及侵袭转移是一个多因素参与的复杂过程, 因此研究食管癌发病及转移机制, 并寻找新的治疗靶点具有重要的意义.
樊祥山, 副主任医师, 南京大学医学院附属鼓楼医院病理科
迄今为止, 国内外尚未见食管癌中转化生长因子β1(TGF-β1)、TIEG1和Stathmin的研究报道, 故研究TGF-β1、早期基因1(TIEG1)和Stathmin蛋白在食管癌中的表达, 并分析三者表达的相关性, 以期为食管癌的分子诊断及临床治疗提供理论依据.
TGF-β1具有双重性, 扮演着肿瘤抑制基因和癌基因的双重角色. TIEG1为TGF-β诱导的早期反应基因, 目前研究者认为TIEG1表达水平的降低与乳腺癌、胃癌和胰腺癌等多种肿瘤的发生、发展有关. Stathmin为一种高度保守的胞质磷蛋白, 在多种肿瘤细胞中过表达.
本文首次应用免疫组织化学SP法检测62例ESCC、31例癌旁不典型增生组织及62例正常食管黏膜组织中TGF-β1、TIEG1和Stathmin蛋白的表达, 探讨三者在食管癌的发生发展及浸润转移中的作用机制.
TGF-β1和TIEG1基因可能结合Stathmin结合位点, 负性调节Stathmin基因, 抑制食管癌增殖. 本实验结果可能为探讨食管癌发病机制, 寻找新的治疗靶点提供了实验依据.
本文为探讨食管癌发病机制, 寻找新的治疗靶点提供了重要的参考价值.
编辑: 田滢 电编: 闫晋利
| 1. | Lu TY, Li WC, Chen RY, Fan QX, Wang LX, Wang RL, Lu SX, Meng H. Inhibition effects of all trans-retinoic acid on the growth and angiogenesis of esophageal squamous cell carcinoma in nude mice. Chin Med J (Engl). 2011;124:2708-2714. [PubMed] |
| 2. | Miyazono K. Molecular mechanisms of transforming growth factor-β signaling and disease: The 59th Fujihara International Seminar, 2010. Cancer Sci. 2011;102:1242-1244. [PubMed] [DOI] |
| 3. | Jin W, Chen BB, Li JY, Zhu H, Huang M, Gu SM, Wang QQ, Chen JY, Yu S, Wu J. TIEG1 inhibits breast cancer invasion and metastasis by inhibition of epidermal growth factor receptor (EGFR) transcription and the EGFR signaling pathway. Mol Cell Biol. 2012;32:50-63. [PubMed] [DOI] |
| 4. | Antonello D, Moore PS, Zamboni G, Falconi M, Scarpa A. Absence of mutations in the transforming growth factor-beta inducible early gene 1, TIEG1, in pancreatic cancer. Cancer Lett. 2002;183:179-183. [PubMed] [DOI] |
| 5. | Wang F, Wang LX, He W, Li K, Wang RL, Zhao PR, Fan QX. [Up-regulation of stathmin induces growth arrest of esophageal squamous cell carcinoma EC9706 cell]. Zhonghua Yixue Zazhi. 2010;90:2140-2144. [PubMed] |
| 6. | Jiang L, Chen Y, Chan CY, Wang X, Lin L, He ML, Lin MC, Yew DT, Sung JJ, Li JC. Down-regulation of stathmin is required for TGF-beta inducible early gene 1 induced growth inhibition of pancreatic cancer cells. Cancer Lett. 2009;274:101-108. [PubMed] [DOI] |
| 7. | 陈 明勇, 庞 霞, 郑 湘予, 李 晟磊, 赵 志华, 张 红新, 陈 奎生. VEGF-C、VEGFR-3、CD105及CD68蛋白在食管鳞状细胞癌组织中的表达及意义. 世界华人消化杂志. 2009;17:578-583. [DOI] |
| 8. | Watabe T, Miyazono K. Roles of TGF-beta family signaling in stem cell renewal and differentiation. Cell Res. 2009;19:103-115. [PubMed] [DOI] |
| 9. | Kitisin K, Saha T, Blake T, Golestaneh N, Deng M, Kim C, Tang Y, Shetty K, Mishra B, Mishra L. Tgf-Beta signaling in development. Sci STKE. 2007;2007:cm1. [PubMed] |
| 10. | Subramaniam M, Harris SA, Oursler MJ, Rasmussen K, Riggs BL, Spelsberg TC. Identification of a novel TGF-beta-regulated gene encoding a putative zinc finger protein in human osteoblasts. Nucleic Acids Res. 1995;23:4907-4912. [PubMed] [DOI] |
| 11. | Subramaniam M, Hawse JR, Johnsen SA, Spelsberg TC. Role of TIEG1 in biological processes and disease states. J Cell Biochem. 2007;102:539-548. [PubMed] [DOI] |
| 12. | Johnsen SA, Subramaniam M, Janknecht R, Spelsberg TC. TGFbeta inducible early gene enhances TGFbeta/Smad-dependent transcriptional responses. Oncogene. 2002;21:5783-5790. [PubMed] [DOI] |
| 13. | Missimer JH, Steinmetz MO, van Gunsteren WF, Dolenc J. Influence of 63Ser phosphorylation and dephosphorylation on the structure of the stathmin helical nucleation sequence: a molecular dynamics study. Biochemistry. 2012;51:8455-8463. [PubMed] [DOI] |
| 14. | Baquero MT, Hanna JA, Neumeister V, Cheng H, Molinaro AM, Harris LN, Rimm DL. Stathmin expression and its relationship to microtubule-associated protein tau and outcome in breast cancer. Cancer. 2012;118:4660-4669. [PubMed] [DOI] |
| 15. | Singer S, Malz M, Herpel E, Warth A, Bissinger M, Keith M, Muley T, Meister M, Hoffmann H, Penzel R. Coordinated expression of stathmin family members by far upstream sequence element-binding protein-1 increases motility in non-small cell lung cancer. Cancer Res. 2009;69:2234-2243. [PubMed] [DOI] |