修回日期: 2012-12-31
接受日期: 2013-01-05
在线出版日期: 2013-02-08
目的: 探讨硫化氢(hydrogen sulfide, H2S)对肝纤维化大鼠肝脏Ⅰ型胶原(COL-Ⅰ)和Ⅲ型胶原(COL-Ⅲ)的影响.
方法: 选择硫氢化钠(sodium hydrosulfide, NaHS)作为H2S的供体, 将32只♀SD大鼠分为3组: 正常组(N组)8只、肝纤维化组(hepatic fibrosis, HF组)13只、NaHS干预组(S组)11只, 采用四氯化碳复合因素法复制肝纤维化模型, S组自造模第6周始给予NaHS 56 μmol/(kg·d)腹腔注射12 d, N组和HF组给予同等剂量的生理盐水腹腔注射. 干预结束后, 宰杀大鼠留取肝脏行肝组织病理切片HE染色评价肝纤维化分期, 行Masson染色观察胶原纤维沉积情况, 应用RT-PCR法检测肝脏中COL-Ⅰ、COL-Ⅲ mRNA表达, 采用SP免疫组织化学法检测肝脏COL-Ⅰ、COL-Ⅲ表达.
结果: HF组与N组相比, COL-Ⅰ、COL-Ⅲ及其mRNA表达升高(均P = 0.000), 与肝纤维化分期结果一致(P = 0.000); S组与HF组相比, COL-Ⅰ和COL-Ⅲ表达降低(均P = 0.000); COL-ⅠmRNA表达降低(P = 0.009), 同时COL-Ⅲ mRNA表达亦降低(P = 0.003), 肝纤维化分期下降(P = 0.047).
结论: H2S具有降低肝脏Ⅰ、Ⅲ型胶原表达的作用, 能够延缓肝纤维化的发生发展.
引文著录: 赵强, 陈卫刚, 赵瑾, 李睿, 宋丽秀, 任嫱, 杨新疆, 郑勇. 硫化氢对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原表达的影响. 世界华人消化杂志 2013; 21(4): 300-306
Revised: December 31, 2012
Accepted: January 5, 2013
Published online: February 8, 2013
AIM: To investigate the effect of hydrogen sulfide on collagen Ⅰ and collagen Ⅲ expression in the liver of rats with experimental hepatic fibrosis.
METHODS: Thirty-two female SD rats were randomly divided into three groups: normal control group, hepatic fibrosis group, and hydrogen sulfide group. Rats in the hepatic fibrosis group and hydrogen sulfide group were subcutaneously injected with carbon tetrachloride to induce hepatic fibrosis. Rats in the hydrogen sulfide group were intraperitoneally injected with sodium hydrosulfide (56 μmol/kg•d; the donor of hydrogen sulfide). Fibrosis was staged using histopathological methods. The expression of collagen Ⅰ and collagen Ⅲ was detected by immunohistochemistry and RT-PCR.
RESULTS: Compared to the normal control group, the stage of fibrosis was elevated (P < 0.01) and the expression of collagen Ⅰ and collagen Ⅲ was increased (both P < 0.01) in the hepatic fibrosis group. Compared to the hepatic fibrosis group, the stage of fibrosis declined (P < 0.05) and the expression of collagen Ⅰ and collagen Ⅲ was decreased (both P < 0.01) in the hydrogen sulfide group.
CONCLUSION: Hydrogen sulfide can decrease the expression of collagen Ⅰ and collagen Ⅲ and inhibit the progression of hepatic fibrosis in rats.
- Citation: Zhao Q, Chen WG, Zhao J, Li R, Song LX, Ren Q, Yang XJ, Zheng Y. Hydrogen sulfide decreases collagen Ⅰ and collagen Ⅲ expression in the liver of rats with experimental hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 300-306
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/300.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.300
肝纤维化(hepatic fibrosis, HF)是肝脏对各种慢性刺激进行损伤修复反应时, 以胶原为主的细胞外基质(extracellular matrix, ECM)在肝内大量沉积的病理过程. 因其发生机制尚未完全明确, 故已成为目前国内外学者研究的热点.
硫化氢(hydrogen sulfide, H2S)是新近发现的存在于体内的气体信号分子, 具有广泛的生物学效应. 近年来, 国内外学者研究发现H2S能缓解心肌纤维化[1]、减轻肺内皮细胞屏障损害[2]、拮抗神经退行性变[3]、改善肾缺血再灌注损伤[4]从而在心血管、呼吸、神经、泌尿等多系统疾病中发挥重要的保护作用. 本课题组前期对肝硬化的研究发现: 肝硬化大鼠门静脉血中H2S降低, 并且随着肝硬化程度加重逐渐降低[5]; 肝硬化时大鼠门静脉压力明显升高, 而给予H2S供体-硫氢化钠(sodium hydrosulfide, NaHS)干预后则明显降低[6], 但H2S对肝纤维化进程的影响仍不确切. 因此, 本实验复制肝纤维化模型, 通过NaHS的干预, 观察肝脏组织病理学变化, 检测与肝纤维化进程中关系最为密切的Ⅰ、Ⅲ型胶原沉积情况, 探讨其对肝纤维化的影响, 为进一步研究H2S与肝纤维化的关系提供理论基础.
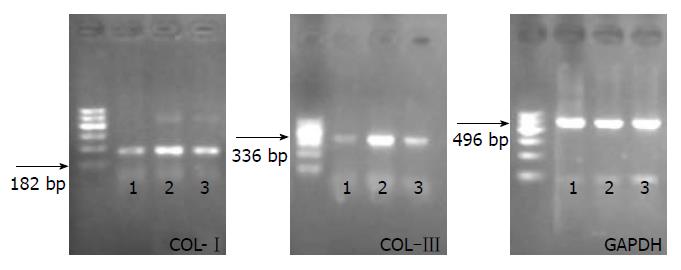
32只实验大鼠购自新疆医科大学实验动物中心, 均为同期出生、纯种系、SPF级4-5周龄的健康♀SD大鼠, 体质量约180-220 g. NaHS为美国Sigma公司产品; 兔抗大鼠Ⅰ型胶原蛋白多克隆抗体、兔抗大鼠Ⅲ型胶原蛋白多克隆抗体为美国Abcam公司产品; 免疫组织化学染色SP试剂盒为北京中杉公司产品; DAB显色剂为DAKO公司产品; RNA提取试剂TRIzol为美国Invitrogen公司产品; 逆转录酶试剂盒为美国Fermentas公司产品; 四氯化碳、无水乙醇、胆固醇粉均为国产分析纯. PCR引物由上海生物工程公司合成, COL-ⅠmRNA引物序列[7]: Forward: 5'-GGTCCCAAAGGTGCTGATGG-3', Reverse: 5'-GACCAGCCTCACCACGGTCT-3', 扩增长度为182 bp; COL-Ⅲ mRNA引物序列[7]: Forward: 5'-CGAGGTGACAGAGGTGAAAGA-3', Reverse: 5'-AACCCAGTATTCTCCGCTCTT-3', 扩增长度为336 bp; GAPDH引物序列: Forward: 5'-CAAGGTCATCCATGACAACTTTG-3', Reverse:5'- CAAGGTCATCCATGACAACTTTG -3', 扩增长度为496 bp.
1.2.1 制备模型及实施干预: 根据本课题组前期实验经验, 采用四氯化碳复合因素法复制肝纤维化大鼠模型. 将32只大鼠随机分为3组: N组(正常对照组)8只, HF组(肝纤维化组)13只和S组(NaHS干预组)11只. 给予HF组和S组大鼠背部皮下注射40%四氯化碳棉籽油溶液, 首剂5 mL/kg体质量, 后每隔4 d注射一次, 剂量为3 mL/kg体质量, 共注射12次; 以100 mL/L乙醇溶液为唯一饮用液体; 前2 wk喂以20%猪油高脂肪饲料, 以后喂以0.5%高胆固醇饲料; N组同期给予相同剂量的生理盐水背部皮下注射, 喂正常复合饲料, 饮清洁饮用水. 自造模第6周开始, S组大鼠给予腹腔注射NaHS溶液[56 μmol/(kg·d)], 共注射12 d, 其余两组腹腔注射相同剂量生理盐水.
1.2.2 标本留取: 模型复制及干预剂实施结束后, 乙醚麻醉后处死大鼠, 取大鼠肝左叶以10%中性甲醛溶液固定, 其余肝脏投入液氮速冻后置于-80 ℃备用.
1.2.3 肝组织形态学观察: 石蜡包埋组织制作切片(4 μm), 行HE染色观察肝纤维化分期, 分期标准符合《病毒性肝炎肝炎防治方案》[8]; 行Masson染色观察肝组织胶原沉积情况, 评价标准依照《肝纤维化诊断及疗效评估共识》[9]中纤维化半定量评分系统(SSS).
1.2.4 SP免疫组织化学法检测肝组织COL-Ⅰ、COL-Ⅲ表达: 石蜡切片常规脱蜡至水; 3%H2O2甲醇溶液室温孵育10 min以阻断内源性过氧化物酶; PBS浸洗3遍, 0.01 mol/L枸橼酸盐缓冲液(pH 6.0)高温修复8 min; 自然冷却至室温后PBS浸洗5 min×3次, 滴加适量山羊血清工作液, 37 ℃封闭20 min; 甩去多余血清, 滴加COL-Ⅰ一抗(1:200)或COL-Ⅲ一抗(1:200), 4 ℃过夜. 次日PBS浸洗5 min×3次, 滴加生物素化山羊抗兔二抗工作液, 37 ℃孵育20 min; PBS浸洗5 min×3次, 滴加辣根酶标记链霉卵白素工作液, 37 ℃孵育20 min后PBS浸洗5 min×3次. DAB显色, 镜下观察以控制显色时间. 显色满意后, 自来水冲去DAB, 苏木素复染, 0.1%盐酸乙醇分化, 自来水中返蓝, 脱水、透明、中性树脂封片. 选取人正常皮肤组织作为阳性对照; 阴性对照为N组大鼠肝脏, 以滴加PBS代替一抗. COL-Ⅰ、COL-Ⅲ结果以细胞外基质着棕黄色为阳性染色. 采用Image-Pro Plus 6.0图像分析系统进行分析, 每张切片随机观察5个高倍视野(×200), 以光密度(A)值代表目的蛋白的表达水平, A值越大则目的蛋白越多, 反之则越少.
1.2.5 RT-PCR法检测肝组织中COL-ⅠmRNA和COL-Ⅲ mRNA的表达: 使用TRIzol法提取肝脏总RNA, 用紫外分光光度仪行RNA浓度及纯度测定, A260/280均在1.9-2.0之间, 说明RNA纯度较高, 并将总RNA调至相同浓度. 使用RevertAidTM H Minus First Strand cDNA Synthesis kit试剂盒将总RNA逆转录为cDNA, 然后进行PCR扩增. COL-ⅠmRNA扩增条件: 95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. COL-Ⅲ mRNA扩增条件: 95 ℃ 5 min, 95 ℃30 s, 55 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. GAPDH扩增条件: 95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. 反应结束后, PCR产物用2%琼脂糖凝胶进行电泳分析, 采用Quantity one凝胶成像分析系统测定各相应条带的灰度值, 选取GAPDH作为内参照, 以COL-Ⅰ/GAPDH和COL-Ⅲ/GAPDH的比值作为目的基因的相对表达水平.
统计学处理 采用SPSS17.0统计软件进行分析. 计量资料数据以mean±SD表示, 选择单因素方差分析进行均数差异性比较, 多样本两两比较选择Bonferroni法; 肝纤维化分期半定量资料的比较采用多样本比较的秩和检验(Kruskal-Wallis法), 多样本间两两比较时选择Nemenyi法; P<0.05为差异有统计学意义.
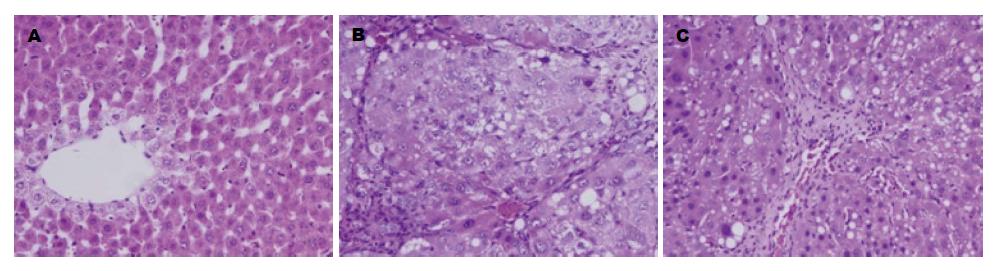
肝组织HE染色可见(图1): N组肝小叶结构清晰, 小叶内肝细胞无脂肪变性、坏死, 无炎症细胞浸润及纤维组织增生. HF组肝小叶结构紊乱, 纤维组织增生、假小叶形成, 肝细胞变性、坏死明显, 部分细胞可见气球样变, 有大量炎细胞浸润. S组肝组织仍可见假小叶结构, 但部分区假小叶纤维间隔变窄或局灶模糊不清, 肝细胞脂肪变性、坏死较HF组为轻. HF组肝纤维化分期较N组明显升高(P = 0.000), 给予NaHS干预的S组其肝纤维化分期较HF组降低(P = 0.047), 差异均具有统计学意义(表1).
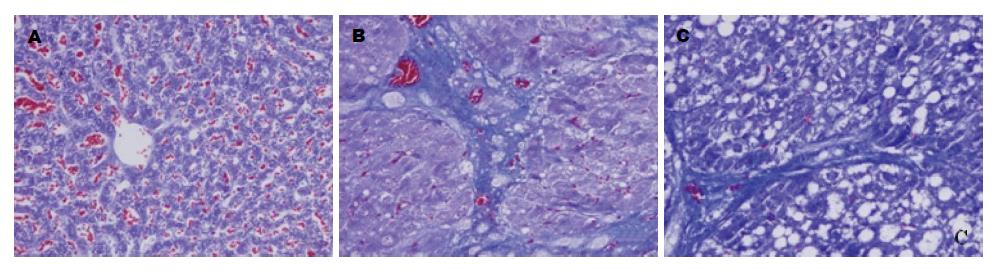
肝组织Masson染色可见(图2): N组肝小叶结构完整, 仅中央静脉和汇管区有少量胶原纤维; HF组肝小叶结构破坏, 胶原纤维增多增粗, 呈弥漫分布; S组仍可见部分假小叶结构, 但胶原纤维沉积减少, 纤维间隔纤细菲薄. HF组SSS评分较N组明显升高(P = 0.000), S组其SSS评分较HF组降低(P = 0.006), 差异均具有统计学意义(表2).
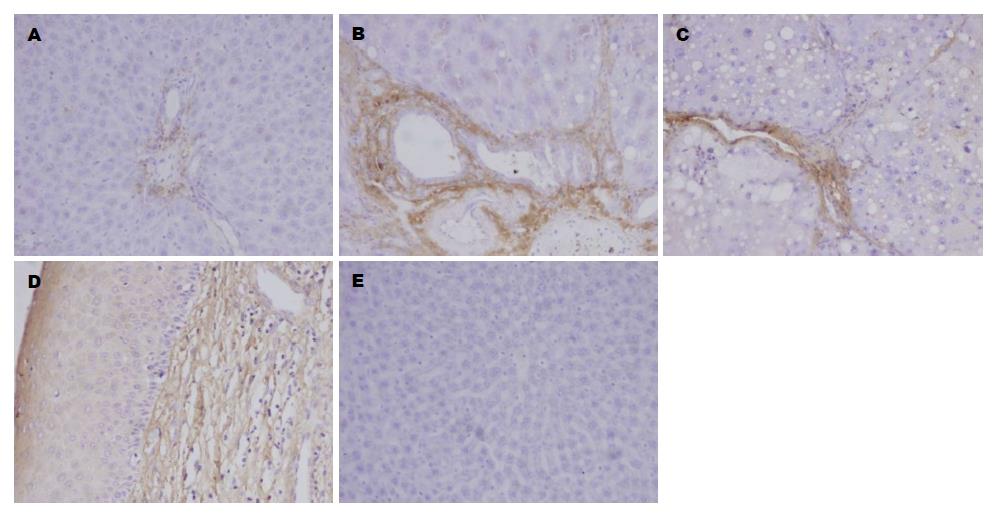
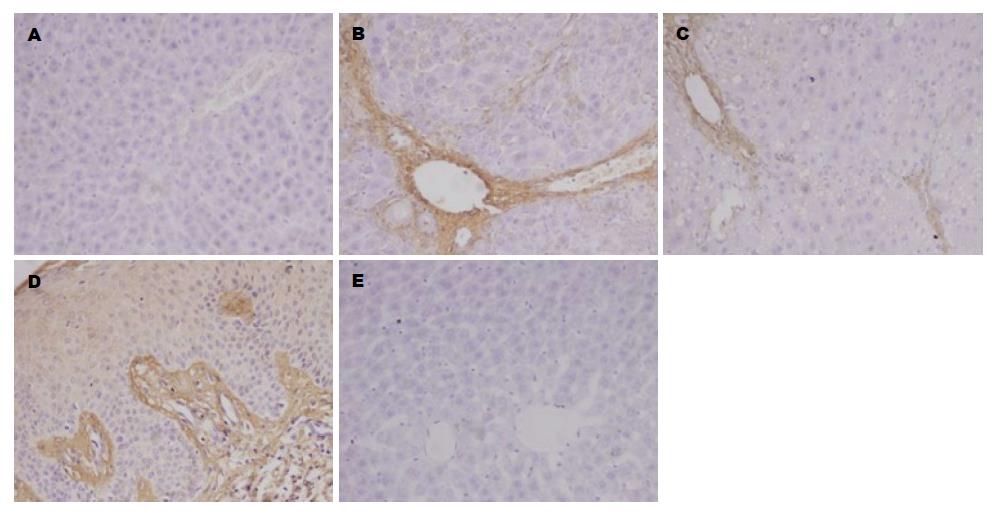
免疫组织化学染色示: N组肝组织中央静脉、汇管区中可见少量Ⅰ型(图3)、Ⅲ型(图4)胶原表达. HF组肝组织Ⅰ型、Ⅲ型胶原成条索状或小片状广泛分布, 主要表达于中央静脉、汇管区以及肝窦Disse间隙中, A值均较N组显著升高(均P = 0.000). NaHS干预的S组Ⅰ型、Ⅲ型胶原表达部位基本同HF组, 但着色面积减少、染色强度降低, 且A值较HF组降低(均P = 0.000). 差异均具有统计学意义(表2).
肝硬化是由多种原因引起以肝功能减退、门静脉高压为主要表现的疾病, 严重影响人们的健康及生活质量, 而且已成为主要的医疗保健负担. 目前尚无特效药物能将肝硬化治愈, 但肝纤维化作为各种慢性肝病进展为肝硬化的一个必经阶段, 已被证实是可逆的[10]. 肝纤维化的发生发展是一个复杂的全身病理生理过程, 涉及多种细胞因子及细胞内信号分子网络. 他的特征改变是肝脏内ECM沉积, 发生的主要机制是肝脏内的胶原过度生成、沉着和ECM重分布, 导致ECM合成与降解失衡而引起的. 肝纤维化时ECM以胶原蛋白为主, 尤以Ⅰ、Ⅲ型胶原蛋白为其主要成分.
H2S与CO、NO一样, 具有类似的生物学功能, 在肝纤维化发展过程中起着重要的调节作用. 在哺乳动物体内, H2S大部分来源于肝脏, 主要在胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CSE)的催化下产生, Kabil等[11]发现在肝脏内由CBS催化产生的H2S仅占3%, 而97%的H2S由CSE催化产生. 本课题组前期研究表明[5,6,12]; 肝硬化大鼠CSE-H2S系统表达下调, 肝硬化程度越重CSE-H2S系统表达下调越明显, 给予NaHS后则可改善这一现象, 故H2S对肝纤维的发生发展具有延缓作用, 并对肝硬化门脉高压具有一定的保护性调节作用.
本实验表明: 正常大鼠肝脏内Ⅰ、Ⅲ型胶原表达很少, 肝纤维化组大鼠肝脏纤维化分期及Ⅰ、Ⅲ型胶原的表达较正常组明显升高, 说明肝纤维化模型复制成功; 肝纤维化大鼠在给予NaHS后肝内Ⅰ、Ⅲ型胶原的表达降低, 同时从组织病理学观察肝纤维化分期下降, 表明H2S能够减少胶原沉积, 改善肝脏损害.
肝脏内ECM最主要来源于肝星状细胞(hepatic stellate cell, HSC)[13], 目前认为HSC的活化在肝纤维化发展中起着关键作用, 激活的HSC能够转化成肌成纤维母细胞, 分泌大量的ECM[14], 而H2S发挥其生物学效应的重要机制是参与调控细胞增殖与凋亡和细胞保护作用. 肝细胞作为肝脏的主体细胞, 当其受损时就能够启动HSC的激活. 当H2S缺乏时, 肝硬化大鼠肝细胞的凋亡增加, 进而促进肝纤维化启动与发生[15]. 在肝缺血再灌注损伤中, 外源性H2S可减轻肝细胞损伤、抑制肝细胞凋亡而发挥保护性作用[16]. 可见, H2S可能通过保护肝细胞间接抑制HSC的激活, 而减少胶原的生成. 阎继攀等[17]报道H2S能够抑制实验性肝纤维化大鼠肝组织内细胞的增殖, 推测最可能是HSC和肝脏门静脉汇管区血管平滑肌细胞. 在细胞水平复制肝纤维化模型的研究中, 证实H2S能够抑制HSC的增殖, 抑制细胞进入合成期[18]. 这些说明H2S可能直接抑制HSC生成胶原, 对肝纤维起到保护性作用.
肝纤维化的ECM沉积另一原因是ECM的降解减少, 这在肝纤维化后期比ECM生成增多对肝纤维化形成的意义更为突出. ECM降解有赖于基质金属蛋白酶(MMPs), 而基质金属蛋白酶组织抑制因子(TIMPs)可抑制MMPs的活性, TIMPs与MMPs比例失衡对ECM降解和肝纤维化发生发展有着重要的作用[19]. H2S能够调节TIMPs与MMPs的比例, 他可使高肺血流肺动脉高压大鼠肺动脉MMP-13及TIMP-1的表达增多, 同时以MMP-13/TIMP-1比值升高更加明显, 而使肺动脉Ⅰ、Ⅲ型胶原的降解增加[20].
综上所述, H2S可能通过减少肝细胞的损伤和凋亡而间接抑制HSC的激活, 或者直接抑制HSC增殖, 使Ⅰ、Ⅲ型胶原的合成来源减少; 亦通过增加Ⅰ、Ⅲ型胶原的降解, 使ECM的沉积减少. 我们的研究表明, H2S能够减少肝内Ⅰ、Ⅲ型胶原表达, 延缓肝纤维化的进程, 这可能会为防治肝纤维化及肝纤维化的研究提供理论依据.
硫化氢(H2S)是新型的气体信号传导分子, 具有多种生物学功能, 如抗氧化、抗炎、细胞保护、调节细胞增殖与凋亡等作用. 本课题组的前期研究证实其在肝纤维化的发展及门脉高压的调节过程中具有重要的意义.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
H2S能通过其抗氧化、抗炎、细胞保护、抗纤维化等多种生物学作用减轻和保护四氯化碳诱导的肝毒性、肝硬化以及门脉高压症, 这意味着他可能为预防和治疗慢性肝病提供新方向.
H2S能够增加肺动脉胶原的降解, 减少胶原的含量. 肝脏中, H2S能抑制肝细胞凋亡, 亦可抑制肝星状细胞(HSC)的增殖, 提示H2S能够减少胶原的合成.
本研究结果表明H2S能够减少肝内I、Ⅲ型胶原表达, 延缓肝纤维化的发展, 这可能与其能够直接或间接地减少胶原合成以及增加胶原降解有关. 因此关于H2S保护作用详尽机制的研究以及如何将其应用于临床是目前的研究热点.
本文可为H2S的基础研究提供数据, 同时为H2S应用于临床防治肝纤维化提供理论支持.
本文设计合理, 数据准确, 结论可靠, 为H2S与肝纤维化的进一步研究提供了理论基础, 具有一定的实际意义.
编辑: 田滢 电编: 闫晋利
| 1. | Shi YX, Chen Y, Zhu YZ, Huang GY, Moore PK, Huang SH, Yao T, Zhu YC. Chronic sodium hydrosulfide treatment decreases medial thickening of intramyocardial coronary arterioles, interstitial fibrosis, and ROS production in spontaneously hypertensive rats. Am J Physiol Heart Circ Physiol. 2007;293:H2093-H2100. [PubMed] [DOI] |
| 2. | Wang T, Wang L, Zaidi SR, Sammani S, Siegler J, Moreno-Vinasco L, Mathew B, Natarajan V, Garcia JG. Hydrogen sulfide attenuates particulate matter-induced human lung endothelial barrier disruption via combined reactive oxygen species scavenging and Akt activation. Am J Respir Cell Mol Biol. 2012;47:491-496. [PubMed] [DOI] |
| 3. | Hu LF, Lu M, Tiong CX, Dawe GS, Hu G, Bian JS. Neuroprotective effects of hydrogen sulfide on Parkinson's disease rat models. Aging Cell. 2010;9:135-146. [PubMed] [DOI] |
| 4. | Hunter JP, Hosgood SA, Patel M, Rose R, Read K, Nicholson ML. Effects of hydrogen sulphide in an experimental model of renal ischaemia-reperfusion injury. Br J Surg. 2012;99:1665-1671. [PubMed] [DOI] |
| 5. | 张 宁, 郑 勇, 王 于理, 李 睿, 孙 侃, 常 向云, 陈 卫刚, 赵 瑾, 李 洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志. 2009;17:307-311. [DOI] |
| 6. | 陈 卫刚, 郑 勇, 宋 丽秀, 刘 维国, 李 文娟, 刘 清华, 张 宁, 齐 翠花. 内源性H2S对大鼠实验性肝硬化门脉高压的影响. 世界华人消化杂志. 2011;19:467-471. [DOI] |
| 7. | Fang HL, Lai JJ, Lin WL, Lin WC. A fermented substance from Aspergillus phoenicis reduces liver fibrosis induced by carbon tetrachloride in rats. Biosci Biotechnol Biochem. 2007;71:1154-1161. [PubMed] [DOI] |
| 10. | Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009;8:283-291. [PubMed] |
| 11. | Kabil O, Vitvitsky V, Xie P, Banerjee R. The quantitative significance of the transsulfuration enzymes for H2S production in murine tissues. Antioxid Redox Signal. 2011;15:363-372. [PubMed] [DOI] |
| 12. | 李 文娟, 郑 勇, 陈 卫刚, 刘 清华, 张 宁, 宋 丽秀, 刘 维国. 内源性硫化氢对实验性肝硬化门静脉高压调节作用. 中华实用诊断与治疗杂志. 2010;24:429-432. |
| 13. | Gäbele E, Brenner DA, Rippe RA. Liver fibrosis: signals leading to the amplification of the fibrogenic hepatic stellate cell. Front Biosci. 2003;8:d69-d77. [PubMed] [DOI] |
| 15. | 刘 浩, 郑 勇, 陈 卫刚, 赵 瑾, 李 睿, 张 宁, 刘 芳, 阎 继攀. 内源性硫化氢对肝硬化大鼠肝细胞凋亡的影响. 世界华人消化杂志. 2012;20:670-674. [DOI] |
| 17. | 阎 继攀, 郑 勇, 刘 浩, 李 睿, 张 宁, 齐 翠花, 宋 丽秀, 陈 卫刚. 实验性肝硬化大鼠肝组织中CSE和Ki-67的表达及其意义. 胃肠病学和肝病学杂志. 2012;21:232-235. |
| 19. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] |