修回日期: 2013-11-27
接受日期: 2013-11-29
在线出版日期: 2013-12-28
目的: 研究戊型肝炎患者戊型肝炎病毒(hepatitis E virus, HEV)-Ag与其他检测指标的相关关系, 评价HEV-Ag检测在临床诊断戊型肝炎中的意义.
方法: 116例急性戊型肝炎患者血清标本应用酶联免疫吸附试验试剂盒进行抗HEV IgM、抗HEV IgG和HEV-Ag检测, 应用RT-Nested-PCR进行HEV RNA检测. 通过比较分析血清中HEV-Ag与HEV RNA检测结果, 对HEV-Ag检测的临床意义进行评价.
结果: 诊断为戊型肝炎的116例患者初次采集的血清进行HEV感染标志物的检测, 其中55.2%(64/116)为HEV-Ag阳性. 116例患者中分别有5、21、63和27例为抗HEV IgM-IgG-、IgM+ IgG-、IgM+IgG+和IgM-IgG+, 这4组中HEV-Ag的检出率分别为100%、90.5%、61.9%和3.7%. 64例抗原阳性样本中40例(62.5%, 40/64)为HEV RNA阳性, 而52抗原阴性样本中只有1例(1.9%, 1/52)为HEV RNA阴性, 对HEV-Ag检测和HEV RNA检测的结果进行相关性分析, Kappa指数为0.582, 显示血清中HEV-Ag检测和HEV RNA检测具有比较好的一致性.
结论: HEV-Ag与HEV RNA的检测结果具有较好的一致性, HEV-Ag检测有助于戊型肝炎的早期诊断及慢性感染的诊断.
核心提示: 一些戊型肝炎患者初次就诊时, 血清中尚未出现抗HEV抗体, 但能检测到HEV-Ag或HEV RNA; HEV-Ag与HEV RNA的出现存在较好一致性; 检测抗HEV IgM的同时开展HEV-Ag的检测, 能够提高戊型肝炎的临床诊断水平.
引文著录: 耿彦生, 李红权, 张宏馨, 廉海晨, 李军, 耿坤静, 周艳春. 戊型肝炎患者血清ORF2抗原的检测及临床意义. 世界华人消化杂志 2013; 21(36): 4153-4157
Revised: November 27, 2013
Accepted: November 29, 2013
Published online: December 28, 2013
AIM: To analyze the correlation of serum hepatitis E virus (HEV) ORF2 antigen with other serum markers of HEV infection and assess the significance of HEV ORF2 antigen detection for the diagnosis of HEV infection.
METHODS: Serum samples collected from sporadic hepatitis E patients were detected for anti-HEV IgM, anti-HEV IgG and HEV-Ag using ELISA kits. HEV RNA was detected by RT-Nested-PCR. The use of hepatitis E virus antigen as an early diagnostic marker for HEV infection was evaluated by comparing with HEV RNA detection.
RESULTS: Among 116 samples collected for the first time after patient admission to the hospital, 5, 21, 63 and 27 were IgM-IgG-, IgM+ IgG-, IgM+IgG+ and IgM-IgG+, respectively, and the HEV-Ag positive rate in each group was 100% (5/5), 90.5% (19/21), 61.9% (39/63) and 3.7% (1/27), respectively. Out of the 64 HEV-Ag positive samples, 40 (62.5%, 40/64) were HEV RNA positive; while out of the 52 HEV-Ag negative samples, only 1 (1.9%, 2/52) was HEV RNA positive. The consistency between ELISA for ORF2 antigen detection and RT-PCR for HEV RNA was good (Kappa value = 0.582).
CONCLUSION: The presence of HEV antigen is correlated with HEV RNA in serum samples of hepatitis E patients. HEV antigen detection is useful for the early diagnosis of acute hepatitis E.
- Citation: Geng YS, Li HQ, Zhang HX, Lian HC, Li J, Geng KJ, Zhou YC. Clinical significance of serum hepatitis E virus ORF2 antigen detection in hepatitis E patients. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4153-4157
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4153.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4153
戊型肝炎是由戊型肝炎病毒(hepatitis E virus, HEV)感染引起的一种病毒性肝炎. 我国是戊型肝炎的主要流行区之一, 近年来戊肝发病率有上升趋势. 戊型肝炎以急性肝炎为主, 也可引起重症肝炎. 免疫功能低下的患者感染HEV后, 可发展为持续性感染和慢性戊型肝炎.
急性戊型肝炎的临床表现与甲型肝炎类似, 典型的特征为一过性的病毒血症和转氨酶升高. 戊型肝炎的潜伏期为15-60 d, 发病后1 wk左右血清中能够检测到HEV RNA, 3-4 wk后HEV RNA消失; 粪便中HEV RNA的出现和消失都稍晚于血清, 持续时间2-3 wk; 发病后转氨酶水平升高, 一般3 wk左右恢复正常[1,2]. 由于戊型肝炎与其他急性病毒性肝炎的临床表现类似, 需要通过病原学检测进行确诊. 目前急性戊型肝炎的实验诊断比较常用的方法是应用酶联免疫吸附试验(ELISA)检测血清中的抗HEV IgM抗体, 或对抗HEV IgG抗体进行动态检测[2,3]. 但由于病毒抗体的产生需要一定时间, 一些患者就诊时可能尚处于病毒感染的"窗口期", 即已有病毒血症但并不能检测到抗体, 因此PCR检测血清中的HEV RNA有助于急性戊型肝炎的早期诊断[4]. HEV慢性感染通常发生在免疫抑制患者, 由于免疫力低下, 抗体的产生受到影响, 患者体内虽然有病毒, 但可能检测不到抗HEV抗体, 因此慢性戊型肝炎的诊断主要依靠对HEV RNA的检测. 虽然HEV RNA检测是诊断HEV感染的可靠方法, 但由于进行RT-PCR的样本保存条件要求高、检测程序复杂、检测成本高以及易污染产生假阳性等原因, 在实际临床诊断中很少应用. 病毒抗原检测的方法易操作、成本低, 已成功用于一些病毒性疾病的诊断中[5-7]. HEV感染后在血清和粪便样本中能检测到HEV抗原, 我国已经开发了HEV抗原(HEV-Ag)ELISA试剂盒[8]. 本文旨在研究戊型肝炎患者血液中HEV-Ag的出现与HEV RNA的相关关系, 分析HEV ORF2抗原检测在戊型肝炎临床诊断中的意义.
选择2010-07/2012-06于辽宁省和河北省的两地市级传染病院疑似戊型肝炎并根据医嘱进行抗HEV抗体检测的患者, 保留其静脉血血清, -80 ℃冻存备用. 戊型肝炎的诊断参照戊型病毒性肝炎诊疗规范[4], 排除酒精、药物、自身免疫性肝损害, 同时排除HAV、HBV、HCV、HDV及CMV和EBV感染. 诊断为戊型肝炎的患者, 应用留存的血清进行抗HEV IgM、抗HEV IgG、HEV-Ag及HEV RNA检测. 本研究方案经河北大学医学部伦理委员会批准.
1.2.1 抗HEV抗体及HEV-Ag检测: 应用北京万泰生物药业有限公司的酶联免疫吸附法检测试剂盒进行血清抗HEV IgM、抗HEV IgG及HEV-Ag的检测. 其中HEV-Ag ELISA检测试剂盒采用双抗体加心法, 应用单克隆抗体捕获并检测HEV ORF2蛋白. 检测过程按照试剂盒说明书进行, 反应终止后用酶标仪进行吸光度(A)值测定, 计算S/CO值(S = 样本A值, CO = 临界值), S/CO值>1判断为阳性.
1.2.2 HEV RNA的检测: 应用北京全式金生物有限公司的EasyPure Viral DNA/RNA Kit对血清样本进行RNA提取. 按照试剂盒说明书从200 μL血清中提取病毒RNA, 用40 μL纯水对所提取的RNA进行回收. 取10 μL RNA提取物, 应用全式金TransScript First-Strand cDNA Synthesis SuperMix试剂盒, 使用随机引物合成基因组cDNA, 反应条件为42 ℃ 30 min. 取7 μL第一链进行cDNA RT-Nested-PCR的第一轮扩增, 引物为SEBO1: 5'-AAY TAT GCW CAG TAC CGG GTT G-3', SEEO1: 5'-CCC TTA TCC TGC TGA GCA TTC TC-3'; 取第一轮PCR产物2 μL作为模板进行第二轮扩增, 引物为 SEBI1: 5'-GTY ATG YTY TGC ATA CAT GGC T-3', SEBI1: 5'-GTY ATG YTY TGC ATA CAT GGC T-3'. PCR反应条件与以前报道相同[9]. 扩增片段长348 nt, 位于HEV基因组的ORF2区域.
1.2.3 基因序列的测定及分析: PCR产物DNA序列测定由北京华大基因科技有限公司进行, 测序引物为SEBI1和SEEI1, 双向进行. 应用DNA Star、MEGA5.2等生物软件对测得PCR片段的基因序列与GenBank中的有代表性不同基因型HEV基因序列进行比对及基因进化树分析, 确定病毒的基因型.
统计学处理 应用SPSS17.0进行统计学分析, 组间率的比较应用χ2检验, P<0.05为差异有统计学意义; 应用Kappa指数对HEV-Ag检测与HEV RNA检测的一致性进行分析.
选择2010-07/2012-06根据戊型病毒性肝炎诊断标准(行业标准ws301-2008, 卫生部)诊断为戊型肝炎并且其留存静脉血清允许进行本研究的患者共116例. 入院后第1次(入院后1-3 d)采集的静脉血血清抗HEV抗体及抗原检测, 结果抗HEV IgM和抗HEV IgG均为阴性(IgM-IgG-)、抗HEV IgM阳性而抗HEV IgG阴性(IgM+IgG-)、抗HEV IgM阳性和抗HEV IgG均阳性(IgM+IgG+), 以及抗HEV IgM阴性而抗HEV IgG阳性(IgM-IgG+)的病例数分别为所占比例分别为4.3%(5/116), 18.1(21/116), 54.3(63/116)和23.3%(27/116), 其中血清抗HEV IgM+IgG+的病例所占比例最高.
在116位患者初次就诊时, 64例血清HEV-Ag阳性, 阳性率为55.2%(表1). 在以抗HEV抗体的出现为标志的病毒感染的不同时期, 患者血清抗原阳性率有明显差异, 有5例患者入院时抗HEV IgM和抗HEV IgG为阴性但HEV-Ag为阳性, 阳性率为100%(表1). 而另外3组血清HEV抗原阳性率分别为90.5%(19/21)、58.7%(39/63)和3.7%(1/27), 显示随着血清中抗体的变化抗原从出现到减弱的过程(表1).
| 血清抗体 | n | 抗原阳性 | |
| (抗HEV IgM/抗HEV IgG) | 病例数 | 阳性率(%) | |
| IgM-/IgG- | 5 | 5 | 100 |
| IgM+/IgG- | 21 | 19 | 90.5 |
| IgM+/IgG+ | 63 | 39 | 61.9 |
| IgM-/IgG+ | 27 | 1 | 3.7 |
| Total | 116 | 64 | 55.2 |
本研究中, 5例入院时血清抗HEV IgM-IgG-的患者, 入院后第2周又进行了抗HEV IgM和抗HEV IgG检测, 结果抗HEV IgM均转为阳性, 表明血清中HEV-Ag的出现可能会早于抗HEV IgM.
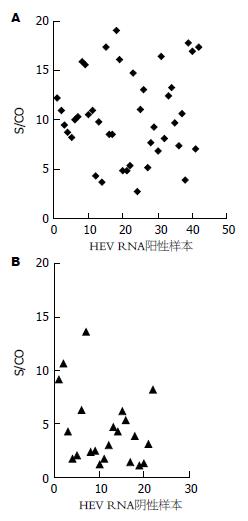
对116例患者的入院后初次采集的血清进行HEV RNA检测, 其中41例为HEV RNA阳性, 阳性率为35.3%. 血清中HEV-Ag的出现与HEV RNA的出现具有相关性, 在HEV-Ag阳性的64个血清样本中40个为HEV RNA, 检出率为62.5%; 而52个HEV-Ag阴性的样本中只有1个为HEV RNA阳性, 检出率为1.9%, 前者的检出率高于后者(χ2 = 21.2, P<0.01)(表2). 对HEV-Ag与HEV RNA两种指标检测结果进行相关性检测, Kappa指数为0.582, 显示两种检测结果的一致性较好, 只是HEV-Ag的检出率高于HEV RNA. 62个HEV-Ag阳性样本中的41个HEV RNA同时阳性的样本, S/CO值的中位数为9.74; 而22个HEV RNA阴性样本S/CO值的中位数为3.58. 总体来看, 在HEV-Ag阳性样本中能检测到HEV RNA的样本, 其ELISA的S/CO值高于未检测到HEV RNA的样本(图1).
| HEV-Ag | HEV RNA | 合计 | Kappa值 | |
| 阳性 | 阴性 | |||
| 阳性 | 40 | 24 | 64 | 0.582 |
| 阴性 | 1 | 51 | 52 | |
| 合计 | 41 | 75 | 116 | |
对41例患者血清中HEV RNA的PCR扩增产物进行序列测定, 基因进化树分析显示41个HEV病毒分离株中分别有37株、3株和1株各属于基因4型、基因1型和基因3型. 这些基因序列已提交GenBank(基因型序列登录号为: KF691570-KF691670).
我国是戊型肝炎的流行区, 许多地区曾有规模不等的戊性肝炎的暴发流行, 近年散发病例的报告数有增加趋势. 长期以来, 戊型肝炎的特异性诊断主要应用ELISA方法检测抗HEV IgM和IgG抗体. 抗HEV IgM检测灵敏度较高、方法简便、易于操作, 但若初诊患者采血时间在HEV感染窗口期, HEV抗体未产生, ELISA检测则无法给出可靠的检测结果. 而核酸可在HEV感染的早期或窗口期检出, 有利于HEV感染的早期诊断[8]. 与2008年卫生部制定的《戊型病毒性肝炎诊断标准》(ws301-2008)相比, 中国医师协会2009年制定的《戊型病毒性肝炎诊疗规范》中HEV急性感染的诊断指标增加了HEV RNA的检测: 在诊断为急性肝炎的基础上, (1)血清HEV-IgM阳性; (2)急性期和恢复期血清具有HEV-IgG抗体滴度4倍及以上增长; (3)血清和/或粪便HEV RNA阳性, 三项指标中一项阳性即可作为急性戊型肝炎的诊断依据[4]. 本研究中, 有5例患者入院时初次检测抗HEV IgM和IgG均为阴性, 但HEV RNA检测为阳性, 1 wk后抗HEV IgM检测结果均转为阳性, 这个结果与以前的报告一致, 表明在抗HEV抗体出现之前, 一些患者血清中即可检测到HEV RNA.
虽然血清中RNA的检测有助于急性戊型肝炎的早期诊断, 但目前应用PCR检测HEV RNA在临床诊断中很少应用, 其原因除了检测结果不稳定, 容易出现假阳性或假阴性外, 更主要的原因是样本采集及及保存条件要求严格、实验操作程序复杂及检测成本高. 而HEV-Ag检测则简单、易操作、成本低. 目前HEV-Ag检测主要针对HEV ORF2抗原. HEV病毒基因组包含3个开放读码框(ORFs), 分别编码三种蛋白分子, 其中ORF2蛋白为病毒衣壳蛋白, 在病毒感染、吸附、入侵及包装等一系列病毒活动过程中具有重要作用[10]. 研究发现戊型肝炎患者和感染HEV的实验动物血清和粪便中能检测到ORF2抗原, 并且ORF2抗原的出现与HEV RNA的存在具有相关性, 提示检测到的ORF2蛋白可能是存在于病毒体的成分, 而非游离于病毒体外, 因此HEV ORF2抗原阳性可能代表样本中有HEV的存在, ORF2抗原可以作为HEV感染的一个重要标志物用于戊型肝炎临床实验诊断[11]. 本次研究在116例戊型肝炎患者中64例血清HEV Ag阳性, 阳性率为55.2%, 其中5例在感染早期抗-IgM尚未出现之前, 血清中同时检测到了HEV RNA和HEV-Ag, 表明HEV-Ag检测可能能够替代HEV RNA用于戊型肝炎的早期诊断. 随着血清中抗HEV IgM、HEV-IgG出现时, HEV-Ag检出的阳性率逐渐下降, 其变化规律与血清中HEV RNA的变化规律相同, 显示这两种检测指标具有关联性, 这一结果也与最近报告的一些研究结果一致[12-14].
在116例患者入院时进行HEV感染标志物检测, 其中HEV-Ag与HEV RNA均为阳性41例, 均为阴性51例, 两项指标检出的一致率为78.5%(91/116). 应用Kappa指数, Kappa指数为0.582, 显示两种检测结果一致性较好. 对HEV-Ag阳性的64个样本ELISA检测S/CO值进行分析, 总体上看来42个HEV RNA阳性样本的S/CO值高于24个HEV RNA阳性样本的S/CO值(图1), 进一步表明HEV RNA与HEV-Ag检测结果具有较强的关联性.
本次实验的116个样本中HEV-Ag和HEV RNA的阳性率分别为55.2%和35.3%, 血清样本HEV-Ag的检测率高于HEV RNA(χ2 = 21.2, P<0.01). PCR检测的灵敏度受很多因素影响, 前期的研究显示RT-Nested-PCR灵敏度低于Real-time PCR[11]. 但由于Real-time PCR检测成本更高, RT-Nested-PCR检测HEV RNA在临床检测中的使用更为普遍, 因此本研究应用了RT-Nested-PCR与HEV-Ag的检测进行比较. 目前我国人群中流行的HEV主要为基因4型, 在一些地区还有1和3型[15]. 为了能够检测到不同基因型HEV, 同时保证检测的灵敏度, 本次研究中应用RT-Nested-PCR扩增ORF2区域348 nt的基因片段进 行HEV RNA检测, 所用引物为保守区域的简并引物, 能够检测1、3、4型及兔HEV.
总之, 本研究显示戊型肝炎患者血清HEV-Ag检测与HEV检测结果一致性比较好. 在不具备核酸检测条件时, 可检测HEV抗原作为IgM抗体检测的补充, 有利于急性戊型肝炎的早期诊断以及慢性戊型肝炎的确诊.
HEV RNA的检测有助于戊型肝炎的早期诊断及慢性肝炎的诊断, 但由于实验程序复杂、成本高等原因, 实际应用较少. HEV感染时血清中能检测到抗HEV ORF2抗原, 目前我国已开发了抗HEV ORF2抗原的ELISA检测试剂盒.
姚登福, 教授, 南通大学附属医院
本研究显示戊型肝炎患者血清HEV-Ag与HEV RNA的检测结果具有较好一致性; HEV-Ag检测有助于戊型肝炎的早期诊断.
目前戊型肝炎的特异性诊断主要通过ELISA方法检测血清中抗HEV IgM抗体, 同时进行HEV-Ag检测, 有助于提高戊型肝炎的诊断水平.
本文具有一定临床指导意义.
编辑:田滢 电编:闫晋利
| 1. | Mushahwar IK. Hepatitis E virus: molecular virology, clinical features, diagnosis, transmission, epidemiology, and prevention. J Med Virol. 2008;80:646-658. [PubMed] [DOI] |
| 2. | Aggarwal R. Hepatitis E: clinical presentation in disease-endemic areas and diagnosis. Semin Liver Dis. 2013;33:30-40. [PubMed] [DOI] |
| 3. | Teshale EH, Hu DJ. Hepatitis E: Epidemiology and prevention. World J Hepatol. 2011;3:285-291. [PubMed] [DOI] |
| 5. | Prendergast C, Papenburg J. Rapid antigen-based testing for respiratory syncytial virus: moving diagnostics from bench to bedside? Future Microbiol. 2013;8:435-444. [PubMed] [DOI] |
| 6. | Ding X, Hu D, Chen Y, Di B, Jin J, Pan Y, Qiu L, Wang Y, Wen K, Wang M. Full serotype- and group-specific NS1 capture enzyme-linked immunosorbent assay for rapid differential diagnosis of dengue virus infection. Clin Vaccine Immunol. 2011;18:430-434. [PubMed] [DOI] |
| 7. | Fukushi S, Tani H, Yoshikawa T, Saijo M, Morikawa S. Serological assays based on recombinant viral proteins for the diagnosis of arenavirus hemorrhagic fevers. Viruses. 2012;4:2097-2114. [PubMed] [DOI] |
| 8. | Zhang F, Li X, Li Z, Harrison TJ, Chong H, Qiao S, Huang W, Zhang H, Zhuang H, Wang Y. Detection of HEV antigen as a novel marker for the diagnosis of hepatitis E. J Med Virol. 2006;78:1441-1448. [PubMed] |
| 9. | Geng Y, Zhao C, Fan J, Harrison TJ, Zhang H, Lian H, Geng K, Wang Y. Genotype analysis of hepatitis E virus from sporadic hepatitis E cases in northern China. Infect Genet Evol. 2013;20:413-417. [PubMed] [DOI] |
| 10. | Ahmad I, Holla RP, Jameel S. Molecular virology of hepatitis E virus. Virus Res. 2011;161:47-58. [PubMed] [DOI] |
| 11. | Zhao C, Li L, Harrison TJ, Wang Q, Song A, Fan J, Ma H, Zhang C, Wang Y. Relationships among viral diagnostic markers and markers of liver function in acute hepatitis E. J Gastroenterol. 2009;44:139-145. [PubMed] [DOI] |
| 13. | Majumdar M, Singh MP, Pujhari SK, Bhatia D, Chawla Y, Ratho RK. Hepatitis E virus antigen detection as an early diagnostic marker: report from India. J Med Virol. 2013;85:823-827. [PubMed] [DOI] |
| 14. | Gupta E, Pandey P, Pandey S, Sharma MK, Sarin SK. Role of hepatitis E virus antigen in confirming active viral replication in patients with acute viral hepatitis E infection. J Clin Virol. 2013;58:374-377. [PubMed] [DOI] |
| 15. | Liu P, Li L, Wang L, Bu Q, Fu H, Han J, Zhu Y, Lu F, Zhuang H. Phylogenetic analysis of 626 hepatitis E virus (HEV) isolates from humans and animals in China (1986-2011) showing genotype diversity and zoonotic transmission. Infect Genet Evol. 2012;12:428-434. [PubMed] [DOI] |