修回日期: 2013-10-28
接受日期: 2013-11-06
在线出版日期: 2013-12-28
目的: 研究二甲双胍对人食管鳞状细胞癌Eca109细胞的增殖、凋亡的影响及其机制.
方法: 倒置相差显微镜观察二甲双胍作用于Eca109细胞后细胞形态学的改变; 二甲双胍或二甲双胍联合5-氟尿嘧啶(5-fluorouracil, 5-FU)干预细胞24、48、72 h后, MTT检测细胞抑制率; Hoechst33258荧光染色法观察凋亡细胞核的形态学变化; 药物干预后, 流式细胞仪检测细胞周期的改变, 抽提mRNA并以RT-PCR(reverse transcription PCR)检测相关基因cyclinD1、p27的转录情况.
结果: 二甲双胍处理后倒置相差显微镜观察其大体形态和荧光显微镜观察其细胞核均呈现凋亡的形态学变化; MTT结果显示,不同浓度二甲双胍作用于食管癌Eca109细胞后, 相关分析结果显示, 食管癌Eca109细胞生长抑制率与二甲双胍浓度呈正相关(r = 0.968, P<0.05), 与作用时间呈正相关(r = 0.914, P<0.05); 与5-FU联合使用时(联合用药组24 h: t = 6.943, P<0.05, 48 h: t = 7.764, P<0.05, 72 h: t = 14.554, P<0.05 vs 单用二甲双胍组), 但根据金正均法判断, 三组的q值0.85-1.15, 表示两药有单纯相加作用, 并无协同作用; 流式测细胞周期结果显示, 二甲双胍阻滞细胞于G0/G1期细胞; RT-PCR结果显示周期相关基因cyclinD1 mRNA显著下调(P<0.05), p27 mRNA显著上调(P<0.05).
结论: 二甲双胍能促进人食管癌细胞系Eca109的凋亡, 与5-FU联合用药时无明显协同作用, 阻滞细胞周期于G0/G1期, 其机制可能与上调或下调某些细胞周期相关基因的表达有关.
核心提示: 研究结果表明安全且价廉的口服降糖药二甲双胍能抑制食管癌细胞系Eca109细胞的增殖, 促进肿瘤细胞凋亡, 并使细胞周期阻滞于G0/G1期, 这些可能与下调细胞周期素相关蛋白D1及上调调控细胞周期并抑制细胞分裂的重要抑癌基因p27有关.
引文著录: 梁凤, 王昌成, 费素娟. 二甲双胍对人食管癌Eca109细胞的增殖与凋亡的影响及其机制. 世界华人消化杂志 2013; 21(36): 4075-4083
Revised: October 28, 2013
Accepted: November 6, 2013
Published online: December 28, 2013
AIM: To investigate the effects of metformin on cell proliferation, apoptosis and cell cycle progression in human esophageal cancer cell line Eca109 in vitro, to explore the possible mechanisms, and to observe whether there is a synergistic effect between metformin and 5-fluorouracil (5-FU).
METHODS: MTT assay was used to detect cell inhibition rate after treatment with metformin alone or in combination with 5-FU. Morphological changes of cells were observed by Hoechest33258 staining. The changes in cell cycle progression were examined by flow cytometry (FCM). The expression of p27 and cyclin D1 mRNAs in Eca109 cells was detected by reverse transcription-PCR.
RESULTS: Apoptotic features including nuclear pyknosis, chromatin margination and apoptotic bodies were observed in Eca109 cells after treatment with metformin by inverted phase contrast microscopy and Hoechest33258 staining. Metformin significantly inhibited the proliferation of Eca109 cells in a dose- (r = 0.968, P < 0.05 ) and time-dependent (r = 0.914, P < 0.05) manner. Metformin treatment enhanced 5-Fu-mediated cell growth inhibition (24 h: t = 6.943, P < 0.05; 48 h: t = 7.764, P < 0.05; 72 h: t = 14.554, P < 0.05 vs metformin alone). However, metformin and 5-FU had no synergistic anti-proliferative effect in esophageal cells. Flow cytometry analysis showed that metformin increased the percentage of cells in G0/G1 phase in a dose-dependent manner. The expression of cyclin D1 mRNA was down-regulated, while the expression of p27 mRNA was up-regulated after metformin treatment.
CONCLUSION: Metformin inhibits cell proliferation, promotes apoptosis and blocks the cell cycle at G0/G1 phase, which may be attributable to down-regulation of cyclin D1 and up-regulation of p27. Metformin and 5-FU have no synergistic anti-proliferative effect in Eca109 cells.
- Citation: Liang F, Wang CC, Fei SJ. Effects of metformin on cell proliferation and apoptosis in human esophageal squamous cancer cell line Eca109. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4075-4083
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4075
食管癌是消化系统常见的恶性肿瘤之一, 近年来有发病率增加和日趋年轻化倾向. 因患者有临床表现而就医时, 均已处于中晚期, 大部分失去了手术的机会, 而此时化疗成为食管癌重要治疗手段之一. 但目前所用的化疗药物大多不良反应大, 且容易产生抗药性. 因此, 寻找高效低毒的化疗药物或联合用药减轻不良反应成为抗癌研究的热点问题之一. 二甲双胍是在上世纪50年代被引入用来治疗2型糖尿病的双胍类口服降糖药[1]. 2005年, Evans等[2]发表了一项对983例2型糖尿病患者和1846例对照人群使用二甲双胍情况的回顾性临床对照研究, 结果表明二甲双胍能显著降低糖尿病者的肿瘤风险(校正后的相对危险度RR = 0.79, 95%CI: 0.67-0.93). 这些研究引发随后关于二甲双胍抗肿瘤效应的研究日趋增多. 本实验的目的是研究二甲双胍对人高分化食管鳞状癌细胞系Eca109细胞的增殖、凋亡及对细胞周期的影响, 及其与化疗药物5-氟尿嘧啶(5-fluorouracil, 5-FU)联合使用时是否有协同作用, 并初步探讨可能机制, 为进一步的临床用药提供一定的理论基础.
人高分化食管鳞状细胞癌细胞系Eca109购自中国科学院上海细胞库并由徐州医学院中心实验室保存; DMEM培养液购自GIBCO公司; 青霉素-链霉素溶液胰酶购自VICMED公司; 胎牛血清购自杭州四季青; 二甲双胍、5-FU均购自Sigma公司; 细胞周期试剂盒购自南京凯基; TRIzol试剂、逆转录试剂盒、PCR试剂盒购自TIANGEN科技有限公司; PCR引物由上海生工生物工程技术服务有限公司合成; 酶联免疫检测仪为Thermo公司产品; 流式细胞仪为BD公司产品; DP11显微照相系统购自日本Olympus公司; 凝胶成像系统为Bio-Rad公司产品.
1.2.1 细胞培养: 人食管癌系Eca-109细胞常规培养于含10%胎牛血清、100 U/mL青霉素、100 ng/mL链霉素的DMEM培养基中, 培养条件为37 ℃、5%CO2的湿润无菌环境. 0.25%的胰蛋白酶消化, 1-2 d换液, 3-4 d传代1次.
1.2.2 细胞形态观察: Olympus倒置显微镜下观察培养瓶内细胞正常状态下的生长、形态及加入二甲双胍后不同时间的形态变化情况, 并摄影记录.
1.2.3 MTT法细胞抑制率测定: 取对数生长期的Eca109细胞, 以1×103/mL的密度接种于96孔板, 每孔200 μL, 待贴壁24 h后, 吸除培养基, 置换成含药培养基, 设8个组, 分别为对照组(含细胞不含药的培养基), 二甲双胍(Met)组(1、5、10、20、40 mmol/L), 5-FU组(25 mg/L), 联合组(Met 20 mmol/L+5-FU 25 mg/L), 每组6个复孔, 共3块板, 分别继续培养24、48、72 h. 实验重复3次, 上机检测前, 在各孔中加入5 mg/L MTT 20 μL, 继续培养4 h后弃上清, 每孔加入DMSO 150 μL, 震荡10min待结晶溶解后, 在酶联免疫检测仪570 nm波长处测定各孔的吸光度(A)值, 以周边一圈不加细胞的全PBS孔作为调零孔. 按下列公式计算细胞增殖的抑制率: 抑制率(%) = (1-A实验组/对照组)×100%, 实验重复3次, 结果以均数±标准差的形式表示, 在比较两药联合使用是否有协同作用时, 采用金正均法判断, 公式: q = (Ea+b)/[(Ea+ Eb)-Ea×Eb]. 公式中Ea为二甲双胍组的抑制率, Eb为5-FU组的抑制率, Ea+b为联合用药组的抑制率. 结果q值>1.15表示两药有协同作用, q值<0.85表示两药有拮抗作用, q值为0.85-1.15表示两药有单纯相加作用.
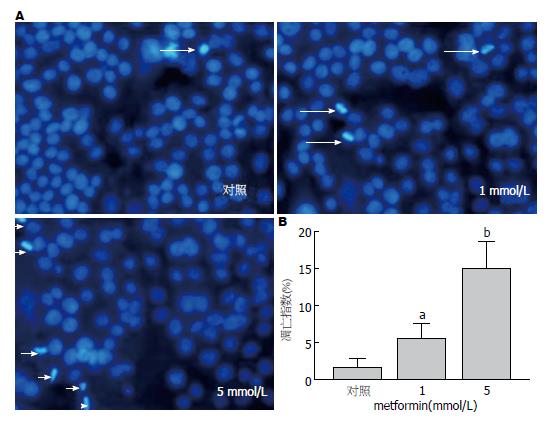
1.2.4 Hoechst33258荧光染色法观察凋亡细胞核的形态学变化: 将细胞接种于6孔板, 常规培养24 h贴壁后, 弃上清, 换成含药培养基, 分3组, 分别为对照组, 二甲双胍组(1、5 mmol/L)每组设3个复孔, 重复3板, 分别培养24 h后, 吸尽培养液, 加入0.5 mL 40 g/L的多聚甲醛液固定细胞10 min; 去固定液, 用0.01 mol/L的PBS洗3 min×2次, 洗涤时用手轻轻晃动, 吸尽液体; 加入1 mL Hoechst 33258染色液, 37 ℃染色15 min; 去染色液, 用 PBS洗2 min×2次, 以去除过多的染色背景; 荧光显微镜下观察, 激发波长为350 nm, 发射波长为460 nm, 细胞核呈致密浓染或呈碎块状致密浓染为凋亡阳性细胞; 拍照保存. 凋亡指数(apoptosis index, AI)(%) = 凋亡细胞数/总细胞数×100%.
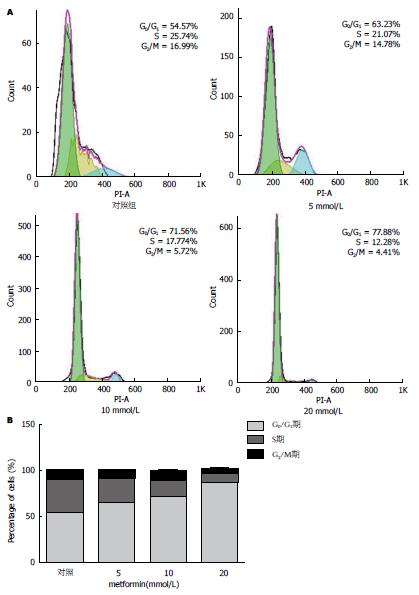
1.2.5 流式细胞仪测细胞周期: 取对数生长期细胞, 接种于六孔板中, 每组设3个复孔, 收集对照组及不同浓度二甲双胍组(5、10、20 mmol/L)处理48 h后的细胞, PBS洗涤细胞2次, 用70%预冷乙醇固定至少过夜, 染色前加入PBS洗涤固定液, 用400目的细胞筛过滤细胞至流式管中, 加入100 μL RNase A, 37 ℃水浴30 min; 再加入400 μL PI染色混匀, 4 ℃避光30 min. 上机检测, 记录激发波长488 nm处红色荧光, 结果用Flowjo软件分析.
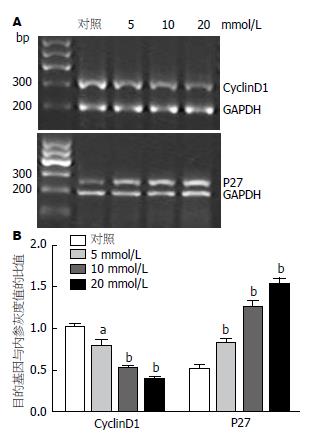
1.2.6 RT-PCR法检测相关基因表达: 不同浓度二甲双胍(5、10、20 mmol/L)作用48 h, 同时以不加任何药物的细胞作为对照组, TRIzol法提取细胞总RNA, 逆转录成cDNA, 以GAPDH作为内参, 行RT-PCR反应. PCR引物(表1), 反应体系: 94 ℃ 3 min; 94 ℃ 30 s, (退火温度)60 s, 72 ℃ 60 s; 72 ℃ 10 min共35个循环, 实验重复3次. 以imageJ计算灰度值, 对各条带灰度值与内参条带灰度值的比值进行分析.
| 基因 | 上下游序列(5'-3') | 产物产度(bp) | 退火温度(℃) |
| cyclinD1 | 上游: CTCGCCAGTCCATTTGAT 下游: GGGCTCCCCTTAGACACT | 314 | 64 |
| p27 | 上游: TCTACACCGACAACTCCATCC 下游: TGTGAGGCGGTAGTAGGACAG | 202 | 60 |
统计学处理 实验数据用mean±SD表示, 应用SPSS13.0统计软件, 多组比较进行单因素方差分析, 两两比较进行t检验, P<0.05为差异有统计学意义.
对照组细胞: 生长旺盛, 贴壁生长, 形态饱满, 境界清晰, 核膜、核仁轮廓明显, 细胞间结构紧密. 二甲双胍处理后细胞呈现凋亡的形态学变化: 可见大部分细胞变圆, 体积缩小, 形态不规则, 结构变松散, 部分细胞表面发芽, 部分脱落漂浮, 少数细胞体积增大、破裂, 呈坏死状, 细胞周围碎片增多, 且随着药物浓度的增加及作用时间的延长, 这种变化更加明显.
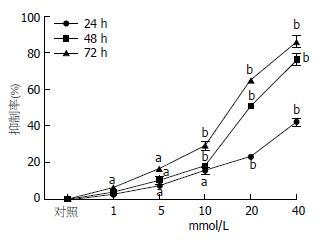
MTT结果显示, 不同浓度二甲双胍作用于食管癌Eca109细胞后, 除1 mmol/L作用24、48 h后, 其抑制率与对照组相比, 差异无统计学意义, 余组抑制率与对照组相比, 差异均有统计学意义(P<0.05), 其中24 h组的20和40 mmol/L浓度组, 48和72 h组的10、20和40 mmol/L浓度组和对照组相比, 差异显著(P<0.01), 相关分析结果显示, 食管癌Eca109细胞生长抑制率与二甲双胍浓度呈正相关(r = 0.968, P<0.05), 说明二甲双胍能有效抑制人食管癌Eca109细胞的增殖, 且呈剂量依赖性. 二甲双胍浓度相同时, 食管癌Eca109细胞生长抑制率随着作用时间的延长而逐渐上升, 72 h组达最高峰, 与24、48 h组相比, 均有显著差异, 相关分析结果显示, 其细胞生长抑制率与时间呈正相关(r = 0.914, P<0.05)(图1).
二甲双胍组和5-FU组(表2), 与对照组相比, 均明显抑制细胞生长且差异有统计学意义(联合用药组24 h: t = 6.943, P<0.05; 48 h: t = 7.764, P<0.05; 72 h: t = 14.554, P<0.05 vs 单用二甲双胍组; 联合用药组24 h: t = 16.02, P<0.01; 48 h: t = 13.21, P<0.01; 72 h: t = 24.21, P<0.01 vs 单用5-FU组), 但根据金正均法判断, 三组的q值为0.85-1.15, 表示两药有单纯相加作用, 并无协同作用.
在荧光显微镜下, 阴性对照组细胞数较多, 凋亡细胞少, 细胞核呈弥散、均匀蓝色荧光; 二甲双胍处理组1、5 mmol/L可见细胞总数减少, 凋亡细胞形态变小, 细胞核或细胞质内可见浓染致密的碎块状蓝色荧光, 有明显的核固缩和染色质边集等变化, 随着药物浓度的增加, 细胞总数逐渐减少, 凋亡阳性细胞数逐渐增多, AI逐渐升高, 差异有显著统计学意义(F = 57.34, 1 mmol/L组P<0.05 vs 对照, 5 mmol/L组P<0.01 vs 对照组)(图2).
不同浓度的二甲双胍干预Eca109细胞48 h后, 行流式细胞术检测发现, 5 mmol/L组G0/G1期所占比重显著高于对照组(P<0.01), S期所占比重显著低于对照组(P<0.01), G2/M期所占比重低于对照组(P<0.05); 10 mmol/L组和20 mmol/L组G0/G1期所占比重显著高于对照组(P<0.01), S期及G2/M期所占比重显著低于对照组(P<0.01)(图3).
半定量PCR结果显示(图4), 不同浓度二甲双胍作用48 h后, 与对照组相比, p27 mRNA的表达升高, cyclinD1 mRNA的表达降低, 5 mmol/L的二甲双胍作用后cyclinD1 mRNA与内参mRNA的灰度值的比值与对照组相比, 其差异有统计学意义(P<0.05), 余各浓度组的目的基因与内参mRNA的灰度值比值与对照组相比, 其差异均有显著的统计学意义(P<0.01).
本研究中我们发现, 从大体来看, 二甲双胍处理后细胞呈现凋亡的形态学变化且随着药物浓度的增加及作用时间的延长, 这种变化更加明显, 特别是从Hoechst33258荧光染色法观察凋亡细胞核的形态学变化中更加显著; 通过MTT结果一方面发现二甲双胍能抑制食管癌Eca109细胞增殖; 另一方面二甲双胍和5-FU联合使用并无协同作用; 从二甲双胍对细胞周期分布的影响结果来看, 二甲双胍有促使细胞周期停滞的趋势, 从其基因转录水平来看, 可能与cyclinD1及p27 mRNA的表达降低和升高有一定的关系.
二甲双胍, 属于口服的双胍类降糖药的一种, 不良反应主要是乳酸酸中毒, 但是发生率极低, 另外一些不良反应主要包括胃肠道反应, 如腹泻、腹胀、恶心呕吐, 而这些不良反应可以通过缓慢增加剂量直至治疗量来避免[3]. 因此该药能被绝大多数糖尿病患者所接受. 二甲双胍作为肝激酶B1-AMP激酶(LKB1-AMPK)激活剂, 能抑制多种肿瘤增殖并促进其凋亡, 其抗肿瘤作用已经得到了许多实验室资料的验证, 当然也包括许多大型的可靠的回顾性研究及病例对照研究[4-6].
Jiralerspong等[7]发现二甲双胍能提高糖尿病患者乳腺癌对新辅助化疗的反应性, 但关于其是否可提高消化系肿瘤对化疗药物反应的研究尚较少. 本实验中, 二甲双胍与食管癌化疗常用的5-FU联合作用后, 并无明显的协同作用, 但有相加作用, 说明二甲双胍和5-FU合用时, 可以一定程度上减少5-FU的用量, 从而减少化疗药物的不良反应. Matsuzaki等[8]的研究发现mTOR抑制剂与5-FU对胃硬癌细胞的治疗具有协同作用, 但对非硬癌细胞, 如MKN45细胞无此协同作用. 另外, 薛知新等[9]的研究发现二甲双胍与5-FU联合使用对于AGS胃癌细胞的生长增殖具有协同抑制作用. Eca109细胞从建系资料来看, 属于高分化人食管癌鳞状细胞癌, 二甲双胍和5-FU联合作用于人食管癌Eca109细胞无协同效应, 可能与食管癌的种类及分化程度有关.
细胞周期与肿瘤的关系一直都是各大实验室的研究热点. 细胞周期分为: 合成DNA的时期称为DNA合成期(S期), 进行DNA拷贝分配和细胞分裂的时期称为有丝分裂期(M期), 在M期结束后和S期开始前的一段间隙称为G1期, 而在S期结束后和M期开始前的间隙则称为G2期, 合成前期又称G0期. 其中G1/S和G2/M期的转换是两个重要的合成转换点. 在细胞周期的一系列调节因子中, 只有G1期的调节因子被发现在肿瘤的发生中出现改变或突变, 从而导致细胞增殖的不可控性[10]. CyclinD1是细胞周期循环控制中起重要作用的蛋白, 特别是细胞从G1至S期, 为细胞周期依赖性蛋白激酶(cyclin-dependent kinases, CDKs)所调控. cyclinD1是细胞周期的调控基因, 若此基因失控, 可致细胞发生异常增生, 过表达是导致癌变的一个主要的原因, 过表达与肿瘤发生有关. Bahnassy等[11]发现周期蛋白D1过表达与肿瘤组织学类型、分化程度、淋巴转移状况密切相关, 周期蛋白D1过表达预后较差. 另外, p27基因是近年来发现的一个调控细胞周期并抑制细胞分裂的重要抑癌基因, 其编码的P27蛋白为周期素依赖性蛋白激酶抑制因子, 对细胞周期具有负调控作用. 他是调节细胞进入S期所必需的细胞周期激酶, 可阻止包括Rb(控制细胞周期的一个抑癌基因)在内的启动S期所必需的关键靶分子磷酸化, 抑制G1相关CYC-CDK复合物及CYCB-CDC2复合物, 其过表达可诱导细胞发生G1/S期阻滞[12,13]. P27在调控细胞周期进展中具有十分重要的作用, 其表达下降可降低他对正性细胞周期调控蛋白的抑制效应, 导致细胞增殖过度乃至肿瘤形成[14]. Penin等[15]用腺病毒将P27蛋白基因转染到星形细胞瘤细胞系, 高表达者CDK活性明显受到抑制, 细胞阻滞于G1期, 另外还观察到非整倍体细胞比例明显下降, 提示P27蛋白具有抑制肿瘤发生发展的作用. CyclinD1/CDK复合物的功能之一是连接或隔离P27, 从而防止P27阻断CyclinD1/CDK复合物的形成, 使G0/G1期可以顺利进入S期. 本研究中发现, 二甲双胍干预食管癌细胞后, 从流式细胞仪的检测结果来看, 细胞的G0/G1期细胞比例显著升高(P<0.05), 而S期及G2/M期细胞所占比例则相应下降, 从而阻滞细胞周期进程的发展, 抑制肿瘤细胞的增殖. 这与Zhuang及Ben Sahra等[16,17]对二甲双胍抗肿瘤的作用机制的研究相一致. 从RT-PCR结果来看, cyclinD1的mRNA的表达量下降, 而p27 mRNA的表达量升高, 这可能与二甲双胍抗肿瘤作用的机制有关, 这与Kobayashi、Zhao及Luo等[18-20]的研究相一致.
近年来, 围绕二甲双胍的抗肿瘤作用, 已经开展很多研究, 并取得一定的成果, 除了上述的调控细胞周期诱导细胞凋亡外, 他抑制肿瘤细胞的代谢并且抑制肿瘤细胞内线粒体复合物Ⅰ(mitochondrial complex Ⅰ)的活性[21,22]. 有争议的是二甲双胍的抗肿瘤效应到底是否与其调节血糖及血胰岛素水平的一系列反应有关呢? 众所周知, 胰岛素样生长因子(insulin-like growth factors, IGFs)是一类多功能细胞增殖调控因子, 在细胞的分化、增殖、个体的生长发育中具有重要的促进作用, 是推进肿瘤发生发展的重要因素[23-25]. 肿瘤细胞可表达有丝裂原作用的胰岛素受体和IGF受体, 胰岛素可降低IGF结合蛋白水平, 并升高IGF-1水平, 也可能结合或活化肿瘤细胞的IGF-1受体. 因此推测, 胰岛素及胰岛素类似物可能有促肿瘤发生的作用. 二甲双胍作为胰岛素增敏剂, 在降低血糖的同时可改善胰岛素敏感性, 从而减少胰岛素用量, 缓解高胰岛素血症. 但在临床研究中, 即使在校正了胰岛素剂量之后二甲双胍的保护作用仍显著, 表明二甲双胍的抗肿瘤作用不能完全用胰岛素节约效应来解释. 一些临床前研究发现, 在不同的老鼠模型中, 肿瘤生长的减缓和血胰岛素水平的降低是密切相关的[26,27], 在这些研究中, 二甲双胍抗肿瘤的机制被归纳为降低循环中胰岛素及IGF-1的水平. Memmott等[28]最近的一项研究提出一个全新且有趣的观点, 认为二甲双胍抗肿瘤的机制是通过诱导4-(N-甲基-N-亚硝胺)-1-(3-吡啶基)-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone], 即NNK[其是烟草特有亚硝胺(tobacco-specific nitrosamines, TSNA)中具有强致癌性物质之一]而完成的, 最终能够导致DNA损伤. 研究发现二甲双胍通过二乙基亚硝胺诱导肝脂肪生成的减少, 进而显著减少肝癌的发生发展[29]. 一些研究也提示二甲双胍拥有抗氧化特性[30], 并且有体内外实验可以证明二甲双胍可以避免晚期糖基化终末产物AGEs的形成[31].
目前的一些临床研究正在探索二甲双胍与传统化疗以及靶向治疗的联合治疗效应. 许多研究支持二甲双胍在恶性肿瘤的化学治疗中起到了一个重要的作用, 但是, 截然不同的设计, 回顾性的分析以及各种混杂因素影响我们得出一个明确的结论. 当前更需要的是一些关于二甲双胍剂量梯度结合联合疗法与胰岛素和其他降低血糖药物的前瞻性试验. 二甲双胍的抗癌作用是其中一个值得深入研究的新方向. 存在的主要问题是, 二甲双胍作为口服降糖药, 其在人体最高用量的血药浓度为10 mmol/L, 远远低于我们的实验浓度, 虽然在体外实验中我们需要排除培养基中的葡萄糖的含量及胎牛血清的影响, 但人体对于高浓度的二甲双胍是否具有良好的耐受性还需要大量的研究证实.
总之, 我们的研究结果表明二甲双胍能抑制食管癌细胞系Eca109细胞的增殖, 促进肿瘤细胞凋亡, 并使细胞周期阻滞于G0/G1期, 这些可能与下调细胞周期素相关蛋白D1及上调调控细胞周期并抑制细胞分裂的重要抑癌基因p27有关.
感谢徐州医学院中心实验室的刘福明及刘小云老师在本试验中给予的大力帮助.
食管癌因患者有临床表现而就医时, 均已处于中晚期, 大部分失去了手术的机会, 而此时化疗成为食管癌重要治疗手段之一. 因此, 寻找高效低毒的化疗药物或联合用药减轻不良反应成为抗癌研究的热点问题之一. 二甲双胍抗肿瘤效应的研究日趋增多, 但在食管癌方面国内外鲜见报道.
许玲, 教授, 主任医师, 上海中医药大学附属龙华医院肿瘤科
近年来, 临床上安全性较高、不良反应较少且价廉的"老药", 逐渐被"新用". 其中二甲双胍作为LKB1-AMPK激活剂, 其在抗肿瘤方面的作用及相关的抗肿瘤机制逐渐成为抗肿瘤药物研究的热点.
cyclinD1是细胞周期的调控基因, 若此基因失控, 可致细胞发生异常增生, 过表达与肿瘤发生有关. 另外, p27基因是近年来发现的一个调控细胞周期并抑制细胞分裂的重要抑癌基因, 其表达下降可降低他对正性细胞周期调控蛋白的抑制效应, 导致细胞增殖过度乃至肿瘤形成.
本研究以"老药新用"为切入点, 将广泛使用的口服降糖药二甲双胍应用于食管鳞状细胞癌细胞, 采用多数成熟的技术观察其抗肿瘤效应, 并探讨其与常用化疗药5-氟尿嘧啶(5-fluorouracil, 5-FU)的联合用药效果, 有望为食管癌的新辅助化疗提供新的思路.
本研究发现食管癌细胞经二甲双胍作用后, 细胞的增殖受到了明显的抑制, 凋亡增加, 细胞周期停滞, 在与食管癌化疗常用的5-FU联合作用后, 并无明显的协同作用, 但有相加作用, 说明二甲双胍和5-FU合用时, 可以一定程度上减少5-FU的用量, 从而减少化疗药物的不良反应.
本文设计思路清楚, 方法比较合理, 具有一定指导意义.
编辑:田滢 电编:闫晋利
| 1. | Witters LA. The blooming of the French lilac. J Clin Invest. 2001;108:1105-1107. [PubMed] [DOI] |
| 2. | Evans JM, Donnelly LA, Emslie-Smith AM, Alessi DR, Morris AD. Metformin and reduced risk of cancer in diabetic patients. BMJ. 2005;330:1304-1305. [PubMed] [DOI] |
| 3. | Laforest C, Saint-Marcoux F, Amiel JB, Pichon N, Merle L. Monitoring of metformin-induced lactic acidosis in a diabetic patient with acute kidney failure and effect of hemodialysis. Int J Clin Pharmacol Ther. 2013;51:147-151. [PubMed] [DOI] |
| 4. | Hadad S, Iwamoto T, Jordan L, Purdie C, Bray S, Baker L, Jellema G, Deharo S, Hardie DG, Pusztai L. Evidence for biological effects of metformin in operable breast cancer: a pre-operative, window-of-opportunity, randomized trial. Breast Cancer Res Treat. 2011;128:783-794. [PubMed] [DOI] |
| 5. | Hosono K, Endo H, Takahashi H, Sugiyama M, Sakai E, Uchiyama T, Suzuki K, Iida H, Sakamoto Y, Yoneda K. Metformin suppresses colorectal aberrant crypt foci in a short-term clinical trial. Cancer Prev Res (Phila). 2010;3:1077-1083. [PubMed] [DOI] |
| 6. | Hosono K, Endo H, Takahashi H, Sugiyama M, Uchiyama T, Suzuki K, Nozaki Y, Yoneda K, Fujita K, Yoneda M. Metformin suppresses azoxymethane-induced colorectal aberrant crypt foci by activating AMP-activated protein kinase. Mol Carcinog. 2010;49:662-671. [PubMed] [DOI] |
| 7. | Jiralerspong S, Gonzalez-Angulo AM, Hung MC. Expanding the arsenal: metformin for the treatment of triple-negative breast cancer? Cell Cycle. 2009;8:2681. [PubMed] |
| 8. | Matsuzaki T, Yashiro M, Kaizaki R, Yasuda K, Doi Y, Sawada T, Ohira M, Hirakawa K. Synergistic antiproliferative effect of mTOR inhibitors in combination with 5-fluorouracil in scirrhous gastric cancer. Cancer Sci. 2009;100:2402-2410. [PubMed] [DOI] |
| 10. | Camidge DR. Cell cycle-associated kinases as targets for therapy in lung cancer. J Thorac Oncol. 2010;5:S461-S462. [PubMed] [DOI] |
| 11. | Bahnassy AA, Zekri AR, Alam El-Din HM, Aboubakr AA, Kamel K, El-Sabah MT, Mokhtar NM. The role of cyclins and cyclins inhibitors in the multistep process of HPV-associated cervical carcinoma. J Egypt Natl Canc Inst. 2006;18:292-302. [PubMed] |
| 12. | Yadav V, Sultana S, Yadav J, Saini N. Gatifloxacin induces S and G2-phase cell cycle arrest in pancreatic cancer cells via p21/p27/p53. PLoS One. 2012;7:e47796. [PubMed] [DOI] |
| 13. | Yoon MK, Mitrea DM, Ou L, Kriwacki RW. Cell cycle regulation by the intrinsically disordered proteins p21 and p27. Biochem Soc Trans. 2012;40:981-988. [PubMed] [DOI] |
| 14. | Belletti B, Baldassarre G. New light on p27(kip1) in breast cancer. Cell Cycle. 2012;11:3701-3702. [PubMed] [DOI] |
| 15. | Penin RM, Fernandez-Figueras MT, Puig L, Rex J, Ferrandiz C, Ariza A. Over-expression of p45(SKP2) in Kaposi's sarcoma correlates with higher tumor stage and extracutaneous involvement but is not directly related to p27(KIP1) down-regulation. Mod Pathol. 2002;15:1227-1235. [PubMed] [DOI] |
| 16. | Zhuang Y, Miskimins WK. Cell cycle arrest in Metformin treated breast cancer cells involves activation of AMPK, downregulation of cyclinD1, and requires p27Kip1 or p21Cip1. J Mol Signal. 2008;3:18. [PubMed] [DOI] |
| 17. | Ben Sahra I, Laurent K, Loubat A, Giorgetti-Peraldi S, Colosetti P, Auberger P, Tanti JF, Le Marchand-Brustel Y, Bost F. The antidiabetic drug metformin exerts an antitumoral effect in vitro and in vivo through a decrease of cyclinD1 level. Oncogene. 2008;27:3576-3586. [PubMed] [DOI] |
| 18. | Kobayashi M, Kato K, Iwama H, Fujihara S, Nishiyama N, Mimura S, Toyota Y, Nomura T, Nomura K, Tani J. Antitumor effect of metformin in esophageal cancer: in vitro study. Int J Oncol. 2013;42:517-524. [PubMed] [DOI] |
| 19. | Zhao L, Wen ZH, Jia CH, Li M, Luo SQ, Bai XC. Metformin induces G1 cell cycle arrest and inhibits cell proliferation in nasopharyngeal carcinoma cells. Anat Rec (Hoboken). 2011;294:1337-1343. [PubMed] [DOI] |
| 20. | Luo Q, Hu D, Hu S, Yan M, Sun Z, Chen F. In vitro and in vivo anti-tumor effect of metformin as a novel therapeutic agent in human oral squamous cell carcinoma. BMC Cancer. 2012;12:517. [PubMed] [DOI] |
| 21. | Ben Sahra I, Laurent K, Giuliano S, Larbret F, Ponzio G, Gounon P, Le Marchand-Brustel Y, Giorgetti-Peraldi S, Cormont M, Bertolotto C. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells. Cancer Res. 2010;70:2465-2475. [PubMed] [DOI] |
| 22. | Svergun DI, Petoukhov MV, Koch MH, König S. Crystal versus solution structures of thiamine diphosphate-dependent enzymes. J Biol Chem. 2000;275:297-302. [PubMed] |
| 23. | Pollak M. Insulin and insulin-like growth factor signalling in neoplasia. Nat Rev Cancer. 2008;8:915-928. [PubMed] [DOI] |
| 24. | Gallagher EJ, LeRoith D. Minireview: IGF, Insulin, and Cancer. Endocrinology. 2011;152:2546-2551. [PubMed] [DOI] |
| 25. | Capoluongo E. Insulin-like growth factor system and sporadic malignant melanoma. Am J Pathol. 2011;178:26-31. [PubMed] [DOI] |
| 26. | Algire C, Amrein L, Bazile M, David S, Zakikhani M, Pollak M. Diet and tumor LKB1 expression interact to determine sensitivity to anti-neoplastic effects of metformin in vivo. Oncogene. 2011;30:1174-1182. [PubMed] [DOI] |
| 27. | Algire C, Zakikhani M, Blouin MJ, Shuai JH, Pollak M. Metformin attenuates the stimulatory effect of a high-energy diet on in vivo LLC1 carcinoma growth. Endocr Relat Cancer. 2008;15:833-839. [PubMed] [DOI] |
| 28. | Memmott RM, Mercado JR, Maier CR, Kawabata S, Fox SD, Dennis PA. Metformin prevents tobacco carcinogen--induced lung tumorigenesis. Cancer Prev Res (Phila). 2010;3:1066-1076. [PubMed] [DOI] |
| 29. | Bhalla K, Hwang BJ, Dewi RE, Twaddel W, Goloubeva OG, Wong KK, Saxena NK, Biswal S, Girnun GD. Metformin prevents liver tumorigenesis by inhibiting pathways driving hepatic lipogenesis. Cancer Prev Res (Phila). 2012;5:544-552. [PubMed] [DOI] |
| 30. | Onaran I, Guven GS, Ozdaş SB, Kanigur G, Vehid S. Metformin does not prevent DNA damage in lymphocytes despite its antioxidant properties against cumene hydroperoxide-induced oxidative stress. Mutat Res. 2006;611:1-8. [PubMed] |
| 31. | Gómez-Abellán P, Madrid JA, Ordovás JM, Garaulet M. [Chronobiological aspects of obesity and metabolic syndrome]. Endocrinol Nutr. 2012;59:50-61. [PubMed] [DOI] |