修回日期: 2013-09-29
接受日期: 2013-11-06
在线出版日期: 2013-12-08
目的: 研究OX40和SLP-2在食管鳞癌(esophageal squamous cell carcinoma, ESCC)中的表达情况, 并探讨OX40和SLP-2与食管鳞癌患者临床病理特性的相关性.
方法: (1)应用免疫组织化学法分别检测OX40和SLP-2在94例食管鳞癌癌组织、31例癌旁不典型增生组织及31例正常组织中的表达. 应用SPSS17.0软件对数据进行统计分析. 两样本的比较采用四格表资料的χ2检验; OX40和SLP-2的相关性采用Spearman等级相关分析. 检验水准α = 0.05.
结果: (1)免疫组织化学结果显示OX40和SLP-2在癌组织(54.3%、50.0%)及癌旁不典型增生组织中(54.8%、25.8%)的表达均明显高于正常组织(3.2%、6.5%)(χ2 = 26.374, 20.988, P<0.05), 且OX40和SLP-2的表达与患者TNM分期及有无淋巴结转移相关; (2)OX40与SLP-2的表达具有相关性(r = 0.363, P<0.05).
结论: (1)OX40和SLP-2在食管鳞癌组织中高表达, 可能参与食管鳞癌的发生发展和转移; (2)OX40和SLP-2的表达具有相关性.
核心提示: OX40和SLP-2在食管鳞癌组织中高表达, 二者的表达与患者TNM分期及有无淋巴结转移相关, 提示其可能参与食管鳞癌的发生发展和转移; 且OX40和SLP-2的表达具有相关性, 具体机制仍有待进一步研究.
引文著录: 蒋冬, 李建生, 张金平, 李东颖, 刘艳红. OX40和SLP-2在食管鳞癌中的表达及其临床意义. 世界华人消化杂志 2013; 21(34): 3853-3857
Revised: September 29, 2013
Accepted: November 6, 2013
Published online: December 8, 2013
AIM: To investigate the expression of OX40 and SLP-2 in esophageal squamous cell carcinoma (ESSC) and to analyze their correlation with clinicopathological status of ESSC patients.
METHODS: The expression of OX40 and SLP-2 was detected by immunohistochemistry in 94 ESSC tissues, 31 adjacent atypical hyperplasia tissues and 3 adjacent normal esophageal tissues. The correlation between OX40 and SLP-2 expression and clinicopathological features of ESSC was analyzed.
RESULTS: OX40 and SLP-2 expression in ESCC (54.3%, 50.0%) was significantly higher than that in atypical hyperplasia tissue and histologically normal esophageal mucosa (3.2%, 6.5%) (χ2 = 26.374, 20.988, P < 0.05). Furthermore, the expression of OX40 and SLP-2 was significantly associated with TNM stage and lymph node metastasis. OX40 expression was correlated with SLP-2 expression in ESCC.
CONCLUSION: The high expression of OX40 and SLP-2 in ESCC may directly influence tumor invasiveness and metastasis. OX40 expression is correlated with SLP-2 expression in ESCC.
- Citation: Jiang D, Li JS, Zhang JP, Li DY, Liu YH. Clinical significance of expression of OX40 and SLP-2 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3853-3857
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3853.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3853
食管癌是主要起源于食管鳞状上皮和柱状上皮的恶性肿瘤, 其中, 食管鳞癌约占90%. 我国是食管癌的高发区, 也是食管癌病死率最高的国家之一, 年死亡率超过100/10万人以上者有19个县市, 年死亡率最高者达302.37/10万. 本病的发病率与性别、年龄有关. 男性多于女性, 我国的男女之比约为1.3-2.7:1, 大多数患者在40岁后起病, 且发病率随年龄的增加而增加[1]. OX40是TNFR超家族成员之一, 为相对分子质量约48-50 kDa的Ⅰ型跨膜糖蛋白, 研究表明其与在黑色素瘤、淋巴瘤、结直肠癌中表达增高, 在肿瘤免疫中起着抗肿瘤作用, 且与预后呈正相关[2]. SLP-2属于stomatin基因超家族, 在人食管癌、肺癌、喉癌、子宫内膜癌组织中高表达, 并发现其与肿瘤的发生、发展关系密切[3]. 本研究通过免疫组织化学法检测OX40和SLP-2在ESCC组织中的表达, 并结合患者临床病理资料进行分析, 探讨二者在ESCC中的表达特点及意义.
收集郑州大学第一附属医院2011-01-01/2012-12-30手术切除的ESCC标本94例, 取癌组织、癌旁不典型增生组织(距离癌组织边缘<3 cm)及正常组织(距离癌组织边缘>5 cm). 所有标本均经病理学证实为ESCC, 术前未接受放、化疗. 其中男67例, 女27例, 年龄46-79岁, 中位年龄64岁. 其中组织学分级G1 11例, G2 70例, G3 13例, 有淋巴结转移24例, 无70例; 肿瘤分期按国际抗癌联盟食管癌TNM分期标准(2009年第7版), Ⅰ期14例, Ⅱ期62例, Ⅲ期18例.
1.2.1 免疫组织化学: 鼠抗人单克隆抗体OX40(美国BioLegend公司); 鼠抗人SLP-2单克隆抗体(美国Proteintech公司), SP-9000免疫组织化学试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司); 即用型一步法(非生物素)检测试剂盒(迈新公司). 取上述ESCC组织、癌旁不典型增生组织及正常组织石蜡标本, 连续3 µm切片, 采用免疫组织化学SP法检测OX40和SLP-2的表达情况, 具体操作参照SP试剂盒说明进行, PBS代替一抗作阴性对照, 已知的阳性片子为阳性对照. 免疫组织化学由两位高年资病理科医师在双盲条件下进行评定.
1.2.2 判定标准: OX40阳性反应为肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte, TIL)细胞膜、细胞浆上出现棕黄色或棕褐色颗粒, SLP-2蛋白阳性反应为细胞膜、细胞质呈黄色. 先在低倍视野下随机选取5个视野, 然后在高倍镜(×400)下进行计数(个/HPF), 每个视野计数100个TIL中的阳性细胞数, 取此5个视野的均值, 以中位数为截取值将其分为阳性和阴性. 以阳性细胞比例的平均值定义为该肿瘤的阳性细胞百分比计算阳性细胞率.
统计学处理 采用SPSS17.0统计软件对数据进行处理, OX40和SLP-2二者在肿瘤、癌旁组织、正常组织中的表达差异以及与临床病理类型中的差异采用χ2检验; 二者相关性采用Spearman等级资料相关分析. 检验水准α = 0.05. P<0.05为差异有统计学意义.
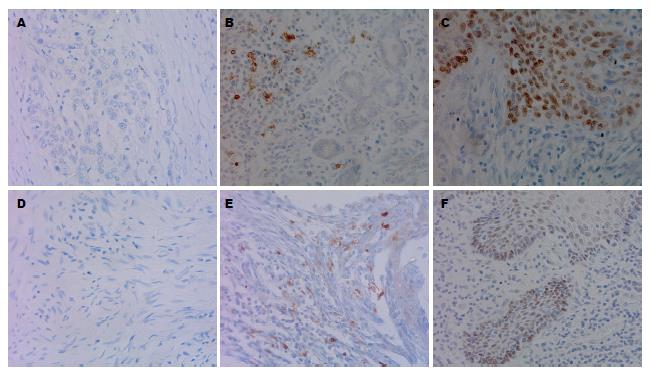
OX40和SLP-2在癌组织及癌旁不典型增生组织中的表达均明显高于正常组织, 差异有统计学意义(χ2 = 26.374, 20.988, P<0.05)(图1, 表1).
| 分组 | n | OX40阳性 | SLP-2阳性 |
| 癌组织 | 94 | 51(54.3) | 47(50.0) |
| 癌旁组织 | 31 | 17(54.8) | 8(25.8) |
| 正常组织 | 31 | 1(3.2) | 2(6.5) |
| χ2值 | 26.374 | 20.988 | |
| P值 | 0 | 0 |
OX40和SLP-2的表达与患者TNM分期及有无淋巴结转移相关(P<0.05, 表2), 而与患者的年龄、性别、浸润深度等因素无关.
| 临床病理特征 | n | OX40阳性 | SLP-2阳性 | ||||
| n(%) | χ2值 | P值 | n(%) | χ2值 | P值 | ||
| 年龄(岁) | 2.328 | 0.127 | 0.029 | 0.865 | |||
| ≥60 | 56 | 34(60.7) | 28(50.0) | ||||
| <60 | 38 | 17(44.7) | 19(50.0) | ||||
| 性别 | 0.224 | 0.636 | 0.052 | 0.82 | |||
| 男 | 67 | 37(55.2) | 34(50.7) | ||||
| 女 | 27 | 14(51.9) | 13(48.1) | ||||
| 浸润深度 | 0.241 | 0.886 | 2.375 | 0.305 | |||
| T1 | 10 | 6(60.0) | 6(60.0) | ||||
| T2 | 33 | 17(51.5) | 13(39.4) | ||||
| T3-T4 | 51 | 28(54.9) | 28(54.9) | ||||
| 淋巴结转移 | 10.98 | 0.001 | 5.595 | 0.018 | |||
| 无 | 70 | 31(44.3) | 34(48.6) | ||||
| 有 | 24 | 20(83.3) | 13(54.2) | ||||
| TNM分期 | 9.564 | 0.008 | 24.7 | 0 | |||
| Ⅰ | 14 | 9(64.3) | 6(42.9) | ||||
| Ⅱ | 62 | 27(43.5) | 30(48.4) | ||||
| Ⅲ | 18 | 15(83.3) | 11(61.1) | ||||
| 组织学分级 | 1.573 | 0.455 | 2.864 | 0.239 | |||
| G1 | 11 | 5(45.5) | 3(27.3) | ||||
| G2 | 70 | 37(52.9) | 38(54.3) | ||||
| G3 | 13 | 9(69.2) | 6(46.2) | ||||
| 肿瘤大小(cm) | 0.389 | 0.533 | 0.184 | 0.668 | |||
| ≥4 | 34 | 17(50.0) | 18(52.9) | ||||
| <4 | 60 | 34(56.7) | 29(48.3) | ||||
肿瘤组织中OX40和SLP-2阳性为34例, OX40阳性、SLP-2阴性为17例, OX40阴性、SLP-2阳性为13例, OX40和SLP-2都阴性的为34例. 经过分析OX40与SLP-2在肿瘤组织中的表达具有相关性(r = 0.363, P<0.05).
OX40(又称ACT35、CD134、TNFRSF4)属于TNFR超家族成员之一, 于1987年首次发现, 为相对分子量约48-50 kDa的Ⅰ型跨膜蛋白. 人OX40基因位于1号染色体上, 诱导性表达在活化的CD4+和CD8+ T细胞, 并且在活化的调节性T细胞、NKT细胞、NK细胞核中性粒细胞也有表达. OX40配体OX40L(CD134L、gp34)属TNF超家族成员之一, 为相对分子量约34 kDa的Ⅱ型跨膜蛋白, 其诱导性表达于专职的抗原提呈细胞APCs以及T细胞[4]. OX40/OX40L介导的共刺激信号参与T细胞活化、增殖和迁移, 并在记忆性T细胞的形成和Th1、Th2分化过程中发挥重要的作用. 国内外文献多报道OX40/OX40L通路在自身免疫性疾病的发生、发展中的作用, 对于其在肿瘤细胞中的研究较少. OX40/OX40L信号可通过包括促进细胞因子转录、上调Bcl2家族抗凋亡基因等多种机制延长OX40+ T细胞存活期, 因此其被认为是一个抗凋亡分子[5]. 有文献报道OX40在乳腺癌、黑色素瘤、结直肠癌等中呈高表达状态[6,7], 在肿瘤免疫中起到抗肿瘤的作用, 且与预后呈正相关[2]. 本研究结果与此结论并不一致. 另外还有文献报道OX40/OX40L除发挥共刺激信号作用外, 还可介导细胞间的物理黏附, 并通过活化多种黏附分子, 促进细胞黏附从而有利于ATL细胞在体内微环境的存活[8]. 在乳腺癌的研究表明OX40与乳腺癌的TNM分期、淋巴结转移成正相关, 提示OX40的高表达可能与乳腺癌的发生、发展、侵袭和转移有关[9]. 本研究结果显示, OX40在食管癌癌组织中的表达与TNM分期、淋巴结转移存在明显正相关性(P<0.05). OX40的表达在有淋巴结转移的情况下较无淋巴结转移组明显升高, 在TNMⅢ期组织中的表达明显高于Ⅰ、Ⅱ期. 原因可能为OX40可介导细胞间的物理黏附, 并可通过OX40/OX40L活化许多黏附分子, 促进细胞黏附, 从而有利于食管癌细胞在体内微环境存活. 提示OX40可能作为黏附因子不仅在ESCC的发生过程中起作用, 还参与ESCC的进展.
SLP-2基因是2000年首次发现并命名的一个新基因, 其表达产物在当时被鉴定为细胞膜相关蛋白[10]. SLP-2是stomatin基因超家族的一员, 其编码的SLP-2蛋白在人体组织中如脑、肺、胸腺、气管、食管黏膜等中广泛表达, 其中在骨骼肌和心肌中的表达水平较高. 多项研究表明, SLP-2在恶性肿瘤中表达明显上调, 在肿瘤的发生、发展过程中可能具有重要作用[11]. 张立勇等[12]首次发现SLP-2基因在食管鳞状细胞癌中过表达. 此后的一些研究表明, SLP-2基因在胃癌、肺癌、喉癌、子宫内膜癌[13-16]等恶性肿瘤中也存在高表达, 推测其在恶性肿瘤中的高表达是一个较为普遍的现象, SLP-2可能是一个新的癌基因. 但目前关于SLP-2基因的研究较少. 本研究采用免疫组织化学法检测食管鳞癌、癌旁组织及正常组织中SLP-2蛋白表达水平, 结果显示SLP-2基因表达在食管癌组织及癌旁组织中表达较正常组织明显升高(P<0.05). 结合免疫组织化学结果和患者临床病理资料进行分析发现, SLP-2蛋白的高表达与食管鳞癌的临床分期和有无淋巴结转移有关(均P<0.05), 即较晚期病例的食管鳞癌组织SLP-2蛋白表达水平高于较早期病例的食管鳞癌组织, 有淋巴结转移的病例相对应的食管鳞癌组织中SLP-2蛋白的表达水平高于无淋巴结转移的病例. 而SLP-2蛋白的表达与其他临床病理变量没有显著相关性, 提示SLP-2可能是一个与食管鳞癌分期和转移相关的指标, 在食管鳞癌的发展和转移中起一定的促进作用.
总之, 本研究发现OX40和SLP-2在食管鳞癌组织中呈高表达, 并与食管鳞癌的TNM分期和淋巴转移有关. 恶性肿瘤的分期及是否有淋巴结转移和远处转移是决定其预后的重要因素. 因此, OX40和SLP-2的表达水平可能作为食管鳞癌的预后指标, 指导食管鳞癌患者的预后生存. 本研究发现OX40与SLP-2的表达存在相关性, 但是其具体机制仍有待进一步深入研究.
OX40是TNFR超家族成员之一,研究表明其在黑色素瘤、淋巴瘤、结直肠癌中表达增高, 在肿瘤免疫中起着抗肿瘤作用, 且与预后呈正相关. SLP-2属于stomatin基因超家族, 在人食管癌、肺癌、喉癌、子宫内膜癌组织中高表达, 并发现其与肿瘤的发生、发展关系密切. 目前国内外文献甚少有两者在食管癌中的表达及相关性的研究报道.
张志坚, 教授, 福州总医院消化内科
通过免疫组织化学法检测OX40和SLP-2在食管鳞癌(esophageal squamous cell carcinoma, ESCC)组织中的表达, 并结合患者临床病理资料进行分析, 探讨二者在ESCC中的表达特点及意义.
2008年Sarff等研究发现OX40在黑色素瘤等恶性肿瘤中呈高表达, 在肿瘤免疫中起着抗肿瘤的作用; 张立勇等首次发现SLP-2基因在食管鳞状细胞癌中过表达, 并与肿瘤的发生、发展关系密切. 而两者在食管癌组织中的共同表达及相关性分析尚未见报道.
本实验对94例ESCC标本中OX40和SLP-2的表达水平进行检测, 结果表明, OX40和SLP-2在食管鳞癌组织中高表达, 可能参与食管鳞癌的发生发展和转移, 且二者的表达具有相关性, 对于更进一步的研究指明了方向.
对于OX40和SLP-2在食管组织中表达水平的检测可能作为食管鳞癌的预后指标, 指导食管鳞癌患者的预后生存, 并有可能作为一个新的肿瘤靶向治疗的靶点.
本文具有一定科学性和创新性, 对食管癌临床的诊断和治疗有一定的帮助.
编辑: 田滢 电编:闫晋利
| 2. | Sarff M, Edwards D, Dhungel B, Wegmann KW, Corless C, Weinberg AD, Vetto JT. OX40 (CD134) expression in sentinel lymph nodes correlates with prognostic features of primary melanomas. Am J Surg. 2008;195:621-625; discussion 625. [PubMed] [DOI] |
| 3. | Hájek P, Chomyn A, Attardi G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2. J Biol Chem. 2007;282:5670-5681. [PubMed] |
| 4. | Croft M, So T, Duan W, Soroosh P. The significance of OX40 and OX40L to T-cell biology and immune disease. Immunol Rev. 2009;229:173-191. [PubMed] [DOI] |
| 5. | Song J, So T, Croft M. Activation of NF-kappaB1 by OX40 contributes to antigen-driven T cell expansion and survival. J Immunol. 2008;180:7240-7248. [PubMed] |
| 6. | Hamidinia M, Ghafourian Boroujerdnia M, Talaiezadeh A, Solgi G, Taghdiri M, Khodadadi A. Concomitant Increase of OX40 and FOXP3 Transcripts in Peripheral Blood of Patients with Breast Cancer. Iran J Immunol. 2013;10:22-30. [PubMed] |
| 7. | Cepowicz D, Gryko M, Zaręba K, Stasiak-Bermuta A, Kędra B. Assessment of activity of an adhesion molecule CD134 and CD137 in colorectal cancer patients. Pol Przegl Chir. 2011;83:641-645. [PubMed] [DOI] |
| 8. | Imura A, Hori T, Imada K, Ishikawa T, Tanaka Y, Maeda M, Imamura S, Uchiyama T. The human OX40/gp34 system directly mediates adhesion of activated T cells to vascular endothelial cells. J Exp Med. 1996;183:2185-2195. [PubMed] |
| 9. | Xie F, Wang Q, Chen Y, Gu Y, Mao H, Zeng W, Zhang X. Costimulatory molecule OX40/OX40L expression in ductal carcinoma in situ and invasive ductal carcinoma of breast: an immunohistochemistry-based pilot study. Pathol Res Pract. 2010;206:735-739. [PubMed] [DOI] |
| 10. | Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homologue of stomatin (band 7.2b) present in erythrocytes and other tissues. J Biol Chem. 2000;275:8062-8071. [PubMed] |
| 11. | Cao W, Zhang B, Ding F, Zhang W, Sun B, Liu Z. Expression of SLP-2 was associated with invasion of esophageal squamous cell carcinoma. PLoS One. 2013;8:e63890. [PubMed] [DOI] |
| 12. | 张 立勇, 王 涛, 丁 芳, 刘 仲敏, 刘 芝华, 李 衍达. SLP-2基因在食管鳞癌中的差异表达及其生物信息学分析. 世界华人消化杂志. 2004;12:1517-1521. [DOI] |
| 14. | Chang D, Ma K, Gong M, Cui Y, Liu ZH, Zhou XG, Zhou CN, Wang TY. SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma. Biomarkers. 2010;15:104-110. [PubMed] [DOI] |
| 15. | Cao WF, Zhang LY, Liu MB, Tang PZ, Liu ZH, Sun BC. Prognostic significance of stomatin-like protein 2 overexpression in laryngeal squamous cell carcinoma: clinical, histologic, and immunohistochemistry analyses with tissue microarray. Hum Pathol. 2007;38:747-752. [PubMed] |