修回日期: 2013-10-22
接受日期: 2013-11-11
在线出版日期: 2013-11-28
目的: 探讨射频消融术(percutaneous radiofrequency ablation, PRFA)后超声影像学表现与生化指标、复发率的关系.
方法: 选取PRFA患者36例, 分析并比较其术前、术后7、14、28 d的谷丙转氨酶(alanine aminotrans-ferase, ALT)、谷草转氨酶(aspartate aminotrans-ferase, AST)、总胆红素(total bilirubin, TBIL), 白蛋白(albumin, ALB), 甲胎蛋白(alpha fetal protein, AFP)水平及超声和核磁共振(magnetic resonance imaging, MRI)的影像学表现.
结果: PRFA患者术后7 d ALT、AST均较术前明显升高(102.21 U/L±53.41 U/L vs 55.34 U/L±36.57 U/L, 90.58 U/L±37.22 U/L vs 65.77 U/L±40.29 U/L), 14 d后降至术前水平. 血清AFP值转阴及AFP值下降≥50%者同期MRI显示肿瘤完全消融, 超声显示病灶回声增强, 病灶出现中央液化, 内部无血流. 血清AFP值升高者同期MRI显示肿瘤不完全消融, 超声显示病灶部分回声增强, 内见点状血流. 以肿瘤标志物AFP水平为参考指标, PRFA的有效率≥60%. PRFA患者的术后3年生存率68%, 中位生存时间38.09 mo.
结论: PRFA术后患者影像学表现与生化指标、肿瘤复发相一致. 影像检查可作为检测肿瘤复发的一种有效手段.
核心提示: 本文对36例患者进行回顾性研究, 以期探讨非手术适应症肝癌患者术后影像学表现与生化指标以及复发率的关系, 以便于患者及医务工作者重视术后影像学改变并积极采取措施, 从而降低复发率, 提高生存率.
引文著录: 付雪丹, 刘彦丽. 超声引导下PRFA治疗非手术适应症肝癌术后的肿瘤影像表现与疗效的关系. 世界华人消化杂志 2013; 21(33): 3747-3751
Revised: October 22, 2013
Accepted: November 11, 2013
Published online: November 28, 2013
AIM: To investigate the relationship between postoperative imaging findings and therapeutic effect in patients with unresectable hepatocellular carcinoma after ultrasound-guided percutaneous radiofrequency ablation (PRFA).
METHODS: Thirty-six patients with unresectable hepatocellular carcinoma who undersent ultrasound-guided percutaneous radiofrequency ablation were selected. The levels of alanine aminotransferase (ALT), aspartate aminotrans-ferase (AST), total bilirubin (TBIL), albumin (ALB), and alpha fetal protein (AFP) as well as imaging findings were retrospectively analyzed (1 day before, 7, 14 and 28 d after PRFA).
RESULTS: The levels of ALT and AST were significantly higher on day 7 after PRFA than on day 1 before PRFA (102.21 U/L ± 53.41 U/L vs 55.34 U/L ± 36.57 U/L, 90.58 U/L ± 37.22 U/L vs 65.77 U/L ± 40.29 U/L), and they decreased to preoperative levels on day 14. Patients with an AFP level decreased by ≥ 50% on day 28 showed complete ablation of the tumors on magnetic resonance imaging (MRI) and high echo area with liquefaction and no blood flow in the center of the lesions on ultrasound. Patients with elevated AFP values showed incomplete ablation of the tumors on MRI and incomplete high echo area with blood flow on ultrasound. The effective rate of PRFA was higher than 60% when the levels of AFP were used as evaluation criterion. The 3-year survival rate was 68%. The median survival time was 38.09 mo.
CONCLUSION: The imaging findings can well reflect the changes of serum markers and recurrence in patients with unresectable hepatocellular carcinoma after ultrasound-guided percutaneous radiofrequency ablation. Imaging examinations can be used as an effective approach for the detection of recurrence of hepatocellular carcinoma.
- Citation: Fu XD, Liu YL. Relationship between postoperative imaging findings and therapeutic effect in patients with unresectable hepatocellular carcinoma after ultrasound-guided percutaneous radiofrequency ablation. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3747-3751
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3747.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3747
原发性肝癌是严重威胁人类健康的癌症之一, 居世界恶性肿瘤发病率的第6位[1]. 我国是乙型肝炎大国, 原发性肝癌一直是困扰我国公民的健康问题[2]. 手术治疗是肝癌最有效的治疗方式, 但受肿瘤大小、位置、肝功能等影响, 只有极少部分患者能够接受手术治疗. 而超声引导下经皮射频消融术(percutaneous radiofrequency ablation, PRFA)治疗因其操作简单, 安全性高等优点越来越被临床医生及患者所接受[3]. 但目前就PRFA术后影像学表现与生化指标以及复发率的关系的报道并不多见. 本文对36例患者进行回顾性研究, 以期探讨非手术适应症肝癌患者术后影像学表现与生化指标以及复发率的关系, 以便于患者及医务工作者重视术后影像学改变并积极采取措施, 从而降低复发率, 提高生存率.
选取2009-01/2011-01行PRFA的患者36例, 其中男性22例, 女性14例, 年龄范围44-61岁, 平均年龄为46.1岁±11.2岁. 所有患者的诊断均经病理学证实, 且为首次诊断. 入选标准: (1)肝功能Child A级; (2)肿瘤最大直径≤3 cm, 肝内病灶个数≤3; (3)无血管、胆管侵犯, 无癌栓、腹腔淋巴结及远处转移; (4)未经化疗、放疗等其他治疗. 所有患者或家属均签署知情同意书. Logiq-S6超声诊断仪(探头频率3.5 MHz, 美国GE公司)和RF2000型射频消融仪(射频针为Leveen针, 美国RadioTheraPeutics公司).
1.2.1 影像检查: 根据进针部位患者采取仰卧位或左侧卧位, 消毒、铺无菌洞巾, 以2%利多卡因局部麻醉至肝被膜下, 部分患者采用持续硬膜外麻醉. 电极贴于患者腰背部, 在超声引导下将电极针插入肿瘤深处并开始消融, 功率从20 W开始, 每分钟调高10 W, 直至最高能量90 W. 对肿瘤较大者应多方位、多点、多针、多角度反复治疗, 以保证消融范围达到整个癌灶.
1.2.2 定期复查: (1)术后7、14、28 d复查肝功能指标: 谷丙转氨酶(alanine aminotrans-ferase, ALT)、谷草转氨酶(aspartate aminotrans-ferase, AST)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB), 彩色超声、核磁共振(magnetic resonance imaging, MRI)结合肿瘤标志物甲胎蛋白(alpha fetal protein, AFP)水平判断疗效, 认为AFP转阴或下降≥50%为有效; (2)每1 mo复查肝功能、AFP、彩色超声; (3)每3 mo、6 mo复查超声或MRI 1次.
1.2.3 随访: 通过电话回访或门诊复查等方式进行随访, 获得患者生存状态和死亡时间, 了解与射频消融治疗的近期和远期疗效. 生存时间: 自射频治疗日开始至死亡日、失访日或随访结束日(2013-05-31)止, 以月计算.
统计学处理 所有数据结果均采用SPSS17.0统计软件处理, 计量资料采用t检验或方差分析, P<0.05为差异有统计学意义.
射频消融术后7 d, ALT及AST水平均上升, 术后14 d显著下降, 甚至低于术前水平, 至术后28 d降至最低点. ALB水平术后7 d低于术前水平, 术后14 d进一步下降, 术后28 d与术后14 d的水平相差无几. 而TBIL水平在术前、术后均无明显改变. 射频消融术后肝功能各指标的具体变化值如表1.
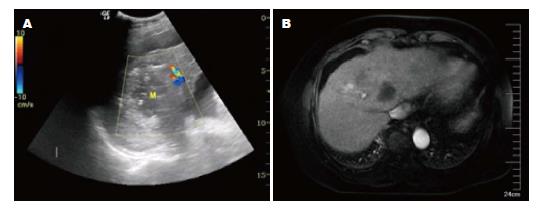
超声引导下PRFA的36例患者中6例患者术前术后血清AFP值阴性(<10.9 μg/L), 术前血清AFP值阳性30例. 术后1 mo复查, 血清AFP值转阴者3例, 占10%(3/30), 血清AFP值下降≥50%者15例, 占50%(15/30), 总有效率60%(18/3), 同期MRI显示肿瘤完全消融, 超声显示病灶回声增强, 其中15个病灶出现中央液化, 内部无血流. 另外有8例患者的血清AFP值下降<50%, 占26.67%(8/30), 同期MRI显示肿瘤完全消融, 超声显示病灶回声增强, 中央无液化, 病灶内部无血流. 有4例患者的血清AFP值有所升高, 占13.33%(4/30), 同期MRI显示1例肿瘤完全消融, 3例肿瘤不完全消融(图1A), 超声显示病灶部分回声增强, 2个病灶内见条状血流信号(图1B), 其余未见血流信号. 术后7、14、28 d AFP水平的变化如表2.
| 术后7 d | 术后14 d | 术后28 d | |||||||||
| 阴性 | 下降≥50% | 下降<50% | 上升 | 阴性 | 下降≥50% | 下降<50% | 上升 | 阴性 | 下降≥50% | 下降<50% | 上升 |
| 3(10) | 16(53.33) | 8(26.67) | 3(10) | 3(10) | 16(59.26) | 8(25.00) | 3(13.89) | 3(10) | 15(50) | 8(26.67) | 4(13.33) |
超声引导下PRFA的36例患者随访至2013-05-31, 随访时间28-52 mo. 36例患者至随访期结束共失访1例, 失访率0.28%(1/36), 存活24例, 死于肝癌复发10例, 死于其他疾病1例. 值得注意的是: 死亡的10例患者中, 4例来自于AFP(28 d时)上升的患者, 5例来自于AFP值下降<50%的患者, 1例来自于AFP值下降≥50%的患者. 1、2、3、4年生存率分别为85%、74%、68%、61%. 中位生存时间38.09 mo.
原发性肝癌是严重威胁我国公民健康的肿瘤之一, 统计表明, 其死亡率位居我国肿瘤相关死亡率的第2位, 每年约有13万人丧命于此[4,5]. 肝癌发病隐匿, 确诊后的积极治疗对患者的生存至关重要. 由于传统的手术治疗方式受到诸多限制, 越来越多的临床医生及患者将目光转移至微创治疗. 随着医学影像技术的快速发展和微创器械及技术的不断改进, 以PRFA治疗为代表的微创治疗已成为治疗肝癌的有效方法之一[6,7]. 经证实, PRFA安全有效并可获得与传统手术相似的远期生存率[8,9]. PRFA利用超声设备引导电极针经皮插入肿瘤, 通过射频波激发周围组织内的离子、水、蛋白质等产生振动、摩擦并产热, 使局部组织形成凝固性坏死和变性, 从而凝固肿瘤组织, 导致肿瘤坏死[10,11]. 据报道, 射频消融术后肿瘤血管的生成受到抑制, 肿瘤细胞的凋亡加快, 同时机体的细胞免疫功能加强, 从而提高了抗肿瘤的免疫力[11,12].
本研究发现射频消融术后7 d ALT及AST水平均显著上升, 经保肝治疗后术后14 d下降至低于术前水平, 至术后28 d降至最低点; ALB水平术后7 d低于术前水平, 但在术后14 d及术后28 d均未见明显下降, 与文献报道相符[13]. 其原因可能为射频消融使得肝癌细胞及其周围肝细胞凋亡, 细胞内转氨酶释放入血, 引起ALT、AST升高[14], 但是经保肝治疗后, 术后14 d相关指标均恢复至术前水平. 因此我们认为PRFA治疗肝癌的方式是值得推荐的. AFP水平是评价肿瘤复发的特异性指标之一[15]. 以AFP水平为参考, 发现本研究结果显示射频消融术的有效率>60%. 大部分患者PRFA治疗后AFP水平有所下降, 影像学检查显示肿瘤组织坏死样变, 且病变的影像学表现与AFP水平变化相符. 提示影像学检查可作为一种监测肿瘤复发的有效手段, 如果在复查时发现病灶出现不完全消融、仅部分强化或者有血流信号, 应警惕肿瘤复发的可能, 并进一步采取积极措施以提高其生存率.
总之, 超声引导下PRFA治疗原发性肝癌, 对肝脏损伤小、安全性高, 术后疗效显著, 具有较高的临床应用价值. 术后应定期复查, 重视影像学表现, 早期发现其异常变化并及时采取积极措施以提高患者的生存率.
原发性肝癌是严重威胁人类健康的癌症之一, 居世界恶性肿瘤发病率的第6位. 我国是乙型肝炎大国, 原发性肝癌一直是困扰我国公民的健康问题. 手术治疗是肝癌最有效的治疗方式, 但受肿瘤大小、位置、肝功能等影响, 只有极少部分患者能够接受手术治疗. 而超声引导下经皮射频消融术(percutaneous radiofrequency ablation, PRFA)治疗因其操作简单, 安全性高等优点越来越被临床医生及患者所接受. 但目前就PRFA术后影像学表现与生化指标以及复发率的关系的报道并不多见.
毛高平, 教授, 中国人民解放军空军总医院
据报道, 射频消融术后肿瘤血管的生成受到抑制, 肿瘤细胞的凋亡加快, 同时机体的细胞免疫功能加强, 从而提高抗肿瘤的免疫力.
超声引导下PRFA治疗原发性肝癌, 对肝脏损伤小、安全性高, 术后疗效显著, 具有较高的临床应用价值. 术后应定期复查, 重视影像学表现, 早期发现其异常变化并及时采取积极措施以提高患者的生存率.
本文选题实用, 设计合理, 结果可靠, 具有很好的参考价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Shiina S, Tateishi R, Arano T, Uchino K, Enooku K, Nakagawa H, Asaoka Y, Sato T, Masuzaki R, Kondo Y. Radiofrequency ablation for hepatocellular carcinoma: 10-year outcome and prognostic factors. Am J Gastroenterol. 2012;107:569-577; quiz 578. [PubMed] [DOI] |
| 3. | Choi D, Lim HK, Rhim H, Kim YS, Yoo BC, Paik SW, Joh JW, Park CK. Percutaneous radiofrequency ablation for recurrent hepatocellular carcinoma after hepatectomy: long-term results and prognostic factors. Ann Surg Oncol. 2007;14:2319-2329. [PubMed] [DOI] |
| 4. | Parisi A, Desiderio J, Trastulli S, Castellani E, Pasquale R, Cirocchi R, Boselli C, Noya G. Liver resection versus radiofrequency ablation in the treatment of cirrhotic patients with hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2013;12:270-277. [PubMed] [DOI] |
| 5. | Solbiati L, Ahmed M, Cova L, Ierace T, Brioschi M, Goldberg SN. Small liver colorectal metastases treated with percutaneous radiofrequency ablation: local response rate and long-term survival with up to 10-year follow-up. Radiology. 2012;265:958-968. [PubMed] [DOI] |
| 6. | Chen MS, Li JQ, Zheng Y, Guo RP, Liang HH, Zhang YQ, Lin XJ, Lau WY. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg. 2006;243:321-328. [PubMed] [DOI] |
| 7. | Min JH, Lee MW, Rhim H, Choi D, Kim YS, Kim YJ, Cha DI, Lim HK. Radiofrequency ablation for viable hepatocellular carcinoma around retained iodized oil after transcatheter arterial chemoembolization: usefulness of biplane fluoroscopy plus ultrasound guidance. Korean J Radiol. 2012;13:784-794. [PubMed] [DOI] |
| 8. | Peng ZW, Liang HH, Chen MS, Zhang YJ, Zhang YQ, Lau WY. Conformal radiofrequency ablation of hepatocellular carcinoma with a multi-pin bipolar system. J Surg Oncol. 2011;103:69-74. [PubMed] [DOI] |
| 9. | Tateishi R, Shiina S, Teratani T, Obi S, Sato S, Koike Y, Fujishima T, Yoshida H, Kawabe T, Omata M. Percutaneous radiofrequency ablation for hepatocellular carcinoma. An analysis of 1000 cases. Cancer. 2005;103:1201-1209. [PubMed] [DOI] |
| 10. | Amersi FF, McElrath-Garza A, Ahmad A, Zogakis T, Allegra DP, Krasne R, Bilchik AJ. Long-term survival after radiofrequency ablation of complex unresectable liver tumors. Arch Surg. 2006;141:581-587; discussion 581-587. [PubMed] [DOI] |
| 12. | Kim JH, Kim PN, Won HJ, Shin YM. Percutaneous radiofrequency ablation using internally cooled wet electrodes for the treatment of hepatocellular carcinoma. AJR Am J Roentgenol. 2012;198:471-476. [PubMed] [DOI] |
| 13. | Minami Y, Kudo M. Review of dynamic contrast-enhanced ultrasound guidance in ablation therapy for hepatocellular carcinoma. World J Gastroenterol. 2011;17:4952-4959. [PubMed] [DOI] |
| 14. | Asahina Y, Nakanishi H, Izumi N. Laparoscopic radiofrequency ablation for hepatocellular carcinoma. Dig Endosc. 2009;21:67-72. [PubMed] [DOI] |
| 15. | Ohmoto K, Yoshioka N, Tomiyama Y, Shibata N, Kawase T, Yoshida K, Kuboki M, Yamamoto S. Use of intra-arterial carbon-dioxide-enhanced ultrasonography for guidance of radiofrequency ablation and transcatheter arterial chemoembolization in hepatocellular carcinoma. Cardiovasc Intervent Radiol. 2006;29:1111-1113. [PubMed] [DOI] |