修回日期: 2013-09-18
接受日期: 2013-10-20
在线出版日期: 2013-11-28
目的: 对肝脏神经内分泌肿瘤进行病理学分级, 探讨其临床病理特点和预后.
方法: 收集34例肝脏神经内分泌肿瘤, 分为原发组和转移组, 应用免疫组织化学方法及透射电镜技术对肿瘤进行观察, 结合文献分析肿瘤的临床病理学特点.
结果: 原发组神经内分泌瘤NET1级(G1级)1例, 神经内分泌瘤NET2级(G2)1例, 神经内分泌癌NEC(G3)2例; 转移组NET1级(G1级)3例, NET2级(G2)15例, NEC(G3)12例.
结论: 肝脏神经内分泌肿瘤分为原发性神经内分泌肿瘤和转移性神经内分泌肿瘤, 肝脏原发性神经内分泌肿瘤非常罕见, 需要完全排除转移性的肝脏神经内分泌肿瘤才能诊断为肝脏原发性神经内分泌肿瘤. 手术是治疗肝脏神经内分泌肿瘤的有效手段.
核心提示: 本文论述了肝脏神经内分泌肿瘤的临床病理特点、治疗和预后, 发现肝脏神经内分泌肿瘤患者最常见的临床表现是腹痛、腹部包块,手术是治疗肝脏神经内分泌肿瘤的有效手段, 而患者的预后与年龄、分级有关.
引文著录: 陆中萃, 张秀辉. 肝脏神经内分泌肿瘤34例. 世界华人消化杂志 2013; 21(33): 3631-3637
Revised: September 18, 2013
Accepted: October 20, 2013
Published online: November 28, 2013
AIM: To investigate the pathological classification, clinicopathological characteristics and prognosis of hepatic neuroendocrine tumors.
METHODS: Thirty-four cases of hepatic neuroendocrine tumors were divided into an primary disease group and a metastatic disease group. Hepatic neuroendocrine tumors were studied by immunohistochemistry and electron microscopy, and their clinicopathological characteristics were analyzed.
RESULTS: Hepatic neuroendocrine tumors could be divided into three groups: neuroendocrine tumor (G1), neuroendocrine tumor (G2) and neuroendocrine carcinoma (G3). There were 1 case of neuroendocrine tumor (G1), 1 case of neuroendocrine tumor (G2) and 2 cases of neuroendocrine carcinoma (G3) in the primary disease group, and the corresponding figures in the metastatic disease group were 3, 15 and 12, respectively.
CONCLUSION: Primary hepatic neuroendocrine tumors are very rare. The diagnosis of primary hepatic neuroendocrine tumors must eliminate the possibility of metastatic hepatic neuroendocrine tumors. Surgery is an effective treatment modality for hepatic neuroendocrine tumors.
- Citation: Lu ZC, Zhang XH. Hepatic neuroendocrine tumors: Analysis of 34 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3631-3637
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3631
神经内分泌肿瘤(neuroendocrine neoplasms)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤[1,2]. 随着免疫组织化学技术和电镜观察在肿瘤病理诊断上的广泛应用, 已发现神经内分泌肿瘤不仅见于传统的内分泌器官, 也见于其他非内分泌器官, 如胃肠道、胰腺、胆囊、肺等. 据报道, 胃肠道的神经内分泌肿瘤的发生率依次为阑尾38%、小肠29%、结肠13%、胃12%、直肠8%[3]. 胃肠道的神经内分泌肿瘤经常转移至肝脏, 而肝脏原发性神经内分泌肿瘤十分罕见[4-6]. 1958年Edmondson报道了第1例肝脏原发性神经内分泌肿瘤, 目前文献报道真正肝脏原发性神经内分泌肿瘤大约100例[7,8]. 本文对肝脏神经内分泌肿瘤进行分析, 结合文献, 探讨其临床表现、病理学特点、治疗方法及预后.
本文共收集2007-2012年华西医院病理科诊断为肝脏神经内分泌肿瘤的病例45例, 临床资料完整的34例. 根据临床资料及病理特点, 30例考虑为肝脏转移性神经内分泌肿瘤, 归入转移组; 其中6例为超声引导下经皮细针穿刺活检标本, 9例为手术冰冻肝脏包块活检标本, 15例为手术切除标本. 原发组4例均为手术切除标本, 通过全身体格检查、胸片、腹部及泌尿系B超、胃肠镜、腹部CT、MRI等检查均未发现其他部位(脏器)存在肿瘤, 随访也未发现原发病灶, 考虑为肝脏原发性神经内分泌肿瘤. CD56、Syn、CgA、CK18及CD10购自北京中杉金桥生物技术有限公司, GPC3和Ki-67购自基因科技(上海)有限公司; EnVision试剂盒购自丹麦Dako公司.
采用免疫组织化学EnVision法染色, 实验步骤按试剂盒说明方法操作. 各组抗体均设阴性和阳性对照. 电镜标本经2.5%戊二醛固定, 树脂包埋, 透射电镜下观察. 根据欧洲神经内分泌肿瘤协会共识、WHO 2010消化系统神经内分泌肿瘤的临床病理学分类标准和中国胃肠胰神经内分泌肿瘤病理学诊断共识意见, 本文将肝脏神经内分泌肿瘤分为两类: 第一类为神经内分泌瘤(neuroendocrine tumor, NET), 包括NET1级(类癌, carcinoid)和NET2级; 第二类为神经内分泌癌(neuroendocrine carcinoma, NEC)[1,9](表1).
| NET1级(G1) | 低度恶性, 位于肝脏内, 没有血管侵犯, 没有坏死<2核分裂象/10 HPF (1个HPF = 2 mm2), 和Ki-67指数<2% |
| NET2级(G2) | 中度恶性, 有血管侵犯, 可见局灶坏死2-20个核分裂/10 HPF, 和Ki-67指数 3%-20% |
| NEC(G3) | 高度恶性, 侵犯邻近脏器和/或转移, 核异型性明显, 可见多灶坏死>20个核分裂象/10 HPF, 和Ki-67指数>20% |
免疫组织化学阳性结果判断CgA、Syn和CK18阳性表达为细胞浆出现棕黄色颗粒[10,11], CD56阳性表达在细胞膜[12], CD10和GPC3阳性表达定位在细胞浆和细胞膜[13,14]. 依据陈远钦等[15]的方法进行结果判断, 阳性细胞评分标准: 显微镜下随机取5个高倍镜视野, 阳性细胞数<5%为0分, 5%-25%为1分, 26%-50%为2分, >50%为3分; 染色程度评分标准: 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; 免疫组织化学结果为上述两项得分的乘积, 0分为阴性(-), 1-2分为弱阳性(+), 3-5分为阳性(++), 6分以上为强阳性(+++).
原发组4例, 女性2例, 男性2例, 发病年龄7-52岁. 转移组30例, 女性17例, 男性13例, 平均年龄52岁(22-75岁). 原发组4例患者均无乙型肝炎病毒感染史. 转移组3例患者有乙型肝炎病毒感染史. 原发组4例均因腹部包块就诊, 其中2例出现腹痛症状, 1例出现体质量减轻, 病程(从出现临床症状或体征到就诊的时间)5-20 d. 转移组中20例患者出现临床症状; 10例无明显临床症状, 因腹部包块就诊(表2). 30例患者中, 病程最长的为10年, 最短的为1 d.
| 症状 | n | 百分比(%) |
| 腹痛 | 17 | 56.7 |
| 腹泻 | 2 | 0.1 |
| 腹部包块 | 20 | 66.7 |
| 黄疸 | 3 | 0.1 |
| 呕吐 | 2 | 0.1 |
| 体质量减轻 | 8 | 26.7 |
原发组中, 3例患者作了血清肿瘤标志物检测, 其中1例CA-125升高. 转移组中27例患者作了血清肿瘤标志物检测, 其中1例癌胚抗原(carcinoembryonic antigen, CEA)、CA-125、CA19-9均升高; 3例CEA、CA19-9升高; 2例CA-125、CA19-9升高; 5例CA19-9升高; 4例CA-125升高; 1例CEA升高.
2.3.1 B超检查: 原发组1例左肝内查见单个稍强回声团; 3例右肝查见单个混合回声团; 转移组有23例行腹部B超检查, 其中1例腹部B超示肝脏形态未见异常, 实质回声稍增强, 欠均匀; 3例胰腺体尾部查见弱回声团, 肝脏未见异常; 11例左、右肝内均查见多个弱回声团; 1例肝左内叶及右前叶查见稍强回声团; 2例右肝内查见弱回声团; 4例左肝查见等回声团; 1例肝方叶查见单个稍强回声结节.
2.3.2 上腹部CT检查: 原发组4例平扫期提示肝实质中低密度肿块, 动脉期示肿块明显强化, 门静脉期肿块强化程度相对降低. 转移组有22例行上腹部CT检查, 其中19例示肝内低密度占位; 1例示肝门区见小片状异常强化灶; 2例患者上腹部CT提示胰腺实性占位, 肝脏未见异常.
2.3.3 MRI检查: 原发组有2例行MRI检查, 转移组有10例行MRI检查, 均示肝内可见稍长T1/T2信号影, 增强动脉期呈不均匀强化, 门脉期强化减低.
2.4.1 大体检查: 原发组4例患者中, 1例肿瘤位于肝左叶, 3例肿瘤位于肝右叶, 4例均为单发肿块. 转移组30例患者中, 有12例肝左、右叶均发现肿瘤, 5例肿瘤位于肝右叶, 11例肿瘤位于肝左叶, 2例肿瘤位于肝方叶. 有11例为单发肿块, 肿瘤的体积从1.2 cm×1.0 cm×0.7 cm到22.2 cm×16.8 cm×10.5 cm, 其中9例肿瘤与周围肝组织分界清楚; 2例肿瘤与周围肝脏组织分界不清. 19例为多发肿块, 直径0.5-13.4 cm, 平均3 cm, 其中12例肿瘤与周围肝脏组织分界清楚; 7例肿瘤与周围肝脏组织分界不清.
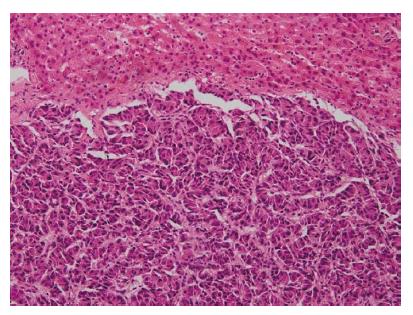
2.4.2 光镜检查: 原发组与转移组的组织学特点类似, 均具有神经内分泌肿瘤的共同特点, 肿瘤细胞呈圆形、立方形或短梭形, 大小一致, 排列呈梁柱状、实体巢团状或腺管状, 间质血管丰富. 原发组中1例为NET1级(G1), 1例为NET2级(G2), 2例为NEC(G3)(表3). 转移组中3例为NET1级(G1), 肿瘤细胞呈腺管状或梁柱状排列, 未见出血、坏死, 核分裂<2个/10 HPF. 15例为NET2级(G2), 其中7例肿瘤细胞排列呈腺管状或腺样(图1), 4例肿瘤细胞呈巢团状排列, 局灶区均可见坏死, 无出血, 核分裂5-18个/10 HPF; 4例肿瘤细胞呈梁柱状排列, 核分裂10-15个/10 HPF, 其中2例为穿刺活检标本, 未见出血、坏死, 2例局灶区可见坏死、出血. 12例为NEC(G3), 肿瘤细胞排列呈粗梁柱状或实体巢团状, 核分裂>20个/10 HPF, 其中2例为穿刺活检标本, 未见出血、坏死, 其余10例均可见明显出血、坏死.
| 序号 | 肿瘤位置 | 肿瘤数目 | 肿瘤大小(cm) | 肿瘤界限 | 出血 | 坏死 | 组织构象 | 细胞学形态 | 核分裂 | 肿瘤分级 |
| 1 | 肝右叶 | 1 | 9×5×5 | 边界清楚 | 明显 | 有 | 梁柱状或巢团状 | 立方形 | 13个/10 HPF | G2 |
| 2 | 肝右叶 | 1 | 12×9×7 | 边界欠清 | 无 | 无 | 腺管状 | 多边形 | <2个/10 HPF | G1 |
| 3 | 肝左叶 | 1 | 2×2×1.5 | 边界清楚 | 无 | 有 | 巢团状或梁柱状 | 圆形或短梭形 | >20个/10 HPF | G3 |
| 4 | 肝右叶 | 1 | 9×7×3.5 | 边界清楚 | 有 | 明显 | 巢团状 | 圆形或短梭形 | >20个/10 HPF | G3 |
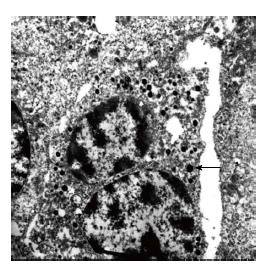
2.4.3 电镜检查: 原发组4例中有1例行电镜检查, 转移组有6例行电镜检查. 肿瘤细胞均呈多边形, 边界清楚, 片状排列, 细胞质多局灶性溶解, 细胞器较少, 细胞核为圆形或椭圆形, 可见核膜内陷, 核内染色质较少, 多集中在核膜周围; 原发组1例在细胞质中可见具有特征性的神经内分泌颗粒(图2), 转移组3例可见神经内分泌颗粒.
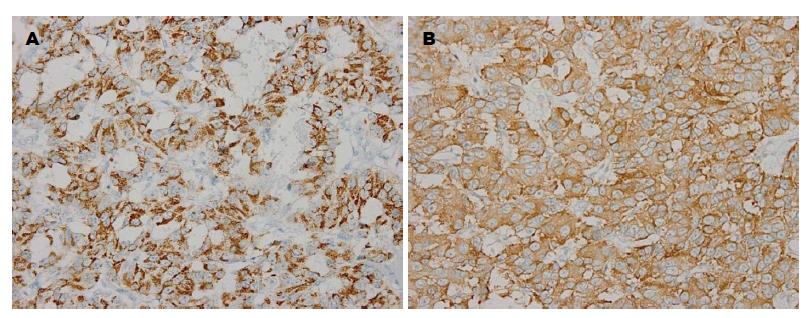
2.4.4 免疫组织化学: 原发组4例Syn、CgA均呈胞浆阳性表达(表4). 转移组15例表达Syn、CgA、CD56等多种神经内分泌标记; 15例表达2种神经内分泌标记(图3, 表5).
| 序号 | Syn | CgA | CD56 | CD10 | GPC3 | CK18 | Ki-67 |
| 1 | ++ | ++ | ++ | - | - | +++ | +, 5% |
| 2 | ++ | ++ | - | - | - | +++ | +, 1%-2% |
| 3 | + | ++ | +++ | - | - | ND | +, 60% |
| 4 | ++ | + | + | - | - | ND | +, 40%-50% |
| 肿瘤分级 | Syn | CgA | CD56 | Ki-67 | |||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | <2% | 3%-20% | >20% | |
| G1 | 0 | 1 | 0 | 2 | 0 | 1 | 2 | 0 | 0 | 1 | 1 | 1 | 3 | 0 | 0 |
| G2 | 3 | 2 | 5 | 5 | 2 | 0 | 7 | 6 | 0 | 4 | 7 | 4 | 0 | 15 | 0 |
| G3 | 2 | 4 | 5 | 1 | 5 | 4 | 2 | 1 | 3 | 4 | 4 | 1 | 0 | 0 | 12 |
21例发现肿瘤的原发部位, 最常见的部位为胰腺(11例), 其余依次为肺(4例)、胆囊(2例)、十二指肠(1例)、宫颈(1例)、胆总管(1例)和胸腺(1例). 其中2例在原发肿瘤切除术后5年出现肝转移; 2例在原发肿瘤切除术后1年出现肝转移; 17例为原发肿瘤与肝转移灶同时被发现, 其中9例原发病灶与肝脏转移灶的组织学构象类似, 其肿瘤分级相同.
原发组4例患者均行肿瘤切除术, 术前、术后均未行放射治疗、化学药物治疗及其他免疫治疗(表6). 转移组30例根据治疗方法不同, 分为6组: (1)手术组: 11例行肿瘤切除术, 术前、术后均未行放射治疗、化学药物治疗及其他免疫治疗, 其中1例失访; 2例神经内分泌癌患者(G3)因肿瘤导致的恶病质及多器官功能衰竭而死亡; 8例术后随访2年未见肿瘤复发或转移. 手术组患者的平均生存时间为35 mo; (2)肿瘤切除术+射频消融组: 1例失访; 2例术后随访2年未见肿瘤复发或转移, 从出现临床症状到目前生存时间为34-66 mo; (3)肿瘤切除术+化疗组: 1例神经内分泌癌患者(G3)死亡, 生存时间为48 mo; (4)肝活检+肝动脉化疗栓塞组: 2例行肝穿刺活检术, 1例行剖腹肝脏包块活检术, 术后均给予肝动脉化疗栓塞治疗, 1例NET2级(G2)和1例NEC(G3)患者死亡, 另1例随访2年肿瘤未见明显增大, 平均生存时间为34 mo; (5)肝脏穿刺活检+化疗组: 1例NET2级(G2)患者失访, 1例NET2级(G2)患者死亡, 1例患者随访2年肿瘤未见明显增大, 平均生存时间为65 mo; (6)肝活检组: 8例行剖腹肝脏包块活检术, 1例行肝穿刺活检术, 术前、术后均未行放射治疗、化学药物治疗及其他免疫治疗, 其中7例失访, 2例存活, 目前生存时间均为24 mo(表7, 8).
| 患者序号 | 患者年龄(岁) | 患者病程(mo) | 肿瘤分型 | 治疗方法 | 随访结果 | 目前生存时间(mo) |
| 1 | 47 | <1 | G2 | 肿瘤切除术 | 存活 | 46 |
| 2 | 41 | <1 | G1 | 肿瘤切除术 | 存活 | 19 |
| 3 | 52 | <1 | G3 | 肿瘤切除术 | 死亡 | 4 |
| 4 | 7 | <1 | G3 | 肿瘤切除术 | 存活 | 12 |
| 年龄(岁) | 随访结果(生存) | 随访结果(死亡) | 随访结果(失访) | 合计 |
| 20-39 | 1 | 1 | 3 | 5 |
| 40-59 | 9 | 1 | 5 | 15 |
| 60-79 | 4 | 4 | 2 | 10 |
| 合计 | 14 | 6 | 10 | 30 |
| 肿瘤分级 | 随访结果(生存) | 随访结果(死亡) | 随访结果(失访) | 合计 |
| G1 | 2 | 0 | 1 | 3 |
| G2 | 8 | 2 | 5 | 15 |
| G3 | 4 | 4 | 4 | 12 |
| 合计 | 14 | 6 | 10 | 30 |
文献报道肝脏原发性神经内分泌肿瘤可出现腹痛、腹部包块、黄疸、恶心、呕吐、乏力、体质量减轻等症状[16,17]. 本文发现肝脏原发性与转移性神经内分泌肿瘤的临床表现类似, 以腹部包块、腹痛最为常见, 这与文献报道相符. 肝脏原发性与继发性神经内分泌肿瘤均具有神经内分泌肿瘤的组织形态学特点, 免疫组织化学染色显示肿瘤细胞表达CgA、Syn、CD56、NSE等广谱性神经内分泌细胞标志物. 近来研究显示CgA和Syn对肝脏神经内分泌肿瘤的病理诊断更具特异性[10,18]. 本文发现肿瘤分级越高, 神经内分泌标记的表达越弱.
肝脏原发性神经内分泌肿瘤的诊断必须满足两个条件, 首先, 必须病理诊断为神经内分泌肿瘤; 其次需完全排除肝外神经内分泌肿瘤转移至肝脏. 肝脏原发性神经内分泌肿瘤与转移性神经内分泌肿瘤的区别要点包括: (1)长期随访: 张文书等[19]发现初诊为肝脏原发性神经内分泌肿瘤的患者在4年后发现空肠的原发肿瘤, 故长期随访是诊断肝脏原发性神经内分泌肿瘤的必要手段; (2)病理学特点: 张文书等[19]认为肿瘤发生的部位、肿瘤的个数对鉴别原发性和转移性神经内分泌肿瘤有一定的参考价值. 肝脏原发性神经内分泌肿瘤好发于肝右叶, 以单发肿块多见, 而肝脏转移性神经内分泌肿瘤多表现为肝内的多发肿块[19,20]. 本文发现与报道相符; (3)影像学检查: 目前诊断肝脏原发性神经内分泌肿瘤常用的检查手段包括腹部B超、CT及MRI检查等. 肝脏原发性神经内分泌肿瘤的影像学表现缺乏特异性, 难以与肝脏转移性神经内分泌肿瘤鉴别[19,21]. 李晓琼等[22]认为用影像学方法查找肝内的转移灶和肝外原发病灶对诊断肝脏转移性神经内分泌肿瘤有意义. Yalav等[23]认为奥曲肽闪烁扫描技术有助于查找神经内分泌肿瘤的发病部位; (4)实验室检查: 杨晓鸥等[24]认为胃肠道来源的神经内分泌肿瘤, 已发生转移患者的血浆CgA明显高于未转移患者. 而且监测患者血浆CgA水平, 对肝脏神经内分泌肿瘤治疗后复发有临床意义[23]. 本文收集的34例病例均具有神经内分泌肿瘤的病理特点, 4例通过全身体格检查、胸片、腹部及泌尿系B超、腹部CT等检查和随访均未发现其他部位(脏器)存在肿瘤, 3例行胃肠镜检查未发现原发病灶, 1例年龄较小(7岁)未行胃肠镜检查, 其肿瘤位于肝右叶, 结合文献报道的肝脏原发性神经内分泌肿瘤的特点, 归入原发组. 转移组30例中21例发现了肿瘤的原发部位; 9例虽未发现原发病灶,仍归入转移组, 其原因为: (1)9例中2例肿瘤标志物CA19-9、CA125均升高, 2例CEA、CA19-9均升高, 2例CA125升高, 2例CA19-9升高, 1例CEA升高, 姚辉盛等[25]认为胃癌、结直肠癌患者血清CA19-9、CA125、CEA均可升高, 故尚不能排除胃肠道肿瘤转移至肝脏; (2)9例中有6例为多发肿块, 肿瘤位于肝左、右叶, 3例为单发肿块, 肿瘤位于肝左叶或肝方叶, 2例失访, 7例随访时间为1-2年, 时间较短, 结合文献报道肝脏转移性神经内分泌肿瘤的特点[19], 考虑转移性神经内分泌肿瘤可能性大, 故目前虽未发现原发病灶, 仍诊断为转移性神经内分泌肿瘤.
肝脏神经内分泌肿瘤需与肝细胞癌及胆管细胞癌相鉴别, 典型的肝细胞癌排列构象多样, 多为梁柱状, 在小梁间有不规则血窦, 常有肝硬化的背景. 胆管细胞癌的间质非血窦而是增生的纤维组织. 除了组织形态, 最主要靠免疫组织化学染色予以区别. 肝脏神经内分泌肿瘤表达神经内分泌标记, 而肝细胞癌和胆管细胞癌则不表达神经内分泌标记. 肝细胞癌可表达AFP、Hepatocyte、GPC-3等肝细胞标志物, 胆管细胞癌通常表达胆管上皮标志物如细胞角蛋白19(Cytokeratin 19, CK19)、CK7、黏蛋白(muc-1)、muc-2及CEA, 而肝脏神经内分泌肿瘤则均不表达这些标志物.
肝脏神经内分泌肿瘤的预后与以下因素有关: (1)治疗方法: 有报道肝脏类癌术后5年的复发率为18%, 手术后5年的生存率为74%-78%. 尽管肝脏神经内分泌肿瘤可出现术后复发, 肝切除术后患者的生存率还是令人满意的[26]. 本文随访结果证明手术治疗对肝脏原发性神经内分泌肿瘤与转移性神经内分泌肿瘤均有疗效. 如果肝脏神经内分泌肿瘤同时发生于肝左、右叶, 并且肿块巨大或为多发性肿块, 不能实施肝切除术者, 可行肝脏移植手术. 肝移植术对原发性和转移性的肝脏神经内分泌肿瘤都有疗效[27,28]. 其他的治疗方法有肝动脉化疗栓塞及射频消融治疗[29,30]. 目前研究, 化学治疗对肝脏神经内分泌肿瘤患者弊大于利, 不推荐常规应用[31]; (2)患者年龄: 本文提示肝脏神经内分泌肿瘤的预后与患者年龄有关, 患者年龄越大, 预后越差; (3)肿瘤的分级: 本文显示肝脏神经内分泌肿瘤的分级越高, 预后越差. 文献报道肝脏原发性神经内分泌肿瘤较肝脏转移性神经内分泌肿瘤及原发性肝细胞癌预后好[32]. 本文收集肝脏原发性神经内分泌肿瘤的例数少, 转移性神经内分泌肿瘤患者的随访资料不齐全, 影响生存率的统计, 尚不能证实肝脏原发性神经内分泌肿瘤患者预后较好. 有待进一步扩大样本量, 深入研究影响肝脏神经内分泌肿瘤的预后因素.
神经内分泌肿瘤是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,可发生于全身许多器官, 如胃肠道、胰腺、胆囊、肺、肝脏等.目前肝脏的神经内分泌肿瘤尚无独特的病理学分级标准,本文参照WHO 2010消化系统神经内分泌肿瘤的临床病理学分类标准和中国胃肠胰神经内分泌肿瘤病理学诊断共识意见对肝脏神经内分泌肿瘤进行病理分级.
王鲁平, 主任医师, 北京军区总医院病理科
胃肠道的神经内分泌肿瘤经常转移到肝脏, 而肝脏原发性神经内分泌肿瘤十分罕见. 近年来的研究热点是肝脏原发性神经内分泌肿瘤的临床病理学特点. 不过肝脏原发性神经内分泌肿瘤的诊断较困难, 寻找敏感性和特异性高的方法来确诊肝脏原发性神经内分泌肿瘤是目前需要解决的问题.
张文书等对肝脏原发性神经内分泌肿瘤和转移性神经内分泌肿瘤进行分析, 发现肝脏原发性神经内分泌肿瘤多为单发肿块, 好发于肝右叶; 而肝脏转移性神经内分泌肿瘤多表现为肝内的多发肿块. 肿瘤发生的部位、肿瘤的个数对鉴别原发性和转移性神经内分泌肿瘤有一定参考价值.
本文分析肝脏神经内分泌肿瘤的病理特点, 发现原发肿瘤与肝转移灶的组织学构象类似, 其肿瘤分级相同; 肿瘤分级越高, Syn、CgA等神经内分泌标记的表达越弱.近来研究发现Syn、CgA对诊断肝脏神经内分泌肿瘤更具特异性.
肝脏原发性神经内分泌肿瘤的诊断必须符合两个条件: 首先, 必须具有神经内分泌肿瘤的病理特点; 其次需完全排除肝外神经内分泌肿瘤转移至肝脏. 可以通过长期随访、病理学特点、影像学检查和实验室检查来排除转移性肝脏神经内分泌肿瘤.
本文对34例肝原发及转移神经内分泌肿瘤进行了临床病理分析, 病例数较多, 有预后随访, 对临床及病理医师有一定参考价值.
编辑: 田滢 电编:鲁亚静
| 3. | Cerwenka H. Neuroendocrine liver metastases: contributions of endoscopy and surgery to primary tumor search. World J Gastroenterol. 2012;18:1009-1014. [PubMed] [DOI] |
| 4. | Gravante G, De Liguori Carino N, Overton J, Manzia TM, Orlando G. Primary carcinoids of the liver: a review of symptoms, diagnosis and treatments. Dig Surg. 2008;25:364-368. [PubMed] [DOI] |
| 5. | Lin CW, Lai CH, Hsu CC, Hsu CT, Hsieh PM, Hung KC, Chen YS. Primary hepatic carcinoid tumor: a case report and review of the literature. Cases J. 2009;2:90. [PubMed] [DOI] |
| 6. | Touloumis Z, Delis SG, Triantopoulou C, Giannakou N, Avgerinos C, Dervenis C. Primary hepatic carcinoid; a diagnostic dilemma: a case report. Cases J. 2008;1:314. [PubMed] [DOI] |
| 7. | Fenoglio LM, Severini S, Ferrigno D, Gollè G, Serraino C, Bracco C, Castagna E, Brignone C, Pomero F, Migliore E. Primary hepatic carcinoid: a case report and literature review. World J Gastroenterol. 2009;15:2418-2422. [PubMed] [DOI] |
| 8. | Shetty PK, Baliga SV, Balaiah K, Gnana PS. Primary hepatic neuroendocrine tumor: an unusual cystic presentation. Indian J Pathol Microbiol. 2010;53:760-762. [PubMed] [DOI] |
| 11. | Rao MS, Khan AA, Parveen N, Habeeb MA, Habibullah CM, Pande G. Characterization of hepatic progenitors from human fetal liver during second trimester. World J Gastroenterol. 2008;14:5730-5737. [PubMed] [DOI] |
| 13. | Wu Y, Li ZW, Li JY. Phenotypic Classification of Well-Differentiated Gastric Adenocarcinoma. Chin J Cancer Res. 2009;21:278-289. |
| 14. | Yao M, Yao DF, Bian YZ, Zhang CG, Qiu LW, Wu W, Sai WL, Yang JL, Zhang HJ. Oncofetal antigen glypican-3 as a promising early diagnostic marker for hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2011;10:289-294. [PubMed] |
| 16. | Gao J, Hu Z, Wu J, Bai L, Chai X. Primary hepatic carcinoid tumor. World J Surg Oncol. 2011;9:151. [PubMed] [DOI] |
| 17. | Schwartz G, Colanta A, Gaetz H, Olichney J, Attiyeh F. Primary carcinoid tumors of the liver. World J Surg Oncol. 2008;6:91. [PubMed] [DOI] |
| 20. | Jia C, Zhang Y, Xu J, Sun K. Experience in primary hepatic neuroendocrine tumor. Turk J Gastroenterol. 2012;23:546-551. [PubMed] [DOI] |
| 23. | Yalav O, Ülkü A, Akçam TA, Demiryürek H, Doran F. Primary hepatic neuroendocrine tumor: Five cases with different preoperative diagnoses. Turk J Gastroenterol. 2012;23:272-278. [PubMed] [DOI] |
| 26. | Huang YQ, Xu F, Yang JM, Huang B. Primary hepatic neuroendocrine carcinoma: clinical analysis of 11 cases. Hepatobiliary Pancreat Dis Int. 2010;9:44-48. [PubMed] |
| 27. | Alekseev D, Goralczyk A, Lorf T, Ramadori G, Obed A. Ten years survival with excellent outcome after living donor liver transplantation from 70 years old donor for primary hepatic neuroendocrine carcinoma: Case report. Int J Surg Case Rep. 2012;3:34-36. [PubMed] [DOI] |
| 28. | 靳 曙光, 严 律南. 应用肝移植治疗神经内分泌肿瘤肝转移的新进展. 中国普外基础与临床杂志. 2009;16:449-451. |
| 29. | Kong W, Qiu Y, Zhang W, Jun C, Zhu X, Qiu J, Ding Y. Diagnosis of primary hepatic carcinoid tumor: report of one case. Chinese-German Journal of Clinical Oncology. 2008;7:673-P675. |
| 30. | Komatsuda T, Ishida H, Furukawa K, Miyauchi T, Heianna J. Primary carcinoid tumor of the liver: report of a case with an emphasis on contrast-enhanced ultrasonographic findings. J Clin Ultrasound. 2005;33:302-304. [PubMed] |
| 31. | Glazer ES, Tseng JF, Al-Refaie W, Solorzano CC, Liu P, Willborn KA, Abdalla EK, Vauthey JN, Curley SA. Long-term survival after surgical management of neuroendocrine hepatic metastases. HPB (Oxford). 2010;12:427-433. [PubMed] [DOI] |
| 32. | Oh YH, Kang GH, Kim OJ. Primary hepatic carcinoid tumor with a paranuclear clear zone: a case report. J Korean Med Sci. 1998;13:317-320. [PubMed] |