修回日期: 2013-10-10
接受日期: 2013-10-17
在线出版日期: 2013-11-18
目的: 探讨靶向沉默caveolin-1(cav-1)基因对阿霉素(adriamycin, ADR)诱导的人胃癌耐药细胞SGC7901/ADR增殖和迁移作用的影响及可能机制.
方法: 通过小干扰RNA转染胃癌细胞SGC7901/ADR, 以未转染细胞为正常对照组, 转染siRNA Control为阴性对照组, RT-PCR法检测靶向沉默cav-1基因的效果, MTT法检测各组SGC7901/ADR细胞的增殖能力, Transwell小室迁移实验检测各组SGC7901/ADR细胞的迁移能力, Western blot检测细胞周期相关蛋白Cyclin D1、Cyclin A1和Cyclin E蛋白表达水平.
结果: 靶向沉默cav-1基因显著抑制胃癌SGC7901/ADR细胞增殖, P<0.05; 靶向沉默cav-1基因显著下调细胞周期相关蛋白Cyclin D1和Cyclin A1, 但对Cyclin E无影响; 同时, 靶向沉默cav-1基因显著抑制胃癌SGC7901/ADR细胞迁移能力.
结论: 靶向沉默cav-1基因可抑制胃癌耐药细胞的增殖和迁移, 可能与其抑制细胞周期相关蛋白Cyclin D1、Cyclin A1和迁移相关分子有关.
核心提示: 靶向沉默cav-1基因可抑制胃癌耐药细胞的增殖和迁移, 可能与其抑制细胞周期相关蛋白Cyclin D1、Cyclin A1和迁移相关分子有关.
引文著录: 张晔, 曲秀娟, 刘云鹏, 徐玲, 赵明芳, 侯科佐, 滕月娥. 靶向沉默caveolin-1基因对胃癌耐药细胞增殖和迁移影响. 世界华人消化杂志 2013; 21(32): 3532-3536
Revised: October 10, 2013
Accepted: October 17, 2013
Published online: November 18, 2013
AIM: To investigate the effect of silencing of the caveolin-1 (cav-1) gene on the proliferation and migration of multidrug resistant gastric adenocarcinoma cells (SGC7901/ADR) and to explore the underlying mechanisms.
METHODS: A siRNA specific for the cav-1 gene was transfected into SGC7901/ADR cells using Lipofectamine 2000. The proliferation and migration of SGC7901/ADR cells were detected by MTT assay and transwell assay, respectively. The mRNA expression of cav-1 was determined by RT-PCR. The protein expression of Cyclin D1, Cyclin A1 and Cyclin E was determined by Western blot.
RESULTS: Compared with the control group, the mRNA expression of cav-1 was significantly decreased in SGC7901/ADR cells after transfection (P < 0.05). The proliferation and migration of SGC7901/ADR cells were inhibited significantly after cav-1 silencing. Additionally, the protein expression of Cyclin D1 and Cyclin A1 was obviously inhibited. However, silencing of cav-1 did not affect Cyclin E expression.
CONCLUSION: Silencing of the cav-1 gene inhibits the proliferation and migration of human gastric cancer SGC7901/ADR cells possibly by decreasing the expression of Cyclin D1 and Cyclin A1.
- Citation: Zhang Y, Qu XJ, Liu YP, Xu L, Zhao MF, Hou KZ, Teng YE. Silencing of the caveolin-1 gene inhibits proliferation and migration of multidrug resistant gastric adenocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2013; 21(32): 3532-3536
- URL: https://www.wjgnet.com/1009-3079/full/v21/i32/3532.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i32.3532
胞膜窖(caveolae)是细胞质膜向内凹陷所形成的囊状脂筏结构, 广泛存在于各种类型的细胞中, 与细胞胞吞、信号传导、跨膜物质转运等多种细胞功能密切相关. Caveolin-1(Cav-1)是其标志性蛋白, 修饰caveolae的内表面, 关联和富集大量信号分子, 与恶性肿瘤发生发展及化疗耐药相关[1,2]. Cav-1在多种肿瘤中出现异常表达, 但不同肿瘤组织和细胞系Cav-1蛋白表达情况缺乏一致性变化. 目前研究普遍认为, 在肿瘤发生早期Cav-1蛋白表达较低, 以避免其发挥抑制肿瘤发生发展的作用; 随着肿瘤进入快速增殖、转移及耐药阶段, Cav-1蛋白表达明显增加, 以适应新环境及耐受凋亡, 即Cav-1在不同肿瘤的发生发展过程中发挥着不同的作用[3-5]. 本研究旨在通过靶向沉默胃癌耐药细胞SGC7901/阿霉素(adriamycin, ADR)的cav-1基因, 深入探讨cav-1基因与胃癌耐药细胞增殖、迁移的关系, 为寻找新的药物靶标及为个体化用药提供实验依据.
RPMI 1640培养基、胰蛋白酶购自Hyclone公司; 胎牛血清购自天津血研所; 四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)均购自美国Sigma公司; 总RNA抽提试剂TRIzol购自Invitrogen公司; RT-PCR试剂盒购自TaKaRa公司; 鼠抗人Cyclin D1、Cyclin A1、Cyclin E单克隆抗体、兔抗人β-actin单克隆抗体均购自Santa Cruz公司; Transwell小室购自Milliproe公司; 转染试剂Lipofectamine 2000购自Invitrogen公司; PCR引物合成于大连TaKaRa公司.
1.2.1 细胞培养与转染: 人胃癌耐药细胞SGC7901/ADR由中国医科大学肿瘤研究所保存, 在含100 mL/L胎牛血清、12 U/mL庆大霉素的RPMI 1640中, 37 ℃, 饱和湿度及50 mL/L CO2的孵育箱内传代培养, 取对数生长期细胞进行实验. 实验分3组: 未转染的对照组、转染siRNA control的阴性对照组、转染siRNA cav-1沉默组. 转染方法按Lipofectamine 2000的说明书进行.
1.2.2 Cav-1的siRNA及阴性对照序列的构建: cav-1的RNA干扰序列(siRNA cav-1): 5'-AACCAGAAGGGACACACAGTT-3'; 阴性对照序列(siRNA Control): 5'-AATTCTCCGAACGTGTCACGT-3'[6], 由上海吉玛制药技术有限公司合成.
1.2.3 MTT法检测细胞增殖实验: 取对数生长期的SGC7901/ADR细胞制成单细胞悬液, 以每孔5×104个细胞接种于96孔培养板, 设3个复孔. 实验分3组: 对照组、siRNA Control组、siRNA cav-1组. 37 ℃、50 mL/L CO2细胞培养箱中培养. 12 h后换无血清RPMI 1640培养液200 μL继续培养12 h, 使细胞周期同步化, 然后换含100 mL/L胎牛血清培养液, 分别再培养24、48、72、96 h后终止培养, 在避光条件下加5 g/L MTT溶液25 μL/孔, 继续孵育4 h后吸弃上清, 加入DMSO 200 μL/孔. 用酶标仪于570 nm波长条件下测定吸光度(A)值. 实验重复3次.
1.2.4 Transwell小室迁移实验: 将Transwell小室置入24孔板中. 收集各组细胞用2.5 g/L胰酶消化, 用无血清的RPMI 1640培养液按5×104个/mL的密度100 μL接种于上室. 吸取含100 mL/L胎牛血清的RPMI 1640培养液500 μL接种于下室, 置于37 ℃、50 mL/L CO2的培养箱中培养24 h. 移液器移走Transwell小室的下室和上室内液体, 去除滤膜上层未迁移的胃癌细胞, PBS冲洗滤膜3遍, 甲醇固定, Giemsa染色, 计数穿过微孔移至滤膜下层的细胞数. 共计数中央和四周5个视野, 取平均值.
1.2.5 蛋白印记法(Western blot)检测蛋白表达: 参照我们已发表文献[7], 4 ℃预冷PBS洗涤各组细胞, 收集2×106个, 裂解于100 µL含有蛋白酶抑制剂(1 mmol/L PMSF, 2 µg/mL Aprotitin)的RIPA裂解液中(1%Triton-100, 150 mmol/L NaCl, 10 mmol/L EDTA pH 8.0, 50 mmol/L Tris-HCl pH 7.4, 100 mmol/L NaF, 100 mmol/L Na Vanadate), 超声粉碎(30 J, 5 s/次, 5次), 4 ℃裂解40 min, 4 ℃ 15000 r/min, 离心30 min取上清. 以上步骤均于冰上操作. 采用Lowry法进行总蛋白定量. 以1:2比例与3×样品缓冲液混匀, 煮沸5 min. 将样品(22 µg/lane)在12%的SDS-聚丙烯凝胶中进行电泳2 h. 后通过半干式转印(恒流60 mA 20 min, 后120 mA 15 min)转印到硝酸纤维素膜上, 5%脱脂奶粉封闭2 h, 按预染Marker标记的分子量剪裁转印膜, 一抗(鼠抗人单克隆抗体Cyclin D1 1:500、Cyclin A1 1:500、Cyclin E 1:500、兔抗人单克隆抗体β-actin 1:1000), 4 ℃过夜, 二抗(山羊抗鼠 1:800、山羊抗兔 1:800)室温孵育30 min, 显色、图象采集及分析处理. 实验重复3次.
统计学处理 应用SPSS13.0统计软件进行分析. 各组间计量资料采用mean±SD表示, 各组样本均数的比较采用单因素方差分析, 组间比较采用t检验, P<0.05为差异有统计学意义.
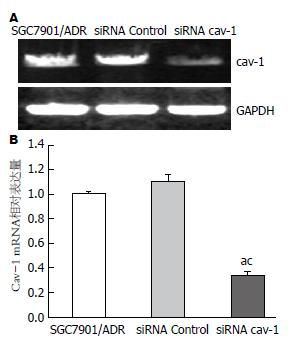
RT-PCR检测结果显示, 与对照组和siRNA Control组相比, siRNA cav-1组细胞中cav-1 mRNA的表达水平显著下调(P<0.05)(图1).
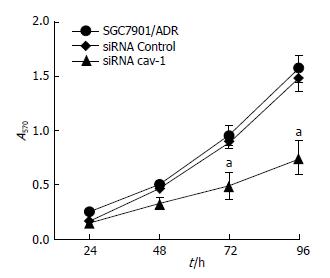
MTT测定细胞生长曲线, 结果显示沉默cav-1基因在72 h和96 h明显抑制SGC7901/ADR细胞的增殖, 与对照组和转染siRNA Control组比较差异有统计学意义(P<0.05, 图2).
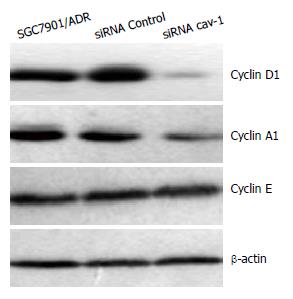
靶向沉默cav-1 48 h后, Western blot检测发现与对照组和siRNA Control组相比, siRNA cav-1组的Cyclin D1和Cyclin A1蛋白表达水平显著下调, 差异有统计学意义(P<0.05, 图3). 而Cyclin E蛋白表达在3组中差异无统计学意义(P>0.05).
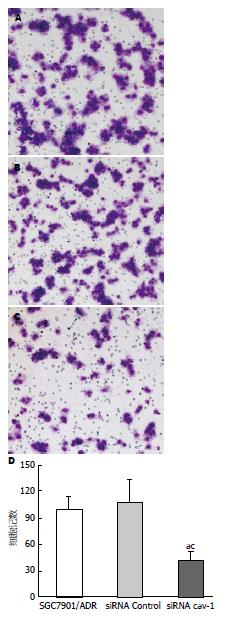
体外迁移实验结果显示, 对照组和转染siRNA Control组穿过小室底部小孔的胃癌细胞数无明显差异, 而干扰组穿过小室底部小孔的胃癌细胞数与对照组和转染siRNA Control组相比, 分别下降了65.1%和70.2%, 差异有统计学意义(P<0.05)(图4).
胃癌是一个多基因参与、多阶段变异累积形成的病理过程, 涉及癌基因的活化、抑癌基因的失活、细胞周期的调控失常、转录子异常活化和表遗传学等方面. 作为一种以浸润性生长为特点的恶性肿瘤, 胃癌侵袭和转移途径的多样性导致了其死亡率逐年上升[8]. 研究作为信号传导枢纽的caveolae结构标记蛋白Cav-1与胃癌细胞增殖和迁移的关系, 可以为寻找新的靶向治疗靶点提供思路.
Gao等[9]应用免疫组织化学方法检测发现, 胃癌中Cav-1的表达阳性率为30.2%, 而胃炎中Cav-1的表达为100%, 其中高、中、低分化腺癌组中Cav-1表达无显著差异. 同时采用RT-PCR法检测了胃癌MGC803和BGC823细胞株中cav-1的表达, 发现上述两株胃癌细胞株中cav-1的表达下调, 提示cav-1可能伴随胃癌的发生发展而表达逐步下调. 罗红梅等[10]运用基因重组技术, 将人全长cav-1基因稳定转染至胃癌MGC803细胞中, 发现cav-1转染后的MGC803细胞形态发生明显变化, 胞核变小、胞质丰富、核/质比例降低, 核分裂相少见, 提示cav-1具有诱导分化的作用. Yang等[11]研究发现, 高表达Cav-1使乳腺癌耐药细胞Hs578T/Dox具有更强的生长能力和抗凋亡能力. Burgermeister等[12]认为肿瘤在形成和发展过程中需要不断地适应外界环境, 在化疗耐药阶段, 为适应变化的新环境, 发挥信号传导中枢作用的Caveolae结构和Cav-1蛋白表达会明显增多. 本研究发现cav-1 mRNA在胃癌耐药细胞SGC7901/ADR中过表达, 通过Lipo 2000将cav-1的siRNA转染SGC7901/ADR, 与对照组和转染siRNA Control组比较, cav-1 mRNA表达受到显著抑制. 采用MTT法检测24、48、72和96 h siRNA cav-1对SGC7901/ADR细胞增殖的影响, 结果发现细胞在靶向沉默cav-1 72和96 h后与对照组相比生长明显减缓. 目前研究认为细胞增殖水平主要受细胞周期G1期调节, 而Cyclin D1、Cyclin A1及Cyclin E主要负责调控G1/S期的转换[13-15]. 本研究发现, 靶向沉默cav-1 48 h后与对照组和siRNA Control组相比, siRNA cav-1组的Cyclin D1和Cyclin A1蛋白表达水平显著下调, 而Cyclin E蛋白表达在3组中差异无统计学意义, 提示靶向沉默cav-1后, 参与调控细胞周期相关的信号通路受到抑制, 影响G1期细胞分化能力, 并改变了Cyclin D1和Cyclin A1蛋白对细胞周期的调节作用. 此外, 本研究中靶向沉默cav-1与对照组和siRNA Control组相比, 穿过Transwell底部小孔的数目明显减少, 差异具有统计学意义, 提示靶向沉默cav-1的胃癌耐药细胞SGC7901/ADR的迁移能力受到了抑制. 其原因可能靶向沉默cav-1后影响细胞外基质的降解, 减弱细胞突破基底膜而形成转移灶的能力, 从而可能影响胃癌耐药细胞的迁移、侵袭等运动能力.
总之, 我们通过靶向沉默胃癌耐药细胞SGC7901/ADR细胞中Cav-1的表达, 可抑制其增殖和迁移的生物学特性, 使其恶性程度降低. 本研究对于胃癌耐药细胞的分子靶向治疗提供了新的理论依据.
Caveolin-1(Cav-1)与恶性肿瘤发生发展及化疗耐药相关. 目前研究认为, 在肿瘤进入快速增殖、转移及耐药阶段, Cav-1蛋白表达明显增加, 以适应新环境及耐受凋亡.
蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
本研究通过靶向沉默胃癌耐药细胞SGC7901/ADR的cav-1基因, 深入探讨cav-1基因与胃癌耐药细胞增殖、迁移的关系, 为寻找新的药物靶标及为个体化用药提供实验依据.
Yang等发现, 高表达Cav-1使乳腺癌耐药细胞具有更强的生长能力和抗凋亡能力. Burgermeister等证实在化疗耐药阶段, Caveolae结构和Cav-1蛋白表达明显增多.
本研究通过靶向沉默胃癌耐药细胞中Cav-1表达, 抑制其增殖和迁移的生物学特性, 使其恶性程度降低, 为胃癌耐药细胞的分子靶向治疗提供了新的理论依据.
靶向沉默cav-1基因可抑制胃癌耐药细胞的增殖和迁移, 为今后恶性肿瘤的分子靶向治疗提供了新的作用靶点.
本文探讨了靶向沉默cav-1基因对人胃癌耐药细胞SGC7901/ADR增殖和迁移作用的影响及部分作用机制, 有一定的科学意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Hansen CG, Shvets E, Howard G, Riento K, Nichols BJ. Deletion of cavin genes reveals tissue-specific mechanisms for morphogenesis of endothelial caveolae. Nat Commun. 2013;4:1831. [PubMed] [DOI] |
| 2. | Briand N, Dugail I, Le Lay S. Cavin proteins: New players in the caveolae field. Biochimie. 2011;93:71-77. [PubMed] [DOI] |
| 3. | Zhao X, He Y, Gao J, Fan L, Li Z, Yang G, Chen H. Caveolin-1 expression level in cancer associated fibroblasts predicts outcome in gastric cancer. PLoS One. 2013;8:e59102. [PubMed] [DOI] |
| 4. | Bocci G, Fioravanti A, Orlandi P, Di Desidero T, Natale G, Fanelli G, Viacava P, Naccarato AG, Francia G, Danesi R. Metronomic ceramide analogs inhibit angiogenesis in pancreatic cancer through up-regulation of caveolin-1 and thrombospondin-1 and down-regulation of cyclin D1. Neoplasia. 2012;14:833-845. [PubMed] |
| 5. | Song Y, Xue L, Du S, Sun M, Hu J, Hao L, Gong L, Yeh D, Xiong H, Shao S. Caveolin-1 knockdown is associated with the metastasis and proliferation of human lung cancer cell line NCI-H460. Biomed Pharmacother. 2012;66:439-447. [PubMed] [DOI] |
| 6. | Pani B, Ong HL, Brazer SC, Liu X, Rauser K, Singh BB, Ambudkar IS. Activation of TRPC1 by STIM1 in ER-PM microdomains involves release of the channel from its scaffold caveolin-1. Proc Natl Acad Sci U S A. 2009;106:20087-20092. [PubMed] |
| 7. | Zhang Y, Qu X, Hu X, Yang X, Hou K, Teng Y, Zhang J, Sada K, Liu Y. Reversal of P-glycoprotein-mediated multi-drug resistance by the E3 ubiquitin ligase Cbl-b in human gastric adenocarcinoma cells. J Pathol. 2009;218:248-255. [PubMed] [DOI] |
| 8. | Correa P. Gastric cancer: overview. Gastroenterol Clin North Am. 2013;42:211-217. [PubMed] [DOI] |
| 9. | Gao X, Sun Y, Huang L, Chen XY, Zhang KL, Kong QY, Liu J, Li H. [Down-regulation of caveolin-1 in gastric carcinoma and its clinical biological significance]. Ai Zheng. 2005;24:311-316. [PubMed] |
| 10. | 罗 红梅, 唐 圣松, 廖 端芳, 严 鹏科, 谭 力铭, 汪 煜华, 龙 治峰, 刘 月顺, 朱 炳阳. Caveolin-1对胃癌细胞系MGC803细胞生长的影响. 世界华人消化杂志. 2006;14:1448-1452. [DOI] |
| 11. | Yang G, Truong LD, Timme TL, Ren C, Wheeler TM, Park SH, Nasu Y, Bangma CH, Kattan MW, Scardino PT. Elevated expression of caveolin is associated with prostate and breast cancer. Clin Cancer Res. 1998;4:1873-1880. [PubMed] |
| 12. | Burgermeister E, Liscovitch M, Röcken C, Schmid RM, Ebert MP. Caveats of caveolin-1 in cancer progression. Cancer Lett. 2008;268:187-201. [PubMed] [DOI] |
| 13. | Zhao X, Yang W, Shi C, Ma W, Liu J, Wang Y, Jiang G. The G1 phase arrest and apoptosis by intrinsic pathway induced by valproic acid inhibit proliferation of BGC-823 gastric carcinoma cells. Tumour Biol. 2011;32:335-346. [PubMed] [DOI] |
| 14. | Singh AK, Swarnalatha M, Kumar V. c-ETS1 facilitates G1/S-phase transition by up-regulating cyclin E and CDK2 genes and cooperates with hepatitis B virus X protein for their deregulation. J Biol Chem. 2011;286:21961-21970. [PubMed] [DOI] |
| 15. | Zhang YY, Xu ZN, Wang JX, Wei DM, Pan XL. G1/S-specific cyclin-D1 might be a prognostic biomarker for patients with laryngeal squamous cell carcinoma. Asian Pac J Cancer Prev. 2012;13:2133-2137. [PubMed] |