修回日期: 2013-09-06
接受日期: 2013-10-20
在线出版日期: 2013-11-18
目的: 研究3D技术指导下个体化肝静脉分型, 改变传统肝段切除肿瘤的方法为个体化、数字化切除.
方法: 收集50例因肝癌住院患者术前64排螺旋CT数据, 运用三维重建软件进行肝脏三维重建, 观察重建后的肝静脉的变异情况并对其分型, 指导肝癌个体化切除.
结果: 肝静脉总体分型: A型: 54.0%(27/50), B型: 46.0%(23/50). 肝右静脉分型: A型: 72.0%(36/50), B型: 20.0%(10/50), C型: 4.0%(2/50), D型: 4.0%(2/50). 肝右静脉亚型: Ⅰ型: 34.0%(17/50), Ⅱ型: 56.0%(28/50), Ⅲ型: 6.0%(3/50), Ⅳ型: 8.0%(4/50). 肝中静脉分型: A型: 78.0%(39/50), B型: 20.0%(10/50), C型: 2.0%(1/50). 肝左静脉分型: A型: 82.0%(41/50), B型18.0%(9/50).
结论: 通过对肝静脉三维成像, 对肝静脉的变异进行分型, 对于肝脏手术中可保留更多正常肝组织, 减少术后并发症的发生.
核心提示: 肝静脉是肝脏重要的回流通路, 手术保证肝静脉通畅是公认的减少术后肝功能不全发生的有效措施之一. 对于肝静脉类型的研究无论在基础和临床肝癌手术中均有重要意义.
引文著录: 陈铁军, 唐云强, 唐辉, 江鹏. 3D技术指导下个体化肝静脉分型及其在肝脏肿瘤切除中的应用. 世界华人消化杂志 2013; 21(32): 3479-3485
Revised: September 6, 2013
Accepted: October 20, 2013
Published online: November 18, 2013
AIM: To conduct 3D imaging-guided individualized typing of hepatic veins to provide a basis for digitalized liver segment resection.
METHODS: Fifty hospitalized liver cancer patients who underwent 64-row spiral CT preoperatively were included. 3D reconstruction of the liver was performed to observe the variation of reconstructed hepatic veins and typing them.
RESULTS: Hepatic veins were overall classified into two types: A (27/50, 54%) and B (23/50, 46%). The right hepatic vein were classified into four types: A: (36/50, 72%), B (10/50, 20%), C (2/50, 4%), and D (2/50, 4%). The right hepatic vein was classified into four subtypes: I (17/50, 34%), II (28/50, 56%), III (3/50, 6%), and IV (4/50, 8%). The middle hepatic vein was classified into three types: A (39/50, 78%), B (10/50, 20%), and C (1/50, 2%). The left hepatic vein was classified into two types: A (41/50, 82%) and B (9/50, 18%).
CONCLUSION: 3D imaging-guided individualized hepatic vein typing can help retain more normal liver tissue and reduce the occurrence of postoperative complications in liver surgery.
- Citation: Chen TJ, Tang YQ, Tang H, Jiang P. 3D imaging-guided individualized hepatic vein typing: Application to liver tumor resection. Shijie Huaren Xiaohua Zazhi 2013; 21(32): 3479-3485
- URL: https://www.wjgnet.com/1009-3079/full/v21/i32/3479.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i32.3479
在肝肿瘤完整切除的前提下, 保留尽量多的正常肝组织, 一直是肝胆外科医生追求的目标. 有资料表明肝脏切除范围越大、出血量越多、手术时间越长对术后肝功能的损害越明显. 肝切除率与肝脏再生能力呈负相关, 而与术后肝功损害呈正相关[1]. 肝静脉是肝血液的流出道, 一旦发生阻塞, 相应出现肝淤血、肝肿大等改变, 继而影响肝功能. 避免肝静脉流出道梗阻, 保证足够的静脉引流是减少术后肝功能不全的有效措施之一. 术中通常会切除病变部位周围部分正常的肝组织, 以防术后这部分正常肝组织淤血、坏死. 肝硬化的患者, 为防止术后肝衰竭, 需要尽可能多保留周围正常的肝组织, 以防止残余肝脏储备功能不足, 但扩大切除范围又加大了肝脏衰竭的风险. 因此, 术前掌握患者 肝静脉走行对手术方案的制订、最大限度保留正常肝组织、减少并发症有重要意义. 本研究采用基于64排螺旋计算机断层扫描(computed tomography, CT)数据进行三维重建, 观察重建后的肝静脉的变异情况并对其分型, 为肝脏肿瘤切除提供解剖学依据.
选取2011-01-01/2012-01-01于广州医科大学附属肿瘤医院行上腹部64排螺旋CT增强扫描并确诊肝癌的50例患者的CT图像数据(所有患者均签订知情同意书, 经广州医科大学医学伦理委员会批准, 符合医疗护理操作常规). 入选标准: 其中男42例, 女8例, 年龄20-78岁, 平均52岁. 肝硬化Child-Pugh分级A-B级、肿瘤直径5-12 cm不等、肿瘤数目为1个的患者30例, 2-3个的患者12例, 3个以上的8例. 包膜完整21例. 肿瘤位于肝左叶者17例, 位于肝右叶者33例, 原发性肝癌患者40例, 转移性肝癌患者10例. 预计生存期超过3 mo. 血常规、肾功能、心电图正常或接近正常, 部分病例临床有乏力、食欲不振、消化不良、恶心、呕吐等不适, 部分病例有黄疸、消化道出血病史, 实验室检测指标提示转氨酶升高或不升高、胆红素升高或无变化、乙型肝炎、或者丙型肝炎表面抗原阳性或阴性, 或者有长期饮酒史, B超、CT检查提示"肝脏占位". 肝内血管显示良好者为研究对象. 剔除标准: 有X线检查禁忌证、对造影剂过敏者, CT检查肝内血管显示不良者.
CT数据收集及研究设备、影像学扫描参数、数据采集方法详见参考文献[2-4]. 图像三维重建: 将数据导入个人计算机, 利用DICOM图片查看器将原始数据的格式转化为JPG格式; 利用ACDSee5.0软件调整图片大小并转换为24位深度BMP格式; 导入三维系统进行程序分割重建, 并输出后缀为STL的格式文件; 将STL模型导入到FreeForm Modeling System进行去噪、平滑、配色等处理后即可显示重建肝静脉模型. 观测肝静脉和其主要分支, 对肝静脉变异进行分型统计.
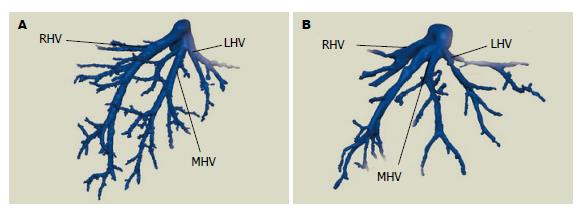
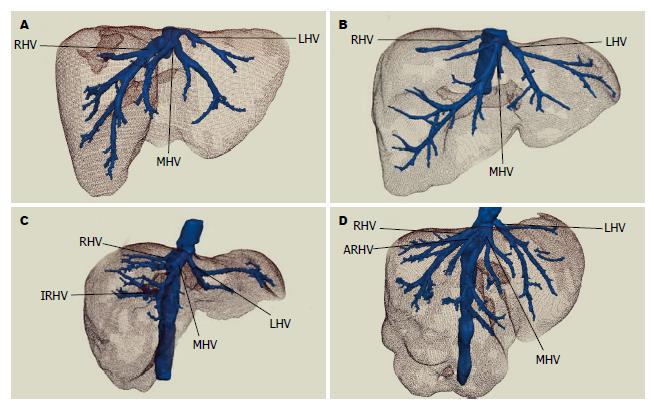
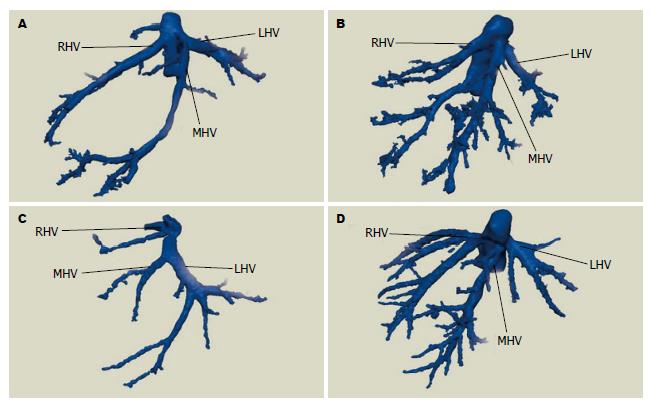
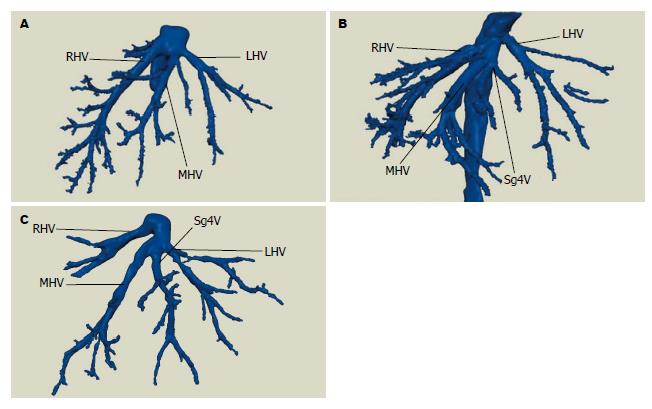
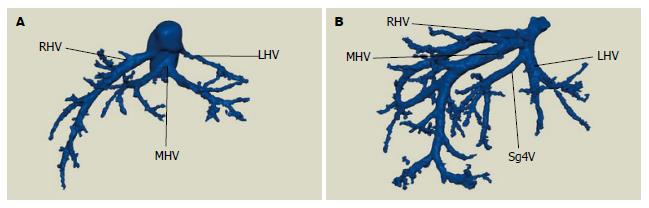
50例患者术中肝静脉走行情况与术前三维重建情况一致, 均行手术肝癌切除, 手术过程顺利, 术后恢复好出院. 结合肝静脉显示情况, 提出个体化肝静脉分型方法: 总体变异与分型(图1): A型: 左、中、右三支肝静脉分别单独汇入下腔静脉; B型: 肝左静脉(left hepatic veins, LHV)和肝中静脉(middle hepatic vein, MHV)合成短干后再汇入下腔静脉. 肝右静脉变异与分型(图2): A型: 此型最常见, 是一个主干和若干小分支; B型: 肝右静脉为一短干, 伴有粗大的肝中静脉起代偿作用; C型: 细小的肝右静脉伴有一较粗大的直接汇入下腔静脉的右后下静脉(inferior right hepatic veins, IRHV); D型: 细小的肝右静脉伴有一支细小的直接注入下腔静脉的副肝右静脉(accessory right hepatic vein, ARHV). 肝右静脉属支变异与肝右静脉的亚型(图3): 主要观察肝右静脉是否在根部即开始分支及分支的数目: Ⅰ型: 肝右静脉在早期根部无大的分支, 仅有一个主干注入下腔静脉; Ⅱ型: 肝右静脉为一个主干, 并在早期分成两个粗细差异不大属支; Ⅲ型: 肝右静脉在下腔静脉根部分成两个粗细差异不大属支; Ⅳ型: 肝右静脉在下腔静脉根部分成两个粗细差异不大属支, 其中一个属支再分成两个粗细差异不大分支. 肝中静脉变异与分型(图4): A型: 此型最常见, 肝中静脉仅有一个主干和若干小分支; B型: 出现汇入肝中静脉的Ⅳ段静脉; C型: 出现直接汇入下腔静脉的Ⅳ段静脉. 肝左静脉变异与分型(图5): A型: 此型最常见, 为肝左静脉仅有一个主干和若干小分支; B型: 出现汇入肝左静脉的4段静脉. 按上述的分型方法, 本次研究的50例肝脏肿瘤肝静脉变异及分型结果如下: 总体分型: A型: 54.0%(27/50), B型: 46.0%(23/50). 肝右静脉分型: A型: 72.0%(36/50), B型: 20.0%(10/50), C型: 4.0%(2/50), D型: 4.0%(2/50). 肝右静脉亚型: Ⅰ型: 34.0%(17/50),Ⅱ型: 56.0%(28/50), Ⅲ型: 6.0%(3/50), Ⅳ型: 8.0%(4/50). 肝中静脉分型: A型: 78.0%(39/50), B型: 20.0%(10/50), C型: 2.0%(1/50). 肝左静脉分型: A型: 82.0%(41/50), B型18.0%(9/50).
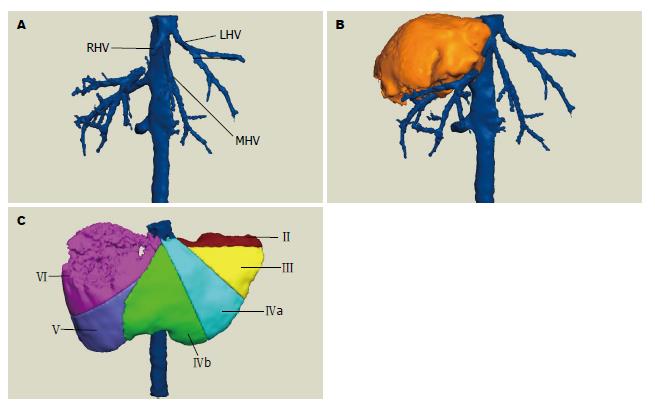
下面举例说明肝静脉个体化分型的临床应用: 病例1, 患者张某, 术前三维重建显示肝中静脉早期分成大小差异不大的两支(图6A), 且肝右静脉被肿瘤组织侵犯(图6B), 难以按Couinaud 法将肝脏分段. 根据肝静脉变异和肿瘤位置、大小形态等决定个体化分段方式(图6C).
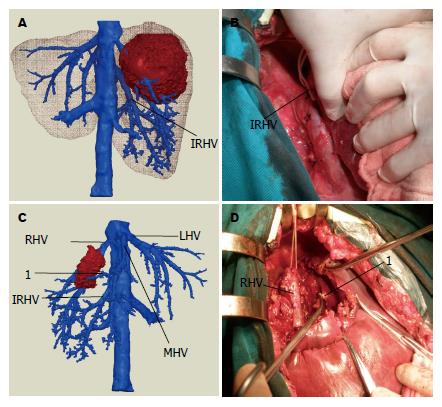
病例2, 患者林某, 肿瘤位于肝脏Ⅶ、Ⅷ段, 存在优势的肝右后下静脉, 可以供应Ⅵ段肝脏(图7A), 在肝肿瘤切除时, 行保留Ⅵ段的精准肝癌切除是可行的. 肝中静脉分出优势的Ⅷ段肝静脉血管(图7C), 在钳夹主肝静脉时, 也要注意钳夹Ⅷ段肝静脉血管(图7D), 钳夹肝右后下静脉(图7B), 减少术中出血和防止癌细胞转移. 减轻肝功损害程度, 改善预后.
病例3, 患者王某, 术前三维重建显示肿瘤切除前的肝静脉变异: 存在汇入肝中静脉的Ⅳ段静脉(图8A), 右半肝切除时可切除肝中静脉, 三维重建显示肿瘤切除后Ⅳ段静脉可较好地回流肝Ⅳ段血液(图8B).
在肝胆外科手术中, 肝脏的血液回流是制约肝脏手术的重要因素. 多少年来外科医生一直期望在术前就能对肝脏内部血管的走行及其与肝内病灶的关系有直观的了解. 肝脏内管道复杂, 最早关于肝静脉的研究来源于尸体解剖学和肝脏铸型标本的观察研究[5,6], 解剖学研究受限于尸体来源困难, 铸型标本则很难任意多角度立体观察. 随着技术进步, B超、DSA、CT、MR等影像设备的应用逐步加入肝静脉的研究中[7-12]. 与其他检查方法比较彩色多普勒超声存在一定的假阳性和假阴性率, 数字减影是有创的检查方法, 有一定的并发症发生率和死亡率. MR可以成功地显示肝动脉, 但是采集门静脉和肝静脉的信号时时相已经滞后, 对比剂开始廓清, 降低了门静脉和肝静脉的强化程度[13].
肝脏肿瘤患者往往合并有肝硬化等, 增加了术后诱发肝衰的风险. 因此, 对肝静脉的走形特点进行归纳总结非常重要. 对肝静脉进行分型、在复杂手术中使用合理的肝静脉阻断技术, 在术中最大限度地保留正常肝组织, 是肝脏外科一个研究热点[14-16]. 根据肝静脉汇入下腔静脉的方式进行分型是肝静脉分型的标准[17], 现已有运用CT和三维成像研究活体肝移植中肝静脉的报导[18].
1957年Couinaud[19]以Glisson系统在肝内分布为基础提出Couinaud分段法, 并逐渐在亚洲和欧洲普及, 依据功能解剖学将肝脏分为8个独立段, 该分段方法以肝裂和门静脉及肝静脉在肝内分布为基础, 肝右静脉将肝脏分为右前段和右后段, 肝中静脉将肝脏分为左半叶和半右叶(或者说右半肝和左半肝)此面从下腔静脉到胆囊窝通过, 肝左静脉将肝左叶分为内侧段和外侧段. 门静脉将肝脏分为上、下段, 左、右门静脉发出上、下分支分别进入每段的中心. 每个肝段分别用罗马数字Ⅰ-Ⅷ标记, Ⅰ段: 尾状叶; Ⅱ段: 左外叶上段; Ⅲ段: 左外叶下段; Ⅳ段: 左内叶(Bismuth分类法第4段又分为4a和4b段); Ⅴ段: 右前叶下段; Ⅵ段: 右后叶下段; Ⅶ段: 右后叶上段; Ⅷ段: 右前叶上段, 段的编号依据顺时针进行, Couinaud分段法按顺时针方向将各段编号, 该分段方法实用性强, 每个肝段有独立的流入和流出血管以及胆管系统, 对于CT影像诊断, 外科手术, 有着比较实用的意义和广泛应用, 在活体肝移植中也有重要的应用价值[20]. 尽管Couinaud法描述肝脏解剖在临床上实用性很强, 但其对肝叶和肝段的划分存在着缺陷. 比如说右前叶与右后叶本是前后关系, Couinaud认为是内外关系, 段Ⅶ与段Ⅵ本是上下关系, Couinaud认为是前后关系等[21]. 这是因为Couinaud法描述肝脏解剖是居于离体肝脏血管铸型的研究结果,由于肝脏血管壁的塌陷, 肝脏本身立体结构和空间构象的改变, Couinand法确定的肝脏管道, 肝中间裂、右纵裂、右叶间裂等与活体肝的实际解剖情况不尽相符[22,23], Couinaud法并不完全精确[24,25]. 因此, 临床实践中不能完全按照该方法划分肝脏以对肝脏肿瘤进行定位.
21世纪手术的"精准性"变得越来越重要, 复杂肝切除手术中肝静脉解剖和肝静脉淤血的个体化评估是提高肝切除"精准性"的重要一环[26]. 肝静脉研究涉及的另外一个重要领域为肝移植, 由于不完全的肝内静脉流出系统所致静脉淤血是活体肝移植术后影响肝功能的重要因素, 为避免其发生, 需要在术前详细了解肝静脉解剖及变异, 并据此制定详细的手术计划, 以保证流出道的通畅[27,28]. 而在肝移植中对于肝中静脉解剖变异的认识, 将有助于对肝移植中切取供肝体积的判断、切口定位和切剖面的选择及供、受体肝静脉的重建[29].
一般情况下肝右静脉引流了大部分Ⅵ、Ⅶ段的肝脏血流, 单纯进行肝脏Ⅶ段的切除会造成Ⅵ段回流障碍, 故肝脏肿瘤切除通常将Ⅵ、Ⅶ段同时切除. 当存在肝右后下静脉的变异时, 肝右静脉可能仅引流肝Ⅶ段的全部, Ⅵ段和Ⅷ段的一部分, 结扎肝右静脉不会导致肝Ⅵ段的静脉淤血, 故当这些变异时, 可行单独切除Ⅶ段而保留Ⅵ段的右后叶次全切. 刑雪等[30]通过保留IRHV从而保存了肝右后叶下段, 并在此基础上提出了4种新的切除RHV而保留IRHV的肝切除方法, 可避免肝功能急性衰竭. 对于存在汇入肝中静脉的Ⅳ段静脉, 右半肝切除时可切除肝中静脉而不影响Ⅳ段肝脏的代偿.
由于肝脏切除率与肝脏再生能力呈负相关, 而与术后肝功损害呈正相关. 掌握肝脏肿瘤肝静脉的变异与分型能保留一些常规手术被连带切除的肝组织. 术前通过对每个肝脏肿瘤患者进行重建, 可以发现一般影像学难以发现的变异肝静脉, 增强对肝脏肿瘤切除术后并发症的预防能力.
肝脏部分切除术后由于肝静脉引流肝脏血液不畅而引发的严重后果被证明后人们才逐渐对肝静脉引流的重要性有所认识. 保证维持足够的静脉引流是公认的减少术后肝功能不全发生的有效措施之一. 因此, 术前对患者肝静脉个体化变异情况的了解对手术方案的制订、最大限度保留正常肝组织、减少术后并发症的发生有重要意义.
王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科); 徐迅迪, 教授, 中南大学湘雅二医院肝胆胰外科; 汤朝晖, 副主任医师, 上海交大医学院附属新华医院普外科
运用三维重建系统对肝脏肿瘤患者肝脏行三维重建, 从而指导肝脏肿瘤的诊断和手术规划, 改进了肝脏肿瘤疾病的传统诊断方式, 对肝内管道系统的进一步研究使我们在手术规划时能将更多正常肝组织保留, 减少术后并发症的发生, 具有显著的临床实用价值.
目前三维重建技术已经广泛应用于整形外科、骨科、腹部外科、肝移植科等多学科研究, 三维重建的图像直观、立体、形象, 在临床疾病诊治中发挥着重要的作用.
通过三维重建研究肝静脉走行、分型及对肝肿瘤切除行规划目前国内文献相关报道较少.
三维重建应用于术前手术方式选择及手术风险评估, 还可以应用于教学.
本文比较新颖, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 2. | 范 应方, 方 驰华, 项 楠, 陈 建新. 数字化微创技术在肝胆管结石诊治中的应用研究. 中国普外基础与临床杂志. 2011;18:688-693. |
| 8. | Atri M, Bret PM, Fraser-Hill MA. Intrahepatic portal venous variations: prevalence with US. Radiology. 1992;184:157-158. [PubMed] |
| 9. | Sahani D, Mehta A, Blake M, Prasad S, Harris G, Saini S. Preoperative hepatic vascular evaluation with CT and MR angiography: implications for surgery. Radiographics. 2004;24:1367-1380. [PubMed] [DOI] |
| 11. | 唐 敏, 杨 尚文, 马 一鸣, 栾 炜, 何 健, 朱 斌. 64排螺旋CT扫描数据基础上的门静脉和肝静脉三维解读及其解剖变异分析. 中国临床医学影像杂志. 2013;24:338-340. |
| 12. | 伍 兵, 孙 家瑜, 夏 春潮, 李 昌宪. 非对比剂增强的磁共振血管成像技术对肝静脉显示的初步评价. 四川大学学报(医学版). 2011;42:387-391. |
| 13. | 姜 滨. 多层螺旋CT对肝静脉的影像学评价. 国外医学临床放射学分册. 2006;29:40-44. |
| 14. | 汪 珍光, 周 伟平, 傅 思源, 潘 泽亚, 杨 远, 章 琎, 刘 辉, 孙 汉勇, 吴 孟超. 肝腔静脉结合部解剖及其在肝静脉阻断术中的应用. 中国实用外科杂志. 2011;31:1058-1059. |
| 18. | Orguc S, Tercan M, Bozoklar A, Akyildiz M, Gurgan U, Celebi A, Nart D, Karasu Z, Icoz G, Zeytunlu M. Variations of hepatic veins: helical computerized tomography experience in 100 consecutive living liver donors with emphasis on right lobe. Transplant Proc. 2004;36:2727-2732. [PubMed] [DOI] |
| 19. | Couinaud C. LeFoie: Etudes Anatomiques et Chirurgicales. Paris: Masson & Cie 1957; 284-289. |
| 22. | Ohashi I, Ina H, Okada Y, Yoshida T, Gomi N, Himeno Y, Hanafusa K, Shibuya H. Segmental anatomy of the liver under the right diaphragmatic dome: evaluation with axial CT. Radiology. 1996;200:779-783. [PubMed] |
| 24. | Thompson EC, Grier JF, Gholson CF, McDonald JC. A critical review of the Couinaud technique of hepatic resection. Arch Surg. 1995;130:553-559. [PubMed] [DOI] |