修回日期: 2013-09-15
接受日期: 2013-10-20
在线出版日期: 2013-11-08
目的: 研究分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)基因启动子区与食管鳞癌的相关性.
方法: 选取食管鳞癌(esophageal squamous cell carcinoma, ESCC)患者22例为实验组, 另同期选取食管良性病变者22例为对照组, 提取术前外周血DNA, 利用甲基化特异性PCR法(MSP)检测SFRP1基因启动子区域甲基化状态, 并分析其与临床病理参数的相关性.
结果: 在22例食管鳞癌患者中其甲基化阳性例数为8例, 甲基化阳性率为36.4%, 在22例食管良性病变者中其甲基化阳性例数为2例, 甲基化阳性率为9.1%(P<0.05). SFRP1基因甲基化与患者临床病理参数及癌胚抗原(carcino-embryonic antigen, CEA)水平无相关性(P>0.05).
结论: 血清SFRP1基因启动子区异常甲基化可能参与食管鳞癌的发生, 有望成为食管鳞癌临床诊断的新型辅助指标.
核心提示: 本文研究了血浆中Wnt通路拮抗因子分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)基因甲基化与食管鳞癌(esophageal squamous cell carcinoma, ESCC)的相关性, 对进一步指导早期筛查ESCC和研发新型抗肿瘤药物提供了一个新的靶向.
引文著录: 刘畅, 李楠, 陆恒, 吴琳, 袁柏思, 汪芳裕. 分泌型卷曲相关蛋白1基因异常甲基化对食管鳞癌的影响. 世界华人消化杂志 2013; 21(31): 3400-3404
Revised: September 15, 2013
Accepted: October 20, 2013
Published online: November 8, 2013
AIM: To study the correlation between secreted frizzled-related protein 1 (SFRP1) gene promoter hypermethylation and clinicopathological features of esophageal squamous cell carcinoma (ESCC).
METHODS: Twenty-two patients with ESCC and 22 patients with benign esophageal diseases were included in this study. DNA was extracted from peripheral blood. Promoter methylation status of the SFRP1 gene was determined by methylation-specific polymerase chain reaction (MSP), and its correlation with clinicopathological parameters of ESCC was analyzed.
RESULTS: The positive rate of SFRP1 gene promoter methylation was significantly higher in ESCC patients than in controls (36.4% vs 9.1%, P < 0.05). SFRP1 gene hypermethylation was not correlated with clinicopathological parameters or carcino-embryonic antigen levels in ESCC patients (all P > 0.05).
CONCLUSION: SFRP1 gene promoter hypermethylation may be involved in the occurrence of ESCC, and SFRP1 may be used as a new marker for ESCC.
- Citation: Liu C, Li N, Lu H, Wu L, Yuan BS, Wang FY. Clinical significance of secreted frizzled-related protein 1 gene promoter hypermethylation in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(31): 3400-3404
- URL: https://www.wjgnet.com/1009-3079/full/v21/i31/3400.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i31.3400
食管鳞癌(esophageal squamous cell carcinoma, ESCC)是我国常见恶性肿瘤, 临床上早期症状不典型, 患者确诊时多属中晚期. 目前, ESCC早期诊断主要依靠内镜检查, 寻找一种更为便捷且敏感的血清肿瘤标志物显得尤为迫切. Wnt/β-catenin信号转导通路是调控细胞增殖生长的重要途径之一, 该通路的异常激活参与人类多种肿瘤的发生. 分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)作为新近发现的Wnt/β-catenin信号转导通路的拮抗剂, 其表达下调可减弱对通路的抑制作用从而使得通路异常活化, 促进肿瘤的发生发展[1]. 研究显示, SFRP1基因启动子区5'端CpG岛高甲基化可能是其表达下调的重要机制[2]. 本研究采用甲基化特异性PCR(MSP)技术, 检测ESCC患者外周血SFRP1基因启动子区甲基化状态, 探讨其在ESCC中的意义, 以期为ESCC患者的早期筛查工作提供新的辅助指标。
选取2012-04/2012-12在我科住院的22例ESCC患者术前血清标本作为实验组, 所有患者均经内镜下活检病理确诊为鳞癌, 并未行放疗和化疗. 同期选取食管良性病变(食管炎、息肉、腺瘤等)患者的血清标本作为对照组.
1.2.1 血清标本收集: 抽取清晨空腹静脉血5 mL, 促凝管收集, 3000 r/min, 离心10 min, 吸取上清液约2 mL, -80 ℃冰箱保存.
1.2.2 外周血DNA提取: 采用DNA抽提Kit试剂盒(AXYGEN公司)提取血清DNA, 紫外分光光度计测吸光度值, 确定其浓度与纯度. 提取的DNA于-20 ℃条件下保存备用.
1.2.3 甲基化修饰: 取1 μg DNA采用亚硫酸盐转化试剂盒(Sigma公司)进行硫化修饰. 经此步骤后单链DNA的未甲基化胞嘧啶转变为尿嘧啶, 而甲基化胞嘧啶则不能被修饰. 修饰好的DNA用于MSP或-20 ℃保存.
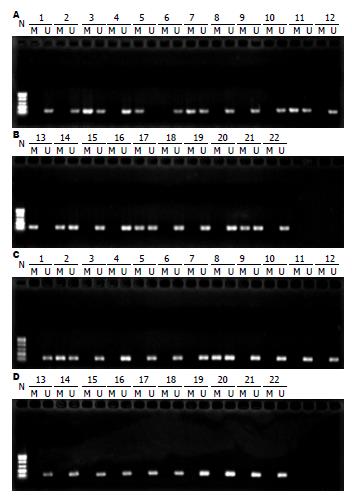
1.2.4 甲基化特异性PCR: MSP引物设计采用MethPrimer软件(网址为http://www.urogene.org/methprimer/), 根据在线软件设计结果与多个参考文献[3-5]比较, 最后采用来自多个参考文献的引物序列, SFRP1基因MSP甲基化上游引物: 5'-GTTTTCGGAGTTAGTGTCGCGC-3', 甲基化下游引物: 5'-ACGATCGAAAACGACGCGAACG-3'; 非甲基化上游引物: 5'-GTAGTTTTTGGAGTTAGTGTTGTGT-3', 非甲基化下游引物: 5'-ACCTACAATCAAAAACAACACAAACA-3', 由上海英骏生物技术有限公司合成. PCR反应体系为Gold 360 Master Mix 6.25 μL, DNA 模版3.25 μL, 上游引物P1 0.5 μL, 下游引物P2 0.5 μL, ddH2O 2.0 μL, 共12.5 μL. 反应条件: 94 ℃预变性2 min, 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸45 s, 共38个循环, 最后72 ℃延伸7 min. 取扩增产物行2%琼脂糖凝胶电泳(电压160 V, 电泳时间2 h), 凝胶成像系统拍照.
统计学处理 采用SPSS17.0统计学软件进行数据分析. 率的比较采用Pearson χ2检验, 当样本总例数<40时, 采用Fisher确切概率法, 以双侧P<0.05为差异有统计学意义.
实验组SFRP1基因甲基化阳性例数为8例, 甲基化检出率为36.4%, 而对照组只有2例发生甲基化, 检出率为9.1%, 两者差异有统计学意义(P = 0.031, 图1).
血清SFRP1基因启动子区高甲基化与ESCC患者的年龄、性别、分化程度、浸润深度、淋巴结转移、TNM分期及血清CEA水平均无相关性(P>0.05, 表1).
| 临床病理参数 | n | SFRP1基因甲基化状态 | 甲基化率(%) | χ2值 | P值 | |
| M | U | |||||
| 年龄(岁) | 0.909 | 0.342 | ||||
| <60 | 8 | 3 | 5 | 37.5 | ||
| ≥60 | 14 | 5 | 9 | 35.7 | ||
| 性别 | 1.989 | 0.158 | ||||
| 男 | 18 | 7 | 11 | 38.9 | ||
| 女 | 4 | 1 | 3 | 25.0 | ||
| 分化程度 | 0.263 | 0.608 | ||||
| 高/中分化 | 16 | 6 | 10 | 37.5 | ||
| 低/未分化 | 6 | 2 | 4 | 33.3 | ||
| 浸润深度 | 0.133 | 0.715 | ||||
| 未及外膜 | 4 | 1 | 3 | 25.0 | ||
| 侵及外膜 | 18 | 7 | 11 | 38.9 | ||
| 淋巴结转移 | 2.134 | 0.148 | ||||
| 有 | 8 | 2 | 6 | 25.0 | ||
| 无 | 14 | 6 | 8 | 42.9 | ||
| TNM分期 | 2.476 | 0.116 | ||||
| Ⅰ/Ⅱ期 | 10 | 4 | 6 | 40.0 | ||
| Ⅱ/Ⅲ期 | 12 | 4 | 8 | 33.3 | ||
| CEA(ng/mL) | 1.686 | 0.198 | ||||
| >9.7 | 3 | 2 | 1 | 66.7 | ||
| <9.7 | 19 | 6 | 13 | 31.6 | ||
Wnt细胞信号转导通路调控着细胞增殖、分化、凋亡等诸多生命过程, 该通路的异常激活与人类多种肿瘤的发生发展密切相关[6,7]. Wnt蛋白在胞膜上与一种卷曲蛋白(frizzled, Frz)的7次跨膜受体相结合是Wnt信号转导通路活化的重要起始信号. 定位于染色体8p12-11.1[8]上的SFRPs属分泌型糖蛋白家族, 由SFRP基因编码, 有300个氨基酸残基, 包括一个同源的N2末端半胱氨酸富集区和一个C2末端[9], 结构上与Frz受体极为相似, 具有同源配体抑制区, 通过竞争性抑制Frz受体而抑制Wnt信号的表达[10]. 其中SFRP1由定位于8p11.2的SFRP1基因编码, 该位点在多种肿瘤中存在缺失现象, SFRP1基因作为Wnt信号拮抗剂, 发挥着抑癌基因的功能. 马传香等[11]检测了60例ESCC组织中SFRP1的表达, 结果阳性表达率为25.0%, 显著低于癌旁正常组织, 并且SFRP1的表达与临床病理因素无相关性, 提示SFRP1在ESCC的发生发展中起一定作用. Liu等[12]对81例ESCC患者血浆中SFRP1启动子区甲基化状态的检测及分析其与术后2年肿瘤复发率关系的研究表明, SFRP1高甲基化状态与ESCC术后复发风险呈显著相关性, 提示血浆中SFRP1启动子区高甲基化状态可作为肿瘤的一个非侵袭性生物预测标记.
响基因转录活性而不涉及改变DNA序列的基因表达调控称为表观遗传调控, DNA甲基化是表观遗传调控的常见方式, 高甲基化将导致抑癌基因表达下调甚至基因沉默, 从而促进肿瘤的发生发展. DNA甲基化在恶性肿瘤的诊断、化疗疗效预测和疾病预后评估等方面的应用已引起广泛重视, 发生DNA甲基化的肿瘤比基因突变、遗传性损伤所致的肿瘤更容易纠正, 经去甲基化治疗恢复抑癌基因的表达状态, 继而达到抑制肿瘤发生发展的目的, 这已被认为是极有潜力的肿瘤基因治疗的新手段[13].
肿瘤患者外周血中循环DNA含量远高于正常人, 且循环DNA具有肿瘤特征性的基因改变, 可作为恶性肿瘤的诊断和监测指标[14]. 因DNA甲基化状态的变化常发生在遗传学改变之前[15], 故早期检测到抑癌基因启动子区域(CpG岛)甲基化状态变化可作为肿瘤发生初期的一个重要依据. 本研究应用MSP法检测了ESCC患者术前血清标本和对照的食管良性疾病血清标本中SFRP1基因CpG岛甲基化状态, 结果显示, ESCC组SFRP1基因甲基化率显著高于食管良性疾病组(P<0.05), 这种基因的高甲基化状态可能导致基因沉默, 使得SFRP1的表达下调或缺失, 其拮抗Wnt通路的功能降低. 同时, 本研究发现SFRP1基因甲基化状态与患者临床病理参数之间无相关性(P>0.05), 提示SFRP1的高甲基化状态在ESCC的发生和恶性表型的维持中起一定作用. 然而, 本研究所取样本例数偏少, 且未对SFRP1及Wnt家族中的成员如Wnt-1等的表达情况进行检测, 尚缺乏足够证据指明SFRP1在ESCC发生发展中的规律. 但本研究仍从表观遗传机制角度显示出SFRP1这种抑癌基因的表观遗传学失活可能是ESCC发生的早期事件之一.
总之, 血清SFRP1基因启动子区异常甲基化可能参与ESCC的发生发展, 并为疾病的早期监测提供可能的分子理论依据, 有望成为ESCC临床诊断的新型辅助指标.
随着表观遗传学的研究发展, 越来越多的证据表明DNA异常甲基化与食管鳞癌(esophageal squamous cell carcinoma, ESCC)发生发展关系密切.
喻春钊, 教授, 主任医师, 南京医科大学第二附属医院普通外科九区
ESCC早期临床症状不典型, 敏感的血清肿瘤分子标志物缺乏, 寻找一种较为便捷且敏感的血清肿瘤标志物有望为患者的早期监测及预后带来新的希望.
Liu等研究表明, SFRP1基因异常甲基化状态与ESCC术后复发风险呈显著相关性, 血浆中SFRP1启动子区高甲基化状态可作为肿瘤的一个非侵袭性生物预测标记.
本文设计合理, 内容清晰, 数据充实, 结论可信, 有利于对ESCC的表观遗传学机制有更深入的认识, 对ESCC的早期监测及靶向治疗有一定的指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Yamamoto H. [Regulation of Wnt signaling pathway and its relationship with tumorigenesis]. Seikagaku. 2008;80:1079-1093. [PubMed] |
| 2. | Fukui T, Kondo M, Ito G, Maeda O, Sato N, Yoshioka H, Yokoi K, Ueda Y, Shimokata K, Sekido Y. Transcriptional silencing of secreted frizzled related protein 1 (SFRP 1) by promoter hypermethylation in non-small-cell lung cancer. Oncogene. 2005;24:6323-6327. [PubMed] [DOI] |
| 3. | Veeck J, Niederacher D, An H, Klopocki E, Wiesmann F, Betz B, Galm O, Camara O, Dürst M, Kristiansen G. Aberrant methylation of the Wnt antagonist SFRP1 in breast cancer is associated with unfavourable prognosis. Oncogene. 2006;25:3479-3488. [PubMed] [DOI] |
| 4. | Urakami S, Shiina H, Enokida H, Kawakami T, Kawamoto K, Hirata H, Tanaka Y, Kikuno N, Nakagawa M, Igawa M. Combination analysis of hypermethylated Wnt-antagonist family genes as a novel epigenetic biomarker panel for bladder cancer detection. Clin Cancer Res. 2006;12:2109-2116. [PubMed] [DOI] |
| 5. | 董 稚明, 王 馥丽, 靳 国梁, 郭 炜, 郭 艳丽, 王 士杰. Wnt拮抗基因SFRP1、SFRP2启动子区甲基化与贲门腺癌关系的研究. 肿瘤研究与临床. 2009;21:799-802. |
| 8. | Stoehr R, Wissmann C, Suzuki H, Knuechel R, Krieg RC, Klopocki E, Dahl E, Wild P, Blaszyk H, Sauter G. Deletions of chromosome 8p and loss of sFRP1 expression are progression markers of papillary bladder cancer. Lab Invest. 2004;84:465-478. [PubMed] [DOI] |
| 9. | Hsieh M, Mulders SM, Friis RR, Dharmarajan A, Richards JS. Expression and localization of secreted frizzled-related protein-4 in the rodent ovary: evidence for selective up-regulation in luteinized granulosa cells. Endocrinology. 2003;144:4597-4606. [PubMed] [DOI] |
| 10. | Enomoto-Iwamoto M, Kitagaki J, Koyama E, Tamamura Y, Wu C, Kanatani N, Koike T, Okada H, Komori T, Yoneda T. The Wnt antagonist Frzb-1 regulates chondrocyte maturation and long bone development during limb skeletogenesis. Dev Biol. 2002;251:142-156. [PubMed] [DOI] |
| 12. | Liu JB, Qiang FL, Dong J, Cai J, Zhou SH, Shi MX, Chen KP, Hu ZB. Plasma DNA methylation of Wnt antagonists predicts recurrence of esophageal squamous cell carcinoma. World J Gastroenterol. 2011;17:4917-4921. [PubMed] [DOI] |
| 13. | Dehan P, Kustermans G, Guenin S, Horion J, Boniver J, Delvenne P. DNA methylation and cancer diagnosis: new methods and applications. Expert Rev Mol Diagn. 2009;9:651-657. [PubMed] [DOI] |
| 14. | Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001;61:1659-1665. [PubMed] |
| 15. | Kim HC, Roh SA, Ga IH, Kim JS, Yu CS, Kim JC. CpG island methylation as an early event during adenoma progression in carcinogenesis of sporadic colorectal cancer. J Gastroenterol Hepatol. 2005;20:1920-1926. [PubMed] [DOI] |