修回日期: 2013-09-02
接受日期: 2013-09-30
在线出版日期: 2013-11-08
目的: 探讨建立功能性慢性内脏痛的不同造模方式及造成的功能性慢性内脏痛的性别差异; 观察功能性慢性内脏痛大鼠下丘脑室旁核(paraventricular nucleus, PVN)内促肾上腺皮质激素释放激素受体1(corticotropin releasing hormone receptor 1, CRH R1)表达变化, 进而认识下丘脑PVN在功能性慢性内脏痛发生中的作用及机制, 为临床防治功能性慢性内脏痛提供理论依据.
方法: 将新生期SD大鼠随机分成雌雄对照组、雌雄母婴分离(neonatal maternal separation, NMS)组、雌雄直结肠扩张(colorectal distension, CRD)组, 每组10只, 成年后进行直结肠内扩张后, 采用腹壁撤离反射(abdominal withdrawal reflex, AWR)和电生理学方法评价其内脏痛觉敏感性; 采用HE染色检测结肠组织形态学变化; 采用Western blot、免疫荧光染色方法检测PVN内CRH R1及c-fos的表达变化. 将正常成年大鼠随机分为正常对照组、生理盐水组和利多卡因组, 每组6只, 通过PVN内微量注射利多卡因观察PVN在正常大鼠内脏痛觉调节中的作用.
结果: (1)大鼠新生期经历母婴分离、直结肠扩张, 成年后AWR评分、腹外斜肌放电幅度增高, 痛阈值下降, 结肠组织均未见明显病理改变, 其中NMS组在20 mmHg直结肠扩张时AWR评分和腹外斜肌放电幅度均比CRD组高(P<0.05, P<0.05); (2)各组大鼠雌雄AWR评分、痛阈值和腹外斜肌放电幅度差别不一致, 但大部分是没有性别差异的; (3)与正常对照组、生理盐水组相比, PVN内微量注射1%利多卡因后10、20、30 min在60 mmHg直结肠扩张时腹外斜肌放电是明显下降的(P<0.05). (4)NMS、CRD组与对照组比较, PVN内c-fos、CRH R1的表达增加(P<0.05, P<0.05).
结论: 早期生活应激会导致成年后功能性慢性内脏痛的发生, NMS导致的触诱发痛(allodynia)更明显, 但没有性别差异. PVN及其内的CRH R1参与大鼠早期生活应激引起的功能性慢性内脏痛的形成和维持.
核心提示: 早期生活应激会导致成年后功能性慢性内脏痛的发生, 母婴分离导致的触诱发痛更明显, 但没有性别差异. 下丘脑室旁核(paraventricular nucleus)及其内的促肾上腺皮质激素释放激素受体1(corticotropin releasing hormone receptor 1)参与大鼠早期生活应激引起的功能性慢性内脏痛的形成和维持.
引文著录: 赵小平, 喻乐, 陈自洋, 花嵘, 张咏梅. 大鼠早期生活应激对成年后功能性慢性内脏痛及下丘脑室旁核内CRH R1表达的影响. 世界华人消化杂志 2013; 21(31): 3344-3355
Revised: September 2, 2013
Accepted: September 30, 2013
Published online: November 8, 2013
AIM: To assess the effect of early-life stress on chronic functional visceral pain and expression of corticotropin releasing hormone receptor 1 (CRH R1) in the hypothalamic paraventricular nucleus (PVN) of rats with chronic functional visceral pain to provide a theoretical basis for the prevention and treatment of abdominal pain-related functional gastrointestinal disorders.
METHODS: Neonatal rats were randomly divided into six groups (n = 10), including a male control group, a female control group, a male separation group, a female separation group, a male distension group and a female distension group. HE staining was used to detect histologic changes in the colon tissue. Western blot and immunofluorescence were used to detect the changes in CRH R1 expression in the PVN. Brain tissue sections were immunostained for c-fos as a marker for activation of the PVN. Furthermore, normal male adult rats were randomly divided into three groups (normal control, saline and lidocaine, n = 6 for each group) to observe the role of PVN in the regulation of chronic functional visceral pain in normal rats by intra-PVN administration of lidocaine (1%, 0.3 µL).
RESULTS: Neonatal maternal separation (NMS) or colorectal distension (CRD) resulted in chronic visceral hypersensitivity without pathological changes in the colon tissue. There was no gender difference in the above change. Electrical discharge of the abdominal external oblique muscle in rats 10, 20, and 30 min after intra-PVN microinjection of 1% lidocaine was decreased significantly under the stimulation of CRD at 60 mmHg compared with normal controls and saline rats. The expression of CRH R1 and c-fos in the PVN of NMS and CRD rats increased compared with control rats.
CONCLUSION: Early-life stress can lead to chronic functional visceral pain in rats in adulthood. Allodynia caused by NMS is more obvious than that by CRD. The PVN and CRH R1 may be involved in the pathogenesis of chronic functional visceral pain caused by early-life stress.
- Citation: Zhao XP, Yu L, Chen ZY, Hua R, Zhang YM. Effect of early-life stress on chronic functional visceral pain and CRH R1 expression in the paraventricular nucleus in adult rats. Shijie Huaren Xiaohua Zazhi 2013; 21(31): 3344-3355
- URL: https://www.wjgnet.com/1009-3079/full/v21/i31/3344.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i31.3344
功能性腹痛综合征(functional abdominal pain syndrome, FAPS)也称为"慢性自发性腹痛"或"慢性功能性腹痛", 主要表现为慢性内脏痛, 且伴随一定程度的日常活动能力减退, 症状至少持续6 mo, 但结肠组织未见明显病理学变化[1]. 目前内脏痛觉过敏被认为是FAPS的主要发病机制之一[2,3], 但其确切的发病机制尚未阐明. 随着脑显像技术的不断发展, 越来越多的研究发现各种慢性疼痛疾病(包括肠易激综合征)患者与应激-觉醒环路相关的脑区灰质密度增高[4], 促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)-CRH R1信号系统是应激和觉醒环路中的一部分[5]. 前期临床资料显示, 应激有关的内脏痛觉过敏, 特别是在结肠水平, 主要是由脑内CRH-CRH R1信号系统激活导致[6-8]. CRH R1主要分布于中枢神经系统, 如下丘脑室旁核(paraventricular nucleus, PVN), 主要介导经典的CRH促进腺垂体促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)的释放作用, 参与应激反应及应激相关行为、自主神经反应、内脏传出调节等[6,9-15]. 新生期母婴分离(neonatal maternal separation, NMS)和新生期直结肠扩张(colorectal distension, CRD)是用于研究慢性内脏痛敏的两种常见动物模型. 对于这两种模型造成内脏痛觉过敏的不同及是否有性别差异尚未见报道. 本研究通过建立不同功能性慢性内脏痛模型探讨其造成内脏痛觉过敏的不同、是否有性别差异及观察功能性慢性内脏痛大鼠PVN内CRH R1表达变化, 加深对早期生活应激致成年后功能性慢性内脏痛形成机制的认识, 对临床采取积极有效的防治措施, 减少早期不良生活经历所造成的危害具有重要意义.
健康成年SD大鼠, 200-250 g, 雌雄各6只, 一雌一雄饲养在6个笼子里, 24 ℃±2 ℃室温, 12 h/12 h昼夜节律, 自由摄食摄水, 正常受孕, 其所生乳鼠作为实验对象. 本实验均遵从国际疼痛研究联合会相关指南, 以尽量减少实验动物数目及对实验动物的伤害为原则, 并经徐州医学院实验动物伦理委员会的许可. 人血管重建气囊20.0 mm×3.0 mm(美国); BL-420E+多道生理记录仪(成都泰盟仪器厂); 台式血压计(上海跃进医疗器械厂); 大鼠脑立体定位仪(日本); 微量进样器(上海); 苏木素伊红染色试剂盒(碧云天生物有限公司); 山羊源多克隆CRH R1抗体(美国Santa Cruz公司); 兔源多克隆c-fos抗体(美国Santa Cruz公司); 碱性磷酸酶标记抗山羊IgG(碧云天生物有限公司).
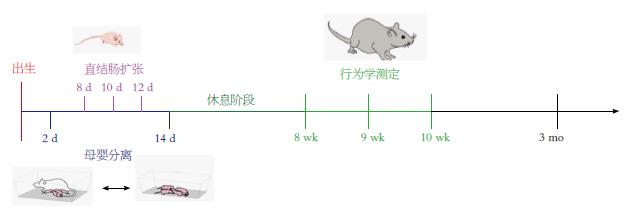
1.2.1 大鼠功能性慢性内脏痛模型的建立及实验分组: NMS模型参照文献[16,17], 自乳鼠出生后第2天至第14天, 每日上午9:00开始将乳鼠与母鼠分离3 h, 连续13 d. 新生期CRD模型参照文献[18,19], 在乳鼠出生后第8、10、12天, 每日9:00开始, 用棉签沾湿温水擦拭肛门后, 将人血管重建气囊插入乳鼠结直肠中, 以气囊完全进入肛门为准, 充气扩张维持l min后放气撤出, 待30 min以后再重复一遍上述操作, 每次扩张完后立即将幼鼠送到母鼠身边. 对照组不予任何处理. 第21天断奶, 第30天雌雄分笼饲养. 常规饲养到第8周即成年后, 进行内脏痛觉敏感性测定. 第12周处死大鼠, 留取结肠进行病理学检查, 留取脑组织进行免疫荧光和免疫组织化学检测. 具体时间流程如图1所示.
为研究不同性别、不同造模方式对大鼠功能性慢性内脏痛的影响, 将60只幼年SD大鼠随机分为6组(n = 10): 雄性对照组(male control, MC)、雌性对照组(female control, FC)、雄性分离组(male separation, MS)、雌性分离组(female separation, FS)、雄性扩张组(male distension, MD)、雌性扩张组(female distension, FD); 为证明PVN在内脏痛觉感受中的作用将♂SD大鼠(200-250 g)随机分为3组(n = 6): 正常对照组(control, C)、PVN内微量注射生理盐水组(nature saline, NS)、PVN内微量注射1%利多卡因组(lidocaine, LD).
1.2.2 内脏痛觉敏感性测定: 参照文献[18,20], (1)AWR评分: 大鼠于实验前18 h禁食, 自由饮水, 乙醚麻醉大鼠, 将涂有石蜡油的气囊插入大鼠结直肠内4.0 cm, 用胶布将肛门外导管固定于大鼠尾根部, 导管经三通连接注射器和血压计. 将大鼠放入有机玻璃观察箱内(20 cm×12 cm×9 cm)观察, 待大鼠苏醒并完全适应环境30 min后开始实验. 分别给予20、40、60、80 mmHg压力, 每次持续扩张20 s, 刺激间隔4 min, 每个压力均重复进行3次AWR评分. AWR评分采用单盲法, 评分标准: 0分: 无明显行为变化; 1分: 仅有简单的头部运动; 2分: 腹部肌肉开始收缩, 但未抬离桌面; 3分: 腹肌明显收缩变平或下腹壁抬离桌面; 4分: 腹壁拱起或伴身体、骨盆躬起; (2)痛阈测定: 实验前准备同AWR评分. 初始压力为10 mmHg, 每次依次递增10 mmHg, 保持10 s, 间隔4 min后重复加压, 直至大鼠达到AWR评分为3分时, 即出现明显的腹肌收缩变平或明显的下腹壁抬离箱底时的压力值即为大鼠的痛阈值, 注意扩张压力不超过80 mmHg. 重复进行5次; (3)腹外斜肌放电记录: 安静且室温24 ℃-26 ℃条件下, 将大鼠用乙醚麻醉后固定于手术台上, 气囊插入同AWR评分, 将银丝电极插入腹外斜肌(腹股沟韧带上方1 cm, 腹中线旁开1.5 cm), 大鼠清醒后适应30 min, 用BL-420E+生物信号采集处理系统记录其腹外斜肌基础放电(参数设置: 高频滤波2 kHz, 时间常数0.001 s, 采样频率40 Hz, 灵敏度500 µV, 走纸速度250 ms/div). 然后给予压力分别为20、40、60、80 mmHg CRD刺激, 每次加压持续10 s, 间隔4 min, 大鼠在不同压力下腹外斜肌放电幅值减去其基础放电幅值的差值代表不同压力下腹外斜肌放电幅值. 通过与正常大鼠的腹外斜肌放电幅值的比较分析, 筛选出造模成功的大鼠进行下一步实验.
1.2.3 结直肠组织病理学检查: 第12周, 经组织灌注固定后, 取大鼠距肛门10 cm处降结肠作标本. 切片由徐州医学院附属医院病理科专家诊断, 观察指标为结直肠局部组织有无损伤及炎症等异常改变.
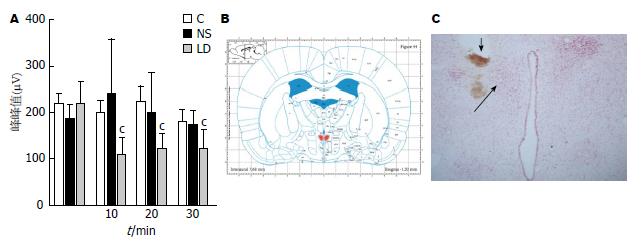
1.2.4 下丘脑PVN内微量注射及鉴定: 成年SD大鼠腹腔注射10%水合氯醛3.5 mL/kg麻醉后, 固定于脑立体定位仪上, 沿正中线切开头皮, 暴露前囟, 根据Paxinos和Watson的大鼠脑立体定位图谱定位PVN(前囟后1.5 mm, 右旁开0.4 mm, 深7.8 mm), 待大鼠清醒, 将1%利多卡因或生理盐水0.3 μL于l min内注射到PVN内[21,22]. 注射完毕后留针5 min防止返流并保证药物扩散. 然后进行电生理记录给药后10、20、30 min时给予60 mmHg CRD刺激下大鼠的腹外斜肌放电峰峰值. 处死大鼠, 取脑, 经中性红染色确定脑定位的准确性. 选择注射位点正确的大鼠, 比较给药前后腹外斜肌放电峰峰值的变化, 注射位点不在PVN内的实验数据不予统计处理.
1.2.5 Western blot检测PVN内CRH R1蛋白的表达: 第12周迅速处死大鼠取脑, 冰上分离PVN置于冻存管内, -80 ℃保存备用. 经过样品处理, 聚丙酰胺凝胶制备后上样与蛋白电泳, 转膜, 漂洗封闭, 依次放入一抗、二抗, 显色, 照相, 采用Image ProPlus图像分析系统对蛋白条带的相对深度进行分析.
1.2.6 免疫荧光(组织化学)染色法检测PVN内CRH R1和c-fos蛋白的表达: 第12周大鼠经心脏组织灌注固定取脑, 浸入30%蔗糖溶液中脱水直至沉底后脑组织冠状冰冻连续切片, 0.01 mol/L的PBS漂洗; 加入0.6%Triton X-100(或3%H2O2) 30 min, 封闭2 h, 一、二抗孵育, 贴片(或DAB溶液显色)、封片, 共聚焦显微镜(或光学显微镜)下观察拍片、计数.
统计学处理 采用SPSS13.0统计学软件进行分析, 实验数据以mean±SD表示, 数据进行方差齐性检验, 各组间比较采用单因素方差分析(one-way ANOVA), 两两比较采用SNK检验, P<0.05为差异有统计学意义.
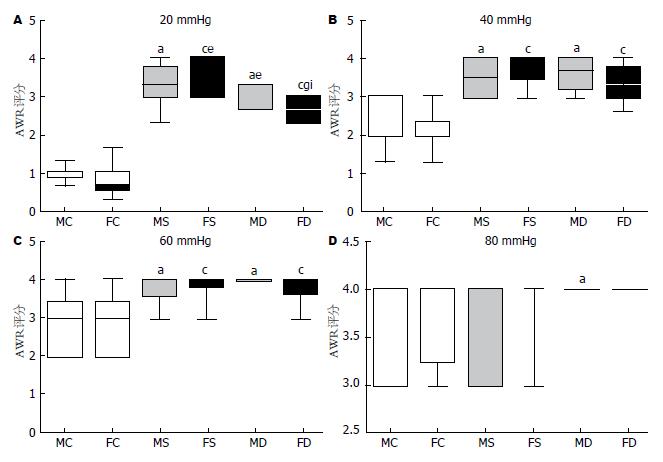
在20 mmHg压力刺激下: MC组与FC组相比, 未见明显差异; MS组与FS组相比, FS组AWR评分较高(P<0.05); MD组与FD组相比, FD组AWR评分较低(P<0.05). MS组、FS组与MC组、FC组比较, MS组、FS组AWR评分较高(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组AWR评分较高(P<0.05, P<0.05). MD组与MS组相比, MD组AWR评分较低(P<0.05); FD组与FS组相比, FD组AWR评分较低(P<0.05).
在40、60 mmHg压力刺激下: MC组与FC组相比, MS组与FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组比较, MS组、FS组AWR评分较高(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组AWR评分较高(P<0.05, P<0.05). MD组与MS组相比, FD组与FS组相比, 均未见明显差异.
在80 mmHg压力刺激下: MC组与FC组相比, MS组与FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组比较, FD组与FC组比较, 均未见明显差异; MD组与MC组比较, MD组AWR评分较高(P<0.05). MD组与MS组相比, FD组与FS组相比, 均未见明显统计学差异(图2).
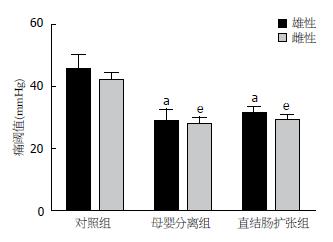
MC组与FC组相比, MS组与 FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组相比, 痛阈值下降(P<0.05, P<0.05); MD组、FD组与MC组、FC组相比, 痛阈值下降(P<0.05, P<0.05). MD组与MS组相比, FD组与 FS组相比, 均未见明显差异(图3).
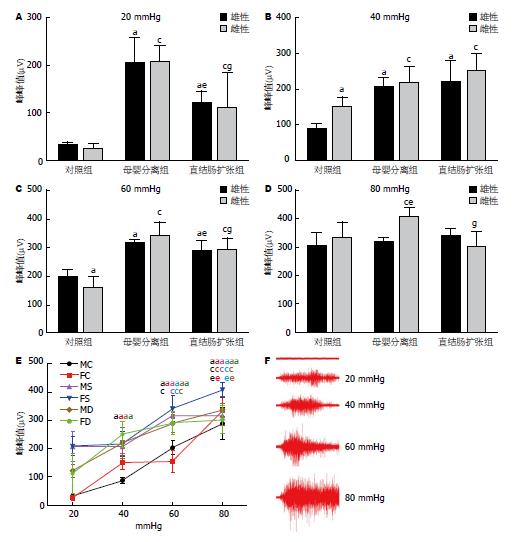
在20 mmHg压力刺激下: MC组与FC组相比, MS组与FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组比较, MS组、FS组腹外斜肌放电增强(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组腹外斜肌放电增强(P<0.05, P<0.05). MD组与MS组相比, MD组腹外斜肌放电较弱(P<0.05); FD组与FS组相比, FD组腹外斜肌放电较弱(P<0.05).
在40 mmHg压力刺激下: MC组与FC组相比, FC组腹外斜肌放电增强(P<0.05); MS组与FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组比较, MS组、FS组斜肌放电增强(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组斜肌放电增强(P<0.05, P<0.05). MD组与MS组相比, FD组与FS组相比, 均未见明显差异.
在60 mmHg压力刺激下: MC组与FC组相比, FC组腹外斜肌放电较弱(P<0.05); MS组与FS组相比, MD组与FD组相比, 均未见明显差异. MS组、FS组与MC组、FC组比较, MS组、FS组斜肌放电增强(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组斜肌放电增强(P<0.05, P<0.05). MD组与MS组相比, 未见明显差异; FD组与FS组相比, FD组腹外斜肌放电较弱(P<0.05).
在80 mmHg压力刺激下: MS组与FS组相比, MS组腹外斜肌放电增强(P<0.05); MC组与FC组相比, MD组与FD组相比, 均未见明显差异. FS组与FC组相比, FS组腹外斜肌放电增强(P<0.05); MS组与MC组相比, MD组、FD组与FD组、FC组比较, 均未见明显差异. FD组与FS组相比, FD组腹外斜肌放电减弱(P<0.05). MD组与MS组相比, 未见明显差异.
从20 mmHg到40 mmHg, 除MS组和FS组外, 其余各组的腹外斜肌放电增强(P<0.05); 从40 mmHg到60 mmHg, 除FC组和FD组外, 其余各组的腹外斜肌放电都增强(P<0.05); 其中FD组从40 mmHg到80 mmHg腹外斜肌放电没有变化; 从60 mmHg到80 mmHg, 除MS组和FD组外, 其余各组的腹外斜肌放电增强(P<0.05)(图4).
肉眼下: 各组大鼠解剖后发现腹腔解剖清晰, 肠道与周围组织没有黏连, 肠腔无明显扩张. 常规病理切片光镜下: 组织结构完整, 排列整齐, 黏膜表面光滑, 固有层内肠腺规则; 胞质呈嗜酸性红染, 胞核为圆形或椭圆形, 染成均匀的蓝黑色, 形态规则, 大小较为一致, 核仁清晰可见; 周围间质无明显水肿, 未见中性粒细胞、单核细胞、巨噬细胞浸润(图5).
PVN内微量注射生理盐水后第10、20、30分在60 mmHg直结肠扩张刺激下, 腹外斜肌放电与给药之前相比均没有变化, 且与正常对照组比较没有差异; 而PVN内给以等容积利多卡因后第10、20、30分在60 mmHg直结肠扩张刺激下, 腹外斜肌放电幅度与给药之前相比均下降(P<0.05); 3个时间点的腹外斜肌放电幅度之间没有差异(图6).
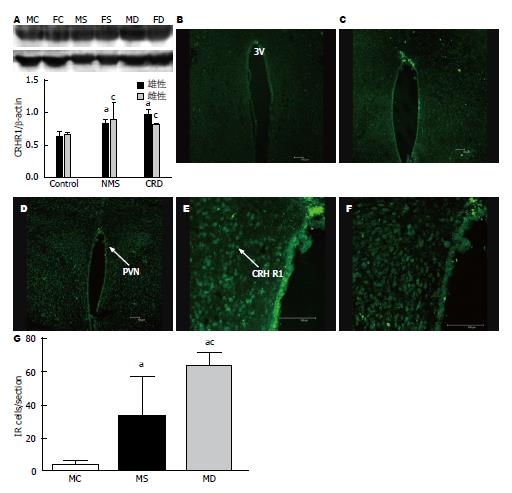
Western blot分析结果显示: MC组与FC组相比, MS组与FS组相比, MD组与FD组相比, 其PVN内CRH R1的表达均未见差异. MS组、FS组与MC组、FC组比较, MS组、FS组其PVN内CRH R1的表达增加(P<0.05, P<0.05); MD组、FD组与MC组、FC组比较, MD组、FD组其PVN内CRH R1的表达增加(P<0.05, P<0.05). MD组与MS组相比, FD组与FS组相比, 其PVN内CRH R1的表达均未见差异.
免疫荧光显示: MC组下丘脑室旁核内有少量免疫阳性细胞, MS组和MD下丘脑室旁核内免疫阳性细胞明显增多. 经统计发现: MS组与MC组相比, MS组PVN内CRH R1的表达增加(P<0.05); MD组与MC组相比, MD组PVN内CRH R1的表达增加(P<0.05). MD组与MS组相比, MD组PVN内CRH R1的表达增加(P<0.05)(图7).
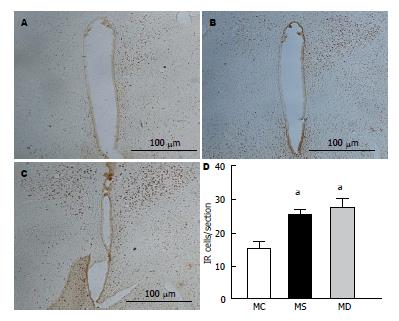
免疫组织化学结果显示: MC组下丘脑室旁核内有少量阳性细胞, 且着色较浅; MS组和MD组下丘脑室旁核内均出现较多深棕色免疫阳性产物, 免疫阳性细胞数目明显增多. 统计后发现, MS组与MC组相比, MS组PVN内c-fos的表达增加(P<0.05); MD组与MC组相比, MD组PVN内c-fos的表达增加(P<0.05). MD组与MS组相比, PVN内c-fos的表达没有差异(图8).
大脑在新生期处于快速发育阶段, 容易受到自身或外界环境影响发生永久的结构、功能性变化, 出生后环境对中枢神经系统发育的影响是必然的. 实验研究[23]表明长时间(3 h或以上)NMS可能影响动物的神经系统正常发育产生永久的损害, 而短时间(15 min)NMS则会产生长久的抗抑郁能力, 提高认知功能. 但是对此是有争议的. 大鼠出生后第2-14天, 每天NMS 3 h, 成年后发现: 与正常对照组相比, NMS组痛阈值降低, AWR评分和腹外斜肌放电增强. 且随着压力刺激强度逐步升级, AWR评分和腹外斜肌放电幅度越来越高. 另外发现, 新生期NMS和CRD后成年大鼠除了在20 mmHg压力刺激下, NMS组AWR评分和腹外斜肌放电幅度比CRD组高之外, 痛阈值、AWR评分和腹外斜肌放电没有太大差异. 最后, 所有成年大鼠结肠都未见明显病理变化. 综合以上分析, 说明新生期NMS和CRD这两种模型都可以作为比较理想稳定的功能性慢性内脏痛模型. 在20 mmHg的结肠压力刺激下, NMS组比CRD组AWR评分和腹外斜肌放电增高的更显著, 说明NMS组比CRD组触诱发痛更明显. 有研究报道, 机体对心理应激和躯体应激的应答有所不同, 心理应激会导致结肠更多的推进性收缩, 移除心理应激后结肠仍然保持较高的运动状态, 而躯体应激移除后结肠动力恢复到基线水平[24]. NMS模拟的仅仅是心理应激, 而CRD主要模拟的还是躯体应激, 因此会稍有差异. 应用这两个模型有助于我们从脑-肠互动的角度进一步探讨功能性慢性内脏痛的病理生理机制, 以及为改善和治愈腹痛相关的功能性胃肠疾病提供有价值的新途径.
研究报道, IBS患者中以女性居多[25,26]. 陈瑜等[27]的研究发现肠易激综合征模型大鼠中, 雌鼠内脏痛觉感受比雄鼠更敏感. 但免疫共沉淀的研究结果显示非应激状态下雌性大鼠皮层CRH R增多, 但是若曾经有应激接触则这种性别差异会消失, 因为雄性会选择性增加CRH R表达[16]. 我们的研究发现, 在非伤害刺激20 mmHg压力刺激下, NMS组雌性较雄性AWR评分高而CRD组雌性较雄性低. EMG结果显示, 在伤害性刺激(40、60、80 mmHg)刺激下腹外斜肌放电存在性别差异, 其中在40 mmHg压力下, 正常组雌性较雄性放电增加; 在60 mmHg压力下, 正常组雄性较雌性放电增加; 在80 mmHg压力下, CRD组雄性较雌性放电增加. 其他的行为学和肌电生理结果显示, 雌雄之间没有差异. 因为AWR评分是在清醒状态下直观测量的, 而EMG是在浅麻醉状态下客观记录的; NMS模拟的是一种心理应激, 而CRD更多的是起着躯体应激的作用. 因此在非伤害性刺激下, 清醒大鼠NMS模型中雌性较雄性内脏痛觉敏感, 清醒大鼠CRD模型中则雄性较雌性内脏痛觉敏感; 在浅麻醉状态下, 伤害性刺激会导致正常雌性大鼠较雄性大鼠内脏痛觉感受更强. 综合以上分析, 我们的研究表明正常大鼠内脏痛觉敏感性无显著的性别差异; NMS和CRD大鼠成年后内脏痛觉敏感性没有性别差异.
室旁核位于下丘脑前区, 是参与机体神经内分泌调节的重要核团, 并对内脏活动的调节发挥重要的调控作用. PVN内微量注射生理盐水后第10、20、30 min在60 mmHg结直肠扩张刺激下的腹外斜肌放电幅度与给药之前相比较没有变化, 且与正常对照组比较没有差异, 而PVN内微量注射等量利多卡因后第10、20、30 min在60 mmHg CRD刺激下的腹外斜肌放电峰峰值与给药之前相比较却均是明显下降的, 但3个时间点的腹外斜肌放电幅度没有变化. 该说明室旁核是调节正常大鼠内脏痛觉敏感性的一个重要部位, 可能参与早期不良生活经历导致功能性慢性内脏痛的发生. CRH R的表达在发育过程中受各种生理或病理条件改变而变化[28,29]. 生理条件下从青春期到成年期, 雄性HPA轴的调节逐渐以CRH R2为主, 而雌性以CRH R1为主[30]. 有研究报道[31], 新生鼠腹腔内注射脂多糖后, 最终导致大鼠到出生后第14天HPA轴功能低下, 海马CA1及CA3区CRH R1 mRNA减少. Ivy等[32]发现CRH R1的激活直接参与早期生活应激对海马突触可塑性和学习, 记忆产生持久的影响, 中枢或皮下给以CRH R1拮抗剂能有效遏制早期生活应激对海马的不利影响. 原癌基因c-Fos是一种即刻早期基因, 可被多种刺激所诱导, 他的表达产物c-fos作为神经细胞反应性的标志物之一, 可以作为评价神经元接受刺激后是否存在活动异常的指标. 我们的结果显示不论雌雄, 与正常对照组相比, NMS组和CRD组其PVN内CRH R1及c-fos的表达都是增加的, 而NMS组和CRD组其PVN内CRH R1的表达是没有差异的. 说明新生期经历NMS或CRD都会导致后期出现室旁核内CRH R1及c-fos的表达增多, 可能与成年后功能性慢性内脏痛的形成有着密切的关系.
总之, 正常大鼠、新生期经历NMS或CRD大鼠成年后内脏痛觉敏感性没有显著的性别差异, 但新生期经历NMS或CRD都会造成内脏痛觉高敏, 且造成内脏痛觉高敏的程度差别不大. 只是新生期NMS导致大鼠内脏触诱发痛更显著一些. 下丘脑室旁核参与大鼠内脏痛觉敏感性的调节. 新生期经历NMS或CRD所导致室旁核内CRH R1及c-fos的表达增多, 可能与后期功能性慢性内脏痛的形成有着密切的关系. 本研究对进一步认识早期生活经历对发育期幼鼠远期功能性慢性内脏痛的病理生理机制, 对临床采取积极有效的防治措施, 减少早期不良生活经历所造成的危害具有非常重要的意义.
功能性腹痛综合征患者通常有慢性内脏痛觉过敏. 因确切的发病机制仍旧尚未阐明, 临床也因此缺乏有效的防治方法. 近年来随着国内外功能性腹痛综合征动物模型的成功建立, 为进一步研究人类功能性腹痛综合征的产生、发展机制以及治疗提供了契机.
王小众, 教授, 福建医科大学附属协和医院消化内科
近年来, 早期生活应激经历对大鼠功能性慢性内脏痛的远期影响已经成为国内外研究的热点. Autumn等发现CRH R1的激活直接参与早期生活应激对海马突触可塑性和学习、记忆产生持久的影响; 中枢或皮下给以CRH R1拮抗剂能有效遏制早期生活应激对海马的不利影响. 对于功能性慢性内脏痛是否伴随下丘脑室旁核内CRHR1的表达变化, 还未有相关报道.
研究发现各种慢性疼痛疾病患者与应激-觉醒环路的脑区灰质密度增高有关. CRH-CRH R1信号系统是应激和觉醒环路中的一部分. 前期临床资料显示, 急性和慢性应激有关的内脏痛觉过敏, 特别是在结肠水平, 主要是由脑内CRH-CRH R1信号系统激活导致的.
新生期NMS和CRD都是比较理想的功能性慢性内脏痛模型. NMS模拟的是心理应激, 而CRD主要模拟的是躯体应激. 这两个模型的应用有助于我们从脑-肠互动的角度进一步探讨功能性慢性内脏痛的病理生理机制, 以及为改善和治愈腹痛相关的功能性胃肠疾病提供有价值的新途径.
本研究对认识早期生活经历对发育期幼鼠远期功能性慢性内脏痛的病理生理机制, 进而进一步认识下丘脑室旁核在功能性慢性内脏痛发生中的作用及机制, 对临床采取积极有效的防治措施, 减少早期不良生活经历所造成的危害具有非常重要的意义.
本研究对大鼠早期生活应激对成年后功能性慢性内脏痛及下丘脑室旁核内CRH R1表达状况进行分析, 探讨了丘脑PVN在功能性慢性内脏痛发生中的作用, 对功能性慢性内脏痛的发生机制的认识有一定价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Thompson WG, Longstreth GF, Drossman DA, Heaton KW, Irvine EJ, Müller-Lissner SA. Functional bowel disorders and functional abdominal pain. Gut. 1999;45 Suppl 2:II43-II47. [PubMed] [DOI] |
| 2. | Delvaux M. Role of visceral sensitivity in the pathophysiology of irritable bowel syndrome. Gut. 2002;51 Suppl 1:i67-i71. [PubMed] [DOI] |
| 3. | Duarte MA, Goulart EM, Penna FJ. Pressure pain threshold in children with recurrent abdominal pain. J Pediatr Gastroenterol Nutr. 2000;31:280-285. [PubMed] [DOI] |
| 4. | Seminowicz DA, Labus JS, Bueller JA, Tillisch K, Naliboff BD, Bushnell MC, Mayer EA. Regional gray matter density changes in brains of patients with irritable bowel syndrome. Gastroenterology. 2010;139:48-57.e2. [PubMed] [DOI] |
| 5. | Mayer EA, Aziz Q, Coen S, Kern M, Labus JS, Lane R, Kuo B, Naliboff B, Tracey I. Brain imaging approaches to the study of functional GI disorders: a Rome working team report. Neurogastroenterol Motil. 2009;21:579-596. [PubMed] [DOI] |
| 6. | Stengel A, Taché Y. Neuroendocrine control of the gut during stress: corticotropin-releasing factor signaling pathways in the spotlight. Annu Rev Physiol. 2009;71:219-239. [PubMed] [DOI] |
| 7. | Taché Y, Bonaz B. Corticotropin-releasing factor receptors and stress-related alterations of gut motor function. J Clin Invest. 2007;117:33-40. [PubMed] [DOI] |
| 8. | Cenac N, Andrews CN, Holzhausen M, Chapman K, Cottrell G, Andrade-Gordon P, Steinhoff M, Barbara G, Beck P, Bunnett NW. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest. 2007;117:636-647. [PubMed] [DOI] |
| 9. | Binder EB, Nemeroff CB. The CRF system, stress, depression and anxiety-insights from human genetic studies. Mol Psychiatry. 2010;15:574-588. [PubMed] [DOI] |
| 10. | Taché Y, Kiank C, Stengel A. A role for corticotropin-releasing factor in functional gastrointestinal disorders. Curr Gastroenterol Rep. 2009;11:270-277. [PubMed] [DOI] |
| 11. | Ji G, Neugebauer V. Pro- and anti-nociceptive effects of corticotropin-releasing factor (CRF) in central amygdala neurons are mediated through different receptors. J Neurophysiol. 2008;99:1201-1212. [PubMed] [DOI] |
| 12. | Greenwood-Van Meerveld B, Johnson AC, Cochrane S, Schulkin J, Myers DA. Corticotropin-releasing factor 1 receptor-mediated mechanisms inhibit colonic hypersensitivity in rats. Neurogastroenterol Motil. 2005;17:415-422. [PubMed] [DOI] |
| 13. | Hauger RL, Grigoriadis DE, Dallman MF, Plotsky PM, Vale WW, Dautzenberg FM. International Union of Pharmacology. XXXVI. Current status of the nomenclature for receptors for corticotropin-releasing factor and their ligands. Pharmacol Rev. 2003;55:21-26. [PubMed] [DOI] |
| 14. | Fukudo S. Role of corticotropin-releasing hormone in irritable bowel syndrome and intestinal inflammation. J Gastroenterol. 2007;42 Suppl 17:48-51. [PubMed] [DOI] |
| 15. | Saito K, Kasai T, Nagura Y, Ito H, Kanazawa M, Fukudo S. Corticotropin-releasing hormone receptor 1 antagonist blocks brain-gut activation induced by colonic distention in rats. Gastroenterology. 2005;129:1533-1543. [PubMed] [DOI] |
| 16. | Ren TH, Wu J, Yew D, Ziea E, Lao L, Leung WK, Berman B, Hu PJ, Sung JJ. Effects of neonatal maternal separation on neurochemical and sensory response to colonic distension in a rat model of irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2007;292:G849-G856. [PubMed] [DOI] |
| 17. | Kalinichev M, Easterling KW, Holtzman SG. Early neonatal experience of Long-Evans rats results in long-lasting changes in morphine tolerance and dependence. Psychopharmacology (Berl). 2001;157:305-312. [PubMed] [DOI] |
| 18. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 19. | Lin C, Al-Chaer ED. Long-term sensitization of primary afferents in adult rats exposed to neonatal colon pain. Brain Res. 2003;971:73-82. [PubMed] [DOI] |
| 20. | Bian ZX, Zhang M, Han QB, Xu HX, Sung JJ. Analgesic effects of JCM-16021 on neonatal maternal separation-induced visceral pain in rats. World J Gastroenterol. 2010;16:837-845. [PubMed] |
| 21. | Sandkühler J, Maisch B, Zimmermann M. The use of local anaesthetic microinjections to identify central pathways: a quantitative evaluation of the time course and extent of the neuronal block. Exp Brain Res. 1987;68:168-178. [PubMed] [DOI] |
| 22. | Zhong MK, Duan YC, Chen AD, Xu B, Gao XY, De W, Zhu GQ. Paraventricular nucleus is involved in the central pathway of cardiac sympathetic afferent reflex in rats. Exp Physiol. 2008;93:746-753. [PubMed] [DOI] |
| 23. | Korosi A, Shanabrough M, McClelland S, Liu ZW, Borok E, Gao XB, Horvath TL, Baram TZ. Early-life experience reduces excitation to stress-responsive hypothalamic neurons and reprograms the expression of corticotropin-releasing hormone. J Neurosci. 2010;30:703-713. [PubMed] [DOI] |
| 24. | Barbara G, Wang B, Stanghellini V, de Giorgio R, Cremon C, Di Nardo G, Trevisani M, Campi B, Geppetti P, Tonini M. Mast cell-dependent excitation of visceral-nociceptive sensory neurons in irritable bowel syndrome. Gastroenterology. 2007;132:26-37. [PubMed] [DOI] |
| 25. | Mayer EA, Berman S, Chang L, Naliboff BD. Sex-based differences in gastrointestinal pain. Eur J Pain. 2004;8:451-463. [PubMed] [DOI] |
| 26. | Toner BB, Akman D. Gender role and irritable bowel syndrome: literature review and hypothesis. Am J Gastroenterol. 2000;95:11-16. [PubMed] [DOI] |
| 28. | Hillhouse EW, Grammatopoulos DK. The molecular mechanisms underlying the regulation of the biological activity of corticotropin-releasing hormone receptors: implications for physiology and pathophysiology. Endocr Rev. 2006;27:260-286. [PubMed] [DOI] |
| 29. | Zmijewski MA, Slominski AT. Modulation of corticotropin releasing factor (CRF) signaling through receptor splicing in mouse pituitary cell line AtT-20--emerging role of soluble isoforms. J Physiol Pharmacol. 2009;60 Suppl 4:39-46. [PubMed] |
| 30. | Weathington JM, Cooke BM. Corticotropin-releasing factor receptor binding in the amygdala changes across puberty in a sex-specific manner. Endocrinology. 2012;153:5701-5705. [PubMed] [DOI] |
| 31. | Amath A, Foster JA, Sidor MM. Developmental alterations in CNS stress-related gene expression following postnatal immune activation. Neuroscience. 2012;220:90-99. [PubMed] |
| 32. | Ivy AS, Rex CS, Chen Y, Dubé C, Maras PM, Grigoriadis DE, Gall CM, Lynch G, Baram TZ. Hippocampal dysfunction and cognitive impairments provoked by chronic early-life stress involve excessive activation of CRH receptors. J Neurosci. 2010;30:13005-13015. [PubMed] |