修回日期: 2013-09-06
接受日期: 2013-09-13
在线出版日期: 2013-10-28
胃里同时发生上皮来源性肿瘤和胃肠道间质瘤(gastrointestinal stromal tumor, GIST)比较罕见, 此时GIST经常在手术或胃镜检查过程中发现在胃黏膜和浆膜, 偶尔在胃体内. 这种现象是两种病变简单的共存还是存在某种因果关系目前不太明确. 本文报道3例胃贲门腺癌患者同时存在胃肠道间质瘤.
核心提示: 3例胃贲门癌合并胃肠道间质瘤的临床病理特征及治疗预后, 结合相关文献进行讨论, 推测可能的病因学.
引文著录: 陈慧, 詹俊, 刘思齐. 贲门癌合并胃肠道间质瘤3例. 世界华人消化杂志 2013; 21(30): 3319-3322
Revised: September 6, 2013
Accepted: September 13, 2013
Published online: October 28, 2013
Synchronous occurrence of epithelial and gastrointestinal stromal tumors (GISTs) in the stomach is uncommon. GISTs are often detected incidentally on the gastric mucosa or serosa, or occasionally intramurally, during surgery or by gastroscopy for other reasons. It is unknown whether such an association is a simple incidental coexistence or whether the two lesions are connected by a causal relationship. In this article, we report three cases of synchronous stromal tumor and cardiac adenocarcinoma incidentally detected in the stomach in three elderly patients.
- Citation: Chen H, Zhan J, Liu SQ. Synchronous cardiac cancer and gastrointestinal stromal tumor in the stomach: Report of three cases. Shijie Huaren Xiaohua Zazhi 2013; 21(30): 3319-3322
- URL: https://www.wjgnet.com/1009-3079/full/v21/i30/3319.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i30.3319
胃里同时发生上皮来源性肿瘤和胃肠道间质瘤(gastrointestinal stromal tumor, GIST)比较罕见, GIST经常在手术或胃镜检查过程中发现在胃黏膜和浆膜, 偶尔在胃体内. 许多学者对此提出了各种假设, 是两种病变简单的共存还是存在某种因果关系目前不太明确. 本文报道3例胃贲门腺癌患者同时存在胃肠道间质瘤, 并根据报道的病例进行讨论.
病例1: 男, 77岁. 因吞咽不适7 mo, 进硬食明显, 流质稍可缓解, 当地医院胃镜检查怀疑贲门癌可能, 为进一步诊治入我院. 实验室检查未见明显异常. 消化系钡餐示: 食管下段、贲门处狭窄, 黏膜紊乱, 部分中断, 并隐约可见软组织肿块, 其以上食管较为扩张, 高度怀疑贲门癌并少许狭窄. 胃镜示: 距切齿40 cm贲门处见环壁生长肿物, 表面糜烂溃疡, 质硬脆, 贲门稍狭窄. 于全麻下行食管下段(主动脉弓下约3 cm)-部分胃(距贲门约3 cm)切除术, 术中见贲门4 cm×4 cm×3 cm大小肿物, 实性, 无外侵, 腹膜无淋巴结转移. 术后病理回报: (1)贲门小块黏膜组织, 腺上皮重度不典型增生及癌变, 幽门螺杆菌(Helicobacter pylori, H. pylori)(-). (2)胃贲门癌(分化较好), 浸润至外层及食管全层, 小弯侧淋巴结转移. 表皮生长因子受体(epidermal growth factor receptor, EGFR)、谷胱甘肽S-转移酶π(glutathione S-transferase-π, GST-π)、肝细胞生长因子受体(C-Met)均(-). 距贲门5 cm处胃体另见一0.7 cm×0.3 cm×0.3 cm大小的肿物, CD117、CD34均(+), 肌间线蛋白(Desmin)、肌动蛋白(Actin)、S-100蛋白(S-100)、增殖细胞核抗原(Ki-67)均(-), 符合胃肠道间质瘤.
病例2: 男, 56岁. 因进食哽咽感伴上腹不适半年, 当地医院以"慢性胃炎、胃肠道功能紊乱"予对症处理, 症状无缓解, 为进一步诊治入我院. 实验室检查示血CEA、CA199升高. 腹部CT示: 贲门、胃底区域可见管壁增厚, 增厚呈偏心性, 病灶同周围脂肪间隙存在. 胃镜示: 距切齿40 cm, 食管下段-贲门-部分胃底区见绕壁生长肿物, 长约4.5 cm, 表面菜花样, 质硬、脆, 有自发及接触性出血. 患者在全麻下行贲门癌根治术(食管下段、部分胃切除术, 食管与残胃吻合术), 术中见胃底贲门肿物, 大小约4 cm×4 cm×4 cm, 下段食管旁、贲门旁、胃左动脉旁可见较多肿大淋巴结. 病理结果回报: 贲门腺癌(分化较好), 浸润外层, 侵犯周围神经组织, 贲门旁、胃大弯、大网膜、胃左动脉、胃小弯、贲门淋巴结转移. 合并胃肠道间质瘤, 肿物直径约0.4 cm, CD34、CD117(+), EGFR(-)、GST-π(+), 肿瘤免疫组织化学: Ki-67(+), Desmin、Actin、S-100(-), 诊断(1)贲门癌. (2)胃肠道间质瘤. 术后予洛铂、艾素、5-氟尿嘧啶、CF化疗, 术后复查无复发.
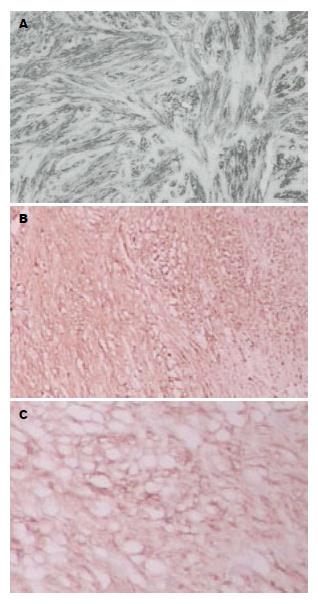
病例3: 男, 73岁, 因柏油样便伴头晕10 d, 外院胃镜提示贲门溃疡恶变. 病理: 贲门黏膜鳞状上皮及腺上皮呈慢性炎, 可见少数细胞癌变. 我院CT示: 贲门壁增厚, 约1.6 cm, 考虑贲门癌可能. 患者在全麻下行全胃切除术+P型空肠代胃, 术中见胃底3 cm×2 cm×2 cm肿物, 浸润肌层, 未侵及浆膜层, 胃小弯、幽门上可见多个肿大淋巴结, 与毗邻组织无粘连. 病理结果回报: 贲门小块组织为低分化腺癌, 浸润肌层, cerb-2(-). 送检的一淋巴结组织中见0.6 cm及0.3 cm结节状梭形细胞肿瘤, 符合胃肠道间质瘤, 免疫组织化学示, CD34(+)(图1A)、CD117(+)(图1B), dog1(+)(图1C), Actin、S-100(-), Vimentin(+).
GIST是属于消化系间叶源性肿瘤, 可能起源于幼稚间充质细胞向卡哈尔(Cajal)间质细胞(胃肠道起搏细胞)分化. 免疫表型上表达c-Kit基因蛋白产物(CD117), 由突变的c-Kit基因和PDGFR-α基因驱动. 可发生于全消化系, 好发部位依次为胃(60%-70%)、小肠( 25%-35%)、大肠和阑尾(5%)及食管(2%-3%), 少数(<5%)可发生于胃肠道外, 包括网膜、肠系膜及腹膜后等[1]. 组织学上GIST的肿瘤细胞主要有梭形细胞和上皮样细胞两种形态, 肿瘤组织可由梭形细胞或上皮样细胞为主或由两种细胞共同组成. 根据GIST的生物学行为可分为良性(无恶性指标)、潜在恶性(具备1项潜在恶性指标)和恶性(具备1项肯定恶性或2项以上潜在恶性指标). 肯定恶性指标: (1)远处转移(经组织学证实); (2)浸润邻近器官. 潜在恶性指标: (1)胃间质瘤>5.5 cm, 肠间质瘤>4.0 cm; (2)胃间质瘤核分裂象>1/10高倍视野(high power field, HPF), 肠间质瘤只要出现核分裂象; (3)肿瘤中心坏死明显; (4)核异型性大; (5)细胞密度大; (6)镜下可见黏膜固有层或血管的浸润; (7)上皮样间质中出现腺泡状结构. GIST的免疫组织化学主要标志为: c-Kit(CD117)、CD34及PDGFR-α, 有条件者应进一步检测基因突变型. 其他免疫组织化学指标如SMA、S-100、Actin、Vimentin在GIST中的表达率低, 特异性不高[2]. 外科手术切除至今仍是GIST治疗的主要手段, 最新进展是伊马替尼(小分子选择性蛋白络氨酸激酶抑制剂)与手术的联合治疗, 这种联合治疗可明显提高治疗效果, 延长生存期. 对术前已有多处转移或难以完整切除的GIST, 可以先用伊马替尼治疗, 寻求手术机会; 恶性潜能高的GIST可于术后以伊马替尼辅助治疗, 可减少术后复发率和转移率, 姑息切除者有条件应长期服用伊马替尼, 至于术后应持续服用多久为宜, 尚无定论[3].
胃肠道间质瘤合并其他上皮性恶性肿瘤的报道逐渐增多, 陈丽荣[4]曾报道103例胃肠道间质瘤中8例合并原发器官或邻近器官的上皮性恶性肿瘤, 其中胃癌3例; Gonçalves等[5]发现101例胃肠道间质瘤中13.8%同时发生其他肿瘤, 胃腺癌最多见(约28.5%). 既往有报道胃肠道间质瘤合并发生结直肠腺癌、原发性肝癌、肺腺癌、乳状头肾母细胞瘤[6-9]. Liu等[10]报道, 上皮性恶性肿瘤伴随的胃肠道间质瘤体积小, 90.7%危险度极低. 但Zhou等[11]报道过一例胃肠间质瘤同时合并食管鳞癌、胃底腺癌的病例, 患者胃肠道间质瘤体积直径即>5 cm, 被认为是潜在恶性, 除对食管鳞癌、胃底腺癌行手术根治术后, 建议患者予伊马替尼治疗. Kawanowa等[12]报道过100例因过胃癌切除的全胃标本中发现镜下胃肠道间质瘤达35%.
胃腺癌是世界范围类第二常见的肿瘤, 而自从70年代以来, 胃贲门癌呈上升趋势. 贲门癌大多数情况下可能侵犯食管下段及胃底、胃体等, 腹腔淋巴结转移较常见, 治愈胃贲门癌的唯一方法是手术切除. 根据患者具体情况, 术后予辅助化疗或放疗. 本报道的3例患者均是在因贲门癌行胃次全切或全切除术后送检胃或淋巴结组织中发现存在胃肠道间质瘤, 因肿物直径均较小未超过1 cm, 术前的消化系钡餐、腹部CT、胃镜等检查中均未发现. 根据胃肠道间质瘤术后危险度评价的最新标准[13], 3例术后危险度评价为极低级别, 所以针对胃肠道间质瘤在术中行切除后, 均未行伊马替尼治疗, 术后复查3例患者均无肿瘤复发.
胃肠道间质瘤伴发于上皮性恶性肿瘤通常影像学检查在术前难以发现, 可能因为肿瘤体积小、位于消化系壁内、CT和MRI检查常误认为是来源于上皮性恶性肿瘤转移的淋巴结, 而大多是在术后病理检查出来的. 因此在消化系肿瘤诊断与治疗过程中应考虑到肿瘤发生的多样性和胃肠道间质的特殊性, 应行仔细、全面的检查, 病理检查观察因胃癌切除的胃标本时对胃壁进行仔细检查以防漏诊伴随的微小胃肠道间质瘤, 反而言之, 在诊断胃肠道间质瘤的时候应怀疑是否合并其他肿瘤的可能. 另外, 伊马替尼治疗胃肠道间质瘤之后, 鉴于受体酪氨酸激酶家族是相当庞大的, 任何给定的抑制剂只是作为其中一个受体的拮抗剂, 有潜在发生二次肿瘤的可能, 因此在使用伊马替尼时应密切监测[14].
许多学者对胃肠道间质瘤与其他肿瘤同时发生的现象提出了各种假设, 如基因突变、金属硫因的表达、临近组织受同一致癌基因的刺激等[15,16], 但目前暂无数据能支持以上各种假设. Maiorana等[17]提出多种关于胃同时发生间质瘤与腺癌的假设, 考虑或是简单的偶然共存或者是存在某种因果关系, 提出了基因突变或者某一种致癌物质能与两种临近组织相互作用, 而致使同一器官的不同组织发生肿瘤, 而单单巧合不能解释这种现象, 尤其在胃癌手术高发区. Andea等[18]则支持偶然共存这一说法. 目前研究认为间质瘤是源于卡哈尔(Cajal)间质细胞, 没有证据表明间质瘤与幽门螺杆菌感染、炎症及肠上皮化生有关[19].
胃肠道间质瘤与胃贲门腺癌等其他肿瘤同时发生, 这种现象是两种或多种病变简单的共存还是存在某种共同致病源或者因果关系目前不太明确. 研究这些病例在分子、基因水平上的表达情况或异常, 可能会发现其中的病因学, 而这有待进一步研究.
因胃癌等疾病行胃及相关淋巴结切除, 术后送检病理组织偶然发现胃肠道及肠系膜间质瘤.
姜相君, 主任医师, 青岛市市立医院消化科
本文对上皮源性肿瘤和间质源性肿瘤同时发生于胃进行报道和讨论, 亟待研究此现象是两种病变是偶然的共存还是存在某种联系.
既往胃肠道间质瘤和贲门癌、结肠癌、肺癌、肾癌、食管癌共存的报道, 并对两种肿瘤共存的现象进行各种可能的假设.
胃里同时出现上皮源性肿瘤(贲门癌)和间质源性肿瘤(间质瘤)的报道比较少.
胃肠道间质瘤伴发于上皮性恶性肿瘤通常影像学检查在术前难以发现, 可能因为肿瘤体积小、位于消化系壁内、CT和MRI检查常误认为是来源于上皮性恶性肿瘤转移的淋巴结, 而大多是在术后病理检查出来的, 在实际临床工作中需对病理送检的组织进行细致检查, 以免漏诊胃肠道间质瘤.
本文内容详实, 可信. 胃癌合并GIST报道较少, 文章对临床工作有指导意义, 学术价值好.
编辑: 郭鹏 电编:闫晋利
| 5. | Gonçalves R, Linhares E, Albagli R, Valadão M, Vilhena B, Romano S, Ferreira CG. Occurrence of other tumors in patients with GIST. Surg Oncol. 2010;19:e140-e143. [PubMed] [DOI] |
| 6. | Bircan S, Candir O, Aydin S, Başpinar S, Bülbül M, Kapucuoğlu N, Karahan N, Ciriş M. Synchronous primary adenocarcinoma and gastrointestinal stromal tumor in the stomach: a report of two cases. Turk J Gastroenterol. 2004;15:187-191. [PubMed] |
| 7. | Jaworski R, Jastrzebski T, Swierblewski M, Drucis K, Kobierska-Gulida G. Coexistence of hepatocellular carcinoma and gastrointestinal stromal tumor: a case report. World J Gastroenterol. 2006;12:665-667. [PubMed] |
| 8. | Wada Y, Koizumi T, Yokoyama T, Urushihata K, Yamamoto H, Hanaoka M, Kubo K. Synchronous gastrointestinal stromal tumor and primary lung adenocarcinoma. Intern Med. 2012;51:2407-2410. [PubMed] [DOI] |
| 9. | Reşorlu B, Baltaci S, Reşorlu M, Kankaya D, Savaş B. Coexistence of papillary renal cell carcinoma and gastrointestinal stromal tumor in a case. Turk J Gastroenterol. 2007;18:47-49. [PubMed] |
| 10. | Liu YJ, Yang Z, Hao LS, Xia L, Jia QB, Wu XT. Synchronous incidental gastrointestinal stromal and epithelial malignant tumors. World J Gastroenterol. 2009;15:2027-2031. [PubMed] |
| 11. | Zhou Y, Wu XD, Shi Q, Jia J. Coexistence of gastrointestinal stromal tumor, esophageal and gastric cardia carcinomas. World J Gastroenterol. 2013;19:2005-2008. [PubMed] |
| 12. | Kawanowa K, Sakuma Y, Sakurai S, Hishima T, Iwasaki Y, Saito K, Hosoya Y, Nakajima T, Funata N. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol. 2006;37:1527-1535. [PubMed] [DOI] |
| 14. | Rygaard K, Nakamura T, Spang-Thomsen M. Expression of the proto-oncogenes c-met and c-kit and their ligands, hepatocyte growth factor/scatter factor and stem cell factor, in SCLC cell lines and xenografts. Br J Cancer. 1993;67:37-46. [PubMed] [DOI] |
| 15. | Rauf F, Ahmad Z, Muzzafar S, Hussaini AS. Synchronous occurrence of gastrointestinal stromal tumor and gastric adenocarcinoma: a case report. J Pak Med Assoc. 2006;56:184-186. [PubMed] |
| 16. | Nemes C, Rogojan L, Surdea-Blaga T, Seicean A, Dumitrascu DL, Ciuce C. Gastrointestinal stromal tumor (GIST) associated with synchronous colon adenocarcinoma - a case report. J Gastrointestin Liver Dis. 2012;21:101-103. [PubMed] |
| 17. | Maiorana A, Fante R, Maria Cesinaro A, Adriana Fano R. Synchronous occurrence of epithelial and stromal tumors in the stomach: a report of 6 cases. Arch Pathol Lab Med. 2000;124:682-686. [PubMed] |
| 18. | Andea AA, Lucas C, Cheng JD, Adsay NV. Synchronous occurrence of epithelial and stromal tumors in the stomach. Arch Pathol Lab Med. 2001;125:318-319. [PubMed] |
| 19. | Kaffes A, Hughes L, Hollinshead J, Katelaris P. Synchronous primary adenocarcinoma, mucosa-associated lymphoid tissue lymphoma and a stromal tumor in a Helicobacter pylori-infected stomach. J Gastroenterol Hepatol. 2002;17:1033-1036. [PubMed] [DOI] |