修回日期: 2013-09-04
接受日期: 2013-09-12
在线出版日期: 2013-10-28
目的: 探讨脂多糖(lipopolysaccharide, LPS)对人肝星状细胞株LX-2增殖、活化和凋亡相关蛋白表达的影响.
方法: 应用Western blot技术检测脂多糖刺激的LX-2细胞中增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、结蛋白(Desmin)和活化的天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase3)表达.
结果: 人肝星状细胞株LX-2经脂多糖刺激后, PCNA和Desmin表达呈现先上升后下降的趋势; 活化的Caspase3在脂多糖低浓度或短时间刺激LX-2时无表达, 在脂多糖高浓度或长时间刺激后呈现显著上升.
结论: 脂多糖在适当的条件下能够诱导LX-2细胞增殖、活化以及凋亡.
核心提示: 本实验从体外细胞实验证实了促炎症因子脂多糖在不同的条件和作用时间下能对肝星状细胞增殖、活化产生了不同的影响, 低浓度和短时间能够诱导肝星状细胞增殖和活化, 高浓度和长时间则能够抑制肝星状细胞活化和增殖, 甚至诱导细胞凋亡, 该结果为进一步观察LPS在体内肝纤维化进展过程中的具体作用提供一定的理论依据.
引文著录: 杨亚楠, 万维琴, 朱丹丹, 孙伟, 冯金荣, 段义农. 脂多糖对人肝星状细胞株LX-2活化和凋亡相关蛋白表达的影响. 世界华人消化杂志 2013; 21(30): 3236-3240
Revised: September 4, 2013
Accepted: September 12, 2013
Published online: October 28, 2013
AIM: To observe the effect of lipopolysaccharide (LPS) on the expression of proteins associated with cell activation and apoptosis in human hepatic stellate cell line LX-2.
METHODS: The expression of proliferating cell nuclear antigen (PCNA), Desmin and active Caspase 3 proteins was detected by Western blot in LX-2 cells treated with LPS.
RESULTS: PCNA and Desmin expression in LX-2 cells could be regulated by LPS stimulation. No expression of active Caspase 3 was detected in LX-2 cells stimulated with low-concentration LPS or with LPS for a short period; however, the expression of active Caspase 3 could be up-regulated by stimulation with high-concentration LPS or with LPS for a long period.
CONCLUSION: The proliferation, activation and apoptosis of LX-2 cells can be induced by LPS under appropriate conditions.
- Citation: Yang YN, Wan WQ, Zhu DD, Sun W, Feng JR, Duan YN. Effect of lipopolysaccharide on expression of proteins associated with cell activation and apoptosis in human hepatic stellate cell line LX-2. Shijie Huaren Xiaohua Zazhi 2013; 21(30): 3236-3240
- URL: https://www.wjgnet.com/1009-3079/full/v21/i30/3236.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i30.3236
脂多糖(lipopolysaccharide, LPS)是革兰阴性菌细胞壁中的主要致病成分, 可通过激活单核细胞、巨噬细胞及内皮细胞等, 诱导机体产生炎症反应[1,2]. 已有研究表明, LPS与肝纤维化的发生发展关系密切[3]. 肝纤维化进程中, LPS能够间接或直接的刺激位于Disse腔内的肝星状细胞(hepatic stellate cells, HSCs), 诱导其活化并提高Ⅰ型和Ⅲ型胶原的表达[4]. LPS对肝星状细胞直接或间接的刺激作用, 主要是依赖肝星状细胞或Kupffer细胞等细胞中内毒素受体. 研究表明, 在LPS诱导的肝星状细胞活化过程中, 可观察到肝星状细胞或Kupffer细胞中Toll样受体4(Toll-like receptor 4, TLR4)受体及CD14受体等表达上调[5-7]. 此外, 研究表明, LPS在肝细胞、Kupffer细胞等均能诱导细胞凋亡[8,9]. 本研究中采用不同浓度、剂量LPS诱导人肝星状细胞株LX-2, 观察LPS对LX-2细胞增殖、凋亡和活化相关蛋白, 如增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、结蛋白(Desmin)以及活化的天冬氨酸特异性半胱氨酸蛋白酶-3(active Caspase3)表达的影响.
LX-2细胞株购于南方细胞技术有限公司; DMEM(高糖型)培养液、胎牛血清、0.25%胰蛋白酶购自美国GIBCO公司; LPS购于美国SIGMA公司; 抗PCNA抗体和抗active Caspase3抗体来自于美国Abcam公司; 抗甘油醛-3-磷酸脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)抗体购自杭州贤至公司; 辣根过氧化物酶(horseradish peroxidase, HRP)标记二抗及抗Desmin抗体来自于美国Santa Cruz公司.
1.2.1 细胞培养与处理 人肝星状细胞株LX-2培养于DMEM培养基(含100 U/mL青毒素、100 μg/mL链霉素、10 mmol/L谷氨酰胺及10%胎牛血清)中, 于37 ℃、5%CO2细胞培养箱培养. 用不同浓度LPS(0、0.001、0.01、0.1、1、10 μg/mL)处理LX-2细胞6 h后, 收集样本, 确定最佳刺激浓度; 选择浓度0.01 μg/mL LPS在不同时间点(0、1、3、6、9、12、18、24 h)处理LX-2细胞, 收集样本.
1.2.2 Western blot 收集的细胞经SDS蛋白裂解液裂解获得蛋白后, 利用Bradford法检测蛋白浓度, 并与上样缓冲液混匀, 100 ℃煮10 min, 离心后上清于10%或12%的SDS-PAGE凝胶电泳, 并转印至PVDF膜. 经5%脱脂奶粉封闭过夜后, 依次孵育相应一抗(25 ℃, 4 h), 二抗(25 ℃, 1 h), 随后ECL显影. 以GAPDH作为内参标准. Bio-Rad Quantity One软件作为灰度扫描软件.
统计学处理 数据分析用SPSS15.0软件统计. 所有实验重复3次, 数据以mean±SD表示, 组间比较采用One-way Anova法(LSD)检验. P<0.05为差异具有统计学意义.
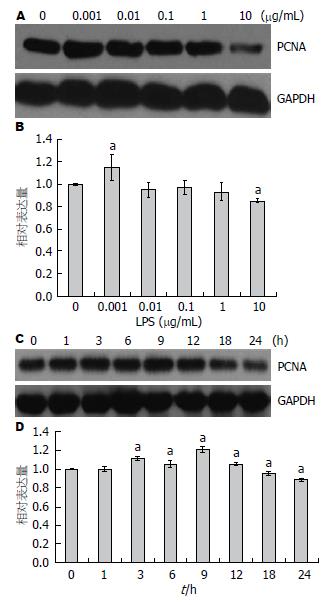
用不同浓度的LPS(0、0.001、0.01、0.1、1、10 μg/mL)处理LX-2细胞6 h后, 用Western blot检测增殖指标PCNA的表达情况, 发现LPS为0.001 μg/mL时, PCNA表达增加并最明显, 随着LPS浓度增加, PCNA的表达逐渐减少, 当LPS为10 μg/mL时, PCNA的表达下降, 与未刺激组相比, 差异有统计学意义(图1A, B). 用0.01 μg/mL LPS以不同时间点(0、1、3、6、9、12、18、24 h)处理LX-2细胞, 用Western blot检测PCNA表达情况, 结果显示LPS促进肝星状细胞增殖从3 h开始, 并持续增加到12 h时后逐渐降低(图1C, D).
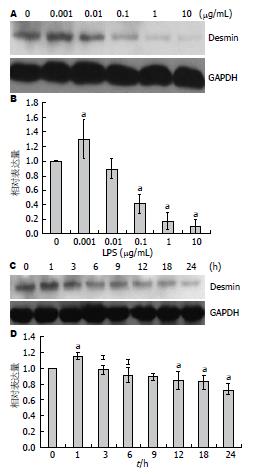
为了检测肝星状细胞的活化状态, 我们用不同浓度LPS(0、0.001、0.01、0.1、1.0、10 μg/mL)分别处理LX-2细胞6 h, 应用Western blot检测HSCs活化指标Desmin表达情况. 结果显示低剂量LPS(0.001 μg/mL)能够增加Desmin表达, 而当LPS浓度增加到0.1 μg/mL处理细胞时, Desmin的表达与未刺激组相比, 下降有统计学差异(图2A, B). 用0.01 μg/mL LPS以不同时间点(0、1、3、6、9、12、18 h)处理细胞, Western blot检测Desmin的表达发现, LPS刺激LX-2仅1 h时, 能够增加Desmin表达, 随后出现下降趋势, 当刺激时间>12 h时, Desmin的表达下降, 与对照组相比, 差异有统计学意义(图2C, D).
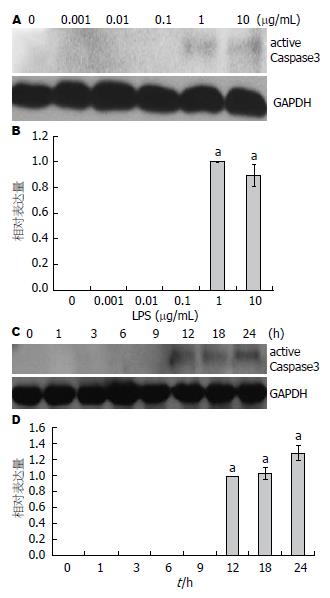
用不同浓度的LPS(0、0.001、0.01、0.1、1.0、10 μg/mL)处理LX-2细胞6 h后, Western blot检测active Caspase3的蛋白表达, 结果显示在LPS为1.0 μg/mL时, active Caspase3开始表达(图3A, B). 用0.01 μg/mL LPS处理LX-2细胞不同的时间(0、1、3、6、9、12、18、24 h)后, Western blot检测active Caspase3表达情况, 发现随着时间的推移, active Caspase3在12 h出现表达, 24 h稍有增加(图3C, D).
肝星状细胞是一种贮存脂滴的肝非实质细胞, 位于肝脏窦周间隙[10], 是肝纤维化过程中细胞外基质(extracellular matrix, ECM)的主要来源细胞. 在慢性肝损伤时, HSCs通过复杂的机制持续激活、增殖, 转化为肌成纤维细胞, 并参与调节ECM的代谢过程[11]. 大量实验研究表明, 肝星状细胞活化并分泌大量细胞外基质是肝纤维化形成的重要机制[12,13].
本实验中我们用LPS刺激人肝星状细胞LX-2, 结果发现, 在一定时间内, 用适当浓度的LPS刺激HSCs相应时间后, 可引起HSCs的增殖活化明显增强. 但随着LPS刺激浓度增加以及刺激时间的延长, LPS刺激HSCs后同样会引起HSCs的增殖活化下降. 实验中我们进一步应用Western blot检测了凋亡指标active Caspase3, 结果显示用1.0 μg/mL和10 μg/mL LPS持续刺激细胞6 h后, 可检测到active Caspase3表达增加; 用0.01 μg/mL LPS刺激细胞12 h后, 在细胞中也可发现active Caspase3出现表达. Caspase3是凋亡研究过程中使用最为广泛的分子之一, 隶属于一种凋亡相关的蛋白酶家族, 在细胞内以非活性形式存在, 当细胞凋亡时, Caspase3能够被自身或上游凋亡分子水解, 产生17和12 kDa的活性亚单位. 本研究中直接采用抗active Caspase3抗体, 检测17 kDa的活性亚单位. 该活性亚单位的表达增强, 可能是由于大剂量的LPS长时间刺激细胞, 会产生一定的细胞毒作用而诱导凋亡, 引起细胞死亡. 因此, 结果证实, LPS对HSCs刺激具有激活和损伤双重作用[14,15], LPS刺激细胞时间过长时, 主要表现为对HSCs的损伤效应, 使细胞活力、细胞的增殖能力和合成代谢能力均受损, 甚至诱导细胞凋亡. LPS刺激细胞时间较短时, 主要表现为激活效应, 细胞可抵抗损伤的影响, 可大大增加自身的增殖能力和合成代谢的能力. 同样, LPS刺激细胞的浓度高低, 也会产生相应的激活和损伤效应[5,16]. 综合实验结果, 我们认为, LPS在不同的刺激条件下, 能够诱导LX-2细胞活化和凋亡状态的改变, 其中, 低浓度(0.001 μg/mL)LPS短时间(6 h)刺激LX-2, 可以较好的刺激肝星状细胞的活化, 能够得到预期的实验结果.
脂多糖(lipopolysaccharide, LPS)是革兰阴性菌细胞壁中的主要致病成分, 与肝纤维化的发生发展关系密切. 在肝纤维化进程中, LPS能够刺激肝星状细胞活化. 然而, LPS也能诱导肝细胞、Kupffer细胞等细胞凋亡.
庹必光, 教授, 遵义医学院附属医院消化科
肝星状细胞(hepatic stellate cells, HSCs)是一种贮存脂滴的肝非实质细胞, 是肝纤维化过程中主要效应细胞. 在慢性肝损伤时, HSCs通过复杂的机制持续激活、增殖, 转化为肌成纤维细胞, 并参与调节细胞外基质(extracellular matrix)的代谢过程.
贾晋斌等发现, 内毒素在刺激Kupffer细胞从而影响肝星状细胞活化的过程中, 并非为单一的活化作用, 高浓度的内毒素能够损伤细胞, 使得高浓度内毒素处理的Kupffer细胞培养上清不能促进肝星状细胞的活化.
本研究观察了LPS对肝星状细胞中蛋白表达的影响, 尤其是对凋亡相关蛋白的影响, 该结果为进一步观察LPS在体内肝纤维化进展过程中的具体作用提供一定的理论依据.
LPS在低浓度短时间刺激LX-2时, 可以较好地刺激肝星状细胞的活化, LPS较高浓度或较长时间刺激LX-2时, 可以抑制肝星状细胞的活化和增殖, 甚至促进肝星状细胞的凋亡, 该结果为进一步观察LPS在体内肝纤维化进展过程中的具体作用提供一定的理论依据.
本文研究了促炎症因子脂多糖对人肝星状细胞增殖、活化和凋亡相关蛋白表达的影响, 旨在进一步阐明脂多糖在肝纤维化发生中的作用机制. 研究结果发现脂多糖在不同的条件和作用时间下能对肝星状细胞增殖、活化产生了不同的影响, 而且能诱导细胞凋亡. 该文有一定的科学及临床意义.
编辑: 郭鹏 电编:闫晋利
| 3. | Soares JB, Pimentel-Nunes P, Roncon-Albuquerque R, Leite-Moreira A. The role of lipopolysaccharide/toll-like receptor 4 signaling in chronic liver diseases. Hepatol Int. 2010;4:659-672. [PubMed] [DOI] |
| 9. | 魏 思东, 李 金政, 龚 建平, 刘 作金, 游 海波, 陈 勇, 吴 传新. GITRL在内毒素诱导的Kupffer细胞凋亡中的作用研究. 细胞与分子免疫学杂志. 2011;27:602-607. |
| 11. | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25:195-206. [PubMed] [DOI] |
| 12. | Bartley PB, Ramm GA, Jones MK, Ruddell RG, Li Y, McManus DP. A contributory role for activated hepatic stellate cells in the dynamics of Schistosoma japonicum egg-induced fibrosis. Int J Parasitol. 2006;36:993-1001. [PubMed] [DOI] |
| 13. | Parola M, Marra F, Pinzani M. Myofibroblast - like cells and liver fibrogenesis: Emerging concepts in a rapidly moving scenario. Mol Aspects Med. 2008;29:58-66. [PubMed] [DOI] |
| 14. | Bauer M, Bauer I, Sonin NV, Kresge N, Baveja R, Yokoyama Y, Harding D, Zhang JX, Clemens MG. Functional significance of endothelin B receptors in mediating sinusoidal and extrasinusoidal effects of endothelins in the intact rat liver. Hepatology. 2000;31:937-947. [PubMed] [DOI] |
| 15. | Friedman SL. Stellate cell activation in alcoholic fibrosis--an overview. Alcohol Clin Exp Res. 1999;23:904-910. [PubMed] [DOI] |