修回日期: 2013-07-10
接受日期: 2013-09-17
在线出版日期: 2013-10-28
目的: 探讨腺病毒介导的白介素12(interleukin-12, IL-12)基因(AdvIL-12)转染能否在体外诱导出更强的抗(hepatocellular carcinoma, HCC)免疫效应.
方法: 在体外, 用AdvIL-12转染HepG2作为实验组, 以Adv-绿色荧光蛋自(green fluorescent protein, GFP)转染的HepG2和未转染的HepG2作为对照组进行培养. 用划痕试验检测载有IL-12的腺病毒对HepG2细胞的迁移能力的影响; 结晶紫法检测对HepG2的生长能力的抑制和杀伤作用; MTT检测对HepG2细胞增殖能力的抑制作用的影响; TUNEL法检测对HepG2细胞的凋亡效应的影响.
结果: 正常生长的HepG2单层贴壁生长, 生长旺盛, 镜下观察为梭形, 胞浆均质透明, 折光性好, 胞间紧密连接, 核质均匀, 核仁清晰可见. 实验组AdvIL-12作用24 h后HepG2细胞迁移距离明显受到抑制, 且随浓度增大, HepG2细胞向划痕区移动的距离越来越小, 细胞数量越少, 划痕越宽. 实验组AdvIL-12结晶紫染色深度随浓度梯度减少而逐渐加深. 取10 μL AdvIL-12时对HepG2细胞杀伤效果最为明显. 酶标仪检测AdvIL-12组、Adv-GFP组和HepG2空白对照组分别培养24、48、72 h后的A值(F1 = 95.7, F2 = 103.6, F3 = 165.8, P<0.01)与对照组相比有统计学意义. 光镜下可见凋亡细胞明显固缩, 体积变小, 胞质致密, 核浓缩甚至消失, 形成凋亡小体. 实验组AdvIL-12组凋亡细胞数量明显多于对照组Adv-GFP组.
结论: 转染AdvIL-12的HepG2细胞能有效抑制HepG2细胞的生长, 增殖和迁移能力, 效果随浓度增大而增强, 并能够促进HepG2细胞的凋亡效应, 从而在体外达到明显的肿瘤抑制作用.
核心提示: 本文采用最新腺病毒作为载体携带白介素12(interleukin-12, IL-12)在体外研究对肝癌(hepatocellular carcinoma, HCC)的抗肿瘤效果. 通过对HCC细胞株HepG2的生长、增殖、迁移以及凋亡的影响得出腺病毒能够良好的携带IL-12并通过免疫机制有效的抑制HCC细胞的生长. 在实际应用中, 可以通过开发相关的免疫疫苗来达到治疗目的.
引文著录: 崔清昱, 秦万民, 张炳远, 刘世海, 孙传东. 腺病毒携带IL-12治疗肝癌细胞株HepG2的体外实验. 世界华人消化杂志 2013; 21(30): 3190-3197
Revised: July 10, 2013
Accepted: September 17, 2013
Published online: October 28, 2013
AIM: To explore whether an adenoviral vector expressing the interleukin-12 (IL-12) gene (AdvIL-12) can induce a strong anti-hepatic carcinoma effect in vitro.
METHODS: HepG2 cells transfected with AdvIL-12 were cultured as the experimental group, and cells transfected with Adv-GFP or non-transfected cells were used as controls. The scratch test was used to detect the migration of AdvIL-12-infected HepG2 cells. The crystal violet staining assay was used to examine the survival of HepG2 cells. MTT assay was used to assess the proliferation of HepG2 cells. TUNEL assay was used to detect the apoptosis of HepG2 cells.
RESULTS: AdvIL-12-infection inhibited the migration of HepG2 cells in a dose-dependent manner. In the experimental group, the dye depth of crystal violet staining deepened with the decrease in the concentration of AdvIL-12. The killing effect of 10 μL of AdvIL-12 had the most obvious killing effect on HepG2 cells. The absorbance values differed significantly between the AdvIL-12 group, Adv-GFP group and non-transfected HepG2 group (F1 = 95.7, F2 = 103.6, F3 = 165.8, P < 0.01) after culture for 24, 48 or 72 h. Under an optical microscope, typical apoptotic cells were visible. The number of apoptotic cells in the experimental group was significantly more than those in the two control groups.
CONCLUSION: AdvIL-12 infection can effectively inhibit the ability of HepG2 cells to grow, proliferate and migrate and promote the apoptosis of HepG2 cells.
- Citation: Cui QY, Qin WM, Zhang BY, Liu SH, Sun CD. In vitro antitumor effect of an adenoviral vector expressing IL-12 in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2013; 21(30): 3190-3197
- URL: https://www.wjgnet.com/1009-3079/full/v21/i30/3190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i30.3190
肝癌(hepatocellular carcinoma, HCC)是世界上最流行的癌症之一, 在癌症导致死亡的疾病中排名第3[1], 原发性HCC在我国高发, 目前我国发病人数约占全球的55%, 在肿瘤相关死亡中仅次于肺癌, 居第2位. 肝炎病毒感染导致的HCC估计可以达到全球HCC病例的78%[2].
HCC具有发现较晚, 发展迅速, 侵袭性强, 转移早, 预后差的特点. 治疗方法根据肿瘤情况, 肝脏功能, 全身身体状况和治疗效果而制定, 主要有经皮穿刺消融、外科切除、肝移植和生物疗法. 由于HCC通常发现时已晚, 已丧失最佳手术时机, 或可切除, 但可早期出现转移, 而切除效果不够理想. 肝脏细胞由于缺乏对肿瘤相关性抗原(tumor associated antigen, TAA)的识别, 无法做出有效的免疫反应. 因此对常规免疫治疗效果不够理想, 同时由于其对目前药物化学治疗不够敏感, 且不良反应较大, 所以开发一种新式, 有效的治疗方法成为当务之急[3].
白介素12(interleukin-12, IL-12)是一种由p35和p40组成的异二聚体结构的细胞因子, 又称为细胞毒淋巴细胞成熟因子(cytotoxic lymphocyte maturation factor, CLMF)、NK细胞刺激因子(natural killer cell stimulatory factor, NKSF), 主要由抗原递呈细胞产生, 其中单核/巨噬细胞和B细胞是产生IL-12的主要细胞, 有很强的免疫调节作用. 能诱导NK和T细胞产生干扰素-γ(interferon-γ, IFN-γ)、IL-2等细胞因子, 促进初始Th0细胞向Thl细胞分化、增殖和成熟, 抑制Th2细胞活性, 调节机体细胞免疫反应[4,5]; 能通过诱导肿瘤细胞凋亡和抑制肿瘤组织新生血管的生成而直接抑制肿瘤生长[6]; 能诱导并增强NK细胞和CTL细胞的增殖及细胞不良反应, 介导其抗肿瘤作用的细胞免疫应答; 并能介导IFN-γ的分泌增加p53的激活. P53能够通过介导肿瘤细胞的凋亡来抑制肿瘤的生长[7,8].
但是IL-12的全身应用给机体带来的不良反应较大如发热、恶心、呕吐白细胞减少等[9], 在小鼠或者猴子等动物模型中全身性使用IL-12可以产生可逆的、剂量依赖性的对外周血液的抑制(贫血、白细胞缺乏、血小板减少), 这些情况与脾大及其能致脾髓质造血功能亢进有关[10]. 在肾癌肿的IL-12全身性治疗的临床一期试验已经完成, 二期试验虽然由于明显的不良反应而阻滞, 但是毒性很快被其他方法所克服[11], 因此无法全身应用药物. 于是人们尝试在动物模型体内试验中, 在肿瘤局部皮下接种注射IL-12, 结果显示可增强局部肿瘤免疫反应使皮下肿瘤消退, 同时又不会导致循环血中的IL-12浓度过高. 但是, 由于肝内局部注射IL-12对操作要求较高, 半衰期短, 反复给药可致全身不良反应大且疗效也不够理想[12,13]. 随着分子生物学、免疫学和基因转移技术的发展, 人们尝试着通过新式的基因载体如腺病毒、逆转录病毒和疫苗病毒等来治疗肝脏肿瘤[14]. 因此, IL-12基因治疗的局部应用成为研究关键和难点.
本实验应用腺病毒(adenovirus, Adv)作载体, 将IL-12基因转染到HepG2细胞中, 观察体外HepG2细胞的生长、增殖、迁移和凋亡的作用. 并为日后进一步研究腺病毒携带IL-12增强HCC抗原致敏树突细胞提供理论依据.
重组人AdvIL-12和对照腺病毒载体Adv-绿色荧光蛋自(green fluorescent protein, GFP)由上海吉凯基因化学技术有限公司构建; HCC HepG2细胞株购自青医附院中心实验室细胞库; 培养液DMEM为美国Hyclone公司产品; 新生牛血清(newborn bovine serum, NBS, 杭州四季青生物工程材料有限公司); TUNEL(terminal deoxynucleotidylt ransferase dUTP nick end labelling)试剂盒购自promega北京生物技术有限公司.
1.2.1 细胞培养: (1)选生长良好, 约铺满80%瓶底的HepG2细胞, 吸弃培养瓶内的旧培养基; (2)用37 ℃ PBS液3-4 mL, 轻轻漂洗细胞, 以除去残留的培养基. 加入0.25%胰酶溶液l mL, 消化2-3 min, 镜下观察消化情况, 发现细胞胞质回缩, 细胞变圆、间隙增大时终止消化; (3)轻轻倒掉瓶内的胰酶溶液. 加入含10%FBS的培养基DMEM培养基10 mL, 用吸管轻轻吹打, 令细胞悬浮混匀, 制成单细胞悬液. 把此细胞悬液按1:3至1:4分装到无菌培养瓶中继续培养; (4)用含10%新生牛血清的DMEM培养液培养, 在饱和湿度, 37 ℃、5%CO2培养箱中培养, 待细胞完全帖壁生长后, 更换培养液1次, 以后每1-2 d换液1次, 视接种的细胞密度不同, 一般3-4 d长满瓶底80%, 可再次消化传代.
1.2.2 转染: (1)取对数期HepG2细胞用无血清的培养液将制成悬液, 接种于24孔板, 用感染性滴度为2×108 PFU/mL的AdvIL-12和Adv-GFP分别转染HepG2细胞; (2)于饱和湿度, 37 ℃、5%CO2培养箱中培养4 h后, 去上清液, 用PBS洗细胞1遍后加入含10%新生牛血清的DMEM培养液继续培养; (3)分别标记为AdvIL-12/HepG2细胞和Adv-GFP/HepG2细胞, 未转染的细胞标记为HepG2细胞.
1.2.3 细胞划痕试验: (1)先用marker笔在6孔板后面, 均匀笔直的划3道线. 将对数期HepG2细胞悬液接种于用marker笔标记过的6孔板中, 每孔约5×105个细胞, 置于饱和湿度, 37 ℃、5%CO2培养箱中培养; (2)待细胞覆盖孔底80%以上时, 大约6 h后在单层细胞表现用1 mL枪头在孔中垂直于培养板划痕划一直线, 然后用PBS清洗2次以去除划下的悬浮细胞, 去除上清液, 分别按1、0.1、0.01浓度将AdvIL-12和Adv-GFP加入6孔板中形成对照, 加入不含血清的培养基培养; (3)4 h后去上清液, 用PBS洗细胞1遍后加入含10%新生牛血清的DMEM培养液继续培养; (4)待12、24、48 h时分别观察显微镜观察划痕中细胞迁移情况.
1.2.4 结晶紫试验: (1)取对数期HepG2细胞悬液种于24孔板中, 置于饱和湿度, 37 ℃、5%CO2培养箱中培养; (2)待细胞覆盖孔底80%以上时, 按浓度10、1、 0.1、00.1、0.001、0.0001无血清培养液倍比稀释的AdvIL-12、Adv-GFP分别加入感染; (3)感染4 h后, 加入含血清培养液继续培养12 h, 倒掉培养液, 用PBS清洗1遍; (4)加入甲醇与乙酸按3:1比例混合液固定10 min后倒掉, 加入结晶紫染色液染10 min, 用吸管洗掉后蒸馏水清洗3遍, 晾干.
1.2.5 MTT法检测: (1)取对数生长期的HepG2细胞消化, 方法同上, 用计数板技术制成2×104/mL浓度的细胞悬液; (2)将细胞接种到96孔板中, 每孔200 μL, 约3×104个/孔的HepG2细胞分为3组, 感染组AdvIL-12, 感染组Adv-GFP和未感染组HepG2分别进行感染, 按浓度10、1、0.1、0.01、0.001无血清培养液倍比稀释培养4 h后; (3)弃上清, 加入含血清培养液继续培养后在12、24、48 h分别进行检测; (4)加入无血清培养基溶解的MTT(终质量浓度5 mg/L事先用PBS调节pH<7.4), 在37 ℃下孵育4 h, 然后用1 mL针管洗掉上清(防止将甲臜吸出, 再加入150 μL/孔 DMSO震荡10 min后使紫色结晶充分溶解; (5)用酶联免疫检测仪在490 nm处检测吸光度(A)值. 抑制率计算: 细胞生长抑制率 = [对照组平均A值-实验组平均A值]/对照组平均A值×100%.
1.2.6 TUNEL法检测: 将对数期HepG2细胞消化后, 用10%血清DMEM培养基制成1×106个/mL的细胞悬液, 种到单个25 cm2培养皿中(提前画圈), 如上法分3组加入病毒感染4 h后, 去上清, 加入含血清培养液继续培养12 h, 然后参考TUNEL试剂盒操作规范进行操作. (1)4%多聚甲醛固定25 min. 用PBS清洗3遍; (2)加入0.2%Tritonx-100通透细胞5 min, 用PBS清洗3遍; (3)在冰上加50 μL TUNEL孵育液: 平衡缓冲液44 μL, 核苷混合物5 μL, rTdT酶(在DNA的3羟基末端掺入荧光素-12-脱氧三磷酸尿苷即fluorescein-12-dUTP)重组末端脱氧核苷酸转移酶1 μL; 每组设阴性对照不加含rTdT的孵育缓冲液; (4)避光下37 ℃恒温箱内孵育60 min加尾反应; (5)加入柠檬酸钠缓冲液20×SSC稀释到2×SSC 15 min, PBS洗3次以除去掺入的荧光素-12-脱氧三磷酸尿苷; (6)加碘化丙啶(1 μg/mL)静置15 min; 去离子水洗3次; (7)在荧光显微镜下观察蓝色荧光和红色荧光.
统计学处理 将数据资料输入SPSS11.5统计软件进行分析, 对数据进行统计及检验. 数据结果以mean±SD差表示, 单因素方差分析比较有无显著性差异, P<0.01为差异有统计学意义.
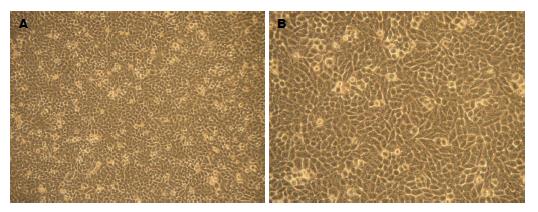
HepG2单层贴壁生长, 生长旺盛, 细胞轮廓清楚, 相互排列紧密, 连接成大片, 镜下观察为梭形, 胞浆均质透明, 折光性好, 胞间连接紧密. 高倍镜下显示细胞核大, 核质均匀, 核仁清晰可见(图1).
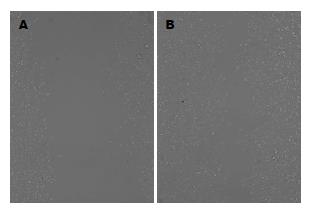
加入1 μL AdvIL-12作用24 h, 与对照试验Adv-GFP相比可见HepG2细胞迁移距离明显受到抑制, 且随浓度增大, HepG2细胞向划痕区移动的距离越来越小, 细胞数量越少, 划痕越宽, 浓度越少, 迁移的距离越大, 划痕越窄(图2).
实验组AdvIL-12结晶紫染色深度随浓度梯度减少而逐渐加深, 染色越深说明HepG2细胞存活越多, 生长越好, 病毒对细胞的杀伤力越弱. 取10 mL AdvIL-12时对HepG2细胞杀伤效果最为明显, 基本可完全杀灭HepG2细胞; 0.01 μL杀伤效果已不明显, 0.001 μL时基本对效果对HepG2细胞生长无明显影响. 对照实验Adv-GFP无染色浓度变化, 即对HepG2细胞生长无明显影响(图3).
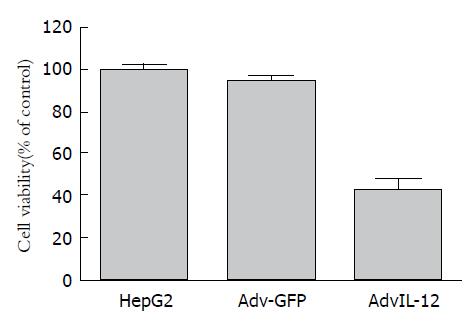
用酶标仪检测AdvIL-12组、Adv-GFP组和HepG2空白对照组分别在培养24、48、72 h后的A值如表1, 其在24、48、72 h各实验组A值(F1 = 95.7, F2 = 103.6, F3 = 165.8, P<0.01)与对照组相比有统计学意义, 且结果表明出现不同程度的生长抑制作用, 随时间和浓度呈逐渐升高趋势, 即在一定时间内, 病毒对HepG2细胞增殖能力的抑制能够随浓度增加而增强(图4).
| 分组 | 不同时间段 | ||||||||
| 24 h | F1 | P值 | 48 h | F2 | P值 | 72 h | F3 | P值 | |
| 10 μL | 0.444±0.005 | 0.356±0.041 | 0.501±0.050 | ||||||
| 1 μL | 0.443±0.007 | 0.445±0.019 | 0.721±0.028 | ||||||
| 0.1 μL | 0.442±0.006 | 0.552±0.034 | 0.968±0.081 | ||||||
| 0.01 μL | 0.447±0.005 | 0.628±0.028 | 0.980±0.081 | ||||||
| 0.001 μL | 0.446±0.005 | 0.651±0.042 | 1.158±0.085 | ||||||
| 对照组 | 0.450±0.006 | 95.7 | <0.01 | 0.745±0.023 | 103.6 | <0.01 | 1.324±0.052 | 165.8 | <0.01 |
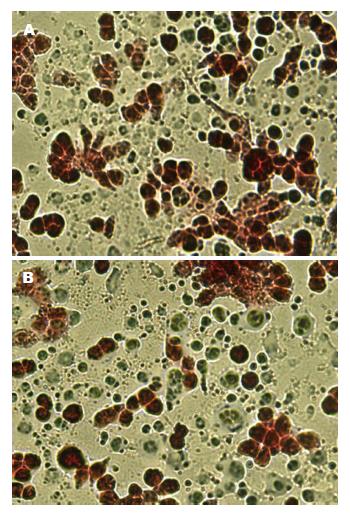
光镜下可见凋亡细胞明显固缩, 体积变小, 胞质致密, 核浓缩以致消失, 形成凋亡小体. 阳性结果由于凋亡的细胞DNA断裂而出现缺口, 在脱氧核糖核苷酸末端转移酶(rTdT)作用下与荧光素-12-脱氧三磷酸尿苷掺入而呈现出定位的绿色荧光, 聚集在核周边. 非凋亡, 正常生长的和凋亡但未与荧光素反应的HepG2细胞均可被碘化丙啶染色而成红色. 实验组AdvIL-12组凋亡细胞数量明显多于对照组Adv-GFP组(图5).
IL-12又称为细胞毒淋巴细胞成熟因子, 主要由抗原呈递细胞产生的异二聚体. 其中单核/巨噬细胞和B细胞是产生IL-12的主要细胞, 有很强的免疫调节作用[15].
首先, IL-12一方面快速磷酸化IFN-γ元件信号形成核内DNA结合物与转录活化因子3、4(signal transducers and activators of transduction, STAT3/4)和活化蛋白1(activator protein, AP-1)一起作用于IFN-γ激活位点元件, 诱导IFN-γ的分泌[16]和促进初始Th0向Th1细胞分化、增殖、调节机体免疫状态, 另外, 能够阻碍IL-4对IFN-γ合成的抑制, 间接促进IFN-γ分泌[17-19]; 其次, 高分泌的IFN-γ能促进NK细胞和CTL细胞的增殖和细胞不良反应, 使其处于有效发挥抗肿瘤作用的免疫应答状态[5]; 再次, IL-12介导的IFN-γ的分泌能够增加p53的激活并能够通过介导肿瘤细胞的凋亡来抑制肿瘤的生长能通过诱导肿瘤细胞凋亡[8]. 同时, IFN-γ能够刺激单核细胞, 内皮细胞和成纤维细胞合成CxCL10(IP-10)和CxCL9(Mig)等趋化因子, 来抑制新的血管的生成. 相关的体内IL-12试验结果表明肿瘤细胞中CxCL10和CxCL9的高表达, 同样也说明IL-12有促进抗肿瘤血管生成的作用[7,20]. 此外还能抑制肿瘤组织新生血管的生成对肿瘤直接抑制上调钙黏着蛋白(E-cadherin)和血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)水平, 抑制肿瘤细胞迁移[21].
由于全身应用IL-12的基因治疗全身不良反应大[22], 由于病毒载体具有转染效率高等优点而应用最多. 特别是腺病毒载体, 其作为载体具备高度感染性, 易培育出高浓度滴度, 由于E1区域被删除而无法提呈感染性复制, 并且由于只有约8 kb大小克隆片段, 而易扩增后插入任何克隆的细胞因子cDNAs[23], 因此高稳定性、高滴度、无插入、不整合突变等优点而使腺病毒被作为首选载体使用. 腺病毒载体发展经历了3代, 第1代腺病毒载体通过删除E1区域而表现出极强的免疫原性[24], 从而限制其用药剂量及用药次数. 第2代腺病毒载体通过降低免疫原性在第1代基础上发展, 但由于其感染力低所以没有得到广泛应用. 尽管基因治疗有许多不足, 但是由于他能够促进细胞因子的表达, 为抗肿瘤免疫治疗的发展提供辅助性刺激而成为近年所研究的方向. 近几年无肠腺病毒载体作为第3代腺病毒载体出现. 无肠腺病毒载体免疫原性大大减弱, 并且将所有编码病毒基因的序列全部去除, 只保留末端重复序列, 可携带36000 bp外源基因. 并已有学者通过HCC体外实验证实通过腺病毒介导IL-24基因在人HCC细胞中能够高表达, 能促使细胞增殖阻滞及诱导肿瘤细胞凋亡, 选择性杀伤HCC细胞[25-27]. Wang等[28]将腺病毒携带IL-12基因用来治疗小鼠原发性HCC, 其体内表达较为稳定, 最长可达一年, 显著抑制了HCC的生长及转移.
本实验通过用腺病毒携带IL-12转染HepG2细胞的划痕实验与对照试验Adv-GFP相比可见HepG2细胞迁移距离明显受到抑制, 且随浓度增大, HepG2细胞向划痕区移动的距离越来越小, 细胞数量越少, 划痕越宽, 浓度越少, 迁移的距离越大, 划痕越窄. 说明腺病毒携带IL-12能够明显限制HepG2细胞的迁移能力. 实验组AdvIL-12结晶紫染色深度随浓度梯度减少而逐渐加深, 染色越深说明HepG2细胞存活越多, 生长较好, 病毒对细胞的杀伤力越弱. 取10 μL AdvIL-12时对HepG2细胞杀伤效果最为明显, 基本可完全杀灭HepG2细胞; 0.01 μL杀伤效果已不明显, 0.001 μL时基本对效果对HepG2细胞生长无明显影响. 对照实验Adv-GFP无染色浓度变化, 对HepG2细胞生长无明显影响. 用酶标仪检测AdvIL-12组、Adv-GFP组和HepG2空白对照组分别在培养24、48、72 h后的A值如表1, 其在24、48、72 h各实验组A值(F1 = 95.7, F2 = 103.6, F3 = 165.8, P<0.01)与对照组相比有统计学意义, 且结果表明出现不同程度的生长抑制作用, 随时间和浓度呈逐渐升高趋势, 即在一定时间内, 病毒对HepG2细胞增殖能力的抑制能够随浓度增加而增强. 光镜下可见凋亡细胞明显固缩, 体积变小, 胞质致密, 核浓缩以致消失, 形成凋亡小体. 阳性结果由于凋亡的细胞DNA断裂而出现缺口, 在脱氧核糖核苷酸末端转移酶(rTdT)作用下与荧光素-12-脱氧三磷酸尿苷掺入而呈现出定位的绿色荧光, 聚集在核周边. 非凋亡, 正常生长的和凋亡但未与荧光素反应的HepG2细胞均可被碘化丙啶染色而成红色. 实验组AdvIL-12组凋亡细胞数量明显多于对照组Adv-GFP组.
上述实验在体外充分说明通过腺病毒携带IL-12能够对HepG2细胞的迁移能力、增殖、生长能力起到明显的抑制所用, 对其杀伤力较为明显; 且能有效促进HepG2细胞的凋亡.
目前, 大量研究表明IL-12在抗肿瘤免疫反应中起到重要作用. 但是IL-12在人类临床实验中作用效果仍然是不够理想的. 并且在晚期肿瘤中, IL-12在以往的研究中表明可能由于免疫抑制所支配的微环境而导致的效率低下[29]. 有关IL-12的新型药物实验的发展主要关注与如何减少IL-12明显的不良反应. 2011-07美国国家健康研究所批准了一期新型药物NHS-IL12用于对实体瘤的治疗. 这种药物通过选择性靶向运输IL-12作用于肿瘤细胞来减少其不良反应(http://clinica ltrials.gov/ct2/show/NCT01417546). 新型的NHS-IL-12由两个IL-12异构体构成, 每一条单链与NHS76中的H-链相连, 其具有与DNA单双链亲和的能力. 所以, NHS-IL-12能够靶向性将IL-12运送到DNA暴露的肿瘤区域. 可以预测这种药物的诞生将有助于避免IL-12的不良反应.
虽然肿瘤免疫研究取得了巨大进展, 但对肿瘤细胞究竟如何诱导免疫耐受并逃避免疫识别的确切机制尚未充分了解. 此外, 如何有效的将细胞因子运送到作用靶点, 并尽可能减少不良反应成为今后基因治疗肿瘤的研究重点之一; 以IL-12为基础的免疫治疗联合其他抗癌药物包括小分子靶向抑制剂, 替西罗莫司, 索拉菲尼和贝伐单抗等单克隆抗体联合应用将有着广泛前景. 可以预见不久的未来, 随着基因治疗载体、基因转移技术及基因表达调控系统的不断发展, 以IL-12为基础的基因治疗一定会为包括HCC在内的肿瘤治疗提供新的途径.
肝癌(hepatocellular carcinoma, HCC)是世界上最流行的癌症之一, 在癌症导致死亡的疾病中居第3位, 原发性HCC在我国高发, 目前我国发病人数约占全球的55%, 在肿瘤相关死亡中仅次于肺癌, 居第2位. 肝炎病毒感染导致的HCC估计可以达到全球HCC病例的78%. HCC具有发现较晚, 发展迅速, 侵袭性强, 转移早, 预后差的特点. 由于HCC通常发现时已晚, 已丧失最佳手术时机, 或可切除, 但可早期出现转移, 而切除效果不够理想, 对常规免疫治疗效果不够理想, 同时由于其对目前药物化学治疗不够敏感, 且不良反应较大, 所以开发一种新式, 有效的治疗方法成为当务之急.
郑鹏远, 教授, 主任医师, 博士生导师, 副院长, 郑州大学第二附属医院消化科
本文通过MTT方法在不同的时间点, 不同浓度的病毒证实腺病毒携带IL-12能够在不同程度上抑制HepG2细胞的生长, 并能够随时间和浓度呈逐渐升高趋势, 即在一定时间内, 病毒对HepG2细胞增殖能力的抑制能够随浓度增加而增强并用TUNEL方法来观察HCC细胞的凋亡取得较好的效果.
本文设计合理, 逻辑性强, 具有一定的理论意义和潜在的临床价值.
编辑: 田滢 电编:闫晋利
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006;45:529-538. [PubMed] [DOI] |
| 3. | Liu LX, Zhang WH, Jiang HC. Current treatment for liver metastases from colorectal cancer. World J Gastroenterol. 2003;9:193-200. [PubMed] |
| 4. | Nelson R, Freels S. Hepatic artery adjuvant chemotherapy for patients having resection or ablation of colorectal cancer metastatic to the liver. Cochrane Database Syst Rev. 2004;CD003770. [PubMed] [DOI] |
| 5. | Del Vecchio M, Bajetta E, Canova S, Lotze MT, Wesa A, Parmiani G, Anichini A. Interleukin-12: biological properties and clinical application. Clin Cancer Res. 2007;13:4677-4685. [PubMed] [DOI] |
| 6. | Coughlin CM, Salhany KE, Gee MS, LaTemple DC, Kotenko S, Ma X, Gri G, Wysocka M, Kim JE, Liu L. Tumor cell responses to IFNgamma affect tumorigenicity and response to IL-12 therapy and antiangiogenesis. Immunity. 1998;9:25-34. [PubMed] [DOI] |
| 7. | Kanegane C, Sgadari C, Kanegane H, Teruya-Feldstein J, Yao L, Gupta G, Farber JM, Liao F, Liu L, Tosato G. Contribution of the CXC chemokines IP-10 and Mig to the antitumor effects of IL-12. J Leukoc Biol. 1998;64:384-392. [PubMed] |
| 8. | Takaoka A, Hayakawa S, Yanai H, Stoiber D, Negishi H, Kikuchi H, Sasaki S, Imai K, Shibue T, Honda K. Integration of interferon-alpha/beta signalling to p53 responses in tumour suppression and antiviral defence. Nature. 2003;424:516-523. [PubMed] [DOI] |
| 9. | Veltri S, Smith JW. Interleukin 1 trials in cancer patients: a review of the toxicity, antitumor and hematopoietic effects. Stem Cells. 1996;14:164-176. [PubMed] [DOI] |
| 10. | Gately MK, Warrier RR, Honasoge S, Carvajal DM, Faherty DA, Connaughton SE, Anderson TD, Sarmiento U, Hubbard BR, Murphy M. Administration of recombinant IL-12 to nonnal mice enhances cytolytic lymphocytes activity and induces production of IFNy in vivo. Int Immunol. 1994;6:157-167. [PubMed] [DOI] |
| 12. | Car BD, Eng VM, Schnyder B, LeHir M, Shakhov AN, Woerly G, Huang S, Aguet M, Anderson TD, Ryffel B. Role of interferon-gamma in interleukin 12-induced pathology in mice. Am J Pathol. 1995;147:1693-1707. [PubMed] |
| 13. | Orange JS, Salazar-Mather TP, Opal SM, Spencer RL, Miller AH, McEwen BS, Biron CA. Mechanism of interleukin 12-mediated toxicities during experimental viral infections: role of tumor necrosis factor and glucocorticoids. J Exp Med. 1995;181:901-914. [PubMed] [DOI] |
| 14. | Pardoll DM. Paracrine cytokine adjuvants in cancer immunotherapy. Annu Rev Immunol. 1995;13:399-415. [PubMed] [DOI] |
| 15. | Suzuki S, Umezu Y, Saijo Y, Satoh G, Abe Y, Satoh K, Nukiwa T. Exogenous recombinant human IL-12 augments MHC class I antigen expression on human cancer cells in vitro. Tohoku J Exp Med. 1998;185:223-226. [PubMed] [DOI] |
| 16. | Foukas LC, Panayotou G, Shepherd PR. Direct interaction of major histocompatibility complex class II-derived peptides with class Ia phosphoinositide 3-kinase results in dose-dependent stimulatory effects. J Biol Chem. 2004;279:7505-7511. [PubMed] [DOI] |
| 17. | Kobayashi M, Fitz L, Ryan M, Hewick RM, Clark SC, Chan S, Loudon R, Sherman F, Perussia B, Trinchieri G. Identification and purification of natural killer cell stimulatory factor (NKSF), a cytokine with multiple biologic effects on human lymphocytes. J Exp Med. 1989;170:827-845. [PubMed] [DOI] |
| 18. | Robertson MJ, Soiffer RJ, Wolf SF, Manley TJ, Donahue C, Young D, Herrmann SH, Ritz J. Response of human natural killer (NK) cells to NK cell stimulatory factor (NKSF): cytolytic activity and proliferation of NK cells are differentially regulated by NKSF. J Exp Med. 1992;175:779-788. [PubMed] [DOI] |
| 19. | Gately MK, Wolitzky AG, Quinn PM, Chizzonite R. Regulation of human cytolytic lymphocyte responses by interleukin-12. Cell Immunol. 1992;143:127-142. [PubMed] [DOI] |
| 20. | Wigginton JM, Gruys E, Geiselhart L, Subleski J, Komschlies KL, Park JW, Wiltrout TA, Nagashima K, Back TC, Wiltrout RH. IFN-gamma and Fas/FasL are required for the antitumor and antiangiogenic effects of IL-12/pulse IL-2 therapy. J Clin Invest. 2001;108:51-62. [PubMed] [DOI] |
| 21. | Furbert-Harris PM, Parish-Gause D, Hunter KA, Vaughn TR, Howland C, Okomo-Awich J, Forrest K, Laniyan I, Abdelnaby A, Oredipe OA. Activated eosinophils upregulate the metastasis suppressor molecule E-cadherin on prostate tumor cells. Cell Mol Biol (Noisy-le-grand). 2003;49:1009-1016. [PubMed] |
| 22. | Leonard JP, Sherman ML, Fisher GL, Buchanan LJ, Larsen G, Atkins MB, Sosman JA, Dutcher JP, Vogelzang NJ, Ryan JL. Effects of single-dose interleukin-12 exposure on interleukin-12-associated toxicity and interferon-gamma production. Blood. 1997;90:2541-2548. [PubMed] |
| 23. | Bramson JL, Graham FL, Gauldie J. The use of adenoviral vectors for gene therapy and gene transfer in vivo. Curr Opin Biotechnol. 1995;6:590-595. [PubMed] [DOI] |
| 24. | Yang Y, Nunes FA, Berencsi K, Furth EE, Gönczöl E, Wilson JM. Cellular immunity to viral antigens limits E1-deleted adenoviruses for gene therapy. Proc Natl Acad Sci U S A. 1994;91:4407-4411. [PubMed] [DOI] |
| 25. | 王 从俊, 薛 新波, 易 继林, 陈 堃, 郑 建伟, 曾 建平, 许 荣华, 王 炜煜, 吴 在德. 腺病毒介导MDA-7/IL-24选择性杀伤肝癌细胞HepG2的研究. 中国普通外科杂志. 2006;15:849-854. |
| 26. | Peron JM, Couderc B, Rochaix P, Douin-Echinard V, Asnacios A, Souque A, Voigt JJ, Buscail L, Vinel JP, Favre G. Treatment of murine hepatocellular carcinoma using genetically modified cells to express interleukin-12. J Gastroenterol Hepatol. 2004;19:388-396. [PubMed] [DOI] |
| 27. | Satoh T, Saika T, Ebara S, Kusaka N, Timme TL, Yang G, Wang J, Mouraviev V, Cao G, Fattah el MA. Macrophages transduced with an adenoviral vector expressing interleukin 12 suppress tumor growth and metastasis in a preclinical metastatic prostate cancer model. Cancer Res. 2003;63:7853-7860. [PubMed] |
| 28. | Wang L, Hernández-Alcoceba R, Shankar V, Zabala M, Kochanek S, Sangro B, Kramer MG, Prieto J, Qian C. Prolonged and inducible transgene expression in the liver using gutless adenovirus: a potential therapy for liver cancer. Gastroenterology. 2004;126:278-289. [PubMed] [DOI] |