修回日期: 2013-08-08
接受日期: 2013-08-29
在线出版日期: 2013-10-18
目的: 探讨MUC1黏蛋白、MUC2黏蛋白在不同类型胃黏膜中的表达.
方法: 随机选取2011-11/2012-04就诊于青岛市市立医院病理诊断为慢性浅表性胃炎(不伴有肠化生)的患者30例、肠上皮化生患者30例, 胃癌患者48例, 用免疫组织化学的方法检测胃黏膜中MUC1黏蛋白和MUC2黏蛋白的表达.
结果: (1)肠上皮化生组患者与慢性浅表性胃炎组患者相比, 胃黏膜内MUC1黏蛋白的阳性表达率下降(P>0.05), 胃黏膜内MUC2黏蛋白的阳性表达率上升(P<0.05), 幽门螺杆菌(Helicobacter pylori, H. pylori)感染率升高(P>0.05); (2)胃癌组患者与肠上皮化生组患者相比, 胃黏膜内MUC1黏蛋白的阳性表达率下降(P>0.05), 胃黏膜内MUC2黏蛋白的阳性表达率下降(P<0.05), H. pylori感染率下降(P<0.05); (3)胃癌组患者与慢性浅表性胃炎组患者相比,胃黏膜内MUC1黏蛋白的阳性表达率下降(P>0.05), 胃黏膜内MUC2黏蛋白的阳性表达率上升(P<0.05), H. pylori感染率下降(P>0.05).
结论: 在胃黏膜癌变过程中MUC1黏蛋白表达下调, MUC2黏蛋白仅在肠上皮化生胃黏膜及胃癌中呈阳性表达, 这种现象的发生可能与胃癌的发生有关. H. pylori感染能导致胃黏膜MUC1黏蛋白的阳性表达率下降, MUC1黏蛋白可能有抗H. pylori感染的作用, H. pylori感染与MUC2黏蛋白的相关性需要进一步探讨.
核心提示: 与幽门螺杆菌(Helicobacter pylori, H. pylori)阴性患者相比H. pylori阳性患者胃黏膜MUC1黏蛋白表达阳性率降低, 提示H. pylori可能影响MUC1黏蛋白的表达; MUC2黏蛋白全部在杯状细胞表达, 在胃癌组织中表达阳性率降低, 提示MUC2黏蛋白可能与胃癌的发展有关, 他与H. pylori的相关性需要研究进一步的证实.
引文著录: 崔小强, 姜曼, 董全江, 高玉强, 解祥军, 战淑慧. 不同类型胃黏膜中MUC1黏蛋白和MUC2黏蛋白的表达. 世界华人消化杂志 2013; 21(29): 3112-3118
Revised: August 8, 2013
Accepted: August 29, 2013
Published online: October 18, 2013
AIM: To detect the expression of mucin-1 and mucin-2 in gastritis, intestinal metaplasia and gastric cancer.
METHODS: Thirty patients with gastritis (without intestinal metaplasia), thirty patients with intestinal metaplasia and forty-eight patients with gastric cancer, who were treated at our hospital from November 2011 to April 2012, were enrolled in this study. The expression of mucin-1 and mucin-2 in different types of gastric lesions was determined by immunohistochemistry.
RESULTS: The expression of mucin-1 in intestinal metaplasia was lower than that in gastritis (P > 0.05), but the expression of mucin-2 in intestinal metaplasia was higher than that in gastritis (P < 0.05). The rate of Helicobacter pylori (H. pylori) infection in intestinal metaplasia was higher than that in gastritis (P > 0.05). The expression of mucin-1 in gastric cancer was higher than that in intestinal metaplasia (P > 0.05), but the expression of mucin-2 in gastric cancer was lower than that in intestinal metaplasia (P < 0.05). The rate of H. pylori infection in gastric cancer was lower than that in intestinal metaplasia (P < 0.05). The expression of mucin-1 in gastric cancer was lower than that in gastritis (P > 0.05), but the expression of mucin-2 in gastric cancer was higher than that in gastritis (P < 0.05). The rate of H. pylori infection in gastric cancer was lower than that in gastritis (P > 0.05).
CONCLUSION: The expression of mucin-1 is down-regulated in the evolution of gastric cancer; however, the expression of mucin-2 is positive only in precancerous lesions and gastric cancer. This finding suggests that mucin-2 may be more closely related to the occurrence of gastric cancer. There is a negative correlation between expression of mucin-1 and H. pylori infection, but a positive correlation between mucin-2 expression and H. pylori infection.
- Citation: Cui XQ, Jiang M, Dong QJ, Gao YQ, Xie XJ, Zhan SH. Expression of mucin-1 and mucin-2 in different types of gastric lesions. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3112-3118
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3112.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3112
黏蛋白是高分子量糖蛋白, 分为膜结合型和分泌型两种形式, 具有多种功能, 如水化、保护、润滑人体内各种管腔的上皮细胞, 调控细胞信号传导及转录等[1-3]. 胃癌在我国的恶性肿瘤发病率和死亡率分别为第2、3位, 在世界上, 胃癌在美国的发病率为第7位, 是威胁人类健康常见的癌症之一[4]. 超过90%以上的胃癌是腺癌, 腺癌分为弥满型胃癌和肠型胃癌[5], 在肠型胃癌的发展过程中, 胃黏膜上皮经历了一系列的病理阶段, 包括慢性浅表性胃炎、萎缩性胃炎、肠上皮化生、异性增生、胃癌[6]. 正常胃黏膜可表达MUC1、MUC5AC、MUC6黏蛋白[7-9], MUC2黏蛋白是一种分泌型黏蛋白, 正常胃黏膜不表达[9,10]. 本实验通过免疫组织化学方法检测不同胃黏膜病变组织MUC1黏蛋白和MUC2黏蛋白的表达情况, 并对他们与幽门螺杆菌(Helicobacter pylori, H. pylori)感染的相关性作初步探讨, 旨在为胃癌的诊断、预防和治疗提供帮助.
随机选取青岛市市立医院病理科2011-11/2012-04诊断为慢性浅表性胃炎(不伴有肠化生)的胃黏膜标本30例, 肠化生胃黏膜标本30例, 胃癌手术标本48例. 标本的获取已通过当地医院的伦理批准或通过患者签署知情同意书.
1.2.1 免疫组织化学: 采用免疫组织化学SP法(streptavidin-perosidase法, 即链霉菌抗生物素蛋白-过氧化物酶连结法), MUC1黏蛋白和MUC2黏蛋白的一抗稀释溶度均为1:100. 主要试剂: 鼠抗人MUC1黏蛋白单克隆抗体浓缩液、鼠抗人MUC2黏蛋白单克隆抗体浓缩液, 均购自北京中杉金桥生物技术公司, 兔抗鼠快捷型酶标抗体、柠檬酸抗原修复液(pH 6.0)及DAB显色试剂盒均购自福州迈新生物技术开发公司. 所有标本均经过10%中性甲醛溶液固定, 常规脱水, 石蜡包埋, 2 μm厚连续切片, 免疫组织化学染色. 免疫组织化学染色步骤包括: 常规脱蜡脱水, 清水冲洗, 过氧化氢孵育10 min清除内源性过氧化物酶, 抗原热修复, 滴加一抗, 37 ℃孵育1 h, 滴加二抗, 常温下孵育10 min, DAB显色3-5 min, 苏木素复染, 二甲苯透明, 中性树胶封片. 实验中设立阴性对照和阳性对照, 以确保实验的特异性和可靠性. 所有的胃组织标本通过HE染色确定H. pylori阳性.
1.2.2 判定标准: 在光学显微镜下观察全片, 对切片染色阳性情况进行评估. 阳性细胞的判定标准: MUC1黏蛋白、MUC2黏蛋白阳性着色位于细胞浆, 着色呈棕黄或棕褐色颗粒, 细胞核不着色. 根据染色程度计分, 其中无色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分. 根据阳性细胞数计分, 阳性细胞数<10%为0分, 10%-30%为1分, 31%-50%为2分, >50%为3分. 染色程度计分与阳性细胞数计分相乘, 0分记为-, 1-3分记为+(弱阳性), 4-5分记为++(阳性), ≥6分记为+++(强阳性), 将弱阳性与阴性归为阴性, 将阳性与强阳性归为阳性.
统计学处理 数据经SPSS17.0软件进行统计学处理, MUC1黏蛋白和MUC2黏蛋白阳性表达的比较分析采用χ2检验, P<0.05为差异有统计学意义.
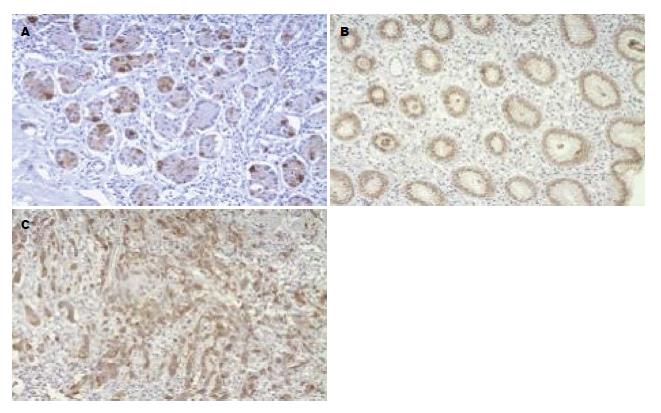
30例慢性浅表性胃炎胃黏膜中MUC1黏蛋白表达阳性率为93.33%, 表达于黏膜固有层腺体, 30例肠化生胃黏膜中MUC1黏蛋白表达阳性率为86.67%, 表达于黏膜固有层腺体, 48例胃癌组织中MUC1黏蛋白表达阳性率为79.17%, 表达于腺体腔缘、胃癌细胞浆. 慢性胃炎组、肠上皮化生组、胃癌组MUC1黏蛋白表达阳性率逐渐下降, 但三者间两两比较差异均无统计学意义(图1, 表1).
| 组织类型 | n | MUC1黏蛋白 | 阳性 | 阴性 | 阳性率(%) | χ2值 | P值 | |||
| (-) | (+) | (++) | (+++) | |||||||
| 慢性浅表性胃炎 | 30 | 0 | 2 | 8 | 20 | 2 | 28 | 93.33 | 0.185 | 0.667 |
| 肠上皮化生 | 30 | 0 | 4 | 9 | 17 | 4 | 26 | 86.67 | 0.288 | 0.592 |
| 胃癌 | 48 | 4 | 6 | 29 | 9 | 10 | 38 | 79.17 | 1.862 | 0.172 |
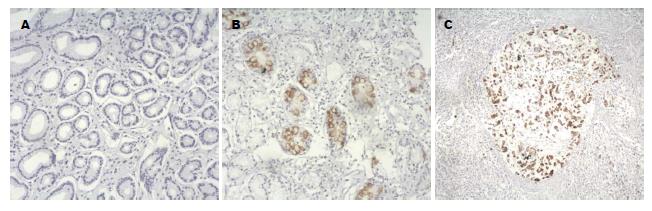
MUC2黏蛋白在30例慢性浅表性胃炎组织中不表达, 在30例肠化生胃黏膜中表达阳性率为93.33%, 表达于杯状细胞胞浆内, 48例胃癌组织中MUC2黏蛋白表达阳性率为31.25%, 表达于癌细胞胞浆内, 呈弥漫性分布, 细胞核内不表达. 肠上皮化生组和慢性浅表性胃炎组相比MUC2黏蛋白表达阳性率明显上升(P<0.05), 胃癌组较肠上皮化生组相比MUC2黏蛋白表达阳性率明显下降(P<0.05), 胃癌组较慢性浅表性胃炎组相比较阳性率明显上升(P<0.05)(图2, 表2).
慢性浅表性胃炎组H. pylori感染率为40.00%(12/30), 肠上皮化生组H. pylori感染率为63.33%(19/30), 胃癌组H. pylori感染率为37.50%(18/48), 慢性胃炎组与肠上皮化生组相比较H. pylori感染率差异无统计学意义(P>0.05), 肠上皮化生组与胃癌组H. pylori感染率差异有统计学意义(P<0.05), 慢性胃炎组与胃癌组相比H. pylori感染率差异无统计学意义(P>0.05)(表3).
| 分组 | n | H. pylori | n | MUC-1 | P值 | MUC-2 | P值 | MUC-1阳性率(%) | MUC-2阳性率(%) | H. pylori感染率(%) | P值 | ||
| (+) | (-) | (+) | (-) | ||||||||||
| 慢性浅表性胃炎 | 30 | 阳性 | 12 | 10 | 2 | 0.296 | 0 | 12 | 83.33 | 0.0 | 40 | 0.071 | |
| 阴性 | 18 | 18 | 0 | 0 | 18 | 100.0 | 0.0 | ||||||
| 肠上皮化生 | 30 | 阳性 | 19 | 17 | 2 | 0.970 | 16 | 3 | 1.00 | 89.47 | 84.21 | 63.33 | 0.026a |
| 阴性 | 11 | 9 | 2 | 9 | 2 | 100.0 | 81.82 | ||||||
| 胃癌 | 48 | 阳性 | 18 | 12 | 6 | 0.199 | 2 | 16 | 0.044 | 66.67 | 11.11 | 37.5 | 0.825 |
| 阴性 | 30 | 26 | 4 | 13 | 17 | 86.67 | 43.33 | ||||||
慢性胃炎组H. pylori感染患者胃黏膜MUC1黏蛋白的阳性表达率较无H. pylori感染患者下降(P>0.05), MUC2黏蛋白阳性表达率为0.0%, 而肠上皮化生组H. pylori感染患者胃黏膜MUC1黏蛋白的阳性表达率较无H. pylori感染患者下降(P>0.05), MUC2黏蛋白上升(P>0.05). 胃癌组H. pylori感染患者胃黏膜MUC1黏蛋白的阳性表达率较无H. pylori感染患者下降(P>0.05), 但MUC2黏蛋白表达阳性率下降(P<0.05).
胃癌的发展过程经历了慢性浅表性胃炎、萎缩性胃炎、肠上皮化生、异性增生、胃癌一系列病理阶段[6]. 黏蛋白是分布在人体消化系的高分子量糖蛋白, 对上皮细胞起重要的保护和润滑作用. 按结构特点黏蛋白分为细胞表面型和凝胶形成型[11], 前者研究比较多的黏蛋白是MUC1黏蛋白, 后者研究则集中在MUC2黏蛋白.
MUC1黏蛋白是一种细胞表面型黏蛋白, 可表达于正常人胃黏膜, 在胃窦部的表层黏膜上皮广泛表达, 在胃窦部幽门腺和胃体腺中呈灶状表达[12]. 2006年Wang和Fang[13]通过免疫组织化学方法研究了中国重庆地区胃癌患者MUC1黏蛋白表达情况, 结果发现46例胃癌患者胃癌组织MUC1黏蛋白阳性表达率63.04%, 胃癌前病变组织MUC1黏蛋白阳性表达率51.35%. 本研究通过免疫组织化学法检测了MUC1黏蛋白在慢性浅表性胃炎癌变过程中的表达情况, 结果显示MUC1黏蛋白在慢性浅表性胃炎、肠上皮化生胃黏膜、胃癌组织中的阳性表达率分别为93.33%、86.67%、79.17%, 阳性表达率逐渐降低, 研究结果与上述文献报道不同, 原因可能与研究对象的饮食习惯、遗传、H. pylori感染及种族差异有关[14]. 因胃癌的发生是一个多因素、多步骤的复杂过程, H. pylori作为胃癌的Ⅰ类致癌原, 是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤和胃癌的主要致病因素, 大约70%的胃癌被认为是由H. pylori引起的[15]. 黏蛋白可能参与了H. pylori感染机制并影响H. pylori的定植[16,17], 2010年Radziejewska等[18]通过酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)方法检测了13例胃液标本中MUC1黏蛋白存在情况及H. pylori与MUC1黏蛋白的黏附情况, 结果显示所有被检测的胃液标本中都含有MUC1黏蛋白, 而且H. pylori都可以与MUC1黏蛋白相黏附, 提示H. pylori感染可以导致MUC1黏蛋白表达降低[19], 2008年Radziejewska等[20]通过Western blot方法检测了H. pylori治疗对胃炎患者胃液中MUC1黏蛋白的影响, 结果显示在治疗之前几乎所有患者胃液中MUC1黏蛋白的含量都较低, 而在治疗末期所有患者胃液中MUC1黏蛋白的含量均有升高, 提示H. pylori可以抑制细胞膜MUC1黏蛋白的表达. MUC1黏蛋白能够为胃黏膜提供保护性屏障, 限制H. pylori定植于胃黏膜上皮表面以及H. pylori导致的炎症[21]. 已经有研究证实MUC1黏蛋白在胃组织中的表达与H. pylori相关疾病的发生呈负相关[22]. 2002年Vinall等[23]使用免疫组织化学方法分析了欧洲人群中胃炎患者胃上皮MUC1黏蛋白表达情况, 结果显示41例H. pylori阴性胃炎患者中胃上皮MUC1黏蛋白表达阳性率为82.93%, 而在36例H. pylori阳性胃炎患者的MUC1黏蛋白表达阳性率为0%. 2006年Wang和Fang[13]通过免疫组织化学方法研究了中国重庆地区胃癌患者MUC1黏蛋白表达情况, 结果显示H. pylori阳性患者中50%胃癌组织表达MUC1黏蛋白, 33.33%胃癌前组织表达MUC1黏蛋白, H. pylori阴性患者中, 80%患者胃癌组织表达MUC1黏蛋白, 68.8%胃癌前组织表达MUC1黏蛋白, 提示与H. pylori阴性胃病变组织相比, MUC1黏蛋白在H. pylori阳性胃癌前病变和胃癌组织的表达率显著下降. 本研究通过免疫组织化学方法检测了青岛地区慢性胃炎组、肠上皮化生组、胃癌组患者中H. pylori(+)组和H. pylori(-)组MUC1黏蛋白的表达阳性率, 结果显示各组中H. pylori(+)患者胃黏膜MUC1黏蛋白的阳性表达率较H. pylori(-)患者下降, 与以上文献报道一致.
MUC2黏蛋白是一种凝胶形成型黏蛋白, 是形成结肠黏液层的主要黏蛋白, 正常胃黏膜不表达[9,10]. 1999年Reis等[24]通过免疫组织化学方法检测了胃黏膜肠化生组织MUC2黏蛋白的表达情况, 结果显示在不完全肠化或肠化组织中都有MUC2黏蛋白的表达, 而且几乎都表达于杯状细胞内. 2006年Barresi等[25]使用免疫组织化学方法检测MUC2黏蛋白在胃癌组织中的表达阳性率, 结果显示37例胃癌组织中其阳性表达率为48.65%. 本研究发现MUC2黏蛋白全部在肠上皮化生胃黏膜中杯状细胞中表达, 在慢性浅表性胃炎胃黏膜中不表达, 而在胃癌组织中的表达阳性率为31.25%, 表明MUC2黏蛋白和胃癌的发展相关. MUC2黏蛋白在不同组织类型胃癌组织中的阳性表达率有显著差异, 中高分化腺癌阳性率高于低分化腺癌、印戒细胞癌、黏液腺癌, 并且在黏液腺癌中呈高表达, 推断MUC2黏蛋白可能与胃癌的组织学分型、预后及肿瘤的进展相关, 本研究为新的胃黏膜癌变发展监测及临床预后新指标的研究提供了理论基础[26,27]. 2008年Kazuyuki Matsuda等[28]使用实时逆转录聚合酶链反应(Real-time reverse transcription-polymerase chain reaction, RT-PCR)检测了H. pylori感染对不同胃癌细胞系MUC2黏蛋白mRNA水平的影响, 结果显示H. pylori感染诱导或不改变胃癌细胞MUC2黏蛋白mRNA的表达. 2013年Michaël Perrais等[29]使用细胞感染的体外模型研究了H. pylori的尿素酶、鞭毛蛋白及毒力因子CagA对MUC2基因调控的影响, 结果显示胃癌细胞H. pylori的感染可以改变MUC2基因的转录. 本研究发现慢性胃炎组、肠上皮化生组、胃癌组中H. pylori(+)患者胃黏膜MUC2黏蛋白的阳性表达率较H. pylori(-)患者相比, 无明显规律性, 因此H. pylori感染与胃黏膜中MUC2黏蛋白表达的关系需要研究进一步的证实.
MUC1黏蛋白和MUC2黏蛋白作为黏蛋白家族的重要成员与胃癌的相关性日益受到关注, 幽门螺杆菌(Helicobacter pylori, H. pylori)作为胃癌的Ⅰ类致病原与胃癌的发展关系密切, 本研究旨在揭示MUC1黏蛋白和MUC2黏蛋白在不同类型胃黏膜的表达以及与H. pylori的关系.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
目前关于MUC1黏蛋白和MUC2黏蛋白与胃癌的关系的报道已有较多, 然而他们与胃癌发生的机制的相关性尚不清楚. MUC1黏蛋白和MUC2黏蛋白是否参与了胃癌的发展、H. pylori感染机制以及他们与H. pylori的相关性仍需进一步探讨.
Radziejewska等通过研究发现根治胃炎患者H. pylori感染后胃液中MUC1黏蛋白的含量会升高; Michaël Perrais等通过研究发现H. pylori的尿素酶、鞭毛蛋白及毒力因子CagA可以影响MUC2基因转录, 提示MUC1黏蛋白和MUC2黏蛋白参与了H. pylori感染机制.
本研究通过免疫组织化学技术检测了沿海青岛地区MUC1和MUC2黏蛋白在胃癌发展阶段不同类型胃黏膜的表达情况, 并探讨他们与H. pylori的相关性.
MUC1和MUC2黏蛋白可能与胃癌的发展相关, 他们的表达异常可能作为胃癌诊断的生物学指标对胃癌的治疗及预后提供理论基础.
本文内容充实, 具有一定意义.
编辑: 田滢 电编:鲁亚静
| 1. | Hattrup CL, Gendler SJ. Structure and function of the cell surface (tethered) mucins. Annu Rev Physiol. 2008;70:431-457. [PubMed] |
| 2. | Bafna S, Kaur S, Batra SK. Membrane-bound mucins: the mechanistic basis for alterations in the growth and survival of cancer cells. Oncogene. 2010;29:2893-2904. [PubMed] [DOI] |
| 3. | Kim YS, Gum J, Brockhausen I. Mucin glycoproteins in neoplasia. Glycoconj J. 1996;13:693-707. [PubMed] |
| 4. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 5. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. an attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] |
| 6. | Chiba T, Marusawa H, Seno H, Watanabe N. Mechanism for gastric cancer development by Helicobacter pylori infection. J Gastroenterol Hepatol. 2008;23:1175-1181. [PubMed] [DOI] |
| 7. | De Bolós C, Garrido M, Real FX. MUC6 apomucin shows a distinct normal tissue distribution that correlates with Lewis antigen expression in the human stomach. Gastroenterology. 1995;109:723-734. [PubMed] |
| 8. | Reis CA, David L, Nielsen P. Immunohistochemical study of MUC5AC expression in human gastric carcinomas using a novel monoclonal antibody. Int J Cancer. 1997;74:112-121. |
| 9. | Piafsky KM, Borgá O, Odar-Cederlöf I, Johansson C, Sjöqvist F. Increased plasma protein binding of propranolol and chlorpromazine mediated by disease-induced elevations of plasma alpha1 acid glycoprotein. N Engl J Med. 1978;299:1435-1439. [PubMed] |
| 10. | Ho SB, Niehans GA, Lyftogt C, Yan PS, Cherwitz DL, Gum ET, Dahiya R, Kim YS. Heterogeneity of mucin gene expression in normal and neoplastic tissues. Cancer Res. 1993;53:641-651. [PubMed] |
| 11. | McGuckin MA, Lindén SK, Sutton P, Florin TH. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. 2011;9:265-278. [PubMed] [DOI] |
| 13. | Wang RQ, Fang DC. Effects of Helicobacter pylori infection on mucin expression in gastric carcinoma and pericancerous tissues. J Gastroenterol Hepatol. 2006;21:425-431. [PubMed] [DOI] |
| 14. | Palli D. Epidemiology of gastric cancer: an evaluation of available evidence. J Gastroenterol. 2000;35 Suppl 12:84-89. [PubMed] |
| 15. | Lindén SK, Sheng YH, Every AL, Miles KM, Skoog EC, Florin TH, Sutton P, Mc Guckin MA. MUC1 Limits Helicobacter pylori infection both by steric hindr ance and by acting as a releasable decoy. PLoS Pathog. 2009;5:e1000617. [PubMed] [DOI] |
| 16. | Radziejewska I, Borzym-Kluczyk M, Namiot Z, Stefańska E. Glycosylation of mucins present in gastric juice: the effect of helicobacter pylori eradication treatment. Clin Exp Med. 2011;11:81-88. [PubMed] [DOI] |
| 17. | Morgenstern S, Koren R, Moss SF, Fraser G, Okon E, Niv Y. Does Helicobacter pylori affect gastric mucin expression? Relationship between gastric antral mucin expression and H. pylori colonization. Eur J Gastroenterol Hepatol. 2001;13:19-23. [PubMed] [DOI] |
| 18. | Radziejewska I, Leszczyńska K, Borzym-Kluczyk M, Namiot Z. Assessment of interactions between mucins of gastric juice and Helicobacter pylori--preliminary study. Hepatogastroenterology. 2010;57:367-371. [PubMed] |
| 19. | Byrd JC, Yunker CK, Xu QS, Sternberg LR, Bresalier RS. Inhibition of gastric mucin synthesis by Helicobacter pylori. Gastroenterology. 2000;118:1072-1079. [PubMed] [DOI] |
| 20. | Radziejewska I, Borzym-Kluczyk M, Kisiel DG, Namiot Z, Gindzieński A. The influence of Helicobacter pylori patients' treatment on MUC 1 content in gastric juice. Hepatogastroenterology. 2008;55:1887-1889. [PubMed] |
| 21. | McGuckin MA, Every AL, Skene CD, Linden SK, Chionh YT, Swierczak A, McAuley J, Harbour S, Kaparakis M, Ferrero R. Muc1 mucin limits both Helicobacter pylori colonization of the murine gastric mucosa and associated gastritis. Gastroenterology. 2007;133:1210-1218. [PubMed] [DOI] |
| 22. | Guang W, Ding H, Czinn SJ, Kim KC, Blanchard TG, Lillehoj EP. Muc1 cell surface mucin attenuates epithelial inflammation in response to a common mucosal pathogen. J Biol Chem. 2010;285:20547-20557. [PubMed] [DOI] |
| 23. | Vinall LE, King M, Novelli M, Green CA, Daniels G, Hilkens J, Sarner M, Swallow DM. Altered expression and allelic association of the hypervariable membrane mucin MUC1 in Helicobacter pylori gastritis. Gastroenterology. 2002;123:41-49. [PubMed] [DOI] |
| 24. | Reis CA, David L, Correa P, Carneiro F, de Bolós C, Garcia E, Mandel U, Clausen H, Sobrinho-Simões M. Intestinal metaplasia of human stomach displays distinct patterns of mucin (MUC1, MUC2, MUC5AC, and MUC6) expression. Cancer Res. 1999;59:1003-1007. [PubMed] |
| 25. | Barresi V, Vitarelli E, Grosso M, Tuccari G, Barresi G. Relationship between immunoexpression of mucin peptide cores MUC1 and MUC2 and Lauren's histologic subtypes of gastric carcinomas. Eur J Histochem. 2006;50:301-309. [PubMed] |
| 26. | Babu SD, Jayanthi V, Devaraj N, Reis CA, Devaraj H. Expression profile of mu cins(MUC2,MUC5AC and MUC6)in Helicobacter pylori infected preneoplasti c and neoplastic human gastric epithelium. Molecular Cancer. 2006;5:10. [PubMed] [DOI] |
| 27. | İlhan Ö, Han Ü, Önal B, Çelık SY. Prognostic significance of MUC1, MUC2 and MUC5AC expressions in gastric carcinoma. Turk J Gastroenterol. 2010;21:345-352. [PubMed] |
| 28. | Matsuda K, Yamauchi K, Matsumoto T, Sano K, Yamaoka Y, Ota H. Quantitative analysis of the effect of Helicobacter pylori on the expressions of SOX2, CDX2, MUC2, MUC5AC, MUC6, TFF1, TFF2, and TFF3 mRNAs in human gastric carcinoma cells. Scand J Gastroenterol. 2008;43:25-33. [PubMed] |
| 29. | Perrais M, Rousseaux C, Ducourouble MP, Courcol R, Vincent P, Jonckheere N, Van Seuningen I. Helicobacter pylori urease and flagellin alter mucin gene expression in human gastric cancer cells. Gastric Cancer. 2013; May 24. [Epub ahead of print]. [PubMed] |