修回日期: 2013-08-28
接受日期: 2013-09-06
在线出版日期: 2013-10-18
目的: 初步探讨二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)抑制剂治疗小鼠溃疡性结肠炎(ulcerative colitis, UC)的作用机制.
方法: 将30只♂Balb/c小鼠随机分为空白对照组、模型对照组、DPP-4抑制剂治疗组、柳氮磺砒啶(sulfasalazine, SASP)治疗组、DPP-4抑制剂和SASP联合治疗组. 除空白对照组外, 其余各组用5%葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导小鼠UC模型, 空白对照组和模型对照组给予0.5%羧甲基纤维素(carboxymethyl cellulose, CMC)灌胃, DPP-4抑制剂组、SASP组、联合治疗组分别给予西格列汀、SASP及两者联合灌胃治疗, 1次/d, 每天记录小鼠疾病活动指数(disease activity index, DAI)值, 6 d后处死小鼠, 分离结肠组织, 进行病理组织学观察, 检测结肠组织髓过氧化物酶(myeloperoxidase, MPO)活性, 采用ELISA法测定小鼠血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-10(interleukin-10, IL-10)、胰高血糖素样肽-2(glucagon-like peptid-2, GLP-2)水平.
结果: 与模型对照组MPO活性(1.81 U/g±0.23 U/g)相比, DPP-4抑制剂组(1.20 U/g±0.19 U/g)、SASP组(0.96 U/g±0.07 U/g)、联合治疗组(0.81 U/g±0.06 U/g)MPO活性均显著降低(P<0.01); 与模型对照组血清TNF-α水平(106.86 ng/L±17.02 ng/L)相比, DPP-4抑制剂组(81.24 ng/L±9.12 ng/L)、SASP组(67.86 ng/L±9.32 ng/L)、联合治疗组(53.37 ng/L±9.08 ng/L)血清TNF-α水平均显著降低(P<0.01); 与模型对照组血清GLP-2水平(33.10 pmol/L±3.22 pmol/L)相比, DPP-4抑制剂组(55.07 pmol/L±4.43 pmol/L)及联合治疗组(58.07 pmol/L±5.43 pmol/L)血清GLP-2水平显著升高(P<0.01); 与模型对照组血清IL-10水平(38.20 pg/mL±2.61 pg/mL)相比, SASP组(58.10 pg/mL±2.72 pg/mL)及联合治疗组(60.68 pg/mL±2.35 pg/mL)血清IL-10水平显著升高(P<0.01).
结论: DPP-4抑制剂通过抗炎和升高血清GLP-2水平, 达到修复结肠炎黏膜损伤的作用, 其抗炎机制与SASP作用机制不同, DPP-4抑制剂与SASP联合用药在治疗小鼠UC方面存在协同作用.
核心提示: 近年来国内外研究表明, 二肽基肽酶-4(dipeptidyl peptidase-4)抑制剂对溃疡性结肠炎(ulcerative colitis, UC)模型小鼠有明显的治疗作用, 其作用机制是通过提高小鼠血清胰高血糖素样肽-2(glucagon-like peptid-2)水平, 修复肠黏膜病理损伤, 同时显著缓解小鼠结肠局部及全身炎症程度, 其抗炎机制不依赖于白介素-10(interleukin-10), 与柳氮磺砒啶(sulfasalazine)联合应用具有协同作用.
引文著录: 李海素, 杨崇美. 二肽基肽酶-4抑制剂治疗小鼠溃疡性结肠炎的机制. 世界华人消化杂志 2013; 21(29): 3102-3106
Revised: August 28, 2013
Accepted: September 6, 2013
Published online: October 18, 2013
AIM: To investigate the mechanisms underlying therapeutic effects of dipeptidyl peptidase-4 (DPP-4) inhibitor against ulcerative colitis in mice.
METHODS: Thirty male Balb/c mice were randomly divided into five groups: a normal group, an experimental colitis group, a DPP-4 inhibitor treatment group, a sulfasalazine (SASP) treatment group, and a DPP-4 inhibitor plus SASP treatment group. Ulcerative colitis was induced in mice with 5% dextran sulfate sodium. The normal group and experimental colitis group were intragastrically given 0.5% carboxymethyl cellulose (CMC), and the DPP-4 inhibitor group, SASP group and DPP-4 inhibitor plus SASP group were given sitagliptin, SASP, and both the two drugs once a day, respectively. Disease activity index (DAI) was assessed every day. After six days, all mice were sacrificed. Colonic pathological changes, myeloperoxidase (MPO) activity and serum levels of tumor necrosis factor-α (TNF-α), interleukin-10 (IL-10) and glucagon-like peptid-2 (GLP-2) were detected.
RESULTS: MPO activity and serum TNF-α level in the DPP-4 inhibitor group, SASP group and the combination group were significantly lower than those in the experimental colitis group (MPO activity: 1.20 U/g ± 0.19 U/g, 0.96 U/g ± 0.07 U/g, 0.81 U/g ± 0.06 U/g vs 1.81 U/g ± 0.23 U/g, all P < 0.01; 81.24 ng/L ± 9.12 ng/L, 67.86 ng/L ± 9.32 ng/L, 53.37 ng/L ± 9.08 ng/L vs 106.86 ng/L ± 17.02 ng/L, all P < 0.01). Serum GLP-2 level was significantly higher in the DPP-4 inhibitor group and the combination group than in the experimental group (55.07 pmol/L ± 4.43 pmol/L, 58.07 pmol/L ± 5.43 pmol/L vs 33.10 pmol/L ± 3.22 pmol/L, both P < 0.01). Serum IL-10 level was significantly higher in the SASP group and the combination group than in the experimental group (58.10 pg/mL ± 2.72 pg/mL, 60.68 pg/mL ± 2.35 pg/mL vs 38.20 pg/mL ± 2.61 pg/mL, both P < 0.01).
CONCLUSION: DPP-4 inhibitor has a synergistic effect with SASP possibly by exerting an anti-inflammatory effect and up-regulating serum level of GLP-2.
- Citation: Li HS, Yang CM. Mechanisms underlying therapeutic effects of DPP-4 inhibitor against ulcerative colitis in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3102-3106
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3102
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性炎症性肠病, 临床以腹痛、腹泻、粘液脓血便为主要表现, 其发病机制尚不完全明确, 目前临床主要用药为5-氨基水杨酸类、糖皮质激素类及免疫抑制剂[1], 长期应用不良反应大, 患者依从性差, 易复发, 因此开发治疗UC的新药物成为研究热点. 二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)抑制剂是治疗2型糖尿病的新型药物[2], 近年来国内外研究表明其对UC模型小鼠有明显治疗作用[3-5], 但具体机制不明. 本实验利用葡聚糖硫酸钠(dextran sulfate sodium, DSS)建立小鼠UC模型, 分别给予DPP-4抑制剂(西格列汀)、柳氮磺胺吡啶(sulfasalazine, SASP)及两者联合用药, 观察小鼠结肠髓过氧化物酶(myeloperoxidase, MPO)活性, 血清胰高血糖素样肽-2(glucagon-like peptid 2, GLP-2)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-10(interleukin-10, IL-10)水平变化, 初步探讨DPP-4抑制剂治疗UC的相关机制.
清洁级♂Balb/c小鼠30只, 7-8周龄, 体质量21.0-25.5 g, 由山东大学实验动物中心提供. DSS(分子量36000-50000)由美国MP公司生产, 用蒸馏水配成5%浓度溶液备用. 捷诺维(磷酸西格列汀片, 100 mg/片)由德国默克公司生产, 用0.5%羧甲基纤维素(CMC)配成相应浓度的混悬液备用. SASP(250 mg/片)由上海三维制药有限公司生产, 用刀片刮去包衣壳, 切碎后用0.5%CMC配成相应浓度的混悬液备用. 邻联甲苯胺由上海亭新化工试剂厂生产, 取1 g邻联甲苯胺溶于冰乙酸及无水乙醇各50 mL的混合液中, 置于棕色瓶中, 保存于4 ℃冰箱备用. MPO试剂盒购自南京建成生物工程研究所; TNF-α酶联免疫检测(ELISA)试剂盒、IL-10 ELISA试剂盒购自北京达科为生物技术有限公司; GLP-2 ELISA试剂盒购自BIO SWAMP公司.
1.2.1 实验分组及干预: Balb/c小鼠适应性喂养1 wk, 按照随机分组原则分为空白对照组、模型对照组、DPP-4抑制剂治疗组、SASP治疗组、DPP-4抑制剂和SASP联合治疗组, 每组6只. 空白对照组小鼠正常饮水、进食, 给予0.5%CMC 0.1 mL灌胃1次/d, 连续6 d; 其余各组自由饮用5%DSS溶液, 模型对照组给予0.5%CMC 0.1 mL灌胃, SASP治疗组每天给予500 mg/kg SASP 0.1 mL灌胃, DPP-4抑制剂治疗组每天给予20 mg/kg西格列汀0.1 mL灌胃, 联合治疗组每天给予500 mg/kg SASP+20 mg/kg西格列汀共0.1 mL灌胃, 均1次/d, 连续6 d后处死小鼠.
1.2.2 标本采集及DAI评分: 每日观察并记录小鼠的体质量和大便情况, 大便隐血检测采用邻联甲苯胺法, 疾病活动指数(disease activity index, DAI) = (体质量减轻率分数+粪便性状分数+隐血程度分数)/3. 小鼠药物治疗6 d后摘眼球取血, 静置30 min后, 3000 r/min离心20 min, 分离血清, 置于-80 ℃冰箱待测. 处死小鼠, 取完整结肠, 将结肠纵形剖开, 用生理盐水冲洗干净, 分为两部分, 一部分经4%甲醛固定、石蜡包埋、连续切片, 做HE染色观察结肠损伤情况; 另一部分置于-80 ℃冰箱中备用于MPO值的检测.
1.2.3 结肠MPO值及血清TNF-α、IL-10、GLP-2检测: 结肠MPO值严格按照MPO试剂盒说明书进行检测, 血清TNF-α、IL-10、GLP-2水平检测则利用ELISA法按照试剂盒说明书操作, 用酶标仪测定结果, 在450 nm处测定A值, 转化为浓度.
统计学处理 应用SPSS16.0软件处理实验数据, 计量资料以mean±SD表示; 多组间样本均数比较采用单因素方差分析, 符合方差齐性检验, 组间两两比较用LSD法; 不符合方差齐性检验, 组间两两比较用Dunnett's T3法, P<0.05为差异有统计学意义.
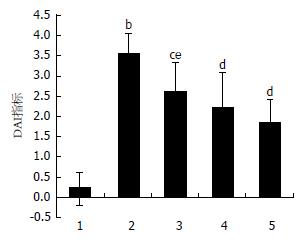
比较各组小鼠实验最后1 d DAI评分, 与空白对照组相比, 模型对照组显著升高(P<0.01); 与模型对照组相比, DPP-4抑制剂组、SASP组及联合治疗组均显著降低(分别P<0.05, P<0.01, P<0.01); 与联合治疗组相比, DPP-4抑制剂组显著升高(P<0.05), SASP组有升高趋势, 但差异不显著(P>0.05)(图1).
空白对照组小鼠结肠黏膜上皮连续、完整, 腺体排列规则, 黏膜、固有层、肌层未见明显异常; 模型对照组小鼠结肠黏膜充血、水肿, 局部黏膜脱落, 溃疡形成, 偶见隐窝脓肿, 大量炎性细胞浸润, 严重者侵及肌层及浆膜层; 与模型对照组相比, 各用药组小鼠结肠炎症均有不同程度的减轻, 尤其联合用药组, 仅局部可见少量炎性细胞浸润.
与空白对照组相比, 模型对照组小鼠结肠组织MPO值、血清TNF-α、IL-10水平显著升高(P<0.01), 血清GLP-2水平有升高趋势, 但差异不显著(P>0.05, 表1).
| 分组 | MPO(U/g) | TNF-α(ng/L) | IL-10(pg/mL) | GLP-2(pmol/L) |
| 空白对照组 | 0.60±0.05 | 35.06±9.40 | 21.67±2.63 | 29.95±3.55 |
| 模型对照组 | 1.81±0.23b | 106.86±17.02b | 38.20±2.61b | 33.10±3.22 |
| DPP-4抑制剂组 | 1.20±0.19de | 81.24±9.12df | 39.29±2.83f | 55.07±4.43d |
| SASP治疗组 | 0.96±0.07de | 67.86±9.32de | 58.10±2.72d | 31.90±5.09f |
| 联合治疗组 | 0.81±0.06d | 53.37±9.08d | 60.68±2.35d | 58.07±5.43d |
与模型对照组相比, DPP-4抑制剂组小鼠结肠MPO值、血清TNF-α水平显著降低(P<0.01), 血清GLP-2水平显著升高(P<0.01); SASP组小鼠结肠组织MPO值、血清TNF-α水平显著降低(P<0.01), 血清IL-10水平显著升高(P<0.01); 联合治疗组小鼠结肠组织MPO值、血清TNF-α水平显著降低(P<0.01), 血清IL-10、GLP-2水平显著升高(P<0.01).
与DPP-4抑制剂组相比, 联合治疗组小鼠结肠组织MPO值、血清TNF-α水平显著降低(分别P<0.05, P<0.01), 血清IL-10水平显著升高(P<0.01); 与SASP组相比, 联合治疗组小鼠结肠组织MPO值、血清TNF-α水平显著降低(P<0.05), 血清GLP-2水平显著升高(P<0.01).
本实验用5%DSS诱导小鼠UC模型, 模型对照组小鼠DAI指标显著高于正常对照组, 结肠病理组织示黏膜充血水肿, 溃疡形成, 大量炎性细胞浸润, 预示着结肠炎建模成功. 与模型对照组相比, 各治疗组DAI指标显著降低, 结肠病理示炎症明显缓解, 尤其联合治疗组小鼠结肠炎症缓解最为明显, 表明DPP-4抑制剂对UC小鼠有较好的治疗效果, 与SASP联合治疗存在协同作用. Ban等[3]、Yazbeck等[4,5]分别用不同的DPP-4抑制剂治疗DSS诱导的UC小鼠均得到了与本实验相同的结论, 我国的一项研究, 用阿格列汀治疗三硝基苯磺酸诱导的UC小鼠, 发现小鼠在症状及病理上均得到了显著缓解[6].
GLP-2是由33个氨基酸残基组成的单链多肽, 主要由末端回肠和结肠的肠内分泌细胞L细胞合成, 其生理作用主要是刺激隐窝细胞增殖, 抑制黏膜细胞凋亡, 还能抑制胃肠道的运动和分泌, 加快营养转运, 增强肠道对营养物质的吸收能力[5]. 国外研究者发现, 用GLP-2及GLP-2类似物治疗UC模型小鼠疗效显著[7,8]. GLP-2在肠黏膜组织及血液循环中主要存在形式是有生物活性的GLP-2-(1-33), 还有部分为无生物活性的GLP-2-(3-33), 为DPP-4降解所产生. 在UC患者的外周血液循环中检测到, 有活性的GLP-2-(1-33)浓度升高, GLP-2-(1-33)所占GLP-2的比例也较正常人高, 而DPP-4活性则下降[9]. 表明UC患者在肠道损伤后, 可能通过某些机制来维持GLP-2的水平, 以尽可能的修复损伤的肠道上皮. 本实验中模型对照组小鼠血清GLP-2水平较空白对照组有升高趋势, 但差异不显著, DPP-4抑制剂组及联合用药组小鼠血清GLP-2水平显著高于模型对照组, 而SASP组与模型对照组无显著差异, 考虑西格列汀是通过抑制DPP-4酶的活性, 减少对GLP-2的降解, 从而升高血清GLP-2水平, 刺激隐窝细胞增殖, 减少细胞凋亡, 达到黏膜修复的作用.
结肠组织MPO活性, 可反映组织中性粒细胞浸润程度, 是DSS诱导UC模型成功的一个重要指标[10]. TNF-α是一种促炎细胞因子, 参与结肠黏膜炎症反应, 诱导上皮细胞凋亡和脱落, 从而增加上皮细胞的通透性, 在UC发病机制中起重要的调节作用[11]. IL-10是一种抑炎细胞因子, 在IBD患者体内普遍低表达[12], 研究表明, IL-10可以阻止动物模型肠炎的进展, 对DSS诱导的动物UC具有治疗作用[13], IL-10-/-小鼠可自发形成以IL-1β、IL-6和TNF-α升高为特点的慢性肠炎[14,15], 以上均说明IL-10是UC的保护性因素. 本试验中, 与模型对照组相比, 各治疗组MPO活性、TNF-α水平显著降低, 而联合治疗组最为明显, 与单独用药组相比均有显著差异, 预示着DPP-4抑制剂有明显的抗炎作用, SASP与DPP-4抑制剂联合应用在缓解肠道炎症损伤方面存在协同作用. 所测血清IL-10水平, 模型对照组较空白对照组显著升高(P<0.01), 考虑DSS诱导小鼠肠道急性炎症, 大量促炎因子释放的同时, 机体进行促炎与抑炎之间的自我平衡调节, 促进相应的抑炎因子释放, 导致模型组小鼠血清IL-10水平高于机体水平. DPP-4抑制剂组小鼠血清IL-10水平与模型对照组相当, SASP组与联合用药组则显著高于模型对照组, 说明SASP治疗UC的抗炎作用与IL-10有关, 而DPP-4抑制剂不能升高UC小鼠体内IL-10水平, 预示着DPP-4抑制剂对UC小鼠的抗炎作用不依赖于IL-10. Ivory等[16]用GLP-2治疗IL-10-/-所致的小鼠肠炎, 小鼠体内IFN-γ、TNF-α、IL-1β等促炎因子水平及隐窝细胞增殖、凋亡指数均显著降低, 间接支持了DPP-4抑制剂抗炎作用不依赖于IL-10的结论.
总之, DPP-4抑制剂可显著缓解UC小鼠症状, 降低结肠MPO活性、血清TNF-α水平, 其抗炎机制不依赖于IL-10, 同时通过抑制DPP-4酶活性, 升高血清GLP-2水平, 起到结肠黏膜修复的作用; SASP是治疗UC的传统性药物, 通过抑制结肠过氧化物酶活性, 抑制前列腺素、白三烯等炎症介质的合成和释放等多种机制达到抗炎、减少肠道黏膜损伤的作用, 该研究中SASP显著降低了UC小鼠DAI评分, 明显降低了结肠MPO活性、血清TNF-α水平, 升高了血清IL-10水平; 联合用药组在缓解结肠炎症、黏膜损伤方面效果最为显著, 较单独用药组有显著性差异, 说明DPP-4抑制剂与SASP联合用药, 可通过不同的机制缓解UC病情, 两者存在协同作用.
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性炎症性肠病, 在我国发病率有逐年上升的趋势, 其发病机制尚不完全明确, 目前临床主要用药为5-氨基水杨酸类、糖皮质激素类及免疫抑制剂, 长期应用不良反应大, 患者依从性差, 易复发.
任粉玉, 教授, 延边大学附属医院消化内科
二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)抑制剂是治疗2型糖尿病的新型药物, 近年来国内外研究表明其对UC模型小鼠有明显治疗作用, 其作用机制不仅是通过抑制DPP-4酶活性, 升高血清胰高血糖素样肽-2(glucagon-like peptid 2, GLP-2)水平, 起到结肠黏膜修复的作用, 还有一定的抗炎机制.
DPP-4抑制剂可显著缓解UC模型小鼠症状, 降低疾病活动指数(disease activity index, DAI), 增加结肠长度, 修复肠黏膜病理损伤, 对UC小鼠疗效显著.
柳氮磺胺吡啶(sulfasalazine, SASP)、DPP-4抑制剂均可缓解UC模型小鼠结肠炎症, 但其抗炎机制不同, SASP通过抑制结肠过氧化物酶活性, 抑制前列腺素、白三烯等炎症介质的合成和释放等多种机制达到抗炎作用, 与IL-10密切相关, 而DPP-4抑制剂的抗炎作用不依赖于IL-10.
本文研究结果具有一定的学术意义, 具有可读性和科学性.
编辑: 郭鹏 电编:鲁亚静
| 1. | Girardin M, Manz M, Manser C, Biedermann L, Wanner R, Frei P, Safroneeva E, Mottet C, Rogler G, Schoepfer AM. First-line therapies in inflammatory bowel disease. Digestion. 2012;86 Suppl 1:6-10. [PubMed] [DOI] |
| 3. | Ban H, Bamba S, Imaeda H, Inatomi O, Kobori A, Sasaki M, Tsujikawa T, Andoh A, Fujiyama Y. The DPP-IV inhibitor ER-319711 has a proliferative effect on the colonic epithelium and a minimal effect in the amelioration of colitis. Oncol Rep. 2011;25:1699-1703. [PubMed] [DOI] |
| 4. | Yazbeck R, Howarth GS, Geier MS, Demuth HU, Abbott CA. Inhibiting dipeptidyl peptidase activity partially ameliorates colitis in mice. Front Biosci. 2008;13:6850-6858. [PubMed] [DOI] |
| 5. | Yazbeck R, Sulda ML, Howarth GS, Bleich A, Raber K, von Hörsten S, Holst JJ, Abbott CA. Dipeptidyl peptidase expression during experimental colitis in mice. Inflamm Bowel Dis. 2010;16:1340-1351. [PubMed] [DOI] |
| 7. | L'Heureux MC, Brubaker PL. Glucagon-like peptide-2 and common therapeutics in a murine model of ulcerative colitis. J Pharmacol Exp Ther. 2003;306:347-354. [PubMed] [DOI] |
| 8. | Drucker DJ, Yusta B, Boushey RP, DeForest L, Brubaker PL. Human [Gly2]GLP-2 reduces the severity of colonic injury in a murine model of experimental colitis. Am J Physiol. 1999;276:G79-G91. [PubMed] |
| 9. | Xiao Q, Boushey RP, Cino M, Drucker DJ, Brubaker PL. Circulating levels of glucagon-like peptide-2 in human subjects with inflammatory bowel disease. Am J Physiol Regul Integr Comp Physiol. 2000;278:R1057-R1063. [PubMed] |
| 10. | Wan YM, Zhu YQ, Xia B, Luo J. Treating TNBS-induced colitis in rats with probiotics. Turk J Gastroenterol. 2011;22:486-493. [PubMed] |
| 11. | 郑 海涵. TNF-α在IBD发病机制中的调节. 胃肠病学和肝病学杂志. 2011;20:191-193. |
| 12. | Castro-Santos P, Suarez A, López-Rivas L, Mozo L, Gutierrez C. TNFalpha and IL-10 gene polymorphisms in inflammatory bowel disease. Association of -1082 AA low producer IL-10 genotype with steroid dependency. Am J Gastroenterol. 2006;101:1039-1047. [PubMed] [DOI] |
| 13. | Lindsay JO, Sandison A, Cohen P, Brennan FM, Hodgson HJ. IL-10 gene therapy is therapeutic for dextran sodium sulfate-induced murine colitis. Dig Dis Sci. 2004;49:1327-1334. [PubMed] |
| 14. | Kühn R, Löhler J, Rennick D, Rajewsky K, Müller W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 1993;75:263-274. [PubMed] [DOI] |
| 15. | Scheinin T, Butler DM, Salway F, Scallon B, Feldmann M. Validation of the interleukin-10 knockout mouse model of colitis: antitumour necrosis factor-antibodies suppress the progression of colitis. Clin Exp Immunol. 2003;133:38-43. [PubMed] [DOI] |
| 16. | Ivory CP, Wallace LE, McCafferty DM, Sigalet DL. Interleukin-10-independent anti-inflammatory actions of glucagon-like peptide 2. Am J Physiol Gastrointest Liver Physiol. 2008;295:G1202-G1210. [PubMed] [DOI] |