修回日期: 2013-07-20
接受日期: 2013-08-13
在线出版日期: 2013-09-28
目的: 探讨肝癌组织、肝硬化组织及正常对照组织中阻抑蛋白1(prohibitin1, PHB1)mRNA的表达及关系.
方法: 采用逆转录-聚合酶链反应方法检测36例肝细胞癌(hepatocellular carcinoma, HCC)患者肝癌组织、癌旁肝硬化组织、非肝癌的肝硬化患者活检组织、肝血管瘤及肝内胆管结等对照组组织中PHB1 mRNA的表达, 用捷达801分析软件对结果进行相对定量分析.
结果: 肝癌组织、肝硬化组织对照组PHB1 mRNA表达率分别为70%、84.1%、100%, 表达率之间无明显统计学差异(P>0.05), 肝癌组织、肝硬化组织和对照组PHB1 mRNA表达量分别为0.81±0.57、1.16±0.58、1.97±1.24; 扩增产物表现出表达量的不同, 呈现渐变趋势, 肝癌组织、肝硬化组织与对照组之间明显统计学差异(P<0.05), HCC组织与LC组织比较无统计学差异(P>0.05).
结论: PHB1参与了肝硬化、肝癌的发生发展, 可能是肝硬化和肝癌潜在诊断标志物和治疗靶点.
核心提示: 阻抑蛋白(prohibitin, PHB)被认为是肿瘤抑制基因, 但此观点目前存在较大争议, 目前已有胃癌、肝癌、肠癌、乳癌、卵巢癌等肿瘤PHB表达改变的报道, 大部分肿瘤组织表达呈下调, 也有部分肿瘤组织呈上调的报道. 本课题组曾利用基因芯片筛选出肝硬化和肝癌组织的下调基因, PHB基因表达下调显著, 免疫组织化学检测PHB蛋白在肝硬化和肝癌组织中表达的研究, 发现肝硬化和肝癌组织中PHB蛋白水平上调. 其在人类肝癌细胞mRNA水平表达如何尚不明确. 本研究应用RT-PCR方法检测PHB1基因在肝硬化和肝癌组织中mRNA水平的表达,发现PHB1 mRNA在肝硬化和肝癌组织中表达下调.
引文著录: 黄东凤, 黄介飞, 张弘, 黄小平, 魏群, 李峰. PHB1 mRNA在肝硬化及肝癌组织中的表达. 世界华人消化杂志 2013; 21(27): 2838-2842
Revised: July 20, 2013
Accepted: August 13, 2013
Published online: September 28, 2013
AIM: To investigate the expression of prohibitin 1 (PHB1) mRNA in hepatocellular carcinoma and cirrhosis.
METHODS: RT-PCR was used to detect the expression of PHB1 mRNA in 36 specimens of hepatocellular carcinoma, cirrhosis, or normal liver tissues.
RESULTS: The positive rate of PHB1 mRNA expression showed no significant difference between hepatocellular carcinoma, cirrhosis and normal liver tissues (70%, 84.1% and 100% respectively; all P > 0.05). The expression level of PHB1 mRNA was significantly lower in hepatocellular carcinoma and cirrhosis than in normal liver tissues (0.81 ± 0.57, 1.16 ± 0.58 vs 1.97 ± 1.24; both P < 0.05).
CONCLUSION: PHB1 may be involved in the development and progression of hepatocellular carcinoma and cirrhosis, and it may be used as a potential biomarker for diagnosis and target for therapy.
- Citation: Huang DF, Huang JF, Zhang H, Huang XP, Wei Q, Li F. Expression of PHB1 mRNA in hepatocellular carcinoma and cirrhosis. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2838-2842
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2838
肝硬化(liver cirrhosis, LC)尤其是乙型肝炎后肝硬化是肝癌发生重要的一个危险因素. 肝细胞癌(hepatocellular carcinoma, HCC)是世界上常见、恶性程度高的肿瘤之一. HCC的发生率和死亡率分别居全球恶性肿瘤的第5位和第3位, 居我国恶性肿瘤的第3位和第2位, 我国每年约有11万人死于HCC, 约占全球HCC死亡人数的45%[1]. HCC进展快、预后差、治疗费用高、早期不易发现. LC和HCC的发生、发展涉及众多基因改变和分子事件, 均存在增殖与凋亡失衡, 及多基因于多阶段异常表达及基因的多效性. LC和HCC的发生、发展是一个多步骤演进的过程, 了解LC和HCC发生、发展过程中的分子事件, 阐明其复杂的发生机制具有重要的临床意义. 阻抑蛋白(prohibitin, PHB)被认为是肿瘤抑制基因. PHB包括PHB1和PHB2. 我们曾利用基因芯片筛选出LC和HCC相关基因[2,3], 发现LC和HCC组织中PHB1下调显著. PHB在LC和HCC组织的mRNA表达如何, 能否成为潜在的诊断标志及治疗靶点, 值得我们进一步研究. 本研究旨在用RT-PCR方法研究PHB1在LC和HCC组织中的表达, 并初步探讨 PHB1与LC和HCC发生、发展的关系.
收集2006-03/2006-11于南通大学附属医院经手术切除组织或活检组织标本共36例. 取得HCC的肝组织20例(其中高分化HCC 6例, 中分化HCC 11例, 低分化HCC 3例); 远癌的LC组织11例(定义: 距肿瘤边缘≥4 cm的肝组织), 非HCC的LC患者活检组织8例, 肝血管瘤4例, 肝内胆管结石2例. 其中男性23例, 女性13例. 切下的组织立即置液氮速冻后, 于-80 ℃保存备用. 所有病例均据病理学进行分类.
1.2.1 引物设计与合成: 根据基因芯片技术筛选LC及HCC相关基因差异性表达的芯片结果, 下调基因中PHB1作为验证基因[2,3]. 从GenBank查取基因序列, PHB2及β-actin基因编号分别为gb: NM_002634、gb: 5016088, 以Primer 5.0软件设计PHB1及β-actin的引物各1对, 再经GenBank BLAST进行同源性检测, 其序列如下: PHB: 5'-TGGAAGGTTTGCGGATGAGG-3'; 5'-GCAGGCATAGAGCCCGTGAG-3'. β-actin 5'-AAGTACTCCGTGTGGATCGG-3'; 5'-ATGCTATCACCTCCCCTGTG-3'. 扩增片段大小分别为483、495 bp.
1.2.2 肝组织中总RNA样品的提取(TRIzol法): 从-80 ℃冰箱中取出肝细胞癌组织和正常肝组织, 解冻后每例组织称取50-100 mg置入匀浆器, 加入1 mL TRIzol, 充分匀浆后倒入1.5 mL离心管, 以下步骤按操作说明书操作. 提取后加入适量DEPC水溶解, -20 ℃冰箱保存备用.
1.2.3 RT-PCR扩增: 在0.5 mL离心管中按顺序加入10×PCR Buffer 5 μL, MgCl2 5 μL, dNTP(10 U/μL)1 μL; cDNA 1 μL, Taq酶(1 U/μL)1 μL, 上游引物1 μL, 下游引物1 μL, 0.1%DEPC水35 μL. 置于PCR扩增仪上扩增. 反应条件为预变性92 ℃ 2 min, 变性92 ℃ 30 s, 退火55 ℃ 30 s, 延伸72 ℃ 30 s, 循环30次, 最后72 ℃延伸5 min, 得到最终产物. 取10 μL PCR产物及上样缓冲液(0.25 g溴酚蓝、30%甘油水溶液100 mL)1 μL, 混匀后短暂离心, 小心加入1.5%琼脂糖凝胶中, 以120 V电压电泳约30 min后, 于320 nm紫外透射仪下观察电泳结果. 用捷达801分析软件对结果进行分析, 以各样本目的基因平均A值/β-actin平均A值表示目的基因的相对表达强度.
统计学处理 本研究实验数据采用Stata7.0统计软件包处理分析, 计量资料以mean±SD表示, 率的比较采用Fisher's确切概率法, PHB1 mRNA表达的相对定量采用单因素方差分析, P<0.05为差异具有统计学意义.
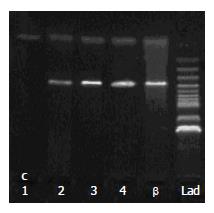
利用RT-PCR检测芯片结果中部分基因mRNA的表达情况, 将PHB1(c)及内参β-actin的RT-PCR产物进行琼脂糖凝胶电泳后, 其条带与100 bp DNA Ladder相比较, 结果表明引物有较好的特异性, 且其分子量大小与预先设计的相一致. PHB1 mRNA虽然在LC及HCC与对照组间阳性表达率无明显统计学差异(均P>0.05, 表1), 但在LC及HCC与对照组间, 扩增产物表现出表达量的不同, 且呈现渐变趋势, HCC及LC与对照组间表达有一定的渐变趋势(图1).
| 分组 | n | 表达 | 不表达 | 阳性率(%) | P值 |
| 肝癌组 | 20 | 14 | 6 | 70.00 | 0.280 |
| 肝硬化组 | 19 | 16 | 3 | 84.21 | 0.554 |
| 对照组 | 6 | 6 | 0 | 100.00 |
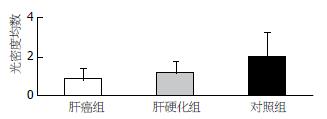
基因PHB1在LC及HCC与对照组间, 扩增产物表现出表达量的不同, HCC及LC与对照组间表达有一定的渐变趋势, 相应目的基因的mRNA的表达水平在HCC及LC与对照组间有明显统计学差异(均P<0.05)(表2, 图2).
| 分组 | n | mean±SD | P值 |
| 肝癌组 | 20 | 0.81±0.57 | 0.002 |
| 肝硬化组 | 19 | 1.16±0.58 | 0.035 |
| 对照组 | 6 | 1.97±1.24 |
HCC是世界上常见、恶性程度高的肿瘤之一. HCC进展快、预后差、治疗费用高、早期不易发现. LC尤其是乙型肝炎后LC是HCC发生重要的一个危险因素. LC和HCC的发生、发展涉及众多基因改变和分子事件, 均存在增殖与凋亡失衡, 及多基因于多阶段异常表达及基因的多效性[4]. LC和HCC的发生、发展是一个多步骤演进的过程, 了解LC和HCC发生、发展过程中的分子事件, 阐明其复杂的发生机制具有重要的临床意义. 我们曾利用基因芯片筛选出LC和HCC相关基因[2,3], 发现LC和HCC组织中PHB1基因下调显著. 而PHB被认为是肿瘤抑制基因. PHB是一个具有抗增殖作用的基因, 对细胞有抗损伤作用[5-7]. 在一些癌症患者中发现存在多态性现象, 该基因非翻译区C基因型编码的功能性RNA能阻滞细胞周期, 因此被认为是一个候选肿瘤抑制基因, 他与癌症的发生、发展以及遗传易感性的关系受到关注. PHB在LC和HCC组织的mRNA表达如何, 能否成为潜在的诊断标志及治疗靶点, 值得我们进一步研究.
PHB基因在进化上高度保守, 从低等的酵母一直到鼠、人, 其氨基酸序列具有高度的同源性. PHB基因家族包含PHB1和PHB2, PHB1基因定位于染色体17q21, PHB2基因定位于染色体12p13、PHB1蛋白和PHB2蛋白一起能形成一种高分子量的复合物. PHB1与PHB2相互依存, 同时PHB1表达下调, PHB2也出现一定程度的减少[22]. PHB主要存在于线粒体内膜上, 发挥分子伴侣作用, 少量存在于细胞核内, 具有负性转录调控作用[8]. 有研究显示, 细胞增殖时PHB表达明显降低; 细胞分化时PHB表达明显升高, 抑制细胞增殖[9]. PHB与起始转录因子E2F结合形成一种盘曲的结构域, 这种结构域本身就可以表现出生长抑制作用[10], 所以PHB的调控作用可能是双向的, 既能阻止细胞过度增殖, 又能维持细胞的生存, 推测PHB是一个双向调节子. 研究[11]发现PHB和c-Fos均受Rb的调控, 在Rb过表达的细胞中PHB和c-Fos的表达受到抑制. PHB和抑癌基因产物Rb在细胞核内存在共定位关系, PHB可通过与Rb作用, 结合E2F的不同部位共同抑制基因的转录, 调节E2F的转录活性, 抑制细胞增殖[12-14]. 还有研究表明, PHB和p53蛋白可以直接相互作用结合并在核内直接参与基因的表达调控. Fusaro等和Rastogi等[15,16]曾在乳腺癌细胞研究中发现, PHB和p53及E2F1在细胞核内具有共定位关系, 认为PHB激活了p53介导的转录并增加p53与启动子的结合能力; 在接受凋亡信号刺激后, p53-PHB发生了向核周和细胞质中转移的现象. Peng等和Rastogi等[17-19]研究证实, PHB是维生素D主要靶基因之一, 他可能通过与维生素D受体(VDR)相互作用从而调节VDR介导的增殖抑制作用. PHB还可以通过Rb依赖性的作用增强Rb对E2F的抑制作用. 现有研究证明, 在不同环境应激及DNA损伤剂诱导细胞周期停滞, 这种生长停滞与老化相似, 参与炎症、肥胖、癌症等过程. Dart等[20]用小RNA干扰技术使PHB功能缺失可使细胞老化表型减少, 在体外实验发现异染色质蛋白(HP1 heterochromatin protein 1)家族成员HP1b、HP1γ结合牢固, HP1γ与PHB相互作用对E2F转录活性有较大影响, 促进 E2F介导转录及诱导的凋亡. 认为PHB还可与P53相互作用, 调节Rb/E2F活性, 促进凋亡. 并提出PHB有诱导促进细胞老化, 抑制肿瘤生长的作用. 目前已有[21,22]胃癌、HCC、肠癌、乳癌、卵巢癌等肿瘤PHB表达改变, 大部分肿瘤表达下调的报道.
本研究中, 我们用RT-PCR方法检测了PHB1 mRNA在对照组、LC组、HCC组中的表达, 结果表明, 对照组、LC组和HCC组PHB1 mRNA表达呈逐渐下调的趋势, LC组及HCC组PHB1 mRNA表达下调逐渐明显, 可能对阻滞细胞周期进展及DNA复制有抑制作用减弱, 促进肝内细胞外基质无限沉积, HCC细胞过度增殖. Ko等[22]在实验中使PHB1缺失, 增殖增加, 使PHB1表达增加, 则凋亡增加, 实验结果表明PHB1至少在正常肝细胞发挥肿瘤抑制作用. 我们的实验结果与之一致. 另外, PHB1下调也可能使PHB通过与VDR相互作用抑制VDR介导的细胞增殖作用减弱. 推测PHB1在LC形成、加重及HCC的发生、发展中可能发挥了重要作用. 目前对PHB在不同肿瘤中的差异表达原因尚不清楚, 可能与组织细胞学类型、分期以及PHB不同亚型及其亚细胞定位有关. 有观点认为PHB的抑癌或促癌取决于其在细胞内定的定位, 浆膜表面的促癌, 核内的PHB同时有促进细胞分化和抑制细胞增殖的作用, 因而对细胞代谢、生长、分化、衰老以及凋亡等诸多方面发挥着重要的调控作用. PHB基因既能阻滞细胞周期进展, 还对DNA复制有抑制作用.
在我们的先期研究中, PHB1基因在2例LC和2例HCC共同表达差异基因中是下调基因. 推测PHB1 mRNA的表达下调使肝星状细胞及HCC细胞老化表型减少, 凋亡减少, 是其得以永生化的原因之一. PHB1在LC及HCC细胞发挥作用、作用的机制以及PHB1的表达水平是否与功能平行, 有待进一步研究. 从本研究结果和已有研究可以推断PHB1可能是诊断LC和HCC有效的检测标志物和治疗 LC和HCC有意义的靶点.
肝硬化和肝癌的发生、发展是一个多步骤演进的过程, 了解肝硬化和肝癌发生、发展过程中的分子事件, 阐明其复杂的发生机制具有重要的临床意义. 阻抑蛋白(prohibitin, PHB)被认为是肿瘤抑制基因, 但此观点目前存在较大争议. PHB在肝硬化和肝癌组织的mRNA表达如何, 能否成为潜在的诊断标志及治疗靶点, 值得我们进一步研究. 本研究旨在用RT-PCR方法研究PHB1在肝硬化和肝癌组织组织中的表达, 并初步探讨 PHB1与肝硬化和肝癌组织发生、发展的关系.
傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院
肝硬化和肝癌关系密切, 尤其是乙型肝炎后肝硬化是肝癌发生、发展最重要的一个危险因素. 因此, 探究肝硬化和肝癌发生发展过程中基因表达变化与病程的关系, 阻断肝硬化的发生、发展及早期预测癌仍为医学攻关的一个热点. PHB被认为是肿瘤抑制基因, 其在人类肝癌细胞表达如何尚不明确, 目前在人肝硬化及肝癌组织中表达报道不多, 本实验用RT-PCR检测PHB1 mRNA肝硬化及肝癌组织在表达情况.
本课题组曾利用基因芯片筛选出肝硬化和肝癌组织的下调基因, PHB基因表达下调显著, 免疫组织化学检测PHB蛋白在肝硬化和肝癌组织中表达的研究, 发现肝硬化和肝癌组织中PHB蛋白水平上调. 本研究应用RT-RNA方法检测PHB1基因在肝硬化和肝癌组织中mRNA水平的表达情况, 发现PHB1 mRNA在肝硬化和肝癌组织中表达下调.
PHB被认为是肿瘤抑制基因, 但此观点目前存在较大争议, 其mRNA在人类肝癌细胞的表达如何尚不明确.与部分肿瘤中PHB表达上调不同, 本研究中PHB1 mRNA在人肝硬化及肝癌组织中表达下调.
PHB1的表达下调可能与肝硬化、肝癌的发生、发展有关, 有可能成为肝癌的诊断标志物, 靶向治疗的靶点, 有助于改善肝癌患者的预后.
本文通过比较肝癌组织, 肝硬化组织和正常肝组织中PHB mRNA表达水平的差异, 探讨PHB在肝脏疾病中的作用. PHB和肝癌的发生发展的关系已得到大量的实验证据. 本文的价值在于提供了临床证据.
编辑: 田滢 电编:鲁亚静
| 1. | Lau WY, Lai EC. Hepatocellular carcinoma: current management and recent advances. Hepatobiliary Pancreat Dis Int. 2008;7:237-257. [PubMed] |
| 4. | Zhang H, Li F, Huang J, Huang D, Hua TY, Wei Q, Zhang J, Huang H. Screening and validation of tumor-associated genes in human hepatocellular carcinoma tissues. Hepatogastroenterology. 2012;59:1048-1053. [PubMed] [DOI] |
| 5. | Theiss AL, Vijay-Kumar M, Obertone TS, Jones DP, Hansen JM, Gewirtz AT, Merlin D, Sitaraman SV. Prohibitin is a novel regulator of antioxidant response that attenuates colonic inflammation in mice. Gastroenterology. 2009;137:199-208, 208. e1-e6. [PubMed] [DOI] |
| 6. | Lee JH, Nguyen KH, Mishra S, Nyomba BL. Prohibitin is expressed in pancreatic beta-cells and protects against oxidative and proapoptotic effects of ethanol. FEBS J. 2010;277:488-500. [PubMed] [DOI] |
| 7. | Liu X, Ren Z, Zhan R, Wang X, Wang X, Zhang Z, Leng X, Yang Z, Qian L. Prohibitin protects against oxidative stress-induced cell injury in cultured neonatal cardiomyocyte. Cell Stress Chaperones. 2009;14:311-319. [PubMed] [DOI] |
| 8. | Mishra S, Murphy LC, Murphy LJ. The Prohibitins: emerging roles in diverse functions. J Cell Mol Med. 2006;10:353-363. [PubMed] |
| 9. | Nijtmans LG, Artal SM, Grivell LA, Coates PJ. The mitochondrial PHB complex: roles in mitochondrial respiratory complex assembly, ageing and degenerative disease. Cell Mol Life Sci. 2002;59:143-155. [PubMed] |
| 10. | Sun L, Liu L, Yang XJ, Wu Z. Akt binds prohibitin 2 and relieves its repression of MyoD and muscle differentiation. J Cell Sci. 2004;117:3021-3029. [PubMed] |
| 11. | Buchmann AM, Swaminathan S, Thimmapaya B. Regulation of cellular genes in a chromosomal context by the retinoblastoma tumor suppressor protein. Mol Cell Biol. 1998;18:4565-4576. [PubMed] |
| 12. | Wang S, Fusaro G, Padmanabhan J, Chellappan SP. Prohibitin co-localizes with Rb in the nucleus and recruits N-CoR and HDAC1 for transcriptional repression. Oncogene. 2002;21:8388-8396. [PubMed] |
| 13. | Fusaro G, Wang S, Chellappan S. Differential regulation of Rb family proteins and prohibitin during camptothecin-induced apoptosis. Oncogene. 2002;21:4539-4548. [PubMed] |
| 14. | Wang S, Zhang B, Faller DV. Prohibitin requires Brg-1 and Brm for the repression of E2F and cell growth. EMBO J. 2002;21:3019-3028. [PubMed] |
| 15. | Fusaro G, Dasgupta P, Rastogi S, Joshi B, Chellappan S. Prohibitin induces the transcriptional activity of p53 and is exported from the nucleus upon apoptotic signaling. J Biol Chem. 2003;278:47853-47861. [PubMed] |
| 16. | Rastogi S, Joshi B, Fusaro G, Chellappan S. Camptothecin induces nuclear export of prohibitin preferentially in transformed cells through a CRM-1-dependent mechanism. J Biol Chem. 2006;281:2951-2959. [PubMed] |
| 17. | Peng X, Mehta R, Wang S, Chellappan S, Mehta RG. Prohibitin is a novel target gene of vitamin D involved in its antiproliferative action in breast cancer cells. Cancer Res. 2006;66:7361-7369. [PubMed] |
| 18. | Peng X, Mehta RG. Differential expression of prohibitin is correlated with dual action of Vitamin D as a proliferative and antiproliferative hormone in breast epithelial cells. J Steroid Biochem Mol Biol. 2007;103:446-450. [PubMed] |
| 19. | Rastogi S, Joshi B, Dasgupta P, Morris M, Wright K, Chellappan S. Prohibitin facilitates cellular senescence by recruiting specific corepressors to inhibit E2F target genes. Mol Cell Biol. 2006;26:4161-4171. [PubMed] |
| 20. | Dart DA, Spencer-Dene B, Gamble SC, Waxman J, Bevan CL. Manipulating prohibitin levels provides evidence for an in vivo role in androgen regulation of prostate tumours. Endocr Relat Cancer. 2009;16:1157-1169. [PubMed] [DOI] |
| 21. | Liu T, Tang H, Lang Y, Liu M, Li X. MicroRNA-27a functions as an oncogene in gastric adenocarcinoma by targeting prohibitin. Cancer Lett. 2009;273:233-242. [PubMed] [DOI] |
| 22. | Ko KS, Tomasi ML, Iglesias-Ara A, French BA, French SW, Ramani K, Lozano JJ, Oh P, He L, Stiles BL. Liver-specific deletion of prohibitin 1 results in spontaneous liver injury, fibrosis, and hepatocellular carcinoma in mice. Hepatology. 2010;52:2096-2108. [PubMed] [DOI] |