修回日期: 2013-07-31
接受日期: 2013-08-29
在线出版日期: 2013-09-28
目的: 探讨胃腺癌恶性腹水的临床病理特征和预后因素.
方法: 回顾性研究2008-01/2012-12收治的223例胃腺癌恶性腹水患者临床的资料, 采用Kaplan-Meier法进行生存分析, 预后因素的单因素分析采用Log-rank检验, 多因素分析采用Cox回归模型.
结果: 223例患者, 占我院同期收治胃癌病例的6.2%(223/3612), 中位年龄52岁(20-81岁), 青年胃癌50例(22.4%), 老年胃癌38例(17.0%). 近端胃癌22例(9.9%), 全胃癌12例(5.4%). 177例(79.4%)患者病理分化程度为低分化腺癌或未分化腺癌. 97例(43.5%)患者在诊断胃癌时即有腹水, 122例(54.7%)患者有胃癌手术史, 148例(66.4%)患者接受了化疗. 无一例其他疾病导致的死亡, 中位总生存期4.9 mo, 1年生存率12.6%(28/223). 单因素分析显示: ECOG评分、以腹水起病, 胃癌手术史、胆红素水平、合并其他部位转移以及是否接受化疗是影响患者预后的因素(均P<0.05). 多因素分析显示, ECOG评分, 以腹水起病, 接受化疗, 合并其他部位转移是影响患者预后的独立因素(均P<0.05).
结论: 以腹水起病、行为评分差和合并其他部位转移的胃癌恶性腹水患者预后较差, 进行腹腔化疗和全身化疗能延长患者的生存时间.
核心提示: 本组胃癌恶性腹水患者的中位生存时间为4.9 mo, 体力状况评分、以腹水起病和合并其他部位转移是独立的预后因素, 进行全身化疗和腹腔化疗能延长患者的生命.
引文著录: 张慧卿, 谢梅, 何波, 芦珊, 万以叶, 宋荣峰. 胃癌恶性腹水患者的临床特征及预后分析223例. 世界华人消化杂志 2013; 21(27): 2826-2831
Revised: July 31, 2013
Accepted: August 29, 2013
Published online: September 28, 2013
AIM: To analyze the clinicopathological features and prognostic factors of gastric cancer patients with malignant ascites.
METHODS: Clinicopathological data for 223 gastric cancer patients with malignant ascites treated at the Jiangxi Provincial Tumor Hospital between January 2008 and December 2012 were retrospectively analyzed. Survival analysis was conducted using Kaplan-Meier method. Factors influencing survival were analyzed using univariate (Log-rank) and multivariate (Cox) models.
RESULTS: A total of 223 patients (95 females and 128 males, median age, 52 years) were included, accounting for 6.2% of all gastric cancer cases treated at our hospital during the same period. Among them, 50 (22.4%) were young, 38 (17.0%) were senile, 122 (54.7%) underwent curative gastric resection or cytoreductive surgery, 97 (43.5%) presented with malignant ascites at the initial diagnosis of gastric cancer, and 148 (66.4%) received systematic and/or intraperitoneal chemotherapy. Proximal gastric cancer was diagnosed in 22 cases (9.9%) and whole stomach cancer in 12 cases (5.4%). Approximately 79.4% (177/223) of cases were diagnosed with poorly differentiated adenocarcinoma or undifferentiated adenocarcinoma. After a median follow-up period of 9.7 months, it was found that the median survival following diagnosis of malignant ascites was 4.9 months, and the overall one-year survival rate was 12.6%. Univariate analysis revealed that ECOG score, presence of malignant ascites at the initial diagnosis of gastric cancer, history of gastric cancer surgery, total bilirubin level, presence of metastasis in other site(s), and chemotherapy were significant factors affecting the survival (all P < 0.05). Multivariate analysis showed that ECOG score (P = 0.01), presence of malignant ascites at the initial diagnosis of gastric cancer (P = 0.001), presence of metastasis in other site(s) (P = 0.002) and chemotherapy (P < 0.001) were independent prognostic factors.
CONCLUSION: The survival of gastric cancer patients with malignant ascites is relatively short. Worse ECOG score, presence of malignant ascites at the initial diagnosis and presence of metastasis in other site(s) are associated with poor prognosis in gastric cancer patients with malignant ascites, and the survival time could be prolonged by systematic and intraperitoneal chemotherapy.
- Citation: Zhang HQ, Xie M, He B, Lu S, Wan YY, Song RF. Clinicopathological features and prognostic factors of gastric cancer patients with malignant ascites: Analysis of 223 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2826-2831
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2826.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2826
恶性腹水, 指肿瘤细胞播散种植至腹膜, 导致腹膜腔内过多液体聚积[1], 约占所有腹水病例的10%[2]. 诊断恶性腹水的金标准是腹水中找见脱落肿瘤细胞, 他常被视为肿瘤的终末期, 中位生存时间5.7 mo, 生活质量明显下降[3-5]. 据报道, 18.3%的恶性腹水与胃癌有关, 预后比卵巢癌和乳腺癌更差[4]. 因此, 有必要了解胃癌恶性腹水特征与预后的关系, 从而针对不同个体选择恰当的治疗方案, 实现"个体化"治疗, 达到尽量延长生存和避免过度治疗的目的. 我们回顾性研究了我院2008-01/2012-12确诊为胃腺癌恶性腹水患者的临床资料, 探讨了胃癌恶性腹水临床特征与预后的关系, 现将结果报告如下.
选取2008-01/2012-12确诊为胃腺癌恶性腹水的患者223例, 临床资料入组标准: (1)外科手术或电子胃镜活检获取病理组织, 确诊为胃腺癌; (2)恶性腹水定义: 排除肝硬化、结核性腹膜炎等良性疾病的基础上, 腹水中找见脱落的肿瘤细胞[3]. 其中男性128例(57.4%), 女性95例(42.6%), 男女之比1.3:1. 发病年龄20-81岁, 中位年龄52岁, 青年胃癌50例(22.4%), 老年胃癌38例(17.0%).
1.2.1 患者进入我院恶性腹水的临床诊疗路径: 腹腔穿刺引流、呋塞米和螺内酯利尿以及基于顺铂的腹腔灌注化疗和全身化疗, 共148例. 拒绝化疗的患者给予引流腹水和利尿等最佳支持治疗, 共75例.
1.2.2 研究方法: 收集患者基本特征(性别, 年龄, ECOG评分、是否以腹水起病, 胃癌手术史), 实验室检查(胆红素, 白蛋白、原发灶位置、病理类型、HER-2状态, 其他部位转移), 治疗方法(化疗与否, 化疗周期)等临床病理资料.
1.2.3 随访: 通过门诊复查、电话或信件等进行随访, 获得总生存期. 生存期计算方法: 腹水中找见脱落肿瘤细胞至死亡时间或末次随访时间(2013-05-02).
统计学处理 采用SPSS13.0软件进行统计分析, Kaplan-Meier法计算生存率, 并绘制生存曲线; Log-rank检验进行预后影响因素的单因素分析, Cox回归模型分析多因素对生存时间的影响, P<0.05认为差异有统计学意义.
入组223例患者, 占我院同期胃癌病例的6.2% (223/3612). 97例(43.5%)患者在诊断胃癌时即有腹水. 141例(63.2%)患者表现出腹水相关的临床症状, 分别为腹胀(49.3%)、腹痛(44.4%)、恶心(26.9%)和乏力(21.5%). 近端胃癌22例(9.9%), 全胃癌12例(5.4%). 177例(79.4%)患者的病理类型为低分化腺癌或未分化腺癌. 153例患者接受了表皮生长因子受体2(epidermal growth factor receptor 2, HER-2)检测, 其中32例(20.9%)阳性. 诊断恶性腹水时中位白蛋白为37.0 g/L(14.0-66.0 g/L), 中位总胆红素11.0 μmol/L(3.5-266.0 μmol/L), 中位CEA为2.4 ng/mL(0.01-29250.0 ng/mL), 中位CA125为70.2 U/mL(0.3-12304.0 U/mL). 最常见的并发转移部位为淋巴结(45.3%)、卵巢(24.7%)和肝脏(19.7%). 35例(15.7%)患者合并肠梗阻.148例患者(66.4%)接受了化疗, 中位全身化疗2周期(1-11周期), 中位腹腔灌注化疗3次(1-9次).
无1例其他疾病导致患者死亡. 223例患者中位总生存期4.9 mo(0.3-53.4 mo), 平均生存时间7.9 mo±0.8 mo, 1年生存率12.6%(28/223). 截止随访结束有21例患者存活.
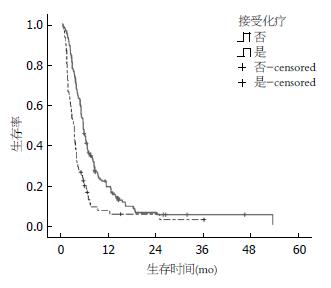
Kaplan-Meier法单因素分析显示, ECOG评分、以腹水起病、胃癌手术史、胆红素、其他部位转移的数目以及接受化疗是影响患者预后的因素(P<0.05)(表1, 图1). 对接受化疗的患者进行亚组分析显示, 全身化疗组、腹腔化疗组和联合化疗组的中位总生存时间分别为5.2、3.5和7.5 mo(P<0.01). 通过Cox回归模型分析得出: ECOG评分, 以腹水起病, 接受化疗和其他部位转移的数目是影响患者预后的独立因素, 贡献最大的是接受化疗和以腹水起病(表2).
| 临床特征 | n | mOS(mo) | 95%CI | χ2值 | P值 |
| 性别 | 0.369 | 0.544 | |||
| 男 | 128 | 4.9 | 4.09-5.71 | ||
| 女 | 95 | 4.5 | 3.33-5.67 | ||
| 年龄(岁) | 1.905 | 0.386 | |||
| <40 | 50 | 4.3 | 2.91-5.69 | ||
| 40-65 | 135 | 4.1 | 4.23-5.97 | ||
| >65 | 38 | 3.0 | 1.49-4.51 | ||
| 胃癌手术史 | 4.035 | 0.045 | |||
| 有 | 122 | 5.1 | 4.24-5.96 | ||
| 无 | 101 | 3.9 | 2.83-4.97 | ||
| 以腹水起病 | 4.420 | 0.036 | |||
| 是 | 97 | 3.9 | 2.85-4.95 | ||
| 否 | 126 | 5.1 | 4.09-6.11 | ||
| 病灶位置 | 2.108 | 0.550 | |||
| 胃底贲门 | 22 | 6.4 | 4.45-8.35 | ||
| 胃体 | 128 | 4.5 | 3.67-5.33 | ||
| 胃窦 | 61 | 4.7 | 3.46-5.94 | ||
| 全胃 | 12 | 3.7 | 2.35-5.06 | ||
| 分化程度 | 1.559 | 0.212 | |||
| 高-中分化 | 46 | 4.5 | 1.56-7.44 | ||
| 低-未分化 | 177 | 4.9 | 4.22-5.58 | ||
| ECOG评分 | 8.683 | 0.003 | |||
| 0-2 | 197 | 5.1 | 4.37-5.83 | ||
| >2 | 36 | 3.4 | 2.22-4.58 | ||
| 其他器官转移 | 10.866 | 0.004 | |||
| 0 | 70 | 5.5 | 4.70-6.30 | ||
| 1-2 | 140 | 4.2 | 3.45-4.95 | ||
| >2 | 13 | 2.4 | 1.23-3.57 | ||
| 接受化疗 | 21.806 | 0.000 | |||
| 是 | 148 | 5.7 | 4.96-6.44 | ||
| 否 | 75 | 3.4 | 2.72-4.08 | ||
| 白蛋白(35 g/L) | 1.818 | 0.178 | |||
| 降低 | 77 | 4.1 | 2.95-5.25 | ||
| 正常 | 146 | 5.1 | 4.30-6.07 | ||
| 胆红素(20 µmol/L) | 4.898 | 0.027 | |||
| 正常 | 183 | 5.1 | 4.27-5.93 | ||
| 升高 | 40 | 3.8 | 2.96-5.50 | ||
| CEA(5 µg/mL) | 0.336 | 0.562 | |||
| 正常 | 137 | 5.1 | 4.19-6.01 | ||
| 升高 | 86 | 4.3 | 3.31-5.29 | ||
| CA125(35 U/mL) | 0.685 | 0.408 | |||
| 正常 | 72 | 5.1 | 3.54-6.66 | ||
| 升高 | 151 | 4.8 | 4.02-5.58 |
| 因素 | β | Wald值 | RR | 95%CI | P值 |
| 接受化疗 | -0.903 | 31.440 | 0.406 | 0.296-0.556 | <0.001 |
| 以腹水起病 | 0.516 | 11.766 | 1.676 | 1.248-2.251 | 0.001 |
| ECOG评分差 | 0.490 | 6.598 | 1.632 | 1.123-2.371 | 0.010 |
| 并发转移器官 | 0.426 | 9.908 | 1.531 | 1.174-1.995 | 0.002 |
恶性腹水患者生活质量和预后较差, 是临床姑息治疗的难题. 恶性腹水的治疗一直缺乏高级别研究的证据, 学术界尚未达成治疗共识[6,7]. 深入研究恶性腹水的病理生理机制, 充分利用现有的治疗手段, 有望改善患者的生存[8].
胃癌作为世界范围内的第二癌症杀手, 是导致恶性腹水的常见病因[4,9]. 目前, 有关恶性腹水预后因素的研究较少, 大多囊括了所有肿瘤, 而且距今已有数年时间[4,10]. 肖隆斌等[11]比较了经手术治疗的合并与未合并腹水的胃癌患者临床特征, 分析出盆结节、腹膜侵犯及脏器侵犯是胃癌发生腹水的最危险因素, 但对胃癌恶性腹水患者的预后影响因素进行分析.
与既往报道有所不同[4], 本研究恶性腹水的定义为腹水中找见脱落肿瘤细胞. 我们入组了胃癌恶性腹水患者223例, 占同期胃癌病例的6.2%. 患者中位生存期4.9 mo, 比2007年英国报道的3 mo更长, 分析可能得益于胃癌化疗药物的进步, 以及对患者进行了腹腔穿刺引流、利尿、腹腔灌注化疗和全身化疗的综合治疗[4]. 43.5%的患者在诊断胃癌时即有腹水, 略低于其他研究的49.0%-54.0%, 分析与本研究未入组卵巢癌患者有关[4,10]. Log-rank单因素分析显示, 以腹水起病的患者中位生存时间仅3.9 mo, 是预后不良的独立因素(P = 0.001). 既往无胃癌手术史的患者, 生存时间明显更短(3.9 mo vs 5.1 mo), 这与Lee等[12]关于胃癌一线化疗预测因素的报道一致.
63.2%的患者出现腹水相关的临床症状, 影响生活质量. 我们的研究结果支持体力状况评分好的患者生存期更长(P = 0.003). 白蛋白下降是患者营养不良的表现, 也是恶性腹水患者预后不良的因素[10]. 本研究中白蛋白<35 g/L的患者中位生存期较白蛋白正常组短1 mo, 但差异无统计学意义(P = 0.178). 胆红素也是中位生存期的影响因素(P = 0.027), 分析与胆红素升高的患者大多发生肝脏转移有关. 临床分期是影响患者生存的重要因素. 本研究显示, 伴有其他脏器转移的患者预后明显更差(P = 0.004), 而且转移部位越多, 生存期越短, 存在2个以上脏器转移的患者中位生存期仅为2.4 mo.
一般认为, 青年胃癌是指发病年龄<40岁的胃癌, 占所有胃癌的12.7%-14.8%[13,14]. 本研究青年胃癌50例, 占22.4%, 高于文献报道的14.8%, 分析与青年胃癌更易发生腹膜转移有关[15]. 据报道, 与中年患者相比, 青年患者胃癌根治术后的预后更好, 5年生存率更高(80.0% vs 76.0%, P<0.018)[14]. 我们的研究提示年龄并非影响胃癌恶性腹水患者预后的因素(P = 0.386), 这与Santoro等[16]的报道相符.
据报道, 组织分化程度是影响胃癌预后的因素, 分化级别越低, 生存时间越短. 本组中79.4%的胃癌恶性腹水患者为低分化腺癌或未分化腺癌, 显著高于Chiaravalli等[17]关于胃癌病例报道的22%; 生存分析显示, 与高分化和中分化者相比较, 低分化和未分化患者的中位生存时间无统计学差异, 提示发生腹膜转移的胃癌细胞可能具有更为特殊的生物学特征. 研究表明, 血清CA125水平的高低与肿瘤细胞腹膜播散的严重程度以及恶性腹水的存在密切相关[18]. 尽管CA125和CEA异常升高不是本组胃癌恶性腹水患者生存的影响因素, 但CA125的阳性表达率达到66.7%, 明显高于CEA的表达(38.6%), 提示在诊断恶性腹水的敏感性方面, 血清CA125比CEA更具应用价值.
本组66.4%的病例接受了全身化疗和腹腔内化疗, 与未接受化疗者相比, 中位生存期明显延长(5.7 mo vs 3.4 mo), 差异有统计学意义(P<0.001). 亚组分析显示: 全身化疗组、腹腔化疗组和联合化疗组的中位总生存时间分别为5.2、3.5和7.5 mo(P<0.01), 提示全身化疗和腹腔化疗的联合治疗更有助于改善胃癌恶性腹水患者的生存.
通过Cox模型多因素分析得出: 接受化疗、以腹水起病, ECOG评分和其他器官转移数目是胃癌恶性腹水患者的独立预后因素, 贡献最大的是接受化疗. 因此, 建议对行为评分≤2分, 其他脏器转移数目≤2和不以腹水起病的患者给予更为积极的综合治疗, 特别是以紫杉类药物为基础的化疗, 以获得更好的治疗效果[8].
总之, 胃癌恶性腹水患者的预后较差, 在引流腹水与利尿的基础上, 联合腹腔灌注化疗和全身化疗能延长患者的生存时间. 43.5%的胃癌患者以恶性腹水起病, 生活质量下降, 有必要依据上述独立预测因子给患者选择恰当的治疗方案, 以实现基于临床特征的个体化治疗.
恶性腹水是临床工作的难点与挑战, 18.3%的恶性腹水与胃癌相关, 有必要研究胃癌恶性腹水临床病理特征与预后关系, 指导临床治疗.
张凤春, 教授, 上海交通大学医学院附属仁济医院
胃癌恶性腹水患者中位生存期短, 生活质量差, 如何实现"个体化"治疗是临床亟待解决的问题.
2007年, 英国Ayantunde等研究发现恶性腹水患者的中位生存时间为5.7 mo, 其中肿瘤来源与类型、肝转移和血清白蛋白是独立的预后因子.
本文首次提出了胃癌恶性腹水患者生存的独立预测因子.
建议对行为评分≤2分, 其他脏器转移数目≤2个和不以腹水起病的患者给予更为积极的综合治疗.
本文分析了胃癌合并恶性腹水患者的临床病理特征及预后相关性, 具有一定的创新, 结论具有一定的临床意义, 对于临床治疗胃癌恶性腹水具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Barni S, Cabiddu M, Ghilardi M, Petrelli F. A novel perspective for an orphan problem: old and new drugs for the medical management of malignant ascites. Crit Rev Oncol Hematol. 2011;79:144-153. [PubMed] [DOI] |
| 2. | Runyon BA. Care of patients with ascites. N Engl J Med. 1994;330:337-342. [PubMed] [DOI] |
| 3. | Aslam N, Marino CR. Malignant ascites: new concepts in pathophysiology, diagnosis, and management. Arch Intern Med. 2001;161:2733-2737. [PubMed] [DOI] |
| 4. | Ayantunde AA, Parsons SL. Pattern and prognostic factors in patients with malignant ascites: a retrospective study. Ann Oncol. 2007;18:945-949. [PubMed] [DOI] |
| 5. | Wimberger P, Gilet H, Gonschior AK, Heiss MM, Moehler M, Oskay-Oezcelik G, Al-Batran SE, Schmalfeldt B, Schmittel A, Schulze E. Deterioration in quality of life (QoL) in patients with malignant ascites: results from a phase II/III study comparing paracentesis plus catumaxomab with paracentesis alone. Ann Oncol. 2012;23:1979-1985. [PubMed] [DOI] |
| 6. | Becker G, Galandi D, Blum HE. Malignant ascites: systematic review and guideline for treatment. Eur J Cancer. 2006;42:589-597. [PubMed] [DOI] |
| 7. | Cavazzoni E, Bugiantella W, Graziosi L, Franceschini MS, Donini A. Malignant ascites: pathophysiology and treatment. Int J Clin Oncol. 2013;18:1-9. [PubMed] [DOI] |
| 8. | Imamoto H, Oba K, Sakamoto J, Iishi H, Narahara H, Yumiba T, Morimoto T, Nakamura M, Oriuchi N, Kakutani C. Assessing clinical benefit response in the treatment of gastric malignant ascites with non-measurable lesions: a multicenter phase II trial of paclitaxel for malignant ascites secondary to advanced/recurrent gastric cancer. Gastric Cancer. 2011;14:81-90. [PubMed] [DOI] |
| 9. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 10. | Parsons SL, Lang MW, Steele RJ. Malignant ascites: a 2-year review from a teaching hospital. Eur J Surg Oncol. 1996;22:237-239. [PubMed] [DOI] |
| 11. | 肖 隆斌, 杨 世斌, 许 峰峰, 吴 文辉, 黎 文峰, 李 明哲. 胃癌合并腹水182例临床病理特征及预后分析. 中华普通外科学文献(电子版). 2012;6:238-242. |
| 12. | Lee J, Lim T, Uhm JE, Park KW, Park SH, Lee SC, Park JO, Park YS, Lim HY, Sohn TS. Prognostic model to predict survival following first-line chemotherapy in patients with metastatic gastric adenocarcinoma. Ann Oncol. 2007;18:886-891. [PubMed] [DOI] |
| 13. | Ramos-De la Medina A, Salgado-Nesme N, Torres-Villalobos G, Medina-Franco H. Clinicopathologic characteristics of gastric cancer in a young patient population. J Gastrointest Surg. 2004;8:240-244. [PubMed] [DOI] |
| 14. | Lai JF, Kim S, Li C, Oh SJ, Hyung WJ, Choi WH, Choi SH, Wang LB, Noh SH. Clinicopathologic characteristics and prognosis for young gastric adenocarcinoma patients after curative resection. Ann Surg Oncol. 2008;15:1464-1469. [PubMed] [DOI] |
| 15. | Kunisaki C, Akiyama H, Nomura M, Matsuda G, Otsuka Y, Ono HA, Takagawa R, Nagahori Y, Takahashi M, Kito F. Clinicopathological features of gastric carcinoma in younger and middle-aged patients: a comparative study. J Gastrointest Surg. 2006;10:1023-1032. [PubMed] [DOI] |
| 16. | Santoro R, Carboni F, Lepiane P, Ettorre GM, Santoro E. Clinicopathological features and prognosis of gastric cancer in young European adults. Br J Surg. 2007;94:737-742. [PubMed] [DOI] |
| 17. | Chiaravalli AM, Klersy C, Vanoli A, Ferretti A, Capella C, Solcia E. Histotype-based prognostic classification of gastric cancer. World J Gastroenterol. 2012;18:896-904. [PubMed] [DOI] |
| 18. | Emoto S, Ishigami H, Yamashita H, Yamaguchi H, Kaisaki S, Kitayama J. Clinical significance of CA125 and CA72-4 in gastric cancer with peritoneal dissemination. Gastric Cancer. 2012;15:154-161. [PubMed] [DOI] |