修回日期: 2013-08-05
接受日期: 2013-08-29
在线出版日期: 2013-09-28
目的: 构建针对人转录因子ETS1的RNA干扰质粒, 鉴定并建立干扰质粒稳定转染的人胰腺癌PANC-1细胞株.
方法: 分别构建3条针对ETS1基因的shRNA干扰质粒(shRNA-1, shRNA-2, shRNA-3), 并将其转染至人胰腺癌PANC-1细胞株, 用药物G418筛选出稳定细胞株, Western blot鉴定稳转细胞株中ETS1表达量.
结果: 3条针对ETS1基因的shRNA干扰质粒转染胰腺癌PANC-1细胞株后, Western blot检测结果显示干扰质粒1(shRNA-1)具有最佳干扰效果. 将具有最佳干扰效果的质粒稳定转染人胰腺癌PANC-1细胞株后, 经Western blot鉴定相较于对照组稳定细胞株其ETS1表达量明显降低.
结论: 成功构建了针对人转录因子ETS1的RNA干扰质粒, 并建立其稳定转染的人胰腺癌PANC-1细胞株.
核心提示: 近年来, 国内外针对ETS1和胰腺癌之间的相关性研究逐渐引起关注, 因此我们设计构建了针对人转录因子ETS1的RNA干扰质粒, 并将其转染至胰腺癌PANC-1细胞株, 因为稳定转染的细胞株相较于瞬时转染的细胞株具有生物学特性稳定等一系列优点.
引文著录: 王钟晗, 王彩莲, 陈蓉, 周旻, 陈岩. 转录因子ETS1 RNA干扰质粒的构建及其稳定转染胰腺癌细胞株的建立. 世界华人消化杂志 2013; 21(27): 2820-2825
Revised: August 5, 2013
Accepted: August 29, 2013
Published online: September 28, 2013
AIM: To construct plasmids carrying shRNAs targeting the ETS1 gene and to obtain a PANC-1 cell line stably transfected with the most efficient constructed plasmid.
METHODS: Three plasmids carrying shRNAs (shRNA-1, shRNA-2, shRNA-3) targeting the ETS1 gene were constructed, and the most efficient one was identified by Western blot and then transfected into PANC-1 cell line. The stably transfected cell line was selected in the presence of G418. The expression of the ETS1 protein was detected by Western blot.
RESULTS: The plasmids carrying shRNAs were successfully constructed. The plasmid carrying shRNA-1 had the highest efficiency. The expression of ETS1 protein in the stably transfected cell line was efficiently knocked down.
CONCLUSION: Plasmids carrying shRNAs targeting the ETS1 gene and the stably transfected PANC-1 cell line have been successfully constructed.
- Citation: Wang ZH, Wang CL, Chen R, Zhou M, Chen Y. Construction of plasmids carrying shRNAs targeting the ETS1 gene and their stable transfection of PANC-1 cell line. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2820-2825
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2820
近年来, 胰腺癌的发病率在全球范围内呈逐年上升趋势, 但其发生发展的机制尚未完全阐明. 研究显示, 转录因子ETS(v-ets鸟类骨髓成红血细胞增多症病毒E26致癌基因)家族中的ETS1的异常表达和多种恶性肿瘤的发生、发展及预后密切相关, 如乳腺癌、肺癌、白血病[1-3]. 目前已有文献报道, ETS1在不同的胰腺癌组织中表达不同, 分化低且预后较差的胰腺癌组织中ETS1表达量相比于分化高且预后较好的胰腺癌组织明显升高[4]. 因此, 我们构建出针对ETS1 mRNA的干扰质粒, 并转染人胰腺癌PANC-1细胞, 筛选出稳定转染的细胞株, 以进一步研究转录因子ETS1在胰腺癌的发生发展中的作用.
人胰腺癌细胞株PANC-1购自中科院上海细胞库, shRNA干扰质粒由上海吉凯公司构建并测序, DMEM培养基购自Wisent公司, 胎牛血清购自美国Gibco公司, Lipo-fectamine 2000购自Invitrogen公司, G418购自Sigma公司, PVDF膜购自Roche公司, WB Immobilon ECL发光液购自Millipore公司, 抗-ETS1抗体购自ABCAM公司, 抗-GAPDH抗体购自Bioworld公司, HPR标记的二抗购自Multisciences公司, 其余试剂均为分析纯.
1.2.1 细胞培养: PANC-1细胞培养于含50 mL/L胎牛血清的DMEM培养基中, 并置于含50 mL/L CO2, 37 ℃的培养箱中. 细胞按1:3进行传代, 并取对数期生长细胞用于实验.
1.2.2 质粒构建: 由上海吉凯生物公司合成针对ETS1基因的干扰质粒并对其进行测序.
1.2.3 细胞转染及Western blot进行有效靶点的筛选: 转染前24 h取对数期的PANC-1细胞约6×105个接种于6孔板中, 使转染时的细胞融合度在90%左右, 转染步骤按照Invitrogen的Lipofectamine 2000说明书严格操作, 取转染质粒2 mg稀释于500 μL Opti-MEM, 3 μL Lipofectamine 2000稀释于500 μL Opti-MEM, 两者混匀后静置20 min, 加入所需要转染的孔中, 3 h后加入500 μL完全培养基培养, 于转染24 h后观察荧光表达情况, 并于48 h后收集细胞并提取蛋白, 用Western blot检测目的蛋白的表达情况, 筛选出最有效的干扰靶点.
1.2.4 稳定转染细胞株的筛选: 用具有最有效干扰靶点的质粒转染细胞, 并于48 h后用含600 mg/L G418的筛选培养基进行筛选, 筛选3 wk后, 带有绿色荧光表达的阳性克隆形成, 用克隆环挑取阳性克隆细胞, 并转移至96孔板, 用二倍稀释法稀释阳性克隆细胞, 直至获得单个细胞, 并用最适培养基进行培养, 培养4 wk后, 挑选荧光强度较强的单克隆细胞进行扩大培养.
1.2.5 Western blot检测ETS1蛋白的表达: 收集足量的稳定转染的实验组及对照组细胞, 并用PBS洗2遍, 用适量的细胞裂解液进行裂解并提取蛋白, 以BCA定量的方法测得上样蛋白的浓度, 并计算相应的上样体积, 经SDS-PAGE凝胶电泳、转膜、脱脂奶粉封闭, 4 ℃冰箱孵育一抗(工作浓度: ETS1 1:500; GAPDH 1:5000)12 h以上, TBST洗去一抗, 10 min×3次, 然后室温孵育HPR标记的二抗(工作浓度为1:5000)1 h, 并用ECL化学发光法进行曝光显影, 以GAPDH作为内参, 实验均重复3次.
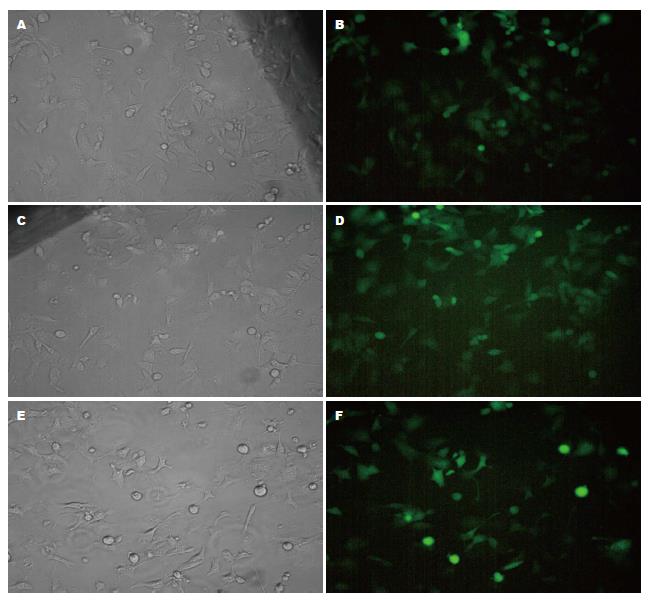
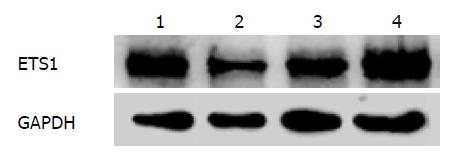
由上海吉凯公司合成针对ETS1的3组干扰质粒及一组对照质粒, 经测序, 质粒构建成功. 将这3个干扰质粒及对照质粒转染PANC-1细胞, 并于24h后在荧光显微镜下观察质粒的转染情况(图1). 质粒所具有的GFP结构可表达绿色荧光蛋白. 荧光显示转染效率皆可达到50%以上. 转染48 h后提取蛋白, 并用Western blot检测ETS1的表达情况(图2). 干扰质粒1具有最佳的干扰效果, 后续实验皆选取此干扰质粒.
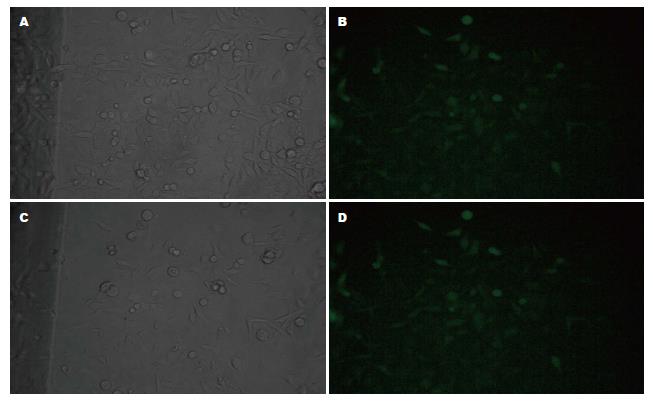
分别将干扰质粒1及对照质粒转染PANC-1细胞, 并用G418进行筛选, 约3 wk后形成阳性克隆(图3). 挑取阳性克隆并用最适培养基进行培养, 培养4 wk后, 挑选荧光强度较强的单克隆细胞进行扩大培养. 用Western blot鉴定, 所获得的干扰质粒稳定转染的细胞株其ETS1表达水平相较于对照质粒稳定转染的细胞株明显降低(图4).
ETS家族首先发现于鸟类白血病病毒E26中, 作为一类融合基因与v-myb基因及gag基因融合在一起. 至今为止, 已有超过30个成员被陆续发现. ETS转录因子家族具有两个主要的功能域, 转录激活域和DNA结合域. 这一家族的转录因子一个共同的特征就是具有一个独特的高度保守的DNA结合域, 又称ETS域. ETS域是由85个氨基酸构成, 可以特异性地识别具有GGAA/T核心元素的DNA序列并与之结合, 从而发挥其转录调控作用[5,6]. ETS家族的绝大多数成员都是Ras-MAPK信号通路的核内靶基因, 因此, ETS家族在细胞的多种生物学行为如增殖、分化、转化、侵袭和凋亡中都发挥重要作用[7]. 此外, ETS家族已经被证实与一些恶性肿瘤的发生发展密切相关, 如前列腺癌、大肠癌、肺癌及乳腺癌等[8,9].
ETS1是转录因子ETS家族中最具代表性的成员之一, 他主要有两种蛋白形式, 一种是51 kDa分子量大小, 另一种是42 kDa分子量大小. 分子量为42 kDa的ETS1蛋白相较于分子量为51 kDa的ETS1蛋白缺乏内含子Ⅶ序列, 而内含子Ⅶ上具有一个自抑性的调节序列可以调节ETS1的DNA结合性[10,11]. 除了此种自身调控机制外, ETS1的转录活性还受到磷酸化的调节. ETS1的氨基末端具有一个RAS敏感的苏氨酸38磷酸化位点, 磷酸化这些残基可以显著增强ETS1的转录活性; 而内含子Ⅶ的氨基末端具有一个钙敏感磷酸化位点, 磷酸化这些丝氨酸残基则可以显著抑制ETS1的转录活性[12-14]. ETS1受磷酸化修饰后, 将信号传导, 从而调控一系列基因的表达水平, 包括一些其他的转录因子, 细胞周期调控基因, 凋亡相关基因以及一些生长因子, 从而影响细胞的增殖, 凋亡及血管生成等. 近年来, 一些已经被证实是恶性肿瘤细胞外基质破坏, 细胞迁移及血管形成的标志如基质金属蛋白酶(matrix metalloproteinase, MMP)-1、MMP-3、MMP-9、尿激酶以及血管内皮生长因子及其受体等, 都被发现是ETS1的下游效应物[15-19], 由此可见, ETS1在肿瘤的发生、发展及侵袭转移中都发挥重要作用.
全球范围内胰腺癌的发病率呈逐年上升趋势, 由于缺乏有效的早期诊断手段及治疗方法, 患者的预后极差, 中位生存期为3-4 mo. 分子靶向治疗已经成为现在及未来肿瘤治疗的主要方法之一, 因此, 寻找胰腺癌的早期诊断的分子标志物及分子靶向治疗靶点具有重要意义[20,21]. ETS1在胚胎发育时参与胰腺的形成, 但在正常的胰腺组织中不表达或仅轻度表达, 而胚胎发育和肿瘤发生又有着密切关系, 从而我们推测ETS1在胰腺癌的发生发展中都具有重要作用[22]. 体外研究表明, ETS1在胰腺癌组织中呈高表达, 提示ETS1可能与胰腺癌的发生密切相关[23-25], 我们前期研究中也检测了胰腺癌组织与癌旁胰腺组织中ETS1表达, 结果表明ETS1在胰腺癌组织中明显高于癌旁胰腺组织[26]. 本课题组前期实验对ETS1的表达与急性髓性白血病患者临床预后进行了相关性分析研究, 结果提示ETS1和急性髓性白血病患者的临床预后密切相关.
近年来, 国内外针对ETS1和胰腺癌之间的相关性研究逐渐引起关注, 因此我们设计构建了针对人转录因子ETS1的RNA干扰质粒, 并将其转染至胰腺癌PANC-1细胞株. 由于稳定转染的细胞株相较于瞬时转染的细胞株具有生物学特性稳定等一系列优点, 我们用药物G418加压筛选出稳定转染的胰腺癌PANC-1细胞株, 并用Western blot反复鉴定, 筛选出具有最佳敲除效果的细胞株两支, 从而为进一步研究ETS1与胰腺癌发生发展之间的相关性研究奠定实验基础.
胰腺癌的发病率在全球范围内呈逐年上升趋势, 大部分患者在确诊时已失去了接受根治性手术的机会, 迫切需要我们去探索和发现新的生物标志物预测胰腺癌治疗疗效和预后生存, 并且为胰腺癌治疗提供一个新的分子靶点.
刘亮, 副主任医师, 复旦大学胰腺癌研究所; 复旦大学附属肿瘤医院胰腺肝胆外科
目前对于ETS1在胰腺癌发生发展中的作用机制尚不清楚, 但令人鼓舞的是, 近来正逐渐引起国际重视, 已有文献证实ETS1在肿瘤发生、发展和侵袭转移过程中起着重要作用.
ETS家族在细胞的多种生物学行为如增殖、分化、转化、侵袭和凋亡中都发挥重要作用. 此外, ETS家族已经被证实与一些恶性肿瘤的发生发展密切相关, 如前列腺癌、大肠癌、肺癌及乳腺癌等.
目前已有研究通过siRNA干扰技术或腺病毒转染技术对胰腺癌细胞株内ETS1表达进行调控, 并进行进一步实验检测下游功能. 本文使用的质粒转染系统有别于前两者, 具有创新性.
ETS1与多种细胞生物学行为有关, 在胰腺癌发生发展中具有重要的作用, 这些作用急待进一步实验阐明. 作者的研究结果为后续实验奠定了良好的基础.
本文的研究结果为后续实验奠定了良好的基础, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Kars MD, Işeri OD, Gündüz U. Drug resistant breast cancer cells overexpress ETS1 gene. Biomed Pharmacother. 2010;64:458-462. [PubMed] [DOI] |
| 2. | Sasaki H, Yukiue H, Moiriyama S, Kobayashi Y, Nakashima Y, Kaji M, Kiriyama M, Fukai I, Yamakawa Y, Fujii Y. Clinical significance of matrix metalloproteinase-7 and Ets-1 gene expression in patients with lung cancer. J Surg Res. 2001;101:242-247. [PubMed] [DOI] |
| 3. | Dreyfus F, Picard F, Gisselbrecht S, Varet B, Tambourin PE, Fichelson S. ets-1 and ets-2 proto-oncogene expression in human leukemia cells and cell lines. Nouv Rev Fr Hematol. 1989;31:217-221. [PubMed] |
| 4. | Ito T, Nakayama T, Ito M, Naito S, Kanematsu T, Sekine I. Expression of the ets-1 proto-oncogene in human pancreatic carcinoma. Mod Pathol. 1998;11:209-215. [PubMed] |
| 5. | Dittmer J. The biology of the Ets1 proto-oncogene. Mol Cancer. 2003;2:29. [PubMed] |
| 6. | Garrett-Sinha LA. Review of Ets1 structure, function, and roles in immunity. Cell Mol Life Sci. 2013;70:3375-3390. [PubMed] |
| 7. | Oikawa T, Yamada T. Molecular biology of the Ets family of transcription factors. Gene. 2003;303:11-34. [PubMed] [DOI] |
| 8. | Shaikhibrahim Z, Wernert N. ETS transcription factors and prostate cancer: the role of the family prototype ETS-1 (review). Int J Oncol. 2012;40:1748-1754. [PubMed] [DOI] |
| 9. | Nakayama T, Ito M, Ohtsuru A, Naito S, Sekine I. Expression of the ets-1 proto-oncogene in human colorectal carcinoma. Mod Pathol. 2001;14:415-422. [PubMed] [DOI] |
| 10. | Lulli V, Romania P, Riccioni R, Boe A, Lo-Coco F, Testa U, Marziali G. Transcriptional silencing of the ETS1 oncogene contributes to human granulocytic differentiation. Haematologica. 2010;95:1633-1641. [PubMed] [DOI] |
| 11. | Choul-Li S, Leroy C, Leprivier G, Laitem C, Tulasne D, Aumercier M. Caspase cleavage of Ets-1 p51 generates fragments with transcriptional dominant-negative function. Biochem J. 2010;426:229-241. [PubMed] [DOI] |
| 12. | Gardner KH, Montminy M. Can you hear me now? Regulating transcriptional activators by phosphorylation. Sci STKE. 2005;2005:pe44. [PubMed] [DOI] |
| 13. | Liu H, Grundström T. Calcium regulation of GM-CSF by calmodulin-dependent kinase II phosphorylation of Ets1. Mol Biol Cell. 2002;13:4497-4507. [PubMed] [DOI] |
| 14. | Cowley DO, Graves BJ. Phosphorylation represses Ets-1 DNA binding by reinforcing autoinhibition. Genes Dev. 2000;14:366-376. [PubMed] |
| 15. | Park YH, Jung HH, Ahn JS, Im YH. Ets-1 upregulates HER2-induced MMP-1 expression in breast cancer cells. Biochem Biophys Res Commun. 2008;377:389-394. [PubMed] [DOI] |
| 16. | Lefter LP, Dima S, Sunamura M, Furukawa T, Sato Y, Abe M, Chivu M, Popescu I, Horii A. Transcriptional silencing of ETS-1 efficiently suppresses angiogenesis of pancreatic cancer. Cancer Gene Ther. 2009;16:137-148. [PubMed] [DOI] |
| 17. | Naito T, Tanihata Y, Nishimura H, Tanaka T, Higuchi C, Taguchi T, Sanaka T. Expression of matrix metalloproteinase-9 associated with ets-1 proto-oncogene in rat tubulointerstitial cells. Nephrol Dial Transplant. 2005;20:2333-2348. [PubMed] |
| 18. | Sahin A, Velten M, Pietsch T, Knuefermann P, Okuducu AF, Hahne JC, Wernert N. Inactivation of Ets 1 transcription factor by a specific decoy strategy reduces rat C6 glioma cell proliferation and mmp-9 expression. Int J Mol Med. 2005;15:771-776. [PubMed] |
| 19. | Kato T, Fujita Y, Nakane K, Kojima T, Nozawa Y, Deguchi T, Ito M. ETS1 promotes chemoresistance and invasion of paclitaxel-resistant, hormone-refractory PC3 prostate cancer cells by up-regulating MDR1 and MMP9 expression. Biochem Biophys Res Commun. 2012;417:966-971. [PubMed] [DOI] |
| 20. | Campbell PJ, Yachida S, Mudie LJ, Stephens PJ, Pleasance ED, Stebbings LA, Morsberger LA, Latimer C, McLaren S, Lin ML. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature. 2010;467:1109-1113. [PubMed] [DOI] |
| 21. | Haug U, Wente MN, Seiler CM, Jesenofsky R, Brenner H. Stool testing for the early detection of pancreatic cancer: rationale and current evidence. Expert Rev Mol Diagn. 2008;8:753-759. [PubMed] [DOI] |
| 23. | Khanna A, Mahalingam K, Chakrabarti D, Periyasamy G. Ets-1 expression and gemcitabine chemoresistance in pancreatic cancer cells. Cell Mol Biol Lett. 2011;16:101-113. [PubMed] [DOI] |
| 24. | Li YY, Wu Y, Tsuneyama K, Baba T, Mukaida N. Essential contribution of Ets-1 to constitutive Pim-3 expression in human pancreatic cancer cells. Cancer Sci. 2009;100:396-404. [PubMed] [DOI] |
| 25. | Ito H, Duxbury M, Benoit E, Clancy TE, Zinner MJ, Ashley SW, Whang EE. Prostaglandin E2 enhances pancreatic cancer invasiveness through an Ets-1-dependent induction of matrix metalloproteinase-2. Cancer Res. 2004;64:7439-7446. [PubMed] [DOI] |