修回日期: 2013-08-13
接受日期: 2013-08-23
在线出版日期: 2013-09-28
目的: 研究5-羟色胺(5-hydroxytryptamine, 5-HT)3受体在慢传输型便秘(slow transit constipation, STC)大鼠胃肠黏膜的表达, 探讨其在慢传输型便秘中的发病机制.
方法: 将24只健康Wistar大鼠随机分为实验组及对照组, 实验组予以复方苯乙哌啶混悬液[8 mg/(kg·d)]灌胃建立慢传输便秘模型, 对照组予以等剂量的生理盐水灌胃. 每5 d记录1次大便粒数、大便干质量及大鼠体质量. 饲养90 d后停药1 wk, 判断模型是否成功. 采用实时荧光聚合酶链反应法(Real-time PCR, RT-PCR)检测5-HT3受体在慢传输型便秘模型大鼠胃、小肠及结肠的表达.
结果: 通过比较实验组及对照组的日均粪便粒数、平均每粒粪便质量及首粒黑便排出时间可判断造模成功. RT-PCR能特异性扩增5-HT3受体, 5-HT3受体在慢传输型便秘大鼠胃、小肠、结肠组织中的表达均低于正常对照组(0.744±0.065, P<0.05; 0.294±0.044, P<0.001; 0.16±0.027, P<0.001).
结论: 慢传输型便秘大鼠胃肠黏膜存在5-HT3受体表达下调, 其可能与STC发病机制有关.
核心提示: 本研究通过人工喂养后的大鼠成功建立慢传输型便秘模型, 针对与结肠传输功能有关的神经递质与受体进行研究, 通过RT-PCR方法发现5-HT3受体在STC大鼠胃肠黏膜中表达下调, 提示STC大鼠胃肠道中5-HT3受体的减少可能为慢传输型便秘的重要病理生理机制
引文著录: 索静宇, 徐华, 毕淑英, 张旭, 郑倩. 慢传输型便秘大鼠胃肠黏膜5-羟色胺3受体的表达. 世界华人消化杂志 2013; 21(27): 2815-2819
Revised: August 13, 2013
Accepted: August 23, 2013
Published online: September 28, 2013
AIM: To investigate the expression of 5-hydroxytryptamine 3 (5-HT3) receptor in the gastrointestinal of rats with slow transit constipation (STC), and to explore its role in the pathogenesis of STC.
METHODS: Twenty-four healthy Wistar rats were divided into either an experimental group or a control group. The experimental group was daily administered with diphenoxylate (8 mg/kg) for 90 days to induce STC, while the control group was fed equal volume of normal saline. The number and weight of fecal granules and the body weight of rats were recorded every 5 days. An activated charcoal suspension pushing test was performed one week after the administration of diphenoxylate to assess whether STC was successfully induced. RT-PCR was used to detect the expression of 5-HT3 receptor in the stomach, small intestine and colon of rats.
RESULTS: By comparing the number of fecal granule, the mean weight of each fecal granule and the discharge time of the first granule of black feces between the experimental group and control group, we could judge that STC was successfully induced. 5-HT3 receptor could be specifically amplified by RT-PCR. The expression of 5-HT3 receptor in the stomach, small intestine and colon was significantly lower in rats with STC than in control rats (all P < 0.05).
CONCLUSION: The expression of 5-HT3 receptor is decreased in the stomach, small intestine and colon of rats with STC, which may contribute to the pathogenesis of STC.
- Citation: Suo JY, Xu H, Bi SY, Zhang X, Zheng Q. Expression of 5-hydroxytryptamine 3 receptor in the gastrointestinal tract of rats with slow transit constipation. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2815-2819
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2815.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2815
慢性便秘是小儿消化系疾病中的常见症状, 发生率约3%-5%[1,2]根据文献报道[3], 小儿便秘可分为: 慢传输型、出口梗阻型、混合型及结肠传输时间正常型4种类型. 结合儿童结肠的发育特点, 以慢传输型便秘(slow transit constipation, STC)最为多见. STC由多种因素引起, 是指结肠运动功能低下导致粪便传输减慢所引起的便秘, 表现为排便次数减少、便意减弱、甚至消失并伴有腹胀[4,5]. 目前其发病机制尚不明确, 其与胃肠神经递质的关系已受到了广泛的关注. 5-羟色胺(5-hydroxytryptamine, 5-HT)是肠神经系统的重要介质[6,7], 研究表明5-HT及其受体与胃肠道疾病密切相关. 其中, 5-HT3受体被认为是调节胃肠道动力的重要因子. 以往对于5-HT3R与STC关系的研究多以蛋白表达为主, 尚无基因层面论证. 本文采用实时荧光PCR(Real-time PCR, RT-PCR)方法从基因水平探讨5-HT3R在STC大鼠胃肠黏膜的表达, 从而为其病理生理机制提供依据.
清洁级健康♂8周龄Wistar大鼠24只, 体质量120 g±10 g, 由中国人民解放军军事医学科学院实验动物中心提供, 生产许可证号SCXK-(军)2007-004, 随机分为实验组和对照组( n = 12). 所有大鼠均分笼饲养, 饲养于中国人民解放军304医院动物实验室. 预饲养1 wk以适应环境(室温20 ℃-22 ℃, 相对湿度50%-70%, 清洁安静). 所有大鼠均以普通干饲料喂养(由北京华阜康生物科技股份有限公司提供). 复方苯乙哌啶(合肥久联制药有限公司), 生理盐水(湖南康源制药有限公司), 活性炭(国药集团化学试剂有限公司); TRNzol-A+Reagent、RNase-free ddH2O、FastQuant cDNA第一链合成试剂盒、SuPerReal PreMix Plus均购自TIANGEN公司, PCR引物和内对照β-actin均由SANGON公司合成(表1). 离心机(德国Heraeus公司), 紫外分光光度仪(UV-2201日本岛津公司), PCR扩增仪(中国SLAN公司).
| 目的基因 | 引物序列 | 片段大小(bp) |
| 5-HT3R | 上游5'-CGCCTGTAGCCTTGACATCTAT-3' | 160 |
| 下游5'-CGACCTCACTTCTTCTGGTGTT-3' | ||
| β-actin | 上游5'-CCCATCTATGAGGGTTACGC-3' | 150 |
| 下游5'-TTTAATGTCACGCACGATTTC-3' |
1.2.1 慢传输型便秘大鼠的模型建立: 参照陈飞波的方法建立慢传输型便秘大鼠模型[8]. 24只大鼠随机分为实验组和对照组, 每组12只, 且体质量及性别无明显差异. 大鼠分笼饲养, 实验组大鼠每日以复方苯乙哌啶灌胃(8 mg/kg), 对照组灌以等量生理盐水. 每5 d记录1次大鼠粪便粒数、粪便干重及大鼠体质量. 饲养90 d后处死大鼠, 取其胃窦、小肠、结肠肌肉组织各0.5 cm×0.5 cm, 储存于液氮中备用. 通过首粒黑便排出时间判断模型建立是否成功.
1.2.2 肠道传输功能测定: 采用活性炭灌胃法测定首粒黑便排出时间. 停药1 wk后的大鼠禁食24 h(不禁水), 经口灌入100 g/L活性炭悬液2 mL. 从灌胃完毕开始计时, 记录从灌胃到首粒黑便排出时间.
1.2.3 组织总RNA提取: 组织块(约40 mg)加入TRNzol-A+1 mL, 用匀浆器进行匀浆处理后置于Eppendorf管, 15 ℃-30 ℃放置5 min, 使核酸蛋白复合物完全分离. 4 ℃ 12000 r/min离心10 min, 取上清, 于上清液中加入氯仿200 mL, 剧烈震荡15 s, 室温放置3 min. 4 ℃ 13000 r/min离心10 min后, 样品会分为3层, RNA主要存在于上层无色的水相中. 将水相移至新的离心管内, 加入等体积的异丙醇, 混匀, 室温放置25 min. 随后4 ℃ 13000 r/min离心10 min, 去上清后可在管侧或管底见到胶状沉淀, 即为RNA沉淀. 加入1 mL 750 mL/L乙醇洗涤沉淀, 再4 ℃ 5000 r/min离心3 min, 倒出液体, 室温干燥2 min, 加入50 µL RNase-free ddH2O, 反复吹打、混匀以充分溶解RNA. 将已提取好的RNA用紫外分光光度仪检测其纯度: 取10 µL样品加入390 µL RNase-free ddH2O稀释, 充分混匀, 测其A260与A280数值, 每个样品重复3次, 取均值. A260/280介于1.8-2.1提示RNA纯度较好. 余样品置于-80 ℃保存备用.
1.2.4 逆转录合成cDNA: 严格按照FastQuant cDNA第一链合成试剂盒说明书操作, 将已提取的RNA逆转录成cDNA, 建立20 µL的反应体系.
1.2.5 引物设计及合成: 通过PubMed数据库寻找相关引物, 采用Primer5.0软件进行分析并挑选出最为合适的引物.
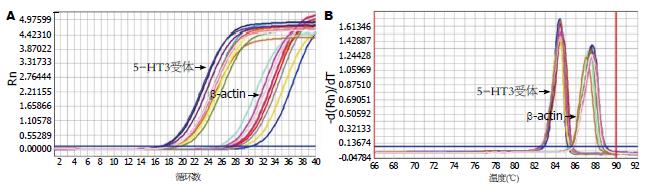
1.2.6 PCR扩增: 严格按照SuPerReal PreMix Plus试剂盒说明书操作, 建立20 µL的反应体系, 通过PCR扩增仪进行扩增, 每组样品重复3次. PCR反应条件(三步法): 95 ℃预变性15 min, 95 ℃变性10 s, 57 ℃退火30 s, 72 ℃延伸32 s, 共40个循环. PCR产物经2%琼脂糖凝胶电泳分析. 电脑记录其融解曲线并记录每个样品的Ct值, 通过相对定量法比较两组间5-羟色胺3受体的表达.
统计学处理 采用SPSS17.0统计软件进行数据分析, 数据以mean±SD表示并进行方差分析和t检验. P<0.05为差异有统计学意义.
实验组大鼠日均粪便粒数明显少于对照组(P<0.01)、平均每粒粪便质量大于对照组(P<0.05); 实验组大鼠首粒黑便排出时间明显长于对照组(P<0.01), 说明实验组大鼠肠道传输时间延长, 表明造模成功(表2).
| 分组 | 粪便粒数(粒/d) | 粪便质量 (mg/粒) | 首粒黑便排出时间(min) |
| 实验组 | 24.04±1.52 | 147.73±6.94 | 970.00±15.28 |
| 对照组 | 34.56±2.74 | 131.60±9.83 | 402.86±22.33 |
| P值 | <0.01 | <0.05 | <0.01 |
5-HT3受体和内参的RT-PCR产物融解曲线均为单一峰, 未发现非特异性扩增和引物二聚体产生, 其目的基因扩增曲线形态良好(图1). 5-HT3受体在慢传输型便秘胃、小肠、结肠组织的相对表达量(2-△△Ct)分别为0.744±0.065、0.294±0.044、0.16±0.027, 均低于正常对照组, 差异有统计学意义(P<0.05, 表3).
| 实验组 | 对照组 | |||||
| 胃 | 小肠 | 结肠 | 胃 | 小肠 | 结肠 | |
| 5-HT3受体相对表达量(2-△△Ct) | 0.74±0.065 | 0.29±0.044 | 0.16±0.027 | 1 | 1 | 1 |
| t值 | -6.826 | -28.061 | -54.8 | |||
| P值 | <0.05 | <0.001 | <0.001 | |||
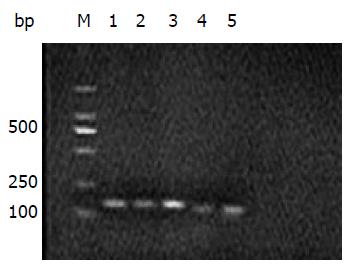
5-HT3受体和β-actin扩增产物经电泳后, 结果显示扩增片段大小与设计的大小完全一致. 2%琼脂糖凝胶电泳显示PCR产物为单一条带(图2), 表明RT-PCR能特异性扩增5-HT3受体, 结果可靠.
5-HT作为重要的单胺类神经递质, 广泛地存在于中枢及外周组织中, 其中95%来源于胃肠道, 且主要存在于肠嗜铬细胞(enterochromaffin cells, EC). 5-HT可通过与特异性受体结合, 从而参与胃肠道运动、分泌和内脏感知调节[9,10]. 5-HT受体是目前已知的神经递质受体家族中最为庞大的个体, 有7种类型, 15个亚型. 其中5-HT1、5-HT2、5-HT3、5-HT4、5-HT7主要分布于胃肠道, 其功能各异[11]. De Ponti等[12]报道5-HT可使胃肠道运动加快, 并提高内脏痛觉的敏感性.
5-HT受体参与胃肠动力和内分泌的调控, 通过激活5-HT3受体可增强胃肠道收缩力、促进肠的分泌, 从而加快胃肠道的传输速度, 缩短肠内容物通过胃肠道的时间[13]. 5-HT3受体是胃肠道5-HT受体中较为重要的类型[14], 可传递肠至脑的信息, 介导胃结肠反射[15], 肠固有神经也可通过5-HT3受体促进胃肠动力及肠分泌. 因此, 5-HT3受体既介导肠感觉的传递, 又参与胃肠动力的产生[6,16]. 近年来脑-肠轴的研究已成为慢传输型便秘机制的研究重点[17,18], 而5-HT及5-HT3受体作为重要的神经递质在此研究中发挥重要的作用. 目前, 关于5-HT3受体在STC胃肠黏膜中的表达仅见蛋白水平, 基因表达的研究尚鲜有报道. 丁建华等[16]通过免疫组织化学法证实STC患者结肠中5-HT3受体阳性染色较对照组明显减少、强度降低. 本次研究显示, 5-HT3受体在大鼠胃、小肠、结肠黏膜的表达较对照组明显降低, 提示慢传输型便秘胃肠道存在5-HT3受体的表达下调. 因此, 5-HT3受体的表达下调一方面影响了肠感觉向脑的传递, 使便意减少; 另一方面又使胃肠动力减弱, 减慢了胃肠道的传输, 减少了肠的分泌, 从而诱导便秘产生.
慢传输型便秘自1986年首次提出以来, 便发现STC是以结肠传输减慢和对纤维素、缓泻剂治疗反应差为主要特点[19]. 本次实验中5-HT3受体在胃黏膜中的下调没有小肠及结肠明显, 且小肠下调趋势亦低于结肠. 此实验结果考虑与STC本身的特点有关, 且与5-HT3受体于肠道内分布多于胃内有关. 以往研究认为部分STC患者的发病与胃动力异常有关[20], Madrid等[21]通过放射学检查证实了STC患者也存在小肠动力障碍. 我们的研究表明STC大鼠全胃肠5-HT3受体表达下调, 可能存在全胃肠动力异常, 并且以肠动力障碍为著.
总之, 慢传输型便秘大鼠胃肠道中5-HT3受体的表达明显低于对照组, 提示可能为慢传输型便秘的重要病理生理机制.
目前, 慢传输型便秘(slow transit constipation, STC)已成为儿童慢性便秘的常见类型, 严重地影响了儿童的身心健康, 但目前临床治疗尚不能取得满意的疗效. 因此, 深入研究STC的病理生理机制已成为当前的主要问题能.
刘宝林, 教授, 中国医科大学附属盛京医院
目前对于STC的研究已发现与多种因素有关, 如胃肠道激素、Cajal细胞、c-kit基因等. STC与胃肠神经递质的关系已受到广泛的关注, 5-HT信号系统通过与特异性受体结合, 参与胃肠道运动、分泌和内脏感知调节.
国外Deponti等报道5-HT可加快胃肠道运动及提高内脏痛觉的敏感性; 国内丁建华等实验显示STC患者结肠中5-HT3受体较对照组明显减少.
本实验首次采用RT-PCR技术从基因层面探讨5-HT3受体在STC中的表达, 并发现其在STC大鼠胃肠黏膜中表达下调, 提示5-HT3受体可能参与了STC的发生.
本文通过研究STC大鼠5-HT3受体的表达水平, 可为STC发生的病理生理机制提供理论依据, 同时也可为临床选择性用药提供新思路.
本文课题设计合理, 方法科学, 课题数据说明一定问题, 值得进一步研究.
编辑: 郭鹏 电编:鲁亚静
| 1. | Benninga M, Candy DC, Catto-Smith AG, Clayden G, Loening-Baucke V, Di Lorenzo C, Nurko S, Staiano A. The Paris Consensus on Childhood Constipation Terminology (PACCT) Group. J Pediatr Gastroenterol Nutr. 2005;40:273-275. [PubMed] [DOI] |
| 2. | Hyman PE, Milla PJ, Benninga MA, Davidson GP, Fleisher DF, Taminiau J. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology. 2006;130:1519-1526. [PubMed] [DOI] |
| 3. | Shahid S, Ramzan Z, Maurer AH, Parkman HP, Fisher RS. Chronic idiopathic constipation: more than a simple colonic transit disorder. J Clin Gastroenterol. 2012;46:150-154. [PubMed] [DOI] |
| 4. | Dinning PG, Di Lorenzo C. Colonic dysmotility in constipation. Best Pract Res Clin Gastroenterol. 2011;25:89-101. [PubMed] [DOI] |
| 5. | Gray JR. What is chronic constipation? Definition and diagnosis. Can J Gastroenterol. 2011;25 Suppl B:7B-10B. [PubMed] |
| 6. | Sikander A, Rana SV, Prasad KK. Role of serotonin in gastrointestinal motility and irritable bowel syndrome. Clin Chim Acta. 2009;403:47-55. [PubMed] [DOI] |
| 7. | Tonini M, Pace F. Drugs acting on serotonin receptors for the treatment of functional GI disorders. Dig Dis. 2006;24:59-69. [PubMed] [DOI] |
| 8. | 陈 飞波, 包 云光, 舒 小莉, 顾 伟忠, 赵 婵, 姚 敏华, 欧 弼悠, 江 米足. 一氧化氮在慢传输型便秘大鼠中的作用及中药治疗评估. 临床儿科杂志. 2009;27:580-584. |
| 9. | Kim YS, Choi SC, Park JM, Choi CH, Lee DH, Son HJ, Sung IK, Jeong JJ, Lee JS, Shim KN. The effect of tegaserod on symptoms and quality of life in korean women with irritable bowel syndrome with constipation. J Neurogastroenterol Motil. 2010;16:61-70. [PubMed] [DOI] |
| 10. | Camilleri M. Serotonin in the gastrointestinal tract. Curr Opin Endocrinol Diabetes Obes. 2009;16:53-59. [PubMed] [DOI] |
| 11. | Gershon MD. Review article: serotonin receptors and transporters -- roles in normal and abnormal gastrointestinal motility. Aliment Pharmacol Ther. 2004;20 Suppl 7:3-14. [PubMed] [DOI] |
| 12. | De Ponti F, Tonini M. Irritable bowel syndrome: new agents targeting serotonin receptor subtypes. Drugs. 2001;61:317-332. [PubMed] [DOI] |
| 13. | 雷 云霞, 蔡 淦. 5羟色胺在肠易激综合征中的作用. 中国中西医结合消化杂志. 2005;13:410-413. |
| 14. | Tong W, Kamiyama Y, Ridolfi TJ, Zietlow A, Zheng J, Kosinski L, Ludwig K, Takahashi T. The role of 5-HT3 and 5-HT4 receptors in the adaptive mechanism of colonic transit following the parasympathetic denervation in rats. J Surg Res. 2011;171:510-516. [PubMed] [DOI] |
| 16. | 丁 健华, 赵 荣华, 傅 传刚, 毕 丽霞, 孟 荣贵, 喻 德洪. 慢传输型便秘患者结肠中五羟色胺受体亚型的表达及意义. 世界华人消化杂志. 2006;14:3111-3115. [DOI] |
| 17. | Devanarayana NM, Rajindrajith S. Association between constipation and stressful life events in a cohort of Sri Lankan children and adolescents. J Trop Pediatr. 2010;56:144-148. [PubMed] [DOI] |
| 18. | Bassotti G, Villanacci V. Slow transit constipation: a functional disorder becomes an enteric neuropathy. World J Gastroenterol. 2006;12:4609-4613. [PubMed] |
| 19. | Bharucha AE, Phillips SF. Slow transit constipation. Gastroenterol Clin North Am. 2001;30:77-95. [PubMed] [DOI] |
| 21. | Madrid AM, Defilippi C. [Disturbances of small intestinal motility in patients with chronic constipation]. Rev Med Chil. 2006;134:181-186. [PubMed] |