修回日期: 2013-09-01
接受日期: 2013-09-09
在线出版日期: 2013-09-18
目的: 探讨病灶组织抑癌基因p16的表达与胃腺癌患者化疗后2年和5年生存率之间的关系.
方法: 选择2004-03/2007-02来我院接受治疗的胃腺癌晚期患者47例作为观察组, 均接受XELOX(奥沙利铂+希罗达)方案化疗. 选择25例健康志愿者作为对照组. 采用免疫组织化学检测观察组和对照组患者胃黏膜组织上皮组织内p16表达情况, 并比较观察组病灶组织p16低表达和正常表达组2年和5年生存率.
结果: 观察组p16阳性率为17.4%±3.6%, 显著低于对照组(P<0.05). p16正常表达组有19例(40.43%), 低表达组有28例(59.57%). p16低表达组16例患者经化疗后2年生存6例(31.58%), 5年生存4例(21.05%), 均显著低于p16正常表达组(P<0.05).
结论: p16过低表达胃腺癌患者化疗预后较差, 且p16基因表达可以作为预测胃腺癌XELOX方案化疗预后.
核心提示: 本文主要探讨胃腺癌患者病灶组织p16基因表达与XELOX方案化疗后2年和5年生存率之间的关系, 以评价p16在胃腺癌化疗预后中的临床价值. 首先比较了观察组和对照组p16基因的表达, 结果表明胃腺癌患者病灶中p16基因会过低表达; 其次统计了观察组中不同p16阳性率范围中患者的例数, 并选择20%阳性率为p16表达的阈值; 最后比较<20%的患者和>20%患者2年和5年的生存情况, 结果表明p16阳性率<20%的患者人群中2年生存率和5年生存率均显著高于p16阳性率>20%的患者人群.
引文著录: 高平, 高亚杰. 抑癌基因p16与胃腺癌患者XELOX方案化疗预后的关系. 世界华人消化杂志 2013; 21(26): 2724-2727
Revised: September 1, 2013
Accepted: September 9, 2013
Published online: September 18, 2013
AIM: To investigate the relationship between p16 expression and the 2- and 5-year survival rates in patients with gastric adenocarcinoma treated with XELOX chemotherapy.
METHODS: Forty-seven patients with advanced gastric adenocarcinoma, who received XELOX (oxaliplatin + capecitabine) treatment from March 2006 to February 2007, were included in the study. Twenty-five healthy volunteers were used as controls. Immunohistochemistry was performed to detect p16 expression in gastric mucosal epithelial tissues. The 2- and 5-year survival rates were compared between patients low p16 expression and those with normal expression.
RESULTS: The positive rate of p16 expression was significantly lower in the observation than in the control group (17.4% ± 3.6% vs 43.7% ± 17.4%, P < 0.05). There were 19 cases (40.43%) who had normal p16 expression, and 28 cases (59.57%) had low expression. The 2- and 5-year survival rates were significantly lower in patients with low p16 expression than in those with normal expression (31.58% vs 64.29%, 21.05% vs 50%, both P < 0.05).
CONCLUSION: Patients with low p16 expression have poor prognosis after XELOX chemotherapy, and p16 expression can be used to predict prognosis in patients with gastric adenocarcinoma treated with XELOX chemotherapy.
- Citation: Gao P, Gao YJ. Relationship between p16 protein expression and prognosis in patients with gastric adenocarcinoma treated with XELOX chemotherapy. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2724-2727
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2724.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2724
在我国胃癌的发病率居所有恶性肿瘤之首, 每年有17万人死于胃癌, 其中有95%患者病理类型为胃腺癌[1,2]. 胃腺癌的发病人群分布在各个年龄段, 且晚期为腺癌患者中有70%年龄>50岁. 胃腺癌晚期患者主要采用化疗药物进行治疗, 其目的是以控制疾病进展, 延长生存期, 因此腺癌晚期患者化疗预后的研究成为了临床医生研究的重要领域. 抑癌基因、癌基因和其他基因表达差异与肿瘤化疗等治疗疗效和预后的关系的研究报道很多, 也成为近几年肿瘤治疗中的研究重点. 本文主要探讨病灶组织抑癌基因p16表达在胃腺癌化疗预后中的作用, 现报道如下.
选择2004-03/2007-02来我院接受治疗的晚期胃腺癌患者47例作为观察组, 均接受XELOX方案化疗. 另外选择25例健康志愿者作为对照组, 未接受任何治疗. 其中观察组男29例, 女18例, 平均年龄为54.2岁±12.3岁; 对照组男16例, 女9例, 平均年龄为53.7岁±13.9岁. 两组患者性别比和年龄无显著统计学差异(χ2 = 0.037, P = 0.848; t = 0.15, P = 0.881), 两组具有可比性. 患者具体入组标准: (1)所有患者经病理证实为晚期胃腺癌; (2)治疗前心电图正常, 白细胞>3.5×109/L, 中性粒细胞>1.5×109/L, 血小板>100×109/L, 肾功能肌酐<上限正常值1.5倍, 无化疗禁忌证; (3)卡氏(KPS)评分≥70分, 预计生存时间≥6 mo; (4)患者或家属签署治疗知情同意书.
1.2.1 化疗: XELOX方案具体用药为: 奥沙利铂(商品名: 艾恒, 生产厂家: 江苏恒瑞医药股份有限公司, 批号: H20000337)130 mg/m2加入5%葡萄糖注射液250 mL中, 静脉滴注180 min, d1, 每3 wk用1次. 卡培他滨(商品名: 希罗达, 生产厂家: 上海罗氏制药有限公司, 批号: H20073024)1000 mg/m2, p.o, bid, d1-14, 每3 wk用1次. 每位患者化疗4-6个周期.
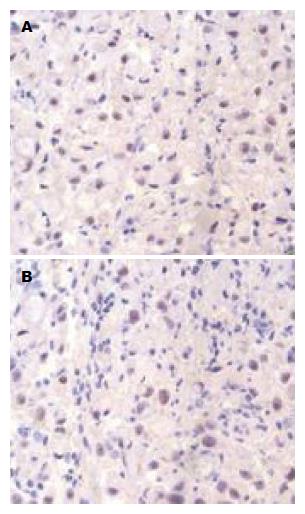
1.2.2 免疫组织化学: p16 rabbit polyclonal IgG均购于美国Santa Cruz(货号为: sc-468), 免疫组织化学SABC试剂盒和DAB显色试剂盒均购自上海蓝基生物公司. 分别检测每位患者胃癌病灶组织和周围正常组织, 2%多聚甲醛固定后, 石蜡包埋并分别隔100 μm深度的层面上连续4 μm切片. 按照SABC试剂盒要求进行操作, 检测标本中p16的表达情况. p16基因阳性表达主要表现为细胞核呈棕色及黄褐色; 偶尔在细胞质呈黄褐色(图1). 采用双盲法, 由两名有经验的病理诊断医师同时进行. 应用Image Pro Plus 6.0图像处理与分析系统, 统计切片视野中阳性细胞和总细胞数, 并按照阳性率 = 阳性细胞/总细胞×100%, 得出每位患者组织的阳性率.
1.2.3 疗效评价: 采用实体肿瘤评价标准[3]对化疗疗效进行评价, 并计算p16低表达组和p16正常表达组2年和5年生存率.
统计学处理 采用SPSS19.0软件进行统计学分析. 所有计量资料采用t检验分析, 所有计数资料采用χ2检验分析, 结果以χ2和P表示. P<0.05为差异有统计学意义.
本文主要探讨胃腺癌患者病灶组织p16基因表达与XELOX方案化疗后2年和5年生存率之间的关系, 以评价p16在胃腺癌化疗预后中的临床价值. 首先比较了观察组和对照组p16基因的表达, 结果表明胃腺癌患者病灶中p16基因会过低表达; 其次统计了观察组中不同p16阳性率范围中患者的例数, 并选择20%阳性率为p16表达的阈值; 最后比较<20%的患者和>20%患者2年和5年的生存情况, 结果表明p16阳性率<20%的患者人群中2年生存率和5年生存率均显著高于p16阳性率>20%的患者人群. 上述结果均表明, p16抑癌基因的过低表达的患者化疗后预后较差, 并且p16基因的表达可以作为预测胃腺癌化疗预后的重要指标.
肿瘤治疗效果的个体差异性可能跟癌基因、抑癌基因或其他基因表达相关. 江洪等[4]发现Ⅲ型β微管蛋白(β-tubulin-Ⅲ)mRNA表达与Ⅱ期非小细胞肺癌对诺维本+顺铂方案化疗敏感度的影响较大. 陈俭云等[5]通过RNAi干扰技术干扰了survivin表达后增强了胰腺癌对厄洛替尼敏感性. 不仅如此, GSTT1、GSTM1、MDR1基因多态性与白血病治疗[6], FTO基因表达与乳腺癌的治疗[7]等均被证明是基因表达与肿瘤化疗治疗的关系的有力证据. 除此之外, p16抑癌基因与肿瘤治疗之间的关系也成为近几年的研究热点.
p16是细胞周期中的重要基因, 参与调控细胞周期、细胞增殖和分裂. 研究表明50%的肿瘤细胞中p16基因均会缺失或突变而过低表达, 目前已经在肺癌[8]、乳腺癌[9]、胃癌[10]、肾癌[11]等肿瘤细胞中证实了上述结论, 因此该基因可以作为预测肿瘤发生的重要指标. 另外, p16还逐步被应用于预测肿瘤疾病治疗预后. 例如张海燕等[12]在6-24 mo随访期间发现p16阴性CINⅡ宫颈癌患者可进展为CINⅢ, 且p16阳性患者病情无明显发展. 在乳腺癌的预后中也类似, 冯云等[13]发现p16阳性患者淋巴结无明显转移, 而阴性患者淋巴结会显著转移. 同样, 在大肠癌的高分化组中p16的表达量也最低, 也说明p16可以作为大肠癌分化预后的重要指标[14]. 以上有关p16在疾病预后中的应用研究均局限于探讨p16与疾病进展关系研究, 而本文是探讨p16表达与胃腺癌化疗生存预后的关系, 马炬明等[15]的结果表明胃癌病灶组织p16阴性时化疗后无瘤生存期明显缩短, 从而提示我们p16表达可能会与胃癌化疗后生存相关. 本文的结果证明了p16过低表达会增加胃腺癌患者化疗后的死亡风险, 且数据表明p16可较好的预测患者化疗预后.
虽然结果表明了p16在胃腺癌患者XELOX方案化疗预后中的临床价值, 但本文的病例样本数较少, 需要增加样本数进行深入分析. 另外, 本文仅探讨p16与XELOX方案化疗预后的关系, 而p16是否在胃腺癌经其他化疗方案或治疗方法中具有预后价值, 还需要进一步去收集临床数据进行分析. 虽然如此, 本文可表明p16可能是预测胃腺癌XELOX方案化疗预后的重要指标.
在我国胃癌的发病率居所有恶性肿瘤之首, 每年有17万人死于胃癌, 其中有95%患者病理类型为胃腺癌. 胃腺癌的发病人群分布在各个年龄段, 且晚期为腺癌患者中有70%年龄>50岁. 胃腺癌晚期患者主要采用化疗药物进行治疗, 其目的是以控制疾病进展, 延长生存期, 因此腺癌晚期患者化疗预后的研究成为了临床医生研究的重要领域.
樊红, 教授, 东南大学医学院, 发育与疾病相关基因教育部重点实验室, 东南大学基础医学院, 遗传与发育生物学系
抑癌基因、癌基因和其他基因表达差异与肿瘤化疗等治疗疗效和预后的关系的研究报道很多, 也成为近几年肿瘤治疗中的研究重点.
江洪等发现Ⅲ型β微管蛋白(β-tubulin-Ⅲ)mRNA表达与Ⅱ期非小细胞肺癌对诺维本+顺铂方案化疗敏感度的影响较大.
本文的结果证明了p16过低表达会增加胃腺癌患者化疗后的死亡风险, 且数据表明p16可较好的预测患者化疗预后.
本文方法设计科学、结果可靠, 结论表明p16可能是预测胃腺癌XELOX方案化疗预后的重要指标, 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Huang YM, Hsieh TY, Chen JR, Chien HP, Chang PH, Wang CH, Huang JS. Gastric and colonic metastases from primary lung adenocarcinoma: A case report and review of the literature. Oncol Lett. 2012;4:517-520. [PubMed] |
| 2. | Vial M, Grande L, Pera M. Epidemiology of adenocarcinoma of the esophagus, gastric cardia, and upper gastric third. Recent Results Cancer Res. 2010;182:1-17. [PubMed] [DOI] |
| 6. | 许 静, 徐 康康, 李 庆平, 王 斌, 顾 海娟, 李 天媛, 廖 清船. GSTT1、GSTM1基因多态性与儿童急性淋巴细胞白血病早期治疗反应及化疗不良反应的关系. 南京医科大学学报(自然科学版). 2010;30:832-836. |