修回日期: 2013-07-13
接受日期: 2013-08-29
在线出版日期: 2013-09-18
目的: 观察白术内酯Ⅰ、Ⅱ、Ⅲ对小鼠结肠癌细胞增殖能力的影响.
方法: CT26细胞种植于96孔板, 24 h后分别加入白术内酯Ⅰ、Ⅱ、Ⅲ 200、100、50、25、12.5、6.25 μg/mL, 放置培养箱48 h后, MTT法检测白术内酯Ⅰ、Ⅱ、Ⅲ不同剂量对CT26细胞增殖能力的影响; 筛选对CT26抑制效果好的白术有效成分, 检测其不同剂量给药后24、48、72 h后CT26细胞增殖能力的影响.
结果: 白术内酯Ⅱ抑制CT26细胞增殖能力最为明显, 其最合适给药剂量为50 μg/mL, 最佳给药时间为48 h.
结论: 白术内酯Ⅱ可能是抑制肿瘤细胞增殖的主要成分之一.
核心提示: 白术内酯Ⅰ、Ⅱ、Ⅲ对小鼠结肠癌细胞均有增殖抑制作用. 以白术内酯Ⅱ效果最为理想, 说明对于消化系肿瘤, 白术内酯Ⅱ可以起到较好的作用.
引文著录: 高小玲, 汪保英, 陈玉龙, 宰炎冰, 白明. 白术内酯对小鼠结肠癌细胞增殖能力的影响. 世界华人消化杂志 2013; 21(26): 2690-2693
Revised: July 13, 2013
Accepted: August 29, 2013
Published online: September 18, 2013
AIM: To observe the effect of atractylenolides Ⅰ, Ⅱ, and Ⅲ on the proliferation of mouse colon cancer cells.
METHODS: CT26 cells were seeded in 96-well plates and treated with different concentrations of atractylenolide Ⅰ, Ⅱ, or Ⅲ (200, 100, 50, 25, 12.5, or 6.25 μg/mL) for 24 h. After culture for an additional 48 h, the proliferation of CT26 cells was detected by MTT assay to screen atractylodes' active ingredient that had the best inhibitory effect. CT26 cells were then treated with the screened atractylodes' active ingredient at different doses for different durations (24, 48, 72 h).
RESULTS: Atractylenolide II had the best inhibitory effect on the proliferation of CT26 cells. The optimal dose was 50 μg/mL, and the best delivery time was 48 h.
CONCLUSION: Atractylenolide Ⅱ can significantly reduce the proliferation of mouse colon cancer cells.
- Citation: Gao XL, Wang BY, Chen YL, Zai YB, Bai M. Atractylenolide Ⅱ significantly reduces proliferation of mouse colon cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2690-2693
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2690.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2690
白术为菊科苍术属(atractylodes macrocephala koidz)多年生草本植物白术的根茎, 为常用中药. 具有补气健脾, 燥湿利水, 止汗, 安胎的功效. 临床多用于脾虚证, 生用或炮制应用[1]. 现代药理学研究表明, 其主要含有挥发油成分和内酯类成分, 是恶性肿瘤辅助治疗的理想药物, 并且其单方或配伍应用有改善肿瘤患者胃肠功能, 抑制氧化应激及随后触发的炎症反应而起到抗IBD的作用[2,3], 其中内酯类成分具有抗炎、抗肿瘤作用[4,5], 并具有调节胃肠道功能和促进营养物质吸收的功效[6]. 但目前白术中哪些化学成分是抗肿瘤成分尚且没有定论. 由此, 我们选择了小鼠结肠癌CT26细胞, 观察白术有效成分白术内酯Ⅰ、Ⅱ、Ⅲ对其增殖能力的影响.
白术内酯Ⅰ, 批号MUST-13012005, 白术内酯Ⅱ, 批号MUST-13012007, 白术内酯Ⅲ, 批号MUST-13012007, 中国科学院成都生物研究所研制; 1640培养基, Lot. No. 20130411, 胰蛋白酶-EDTA消化液, Lot. No. 20130124, solarbio产品; 胎牛血清, 批号: 120509, 浙江天杭生物科技有限公司; MTT、DMSO, Genebase公司产品; 台盼蓝, Sigma公司产品; MTT, Amresco产品; 牛胰岛素insuLin: Sigma产品; CT26细胞, 广州中医药大学脾胃研究所赠送; Sigma低温高速离心机, ELX800UV酶标仪.
1.2.1 CT26细胞的培养传代: 取液氮保存的CT26细胞, 37 ℃水浴使迅速融化, 将冻存液转移至离心管, 1000 r/min离心5 min, 弃上清, 加入2 mL 1640完全培养液, 重新悬浮沉淀细胞, 接种于培养瓶, 37 ℃、50 mL/L CO2培养, 次日换液. 至80%左右融合时, 用0.25%胰酶-0.53 mmol/L EDTA消化传代.
1.2.2 细胞种植及给药: CT26细胞消化计数, 按照1×104个/孔种植于96孔板, 24 h后分别加入白术内酯Ⅰ、Ⅱ、Ⅲ 200、100、50、25、12.5、6.25 μg/mL, 每组3个复孔, 48 h后MTT法检测白术内酯Ⅰ、Ⅱ、Ⅲ各个剂量对CT26细胞增殖能力的影响, 选择白术最佳有效成分进行时效实验.
1.2.3 MTT法检测细胞增殖能力: 细胞给药后一定时间, 每孔中各加入20 μL MTT液(5 mg/mL); 然后在37 ℃、50 mL/L CO2培养箱中继续培养4 h, 弃上清, 每孔加入DMSO 150 μL, 充分振荡10 min; 用酶标仪在570 nm波长处测A值, 同时设置空白对照孔[7].
统计学处理 采用SPSS11.0软件, 进行方差分析, P<0.05为差异有统计学意义.
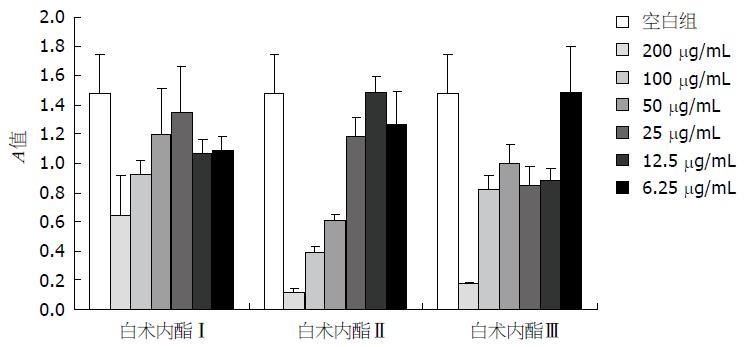
细胞种植24 h后, 给予不同剂量的白术内酯Ⅰ、Ⅱ、Ⅲ, MTT法检测给药48 h后CT26细胞增殖能力的变化(图1).
与空白对照组相比, 白术内酯Ⅰ、Ⅱ、Ⅲ 200、100 μg/mL剂量均对CT26细胞有明显的抑制作用(P<0.01); 白术内酯Ⅱ、Ⅲ 50 μg/mL均对CT26有抑制作用(P<0.01), 实验重复了3次, 结果均表明, 白术内酯Ⅱ50 μg/mL较白术内酯Ⅰ、Ⅲ50 μg/mL抑制作用效果好; 白术内酯Ⅰ、Ⅱ、Ⅲ 6.25 μg/mL效果不明显.
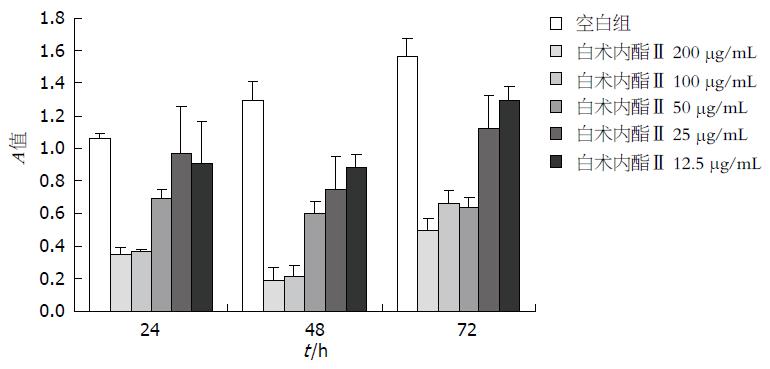
根据以上结果, 选用白术内酯Ⅱ不同剂量进行时效实验. 细胞种植24 h后, 分别给予白术内酯Ⅱ200、100、50、25、12.5 μg/mL, 给药后24、48、72 h检测CT26细胞增殖能力的变化(图2).
与空白对照组比较, 白术内酯Ⅱ200、100、50 μg/mL在给药后24、48、72 h抑制效果明确(P<0.01), 其中给药后48 h最为明显.
白术是传统的健脾药物, 而白术内酯是从白术中提取的有效成分. 对于白术主要有效成分及白术内酯Ⅰ、Ⅱ、Ⅲ的作用一直没有明确的定论. 有研究表明[8,9], 白术可促进肿瘤细胞的凋亡及坏死而具有抑瘤作用, 白术内酯Ⅰ能抑制人白细胞株HL-60和小鼠白血病细胞株的P-388的生长[10], 白术内酯Ⅱ能够抑制B16黑色素瘤细胞的增殖[11], 白术内酯Ⅲ可通过诱导肺癌细胞的凋亡来抑制肿瘤的生长和增加乳酸脱氢酶的释放[12]. 目前, 对于白术内酯Ⅰ和Ⅲ对肿瘤的抑制作用研究较多, 因此, 有学者认为白术内酯Ⅰ、白术内酯Ⅲ为抗炎、抗癌有效成分[13].
也有研究表明, 白术内酯Ⅰ可提高大鼠尿中木糖排泄率, 增强淀粉酶活性的作用[14], 促进脾虚大鼠胃肠道消化吸收功能, 可能是白术健脾运脾的有效成分之一[6]. 而白术内酯Ⅲ对PC12细胞缺氧损伤、兴奋性氨基酸损伤、高钙损伤有不同程度的保护作用[15].
我们的研究表明, 白术内酯Ⅰ、Ⅱ、Ⅲ 200、100、50 μg/mL剂量对小鼠结肠癌细胞增殖抑制效果非常明显. 其中以白术内酯Ⅱ效果最为理想, 实验重复3次结果也比较接近. 考虑到药物溶解试剂DMSO有一定的毒性, 白术内酯50 μg/mL已经可以达到预期效果, 而且剂量也接近细胞的半数抑制率. 在此基础上, 我们也对白术内酯Ⅱ不同剂量在不同时间对CT26细胞增殖能力的影响, 证实在给药后48 h检测细胞的抑制效果比较理想, 一方面让药物充分吸收, 另一方面也避免了给药时间过久未被抑制的细胞出现的过度增殖.
本实验证实, 白术内酯Ⅰ、Ⅱ、Ⅲ均能抑制CT26细胞的增殖, 但是以白术内酯Ⅱ效果最为理想, 说明对于结肠肿瘤, 白术内酯Ⅱ的效果优于白术内酯Ⅰ、Ⅲ, 白术内酯Ⅱ对于结肠癌的治疗能够起到较好的作用. 本实验首次在小鼠结肠癌细胞上进行白术有效成分的抗癌活性研究, 为研究白术的抗癌、抗炎活性部位和活性成分提供了药理学的验证. 我们也将在后续实验中对白术的健脾成分进行研究.
白术具有补气健脾, 燥湿利水, 止汗, 安胎的功效. 现代药理学研究表明, 白术是恶性肿瘤辅助治疗的理想药物, 并且其单方或配伍应用有改善肿瘤患者胃肠功能.
于则利, 教授, 首都医科大学附属北京同仁医院外科
研究表明, 内酯类成分具有抗炎、抗肿瘤作用. 但是对白术内酯Ⅰ、Ⅱ、Ⅲ的作用尚且没有定论.
有研究表明, 白术可促进肿瘤细胞的凋亡及坏死, 认为白术内酯Ⅰ、白术内酯Ⅲ为抗炎、抗癌有效成分, 也有研究表明, 白术内酯Ⅰ可提高大鼠尿中木糖排泄率, 增强淀粉酶活性的作用, 认为白术内酯Ⅰ能促进脾虚大鼠胃肠道消化吸收功能, 可能是白术键脾的有效成分之一.
本实验首次证实, 白术内酯Ⅰ、Ⅱ、Ⅲ均能抑制CT26细胞的增殖, 但是以白术内酯Ⅱ效果最为理想.
本实验为研究白术的抗癌、抗炎活性部位和活性成分提供了药理学的验证, 并未白术的健脾成分的研究提供了基础.
本文写作较为严谨、科学, 有一定创新性, 能较好地反映大肠癌的临床和基础研究的先进水平.
编辑: 田滢 电编: 闫晋利
| 1. | 国家药典委员会编. 中华人民共和国药典(一部). 2005年版. 北京: 化学工业出版社 2005; 68. |
| 4. | Liu Y, Jia Z, Dong L, Wang R, Qiu G. A randomized pilot study of atractylenolide I on gastric cancer cachexia patients. Evid Based Complement Alternat Med. 2008;5:337-344. [PubMed] |
| 6. | 郝 延军, 桑 育黎, 王 勒, 李 宝林, 贾 天柱. 白术内酯Ⅰ、Ⅲ对脾虚大鼠胃肠道消化吸收的影响. 中华中医药学会第五届中药炮制学术会议论文集. 2005;215-217. |
| 10. | Wang CC, Lin SY, Cheng HC, Hou WC. Pro-oxidant and cytotoxic activities of atractylenolide I in human promyeloleukemic HL-60 cells. Food Chem Toxicol. 2006;44:1308-1315. [PubMed] |
| 11. | Ye Y, Wang H, Chu JH, Chou GX, Chen SB, Mo H, Fong WF, Yu ZL. Atractylenolide II induces G1 cell-cycle arrest and apoptosis in B16 melanoma cells. J Ethnopharmacol. 2011;136:279-282. [PubMed] [DOI] |
| 12. | Dong H, He L, Huang M, Dong Y. Anti-inflammatory components isolated from Atractylodes macrocephala Koidz. Nat Prod Res. 2008;22:1418-1427. [PubMed] [DOI] |