修回日期: 2013-07-22
接受日期: 2013-08-13
在线出版日期: 2013-09-08
目的: 探讨十字孢碱(staurosporine, ST)对人的胰腺癌细胞株Panc-1增殖和凋亡的影响及其机制.
方法: 采用CCK-8法检测ST对Panc-1细胞的增殖抑制作用; Hoechst 33258荧光染色观察ST对Panc-1细胞凋亡形态的影响; 流式细胞术检测不同浓度ST对Panc-1细胞凋亡率和周期分布的影响; 蛋白质印迹法检测不同浓度ST对Panc-1细胞周期蛋白cyclin A、cyclin D1、Cdk4和P21表达的影响.
结果: ST对Panc-1细胞的增殖有明显抑制作用(P<0.05), 并且这种抑制作用呈浓度和时间依赖性. Hoechst 33258荧光染色观察发现, ST能明显诱导Panc-1细胞出现典型的凋亡形态学改变. 流式细胞术检测发现, 与对照组相比, ST可诱导Panc-1细胞凋亡率明显增加(P<0.05), 并引起细胞周期阻滞于G1期(P<0.05). 蛋白质印迹法检测结果显示, Panc-1细胞经ST处理后cyclin D1、Cdk4蛋白表达明显降低(P<0.05), P21蛋白表达则明显增加(P<0.05); 低浓度ST上调Panc-1细胞中cyclin A的表达, 而高浓度ST则下调cyclin A的表达(P<0.05).
结论: ST可显著抑制胰腺癌Panc-1细胞增殖并诱导其凋亡, 其机制可能是通过阻滞细胞周期于G1期, 进而抑制肿瘤细胞生长并促进细胞凋亡.
核心提示: 十字孢碱可通过阻滞胰腺癌Pcnc-1细胞周期于G1期, 进而抑制其生长并促进细胞凋亡.
引文著录: 彭丰, 李旭, 江建新, 王敏, 田锐, 徐盟, 郭兴军, 秦仁义. 十字孢碱对胰腺癌Panc-1细胞增殖和凋亡的影响. 世界华人消化杂志 2013; 21(25): 2578-2584
Revised: July 22, 2013
Accepted: August 13, 2013
Published online: September 8, 2013
AIM: To investigate the effect of staurosporine (ST) on cell proliferation and apoptosis in pancreatic cancer cell line Panc-1, and to explore the possible mechanisms involved.
METHODS: After Panc-1 cells were treated with different concentrations of ST for different durations, cell proliferation was assessed by CCK-8 method, cell apoptosis was detected by Hoechst 33258 staining and flow cytometry, cell cycle distribution was investigated by flow cytometry, and expression of cyclin A, cyclin D1, Cdk4 and P21 proteins was detected by Western blot.
RESULTS: ST significantly inhibited the proliferation of Panc-1 cells (P < 0.05) in a concentration- and time-dependent manner. Treatment with ST significantly induced apoptosis of Panc-1 cells, and the apoptosis rate of Panc-1 cells treated with ST increased significantly compared with control cells (P < 0.05). Treatment with ST induced cell cycle arrest in G1 phase (P < 0.05). Moreover, ST treatment significantly decreased the expression of cyclin D1 and Cdk4 proteins and increased the expression of P21 protein in Panc-1 cells (all P < 0.05). Low concentrations of ST raised the expression of cyclin A in Panc-1 cells, while high concentrations of ST reduced the expression of cyclin A (P < 0.05).
CONCLUSION: ST significantly inhibits proliferation and induces apoptosis of Panc-1 cells possibly by inducing cell cycle arrest in G1 phase.
- Citation: Peng F, Li X, Jiang JX, Wang M, Tian R, Xu M, Guo XJ, Qin RY. Staurosporine inhibits cell proliferation and induces apoptosis in pancreatic cancer cell line Panc-1. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2578-2584
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2578.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2578
胰腺癌是恶性程度最高的人类肿瘤之一, 尽管目前临床手术方式和各种综合治疗方法有所改进, 但患者的5年生存率却仍然没有显著提高[1]. 在我国, 胰腺癌的发病率也呈逐年上升趋势, 成为危害国人生命健康的主要疾病之一[2]. 蛋白激酶C(protein kinase C, PKC)是丝氨酸/苏氨酸蛋白激酶家族成员, 其在细胞内参与了广泛的信号传导过程, 对细胞的增殖、分化、血管生成和凋亡等的生物学过程均有一定调节作用[3]. 最近的研究表明, 蛋白激酶C在多种人类肿瘤中高表达, 其参与并维持了肿瘤的多种恶性生物学特性, 是肿瘤转化中的重要信号分子[4]. 十字孢碱(staurosporine, ST)是由放线菌分离的生物碱, 是一种可以通透细胞膜的蛋白激酶C抑制剂. 研究发现, ST可以导致多种肿瘤细胞的凋亡, 但ST对胰腺癌细胞的影响仍不是很清楚, 本研究以人胰腺癌Panc-1细胞为研究对象, 旨在研究ST对胰腺癌细胞增殖、凋亡等的影响.
人胰腺癌细胞系Panc-1购自中科院上海细胞库; 高糖DMEM培养液和胎牛血清购自美国Gibco公司; CCK-8试剂盒购自日本Dojindo公司; 碘化丙啶(propidium iodide, PI)、RNA酶(RNase A)和ST购自美国Sigma公司; ST用DMSO配制成浓度为1 mmol/L的原液并储存于-20 ℃, 实验时根据需要用高糖DMEM培养液将原液稀释成不同浓度的工作液; Annexin V/FITC凋亡检测试剂盒购自南京凯基生物科技发展有限公司; Hoechst 33258细胞凋亡检测试剂盒、BCA蛋白定量试剂盒和RIPA裂解液购自碧云天生物技术研究所; 鼠抗人cyclin D1、Cdk4、P21和β-actin单克隆抗体购自美国Cell signal公司; 鼠抗人cyclin A单克隆抗体及辣根过氧化酶(HRP)标记的羊抗鼠IgG二抗购自武汉博士德生物工程有限公司; 其余试剂均为国产分析纯.
1.2.1 细胞培养: Panc-1细胞用含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养液, 置于37 ℃、CO2体积分数为5%的饱和湿度细胞培养箱中培养, 0.25%胰蛋白酶溶液消化、传代. 选用对数生长期的细胞进行实验.
1.2.2 CCK-8法检测细胞增殖抑制率: 取对数生长期的Panc-1细胞, 调整细胞密度为2.0×104个/mL接种于96孔培养板中, 每孔100 μL, 置于培养箱中培养, 待细胞完全贴壁后吸去培养液, 分别加入200 μL含0.025、0.05、0.10、0.25、0.50和1.00 μmol/L ST的培养液, 同时设立空白对照组及含有同等稀释度DMSO的阴性对照组, 每组设5个复孔. 药物分别作用24和48 h后, 每孔加入10 μL CCK-8, 继续培养4 h后, 于酶标仪波长450 nm处读取吸光度(A)值. 按公式计算细胞的增殖抑制率. 抑制率%(inhibitory rate, IR) = (1-药物处理组平均A值/细胞对照孔平均A值)×100%. 同时根据公式计算细胞的半数抑制浓度(half inhibition concentration, IC50), 以上实验重复3次.
1.2.3 Hoechst 33258染色检测细胞凋亡: 将消毒灭菌后的盖玻片置于六孔板内, 接种处于对数生长期的Panc-1细胞2×105个/孔于盖玻片上. 置于培养箱中培养, 待细胞完全贴壁后吸去培养液, 加入含有不同浓度(0、0.05、0.1、0.25和0.5 μmol/L)ST的培养液, 继续培养24 h. 吸除细胞培养液, 并加入1 mL固定液, 固定10 min. 吸除固定液, PBS洗3遍, 每次5 min, 吸尽液体, 加入1 mL Hoechst 33258染色液, 染色5 min后封片, 于正置荧光显微镜下观察细胞形态并拍照. 以上实验重复3次.
1.2.4 Annexin V-FITC/PI双标法检测细胞凋亡: 取对数生长期Panc-1细胞接种于6孔板, 每孔接种2×105个细胞. 用含ST浓度分别为0、0.05、0.1、0.25和0.5 μmol/L的培养液处理细胞24 h后, 按照凋亡试剂盒说明书进行以下操作. 消化收集细胞, PBS洗涤细胞2次(2000 r/min, 离心5 min), 每管收集约1×105个细胞; 加入500 μL的Binding Buffer重悬细胞后, 再分别加入5 μL Annexin V-FITC和5 μL Propidium iodide染料混匀, 室温避光反应15 min, 于1 h内上流式仪检测细胞凋亡情况并采用CellQuest软件分析实验结果. 以上实验重复3次.
1.2.5 流式细胞术检测细胞周期: 取对数生长期的Panc-1细胞, 按每孔2×105个细胞密度接种于6孔板中, 培养24 h后换成含有不同浓度(0、0.05、0.1、0.25和0.5 μmol/L)ST的培养液, 继续培养24 h; 胰酶消化、收集细胞, 4 ℃预冷的PBS 洗2次, 用200 μL PBS重悬细胞, 缓慢滴入1 mL预冷的无水乙醇, 于-20 ℃固定过夜; 之后离心(1000 r/min, 4 ℃离心5 min)收集细胞, 4 ℃预冷的PBS洗2次并重悬于500 μL PBS中, 然后加入终浓度为50 μg/mL的RNA酶(RNase A)及碘化丙啶(PI)于室温避光反应30 min, 流式仪检测细胞周期分布. 采用CellQuest和ModFit软件分析实验结果, 以上实验重复3次.
1.2.6 蛋白质印迹法检测相关蛋白的表达: 取对数生长期的Panc-1细胞, 按每孔2×105个细胞密度接种于6孔板中, 培养24 h后换成含有不同浓度(0、0.05、0.1、0.25和0.5 μmol/L)ST的培养液, 继续培养24 h; 胰酶消化、收集细胞, 加入RIPA裂解液及蛋白酶抑制剂, 冰上孵育30 min, 4 ℃ 12000 g, 离心20 min. 取上清保存于-80 ℃. BCA法测定蛋白浓度, 以50 μg蛋白/泳道上样, 12%的SDS-PAGE电泳分离, 电泳结束后将胶上蛋白电转至聚偏氟乙烯(PVDF) 膜上; 于5%的脱脂奶粉中室温振荡封闭2 h; 分别加入一抗(稀释比例均为1:500)于杂交袋中4 ℃孵育过夜; 次日用TBS-T洗膜3次, 每次15 min, 室温孵育二抗(1:3000)1 h; TBS-T洗膜3次, 每次10 min; 采用增强化学发光(ECL)法进行显色、曝光. 采集图像后用图像分析软件Quantity One进行灰度分析; 以目的蛋白与内参照蛋白(β-actin)的相对表达量, 即目的蛋白与内参照蛋白的比值进行半定量分析. 以上实验重复3次.
统计学处理 采用SPSS16.0软件作统计处理, 计量数据以mean±SD表示. 不同处理组间差异采用单因素方差分析或Dunnett t检验, 以P<0.05为差异具有统计学意义.
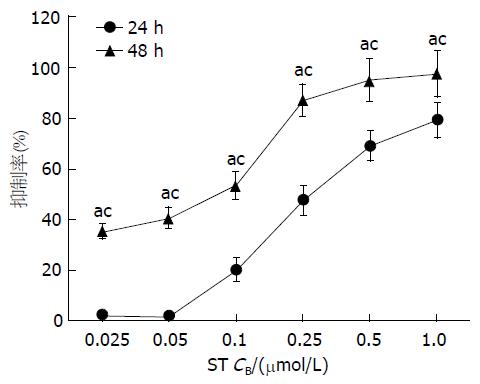
CCK-8检测结果显示, 随着ST药物浓度的增加, Panc-1细胞的增殖抑制率也逐渐增强, 实验组与对照组相比, 差异均有统计学意义(P<0.05); 而同一浓度的ST作用48 h与24 h相比, 细胞增殖抑制率亦逐渐增强, 差异有统计学意义(P<0.05). 提示ST对Panc-1细胞的增殖抑制作用呈浓度依赖性和时间依赖性(图1). 分别计算ST作用24和48 h的IC50值分别为0.31 μmol/L±0.04 μmol/L和0.07 μmol/L±0.01 μmol/L.
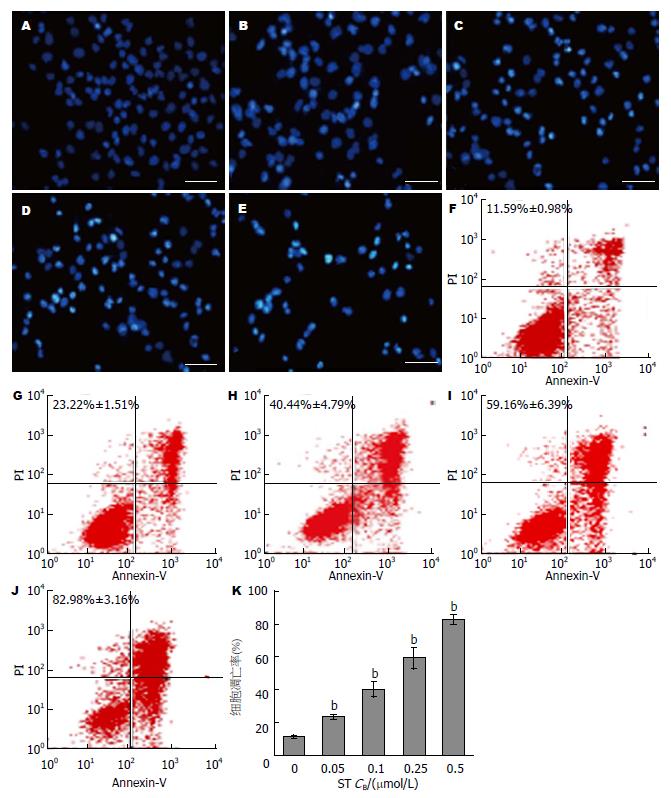
Hoechst 33258荧光染色结果显示, ST作用24 h后可见Panc-1细胞核边缘不规则, 染色质凝集, 并伴有核固缩、核碎裂等典型的凋亡改变; 而未用ST干预的Panc-1细胞核形态规则、染色质均匀, 未见明显凋亡改变. 因此, 从胞核形态变化及荧光强度可看出, 随着ST浓度的增加, 细胞凋亡比例亦逐渐增加(图2A-E).
Annexin V-FITC/PI双标法检测结果显示, 不同浓度的ST(0、0.05、0.1、0.25和0.5 μmol/L)分别作用Panc-1细胞24 h后, 其凋亡率分别为11.59%±0.98%、23.22%±1.51%、40.44%±4.79%、59.16%±6.39%和82.98%±3.16%, 表明随着药物浓度的增加, 细胞凋亡率亦逐渐上升, 实验组与对照组比较, 差异有统计学意义(P<0.01)(图2F-K).
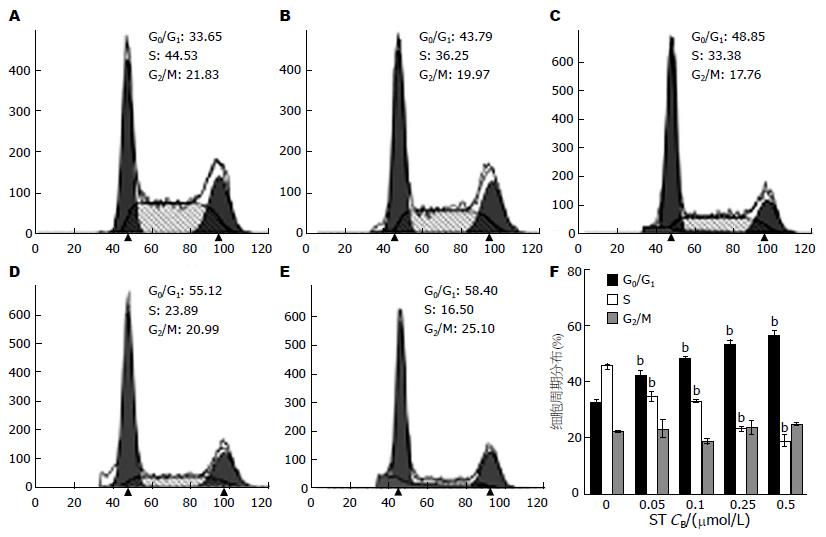
流式细胞术检测结果显示, 作用24 h后, 随着ST药物浓度的升高, Panc-1细胞的S期细胞比例依次下降, 而G0/G1期细胞比例依次增加. 与对照组比较, 差异均有统计学意义(P<0.01). 表明ST作用24 h后, Panc-1细胞被阻滞于G1期(图3).
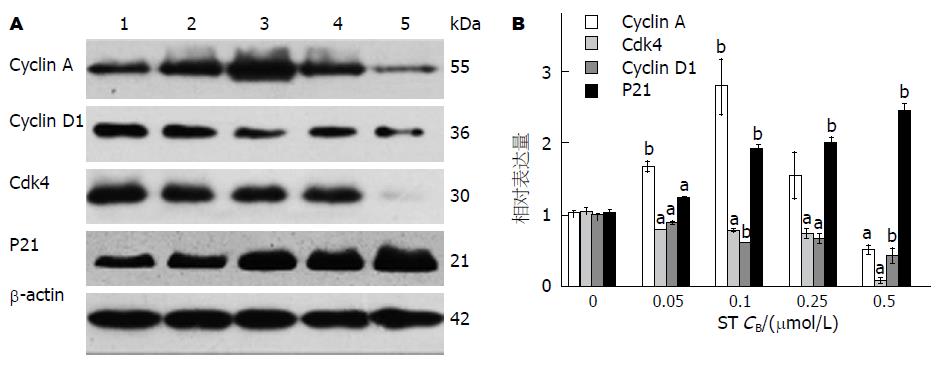
蛋白质印迹法检测结果显示, 作用24 h后, 随着ST药物浓度的升高, 各组内参蛋白β-actin的条带亮度相似, 而cyclin D1和Cdk4蛋白表达水平逐渐下降; cyclin A在低浓度ST作用时表达量升高, 在高浓度ST作用后表达水平亦显著下降; P21蛋白的表达水平则随着药物浓度的增加而逐渐升高(图4)(P<0.05).
胰腺癌是消化系统常见的恶性肿瘤, 近年来其发病率呈逐年上升趋势. 研究表明, 胰腺癌的发生和发展与多种因素相关, 而肿瘤细胞的异常增殖和凋亡抵抗特性在其中起到重要作用[5,6].
一般当正常细胞受到各种凋亡诱导因素刺激后, 可启动多种凋亡途径并激活凋亡相关的蛋白酶, 这些蛋白酶可将细胞内的重要蛋白降解, 引起细胞凋亡. 而在肿瘤细胞中, 正常的凋亡通路调控发生紊乱, 导致细胞产生凋亡抵抗, 从而引起肿瘤细胞的恶性增殖[5]. 同样, 研究表明肿瘤细胞的增殖与其细胞周期之间关系密切. 按照细胞周期的概念, 增殖细胞包括G1期、S期、G2期和M期的所有细胞, 而调控这种细胞周期的过程存在2个关键点, 即G1/S期转换和G2/M期转换; 其中G1/S期转换是控制细胞周期长短的限速期, 而G2/M期转换则是控制细胞分裂增殖的重要阶段[6]. 包括人类肿瘤在内的所有真核细胞中, 细胞周期蛋白A(cyclin A)是S期和G2/M期的重要作用蛋白, 他的生成和降解与肿瘤的恶性增殖密切相关[7]; 细胞周期蛋白D1(cyclin D1)是G1期到S期的关键调控蛋白, 其异常表达见于多种人类肿瘤中[8]; 周期蛋白依赖性激酶(cyclin-dependent protein kinases, Cdks)能不可逆地引发细胞周期转变, 其中Cdk4与cyclin D1结合形成复合物, 在G1期的演进中同样起着重要作用[9]. 而P21是细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitor, CKIs)家族成员之一, 能与cyclin/Cdk复合物结合并抑制其功能, 是G1期的主要抑制蛋白[10].
蛋白激酶C主要由N端的调节区与C端的催化区组成. 研究表明, 蛋白激酶C与肿瘤的增殖和凋亡等生物学特性密切相关[4]. ST是一种广谱的蛋白激酶C抑制剂, 主要作用于C端的催化区, 其与ATP竞争结合蛋白激酶C的ATP结合位点而发挥抑制作用. 通过对人类多种肿瘤的研究发现, ST能够有效抑制肿瘤细胞的生长并促进细胞凋亡[11-13], 然而目前关于ST对胰腺癌细胞增殖、凋亡的影响尚不清楚. 本研究通过CCK-8体外增殖实验、细胞凋亡形态学观察、流式细胞术和蛋白质印迹等检测方法, 发现ST对人胰腺癌Panc-1细胞有显著的生长抑制作用, 且这种效应随着药物浓度的增加和作用时间的延长而增强; 同时, 在ST作用后, Panc-1细胞可出现典型的凋亡形态学改变, 凋亡率明显高于未加药组.
有文献报道ST能诱导细胞周期阻滞于G2/M期或G1期[13,14]. 本研究发现, 低浓度ST(0.05 μmol/L) 作用24 h后即可诱导Panc-1细胞的S期比例下降, 而G0/G1期细胞比例增加; 同时, 蛋白质印迹法检测结果也显示低浓度ST(0.05 μmol/L) 作用24 h后, cyclin D1和Cdk4蛋白表达水平下降, 而p21蛋白的表达水平升高, 这与细胞周期分布的结果一致, 提示细胞被阻滞于G1期. 随着ST浓度的增加, Panc-1细胞的S期比例依次下降, G0/G1期比例依次增加; 而与之相对应, cyclin D1和Cdk4蛋白表达水平亦依次递减, P21蛋白的表达水平依次升高; 但cyclin A蛋白表达水平在低浓度ST作用时表达量升高, 但在高浓度ST作用后表达水平下降, 考虑可能是细胞为通过G1期的一种代偿性上调.
总之, 本研究从体外实验证明ST能够有效抑制胰腺癌Panc-1细胞的增殖并诱导其凋亡, 其作用机制可能是通过阻滞细胞周期于G1期, 进而抑制肿瘤细胞生长并促进其凋亡, 但具体调节机制尚不清楚, 还需进一步研究. 目前, 蛋白激酶C已成为抗肿瘤药物研究中的重要靶点, 其抑制剂十字孢碱有可能成为胰腺癌化疗中起重要作用的药物之一[15].
蛋白激酶C(protein kinase C, PKC)被证实参与并维持了多种肿瘤的恶性生物学行为, 并已成为药物开发的研究热点之一.
谭晓冬, 教授, 中国医科大学附属盛京医院
ST作为一种广谱的蛋白激酶C抑制剂, 其已被证实能有效抑制多种肿瘤细胞的生长并促进细胞凋亡, 但其与胰腺癌的相关研究目前仍未达成共识, 其生物学特性尚需要进一步研究证明.
Yanyan Wang证实ST可通过介导PKC-α的抑制, 诱导E-钙粘蛋白的表达从而抑制肺癌细胞的粘附、侵袭、迁移及远处转移.
本文首次证实了十字孢碱在胰腺癌细胞增殖凋亡方面的生物学作用, 并初步阐明其是通过阻滞细胞周期于G1期来发挥其抑制作用.
本文为进一步研究十字孢碱对胰腺癌的生物学调控作用提供了理论基础, 为进一步的蛋白激酶C相关药物开发提供了理论依据.
本文立题有一定新意, 实验设计合理, 数据翔实准确, 论文逻辑性较强, 研究结果有助于进一步明确胰腺癌细胞增殖及凋亡的调控机制, 具有较好的科学价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 3. | Deacon EM, Pongracz J, Griffiths G, Lord JM. Isoenzymes of protein kinase C: differential involvement in apoptosis and pathogenesis. Mol Pathol. 1997;50:124-131. [PubMed] |
| 4. | Mackay HJ, Twelves CJ. Protein kinase C: a target for anticancer drugs? Endocr Relat Cancer. 2003;10:389-396. [PubMed] |
| 5. | Arlt A, Müerköster SS, Schäfer H. Targeting apoptosis pathways in pancreatic cancer. Cancer Lett. 2013;332:346-358. [PubMed] [DOI] |
| 6. | Schwartz GK, Shah MA. Targeting the cell cycle: a new approach to cancer therapy. J Clin Oncol. 2005;23:9408-9421. [PubMed] [DOI] |
| 7. | Yasmeen A, Berdel WE, Serve H, Müller-Tidow C. E- and A-type cyclins as markers for cancer diagnosis and prognosis. Expert Rev Mol Diagn. 2003;3:617-633. [PubMed] [DOI] |
| 8. | Guo SS, Wu X, Shimoide AT, Wong J, Moatamed F, Sawicki MP. Frequent overexpression of cyclin D1 in sporadic pancreatic endocrine tumours. J Endocrinol. 2003;179:73-79. [PubMed] |
| 9. | Ikehara M, Oshita F, Ito H, Ohgane N, Suzuki R, Saito H, Yamada K, Noda K, Mitsuda A, Kameda Y. Expression of cyclin D1 but not of cyclin E is an indicator of poor prognosis in small adenocarcinomas of the lung. Oncol Rep. 2003;10:137-139. [PubMed] |
| 10. | Sugimoto M, Martin N, Wilks DP, Tamai K, Huot TJ, Pantoja C, Okumura K, Serrano M, Hara E. Activation of cyclin D1-kinase in murine fibroblasts lacking both p21(Cip1) and p27(Kip1). Oncogene. 2002;21:8067-8074. [PubMed] [DOI] |
| 11. | Qiao L, Koutsos M, Tsai LL, Kozoni V, Guzman J, Shiff SJ, Rigas B. Staurosporine inhibits the proliferation, alters the cell cycle distribution and induces apoptosis in HT-29 human colon adenocarcinoma cells. Cancer Lett. 1996;107:83-89. [PubMed] |
| 12. | Yamasaki F, Hama S, Yoshioka H, Kajiwara Y, Yahara K, Sugiyama K, Heike Y, Arita K, Kurisu K. Staurosporine-induced apoptosis is independent of p16 and p21 and achieved via arrest at G2/M and at G1 in U251MG human glioma cell line. Cancer Chemother Pharmacol. 2003;51:271-283. [PubMed] [DOI] |
| 13. | Sarkar J, Singh N, Meena S, Sinha S. Staurosporine induces apoptosis in human papillomavirus positive oral cancer cells at G2/M phase by disrupting mitochondrial membrane potential and modulation of cell cytoskeleton. Oral Oncol. 2009;45:974-979. [PubMed] [DOI] |
| 14. | Zhou W, Lin Y, Wersto R, Chrest J, Gabrielson E. Staurosporine-induced G(1) arrest in cancer cells depends on an intact pRB but is independent of p16 status. Cancer Lett. 2002;183:103-107. [PubMed] |